子宫内膜癌(endometrial cancer,EC)2018年造成全球约9万人死亡[1],子宫内膜样腺癌(endometrial adenocarcinoma,EA)是其最常见的组织病理类型。目前其发病机制研究已深入至分子机制,但具体机制仍不明确。Hippo通路最初是在筛选果蝇中调节器官大小的基因研究过程中被发现的,该通路蛋白的丢失可致细胞增殖和肿瘤发生,已在多种类型人类癌症中被观察到,近年的研究[2-3]更是表明Hippo-YAP通路广泛参与着细胞增殖、各种细胞死亡途径、肿瘤干细胞研究领域、肿瘤免疫研究领域、上皮间质转化等众多肿瘤相关病理生理学过程的调节网络。Yes相关蛋白(yes associated protein,YAP)作为经典Hippo通路的核心效应器,在包括胃癌、肺癌等多种癌症中被认为是癌基因,呈现出过表达,并与肿瘤分期、淋巴结转移状态等预后相关因素有关[4-5],有研究[6]表明,该信号通路的成分在30%的子宫内膜癌中发生突变,在54%的子宫内膜癌中存在微卫星不稳定。YAP在多种人类肿瘤中起着重要作用,但其在子宫内膜癌中的研究目前尚较少。本研究旨在检测YAP在子宫内膜样腺癌及癌旁组织中的表达,分析YAP表达与所研究病例临床病理学参数之间的关系,以期为进一步理解YAP在子宫内膜样腺癌中的意义提供参考。
材料与方法
一、材料
1.临床资料:本研究收集2018年9月至2019年12月在山西医科大学第一医院就诊并行全面分期手术的子宫内膜样腺癌病例共56例,年龄43~69岁(中位年龄为54岁),术前均未接受放、化疗且不合并其他系统肿瘤,所有患者均按照伦理学原则完成知情同意。对病理组织库中已行取材、石蜡包埋处理的对应病例癌、癌旁组织蜡块进行IHC法检测YAP表达。分期参考国际妇产科联盟(FIGO,2009年)修订的手术病理分期[7]。
2.研究材料:(1)一抗。兔抗人YAP1单克隆抗体,购自ABclonal公司,-20℃保存,防止反复冷冻/解冻,根据预实验结果显示1∶100为最适合浓度。(2)二抗(酶标羊抗鼠/兔IgG聚合物,货号:GK600711A)、PBS缓冲液、pH 6.0柠檬酸修复液等试剂及组织切片机、恒湿恒温箱、光学显微镜等设备均由山西医科大学第一医院妇科二病理室提供。
二、方法
1.实验步骤:(1)制片。切片厚度约4 um,60~70 ℃烤蜡60 min;(2)脱蜡水化。将切片分别放入二甲苯Ⅰ、Ⅱ、Ⅲ各10 min、100%、80%、70%梯度乙醇各2 min;(3)抗原修复、封闭。高压锅水浴法进行组织修复;(4)一抗孵育。PBS缓冲液3次×3 min,取出切片擦干组织周围液体后低价一抗(具体量以完全覆盖组织野为宜),滴加一抗后置入湿盒。将湿盒4℃孵育过夜;(5)复温、二抗孵育。滴加二抗、置入湿盒中等待30 min;(6)显色、复染。PBS缓冲液清洗3次,每次3 min。滴加显色剂,观察染色情况,适时终止;苏木素中复染15 s,自来水冲洗后放入盐酸乙醇分化,再用自来水冲洗;(7)脱水、封片。将切片依次置于70%乙醇1 min、90%乙醇1 min、无水乙醇各3 min、无水乙醇Ⅰ2 min,二甲苯Ⅰ、二甲苯Ⅱ各5 min;滴加中性树脂1~2滴,缓盖盖玻片,完成封片。
2.结果判定:染色结果由至少两名病理学家独立并且在不知道临床资料的背景下阅片。每个切片的YAP表达情况按以下标准评分和取用,即(1)染色强度。0分:无着色;1分:浅黄色;2分:棕黄色;3分:棕褐色。(2)阳性细胞百分数计算。0分:≤10%染色;1分:11%至30%染色;2分:31%至50%染色;3分:51%至75%染色;4分:76%至100%染色。如先前发表的研究所示[8],两个染色变量相乘表示每个样本的YAP表达得分,分数≥6被认为是高表达,分数<6被认为是低表达。
3.统计学处理:所有数据均由SPSS 22.0统计分析。YAP在子宫内膜样腺癌、癌旁组织中的表达情况比较采用四格表资料的卡方检验,该蛋白在癌组织中的表达情况与各临床病理指标之间的关系采用卡方检验及Fisher确切概率法,检验水准α=0.05,若 P<0.05,则认为差异有统计学意义。
结 果
一、YAP在子宫内膜样腺癌及癌旁组织中的表达情况
YAP阳性染色结果为位于细胞核或细胞质的棕黄色颗粒,表达情况见图1。
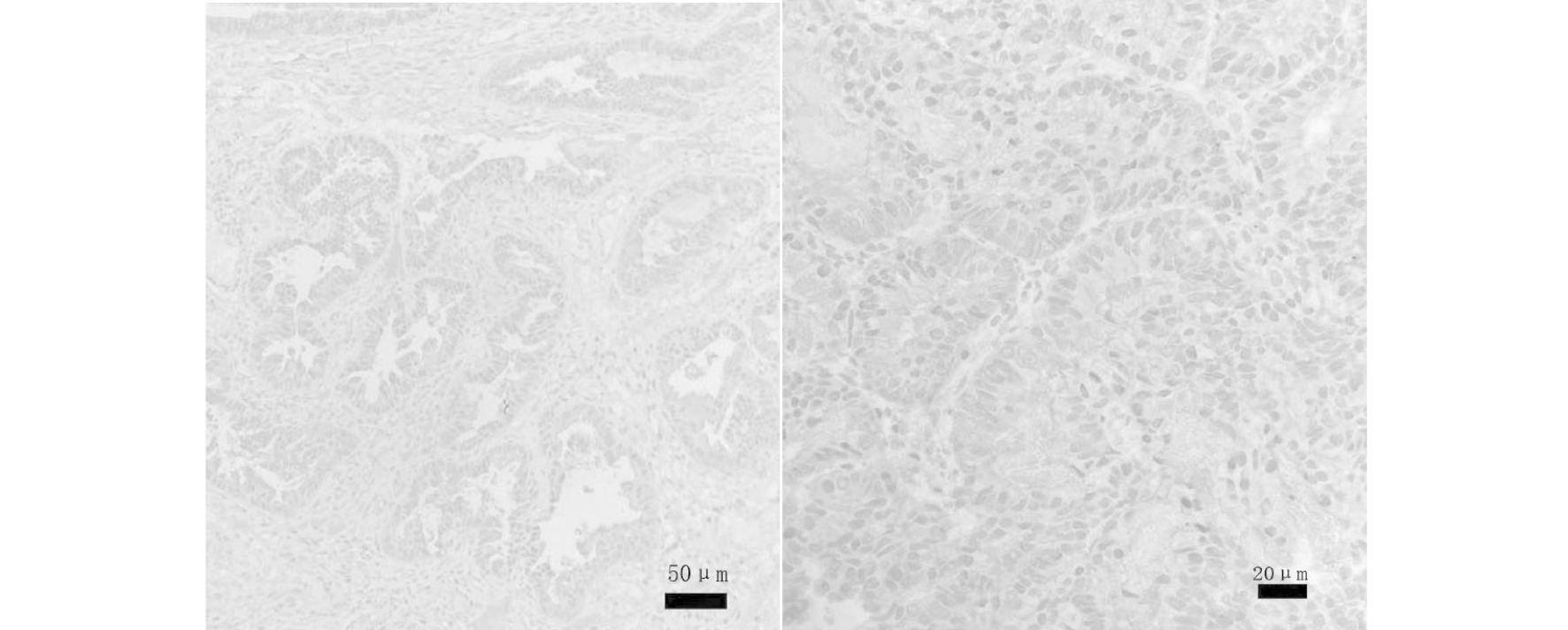
图1 YAP 在子宫内膜样腺癌组织中的表达[左图:× 200,右图:× 400]
Figure 1 Expression of YAP in endometrioid adenocarcinoma[left:× 200,right:× 400]
在子宫内膜样腺癌组织中高表达31例(55.4%),低表达25例(44.6%);而癌旁组织中高表达17例(30.4%),低表达39例(69.6%)。子宫内膜样腺癌癌组织中的表达明显高于癌旁组织(P<0.05)。见表1。
表1 子宫内膜样腺癌癌组织与癌旁组织YAP蛋白的表达情况
Table 1 Expression of YAP protein in endometrioid adenocarcinoma and its adjacent tissues

EndometrialtissuetypesnYAPexpression[n(%)]Highexpression∗LowexpressionCancertissue5631(55.4)25(44.6)Para-carcinomatissue5617(30.4)39(69.6)
Compared between the two groups,*P<0.05
二、子宫内膜样腺癌组织中YAP的表达情况及其与临床病理特征的关系
YAP蛋白在子宫内膜样腺癌中的高表达,根据手术病理分期来看,Ⅰ期11例(37.9%),Ⅱ期12例(70.6%),Ⅲ期8例(80.0%);根据组织学分化程度来看,高分化组10例(37.0%),中分化组14例(70.0%),低分化组7例(77.8%);根据淋巴结转移状态来看,淋巴结转移组8例(80.0%),淋巴结未转移组23例(50.0%);根据肌层浸润深度来看,浅肌层浸润组4例(28.6%),深肌层浸润组27例(64.2%)。YAP在子宫内膜样腺癌组织中的表达情况与手术病理分期、组织学分化程度及肌层浸润深度有关( P均<0.05),但与年龄、绝经状态、淋巴结转移情况、是否合并糖尿病无关(P>0.05)。见表2。
表2 YAP在子宫内膜样腺癌癌组织中的表达与各临床病理特征之间的关系
Table 2 Correlation between YAP expression and clinicopathological features in endometrioid adenocarcinoma by characteristics

VariablesnYAPexpression[n(%)]HighexpressionLowexpressionAge(years) ≤602416(28.6)8(14.3) >603215(26.8)17(30.4)Surgicalpathologicalstage∗ Ⅰ2911(19.6)18(32.1) Ⅱ1712(21.4)5(8.9) Ⅲ108(14.3)2(3.6)Histologicalgrade∗ Highdifferentiation(G1)2710(17.9)17(30.4) Moderatelydifferentiated(G2)2014(25) 6(10.7) Poorlydifferentiated(G3)97(12.5)2(3.6)Menopausalstate Premenopause167(12.5)9(16.1) Post-menopause4024(42.9)16(28.6)Depthofmuscularinfiltration∗ <1/2144(7.1)10(17.9) ≥1/24227(48.2)15(26.8)Lymphaticmetastasis Yes108(14.3)2(3.6) No4623(41.1)23(41.1)Complicatedwithdiabetesmellitus Yes3321(37.5)12(21.4) No2310(17.9)13(23.2)
Compared between the two groups,*P<0.05
讨 论
子宫内膜癌是女性最常见恶性肿瘤之一[9],平均发病年龄位于50~60岁,2008年后在国内妇科肿瘤中发病率已升至首位[10]且发病年龄趋向年轻化[11],虽然大部分预后较好,诊断时患者的分期较早,但研究表明发生淋巴结转移时,5年存活率从80%~90%(FIGOⅠ-Ⅱ期)急剧下降至51%~58%(FIGOⅢ期)[12]。另外,子宫内膜癌的死亡率增长速度约为其发病率增长速度的2倍[13]。因此,详细了解并明确子宫内膜癌的发生发展的生理机制对于子宫内膜癌的诊断、治疗意义重大。
相关蛋白于1994年由Sudol发现,因其基因绑定于非受体酪氨酸激酶src家族成员c-Yes的SH3基序上(scr homology-3 domain,src同源区3)故此命名[14]。又因分子量为65Ku称YAP65,因在YAP的羧基C端仅具转录激活结构域,但无DNA结合结构域,因此将其归类为转录共激活因子[15]。YAP由YAP1基因编码,定位于人类11号染色体长臂(11q21-22),因mRNA的不同剪接分为2种不同的亚型,即YAP1、YAP2。两种亚型之间的区别在于YAP1只有一个WW(双色氨酸结构域),YAP2有两个WW结构域。WW结构域可与含有PPXY(P:脯氨酸,X:任意氨基酸,Y:酪氨酸)序列的配体、或其他含有PPXY模式的转录因子(ErbB4,ErbB2 receptor tyrosine kinase 4,ErbB2受体酪氨酸激酶4、P73)结合发挥转录共激活作用[16],其余结构还包括 14-3-3蛋白结合位点、SH3结合基序、C端转录激活域(可于TEAD等转录共激活因子结合)、PDZ结合基序组成。TAZ和YAP是果蝇Yorkie基因的同源基因。人TAZ定位于3q25.1上,有400个氨基酸残基。TAZ的主要结构域包括N端富脯氨酸序列、多个HXRXXS序列、一个卷曲螺旋域、转录激活域、WW结构域、C端PDZ结合基序LTWL。在哺乳动物中以YAP为重要效应蛋白的Hippo通路是一个庞大的蛋白质网络,该通路核心为多个保守激酶构成的激酶级联反应,生理情况下,磷酸化的MST1/2激活LATS1/2,促进 YAP被激活入核,与TEA结构域家族成员(TEA domain family member,TEAD)结合,促进一系列下游基因表达,促进肿瘤发生[17]。而当Hippo/YAP通路激活时,上游因子在多位点因磷酸化失活YAP,从而使其滞留于胞质中被泛素化降解,下游相关基因表达被抑制,从而抑制肿瘤发生[18]。Hippo/YAP通路通过一系列上游调控机制调控YAP,该通路的异常调控使YAP异常激活,从而导致肿瘤的发生。
本研究显示,YAP在癌组织中的表达水平高于癌旁组织(P<0.05),这与荆丽红[19]、Cheng等[20]的研究结果一致。Wang等[21]的研究也显示,内膜癌细胞中YAP的表达高于正常内膜基质细胞中YAP的表达,且YAP的下调可使内膜癌细胞增殖受到抑制,并可使其对化疗药物增敏。此外,本研究结果表明在癌组织中,YAP的高表达与代表了不良预后的高临床分期、分化程度差、深肌层浸润相关。Yang等[22]的研究也表明YAP的表达与患者分级、分期、术后复发/转移和总生存率显著相关。程允[23]的研究表明,YAP基因的mRNA和蛋白表达与组织学分化和淋巴结转移有一定相关。本研究中淋巴结转移与YAP的表达无关,可能与样本例数较少,代表性不佳有关。另有研究[24]证实,YAP可促进子宫内膜癌细胞株增殖、迁移和侵袭。这也佐证了本研究观点,表明YAP基因的表达与子宫内膜样腺癌的进展及预后有关。而本研究结果显示,年龄、是否合并糖尿病、绝经与否与YAP表达水平无统计学意义。这可能与本研究例数较少,病人结构较为单一有关,未来可进一步设计更大样本容量的研究。本研究初步提示YAP与子宫内膜癌的发生发展密切相关,或可成为子宫内膜癌未来诊断治疗的潜在靶点。
本研究存在一定的局限性。第一,本研究仅通过IHC检测56例子宫内膜样腺癌组织标本中YAP蛋白的表达,需要更多的样本进行检测,并评估YAP表达与更多患者的临床病理参数,如BMI、血糖水平、其他相关因子的免疫组化结果等之间的关系。第二,在纳入的子宫内膜癌患者中病理类型仅局限于子宫内膜样腺癌,未来应将更多的特殊类型子宫内膜癌病例纳入研究当中。第三,因现存病例中尚未对所有内膜癌患者常规进行分子分型,因此无法针对YAP的表达与子宫内膜癌的分子分型之间的关系进行进一步讨论,有待于未来进行进一步的研究设计完善。第四,目前本研究仅针对YAP在子宫内膜癌中的表达及其与临床病理特征之间的关系进行了讨论分析,下一步将针对以YAP为重要组成部分的Hippo通路上下游分子在内膜癌当中的表达以及其与其他通路之间的作用网络进行更深入的研究。
1 Ferlay J,Colombet M,Soerjomataram I,et al.Estimating the global cancer incidence and mortality in 2018:GLOBOCAN sources and methods.Int J Cancer,2019,144:1941-1953.
2 王婷婷,李忠华,李慧峰,等.非小细胞肺癌中YAP1、SRPX2的表达与微血管密度及预后的相关性分析.临床与实验病理学杂志,2020,36:264-269.
3 Fu M,Hu Y,Lan T,et al.The Hipposignalling pathway and its implications in human health and diseases.Signal Transduct Target Ther,2022,7:376.
4 Piccolo S,Panciera T,Contessotto P,et al.YAP/TAZ as master regulators in cancer:modulation,function and therapeutic approaches.Nat Cancer,2023,4:9-26.
5 Zheng L,Du J,Ge F,et al.Thecalcimimetic agent cinacalcet inhibits hepatocellular carcinoma via YAP/TAZ suppression.Pharmazie,2021,76:511-514.
6 Kandoth C,Schultz N,Cherniack AD,et al.Cancer Genome Atlas Research N Intergrated genomic characterization of endometrial carcinoma.Nature,2013,497:67-73.
7 Pecorelli S.Revised FIGO staging for carcinoma of the vulva,cervix,and endometrium.Int J Gynaecol Obstet,2019,105:103-104.
8 宋露露.子宫内膜样癌及其前驱病变YAP1、PTEN、eIF4E和CyclinD1的表达及意义.天津医科大学,2018.
9 Siegel RL,Miller KD,Wagle NS,et al.Cancer statistics,2023.CA Cancer J Clin,2023,73:17-48.
10 Morice P,Leary A,Creutzberg C,et al.Endometrial cancer.Lancet,2016,387:1094-1108.
11 Makker V,Mackay H,Ray-Coquard I,et al.Endometrial cancer.Nat Rev Dis Primers,2021,7:88.
12 Lewin SN,Herzog TJ,Barrena Medel NI,et al.Comparative performance of the 2009 international Federation of gynecology and obstetrics′ staging system for uterine corpus cancer.Obstet Gynecol,2010,116:1141-1149.
13 Siegel RL,Miller KD,Fuchs HE,et al.Cancer Statistics,2021.CA Cancer J Clin,2021,71:7-33.
14 徐婉秋,许晓航,刘畅,等.Hippo信号通路在口腔鳞状细胞癌中的研究进展.中华口腔医学杂志,2021,56:221-225.
15 Zhou Q,Bauden M,Andersson R,et al.YAP1 is an independent prognostic marker in pancreatic cancer and associated with extracellular matrix remodeling.J Transl Med,2020,18:77.
16 祝景伟,佟经伟,许培权.Hippo信号通路中TAZ、YAP在三阴性乳腺癌中的表达及意义.陕西医学杂志,2020,49:940-943,968.
17 Wang D,He J,Dong J,et al.The HIPPO pathway in gynecological malignancies.Am J Cancer Res,2020,10:610-629.
18 Boopathy G,Hong W.Role of Hippo Pathway-YAP/TAZ Signaling in Angiogenesis.Front Cell Dev Biol,2019,7:49.
19 荆丽红.β-catenin、YAP1、TBX5 和 Survivn 在子宫内膜癌中的表达和意义.天津医科大学,2016:1-26.
20 Cheng Y,Huang H,Han Y,et al.Expression of YAP in endometrial carcinoma tissues and its effect on epithelial to mesenchymal transition.Transl Cancer Res,2020,9:7248-7258.
21 Wang J,Song T,Zhou S,et al.YAP promotes the malignancy of endometrial cancer cells via regulation of IL-6 and IL-11.Mol Med,2019,25:32.
22 Yang J,Song DH,Kim CH,et al.Expression of the Hippo Pathway Core Components in Endometrial Cancer and Its Association with Clinicopathologic Features.Diagnostics(Basel),2022,12:2973.
23 程允.YAP 基因在子宫内膜癌中的表达及其与上皮间质转化关系的研究.安徽医科大学,2018:1-27.
24 Wang J,Song T,ZhouS,et al.YAP promotes the malignancy of endometrial cancer cells via regulation of IL-6 and IL-11.Mol Med,2019,25:32.