假性醛固酮减少症(pseudohypoaldosteronism,PHA)是一种发生于新生儿期及婴儿期罕见的失盐综合征,1958年有学者首次报道[1],PHA可分为Ⅰ、Ⅱ、Ⅲ型,PHAⅠ型又可分为系统型和肾型[2]。系统型PHAⅠ型是由于患儿醛固酮升高抵抗,编码上皮钠通道(epithelial sodium channel,ENaC)的基因失活突变引起的一种罕见遗传病。临床上常表现为低钠血症、高钾血症和代谢性酸中毒,系统型还有呼吸道及皮肤粟粒疹改变。SCNN1B基因变异导致的系统型PHA Ⅰ型少见。本文现报道1例SCNN1B基因变异导致的系统型PHA Ⅰ型新生儿病例,并结合相关文献进行复习。
临床资料
1.一般资料:患儿,男,8 d,主因“呕吐、体重不增8 d”于2022年4月19日入住北京大学第一医院宁夏妇女儿童医院新生儿重症监护病房。患儿系第3胎、第2产,胎龄35+6周,因“孕母重度子痫前期、羊水过少、胎儿宫内生长受限”剖宫产娩出,无缺氧窒息病史,出生体重1 860 g(体重位于同胎龄第3~5百分位数之间)。生后转入出生医院新生儿科,给予配方奶喂养,开奶后即出现间断呕吐,禁食后无缓解,排便正常,不伴腹胀、便血。完善血常规、肝肾功、电解质、胃肠道超声、腹平片及消化道造影等检查均未发现异常。母亲自然受孕,规律产检,产前3周发现妊娠期高血压合并重度子痫前期,口服药物治疗效果不佳。父母体健,另有一哥哥,现年4岁,体健。否认近亲结婚及家族遗传性疾病史。
入院体格检查:体温36.9℃,脉搏156次/分,呼吸50次/分,血压62/35 mmHg,体重1 650 g(较出生体重下降11.3%),神清,精神反应差,哭声低弱,毛发少,肤色苍白,皮肤干燥、松弛,弹性差,前囟稍凹陷,前额皮肤皲裂,全身可见以毛囊为中心的白色粟粒疹(见图1),呼吸平稳,双肺听诊未及异常,心率156次/分,心音低顿,律齐。腹软,肠鸣音存在。外生殖器着色较深,双侧睾丸已降至阴囊,足背动脉搏动有力,毛细血管充盈时间2 s。
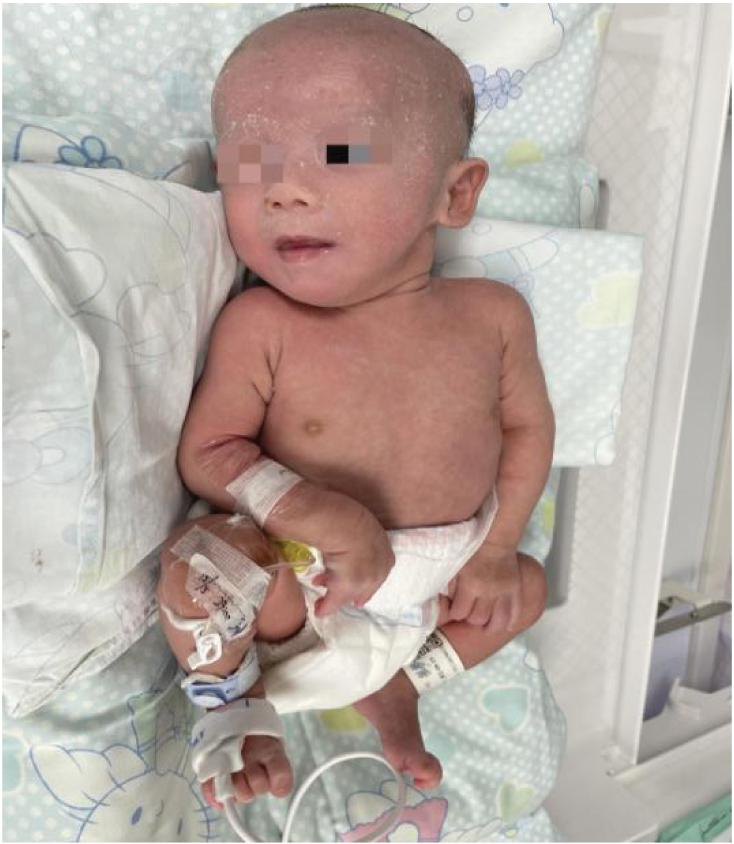
图1 患儿皮肤改变
2.辅助检查:(1)动脉血气分析。PH 7.47,PCO2 21 mmHg,PO2 91 mmHg,BE-8.4,HCO3 15.3 mmol/L,Lac 1.8 mmol/L,GLU 5.7 mmol/L。(2)电解质。K+ 7.05 mmol/L,Na+ 133 mmol/L,Cl- 101.5 mmol/L。肾功能正常。血常规、C反应蛋白、心肌酶谱、血氨、同型半胱氨酸、凝血功能、甲状腺功能、尿便常规均未见异常;(3)心电图。窦性心动过速。头颅、心脏、腹部、泌尿系及肾上腺超声均未发现异常。血、尿串联质谱、17-羟孕酮、ACTH、皮质醇结果正常。(4)第18天血醛固酮>1 000 pg/mL,第21天血醛固酮为3 325.8 pg/mL。
3.诊治经过:入院后予配方奶喂养、补液、补钠、碳酸氢钠、胰岛素、钙剂等治疗,血钾可一过性降至正常,喂养后再次上升>7 mmol/L,且顽固性低钠(118~135 mmol/L),反复呕吐,诊断初步考虑先天性肾上腺皮质增生症失盐型,住院1周时予氢化可的松口服治疗,仍有顽固性高钾(血8.04 mmol/L)、低钠(124.3 mmol/L),同期完善17-羟孕酮结果正常。住院第18天血醛固酮>1 000 pg/mL,考虑醛固酮抵抗,临床诊断假性醛固酮减少症可能,送检基因检测,加用氟氢可的松口服治疗,余上述治疗不变,血钠、血钾可恢复至正常范围但仍有反复,全身粟粒疹消退,皮肤渐光滑。基因检测结果回报后(结果如下,见基因检测)家长于第28天放弃治疗出院,出院时体重2 350 g。院外配方奶按需喂养,未遵医嘱口服药物,出院3 d后在家中死亡。
4.基因检测:在征得患儿父母同意,签署同意书后取先证者及父母双方EDTA抗凝外周血3 mL,送检北京智因东方转化医学研究中心有限公司,进行家系全外显子组测序(trio whole-exome sequencing,trio-WES)和家系基因组拷贝数变异检测(trio copy number variation sequencing,trio-CNVseq)。结果回报为SCNN1B基因复合杂合变异,一位点为c.1152+2T>G新发变异,父母均为野生型,该变异未检索到有相关文献报道,预测为可能致病性变异(PVS1+PM2)[3-4];另一位点为c.1245_1246insC(p.N416fs*35),母源,已有文献报道为致病变异[5]。患儿和父母基因检测结果见图2。
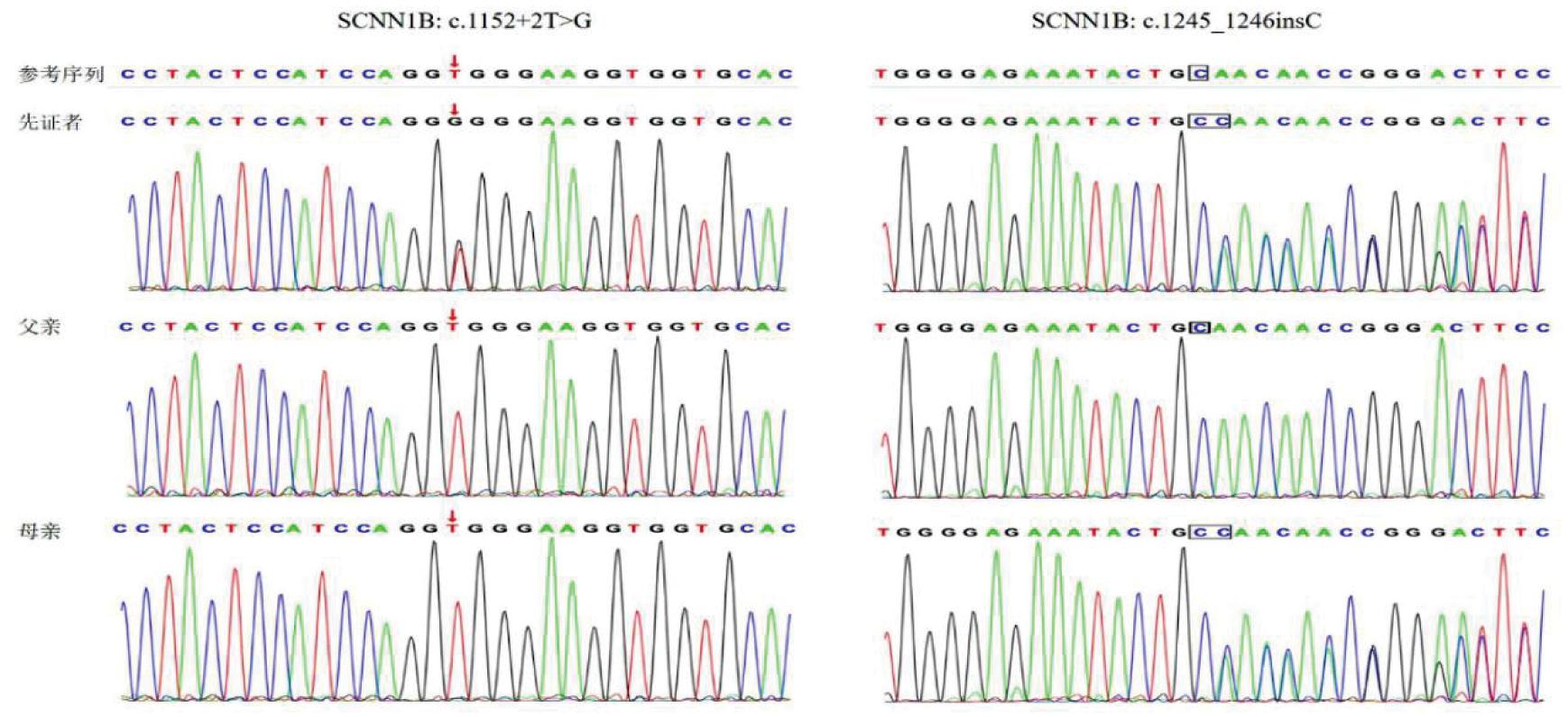
图2 患儿和父母验证者的基因测序结果
讨论
系统型假性醛固酮减少症是一种罕见危及生命的疾病,为常染色体隐性遗传病,是由编码ENaC的基因失活突变引起的[6]。该通道由三个基因编码的三个相关亚单位(α、β和γ)组成,α亚单位基因SCNN1A位于12号染色体上,而β亚单位基因SCNN1B和γ亚单位基因SCNN1G位于16号染色体上。任何一个基因变异失活,均可导致ENaC失活致病。本文报道的新生儿有低钠血症、高钾血症、脱水、代谢性酸中毒,开始怀疑CAH,氢化可的松治疗效果差,检查17羟孕酮正常及醛固酮升高后,临床考虑系统型PHAⅠ型,最终经基因结果证实为SCNN1B变异所致,并结合文献进行复习。
首先,系统型PHAⅠ型一般特点。发病年龄,国内已报道10例系统型PHAⅠ型病例[7-14](见表1),本文报道1例,11例患者均在新生儿期起病,1例新生儿期出现电解质紊乱,误诊为肾上腺皮质增生症,至2月龄确诊为系统型PHAⅠ型[9]。杨汉华等[11]报道1例年龄为4岁3个月,但起病及确诊年龄为新生儿期,11例患儿平均发病年龄11.6 d。性别:男性4例[7-8,12](36.4%,4/11),女性7例[9-14](63.6%,7/11)。家族史:1例患儿父母表兄妹近亲结婚,胞姐因“低钠、高钾、代酸、肾功能不全”夭折[10];2例无近亲结婚史,但其胞姐因“高钾、拒奶”在新生儿期死亡。另2例为双胎兄妹,生后均有相同症状,最终死于恶性心律失常,除该双胎外,家中无其他成员患相同疾病史;其余6例无家族性疾病史。本例患儿起病年龄小、无家族性疾病史,与文献报道结果一致。
表1 系统型PHAⅠ型患儿的临床表现、实验室检查及基因结果
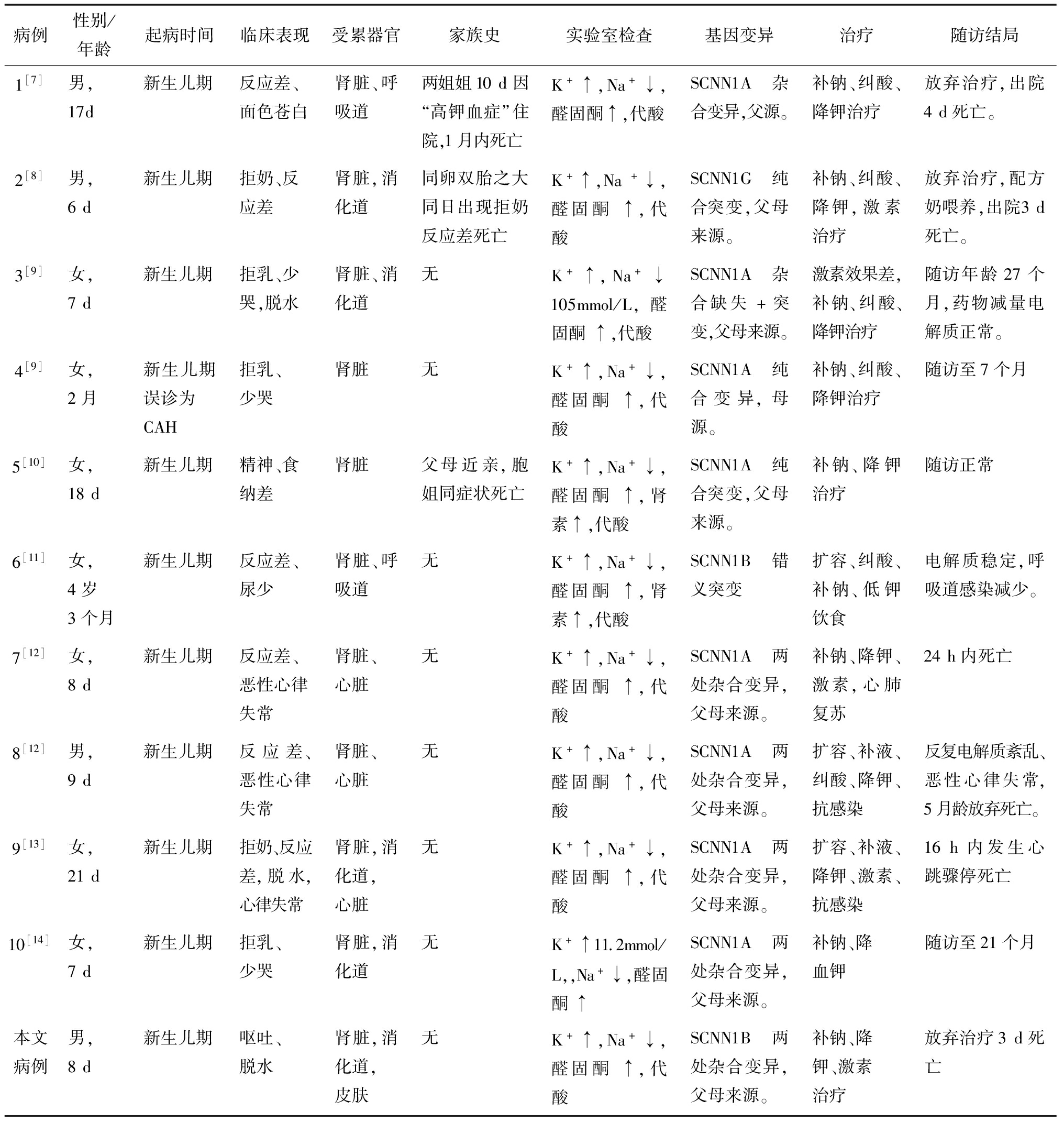
病例性别/年龄起病时间临床表现受累器官家族史实验室检查基因变异治疗随访结局1[7]男,17d新生儿期反应差、面色苍白肾脏、呼吸道两姐姐10d因“高钾血症”住院,1月内死亡K+↑,Na+↓,醛固酮↑,代酸SCNN1A杂合变异,父源。补钠、纠酸、降钾治疗放弃治疗,出院4d死亡。2[8]男,6d新生儿期拒奶、反应差肾脏,消化道同卵双胎之大同日出现拒奶反应差死亡K+↑,Na+↓,醛固酮↑,代酸SCNN1G纯合突变,父母来源。补钠、纠酸、降钾,激素治疗放弃治疗,配方奶喂养,出院3d死亡。3[9]女,7d新生儿期拒乳、少哭,脱水肾脏、消化道无K+↑,Na+↓105mmol/L,醛固酮↑,代酸SCNN1A杂合缺失+突变,父母来源。激素效果差,补钠、纠酸、降钾治疗随访年龄27个月,药物减量电解质正常。4[9]女,2月新生儿期误诊为CAH拒乳、少哭肾脏无K+↑,Na+↓,醛固酮↑,代酸SCNN1A纯合变异,母源。补钠、纠酸、降钾治疗随访至7个月5[10]女,18d新生儿期精神、食纳差肾脏父母近亲,胞姐同症状死亡K+↑,Na+↓,醛固酮↑,肾素↑,代酸SCNN1A纯合突变,父母来源。补钠、降钾治疗随访正常6[11]女,4岁3个月新生儿期反应差、尿少肾脏、呼吸道无K+↑,Na+↓,醛固酮↑,肾素↑,代酸SCNN1B错义突变扩容、纠酸、补钠、低钾饮食电解质稳定,呼吸道感染减少。7[12]女,8d新生儿期反应差、恶性心律失常肾脏、心脏无K+↑,Na+↓,醛固酮↑,代酸SCNN1A两处杂合变异,父母来源。补钠、降钾、激素,心肺复苏24h内死亡8[12]男,9d新生儿期反应差、恶性心律失常肾脏、心脏无K+↑,Na+↓,醛固酮↑,代酸SCNN1A两处杂合变异,父母来源。扩容、补液、纠酸、降钾、抗感染反复电解质紊乱、恶性心律失常,5月龄放弃死亡。9[13]女,21d新生儿期拒奶、反应差,脱水,心律失常肾脏,消化道,心脏无K+↑,Na+↓,醛固酮↑,代酸SCNN1A两处杂合变异,父母来源。扩容、补液、降钾、激素、抗感染16h内发生心跳骤停死亡10[14]女,7d新生儿期拒乳、少哭肾脏,消化道无K+↑11.2mmol/L,,Na+↓,醛固酮↑SCNN1A两处杂合变异,父母来源。补钠、降血钾随访至21个月本文病例男,8d新生儿期呕吐、脱水肾脏,消化道,皮肤无K+↑,Na+↓,醛固酮↑,代酸SCNN1B两处杂合变异,父母来源。补钠、降钾、激素治疗放弃治疗3d死亡
其次,系统型PHAⅠ型临床表现。复习11例病例中均有低钠血症、高钾血症、脱水等肾脏失盐表现,其他肾外表现:皮肤粟粒疹改变1例,伴有拒乳、食奶差等消化系统症状有6例,循环系统出现休克1例,恶性心律失常有3例。其发病机制为系统型PHAⅠ型通常在新生儿期出现严重的盐耗危象[15],因ENaC分布在肾脏远曲小管、呼吸道、外分泌腺、结肠远端和皮肤等的上皮组织,钠通过肾脏、结肠、汗腺和唾液腺流失,导致钠依赖性液体吸收减少,出现低钠血症、高钾血症、酸中毒和脱水,气道腔中的液体过量,导致气道变窄,使患者出现喘息、气道感染、呼吸窘迫等呼吸系统症状[16];消化道表现为拒乳、呕吐、腹泻等症状;累及皮肤表现为大疱性皮炎、脓疱性红色痱子、粟粒疹等[17],是由于汗腺导管闭塞和钠积累导致的小汗腺炎症,本例报道新生儿皮肤表现符合上述改变,对临床提示诊断价值较大;也有患儿可能表现出嗜睡和发育不良。肾素血管紧张素醛固酮代偿性增加,引起高肾素和高醛固酮血症[11],反映了肾脏对醛固酮的抵抗。辅助检查,11例患者均有高钾血症、低钠血症发生,病例10血钾最高达11.2 mmol/L,病例3血钠最低至105 mmol/L,11例醛固酮均升高,2例肾素活性升高,10例有代谢性酸中毒,17羟-孕酮及泌尿系超声检查均未发现异常。系统型PHAⅠ型预后及随访,报道的存活5例患儿中,4例患者基因型为SCNN1A突变,1例基因型为SCNN1B突变,随访年龄为7个月至4岁3个月,病情控制良好;死亡6例中,4例患者在放弃治疗后家中死亡,死亡年龄均在新生儿期;1例患者住院期间发生心跳骤停于入院16 h死亡;1例患者坚持治疗至婴儿期,反复出现电解质紊乱,极易有恶性心律失常,于5个月时死亡;发生恶性心律失常2例为同胞双胎[9-11,14]。诊断与鉴别诊断,系统型PHAⅠ型可通过典型临床表现、家系调查、大小便、汗腺、唾液中排钠增多以及结合实验室检查,包括血尿电解质、血醛固酮、肾素等,最终完善基因检测以确诊[8,18]。系统型PHAⅠ型的初始表现可能与盐耗性先天性肾上腺皮质增生症(CAH)、肾型PHAⅠ型、继发性PHA或肾小管酸中毒(RTA)IV型相混淆,临床需要仔细鉴别,尤其在疾病初始阶段容易误诊为21-羟化酶缺乏引起的盐耗性CAH。醛固酮缺乏导致与醛固酮抵抗出现相同的症状,醛固酮抵抗是PHAⅠ型的特征。继发性PHA是继发于尿路感染或尿路畸形的短暂醛固酮抵抗,在治疗基础疾病后症状可得到改善。RTA型的特征是尿液中氨水平低,通常表现为轻度低钠血症、高钾血症和代谢性酸中毒,伴有醛固酮缺乏或信号传导缺陷[19]。本例患儿表现为呕吐、皮肤粟粒疹改变、电解质紊乱、代谢性酸中毒、醛固酮升高,初步考虑CAH,治疗效果不佳,与文献报道结果相似。
再次,系统型PHAⅠ型基因突变特点。总结国内报道的11例患者,3例纯合突变中死亡1例[8],为SCNN1G型基因变异(家属放弃),另2例为SCNN1A基因变异[9-10],随访正常,预后较好。8例复合杂合突变患者死亡5例[7-8,12-13](SCNN1A型为4例,SCNN1B型为1例),存活3例[9,11,14](SCNN1A型2例,SCNN1B型1例)。从上述资料分析,似乎复合杂合突变的表型要比纯合突变的表型严重,各基因型均存在死亡及存活患者,因病例数少,且患者死亡与家属是否坚持治疗有很大关联,故尚无依据证实表型严重程度与基因突变类型有关。1例系统型PHAⅠ型为SCNN1G基因纯合整码突变,缺失6个碱基,其父母为杂合突变;2例SCNN1B变异中,1例存在两处错义突变,父母未验证;本例患儿SCNN1B变异有两处,一处为新发突变,另一处为来自母亲的移码变异;8例为SCNN1A基因变异,其中7例为杂合突变,其变异均证实来源于父母双方,1例为纯合突变,母亲携带突变为杂合子(见表1)。
最后,在治疗方面。系统型PHA I型患者经常出现严重的盐耗危象,因此需要及时管理以预防严重疾病,尚无根治性治疗手段。在急性期,患儿需要静脉补液纠正脱水、酸中毒以及静脉注射氯化钠来治疗低钠血症。钠的需求量通常很高,出院后仍需长期口服大剂量钠盐纠正低钠血症,随着年龄增长,补钠量逐渐减少,可能与年龄增长,食盐摄入量逐渐增加,肾脏逐渐发育成熟,近端肾单位钠吸收代偿性增加等因素有关[8,20-21]。另外,严重的高钾血症可引起致死性心律失常或心脏停搏,需及时纠正,可通过胰岛素、钙剂、补充降钾树脂等降血钾治疗,严重时可行腹膜透析或血液透析等治疗,出院后低钾饮食并继续口服降钾树脂以降血钾治疗。婴儿可选用高钠低钾配方奶喂养维持电解质平衡[17]。治疗有效的指标为患者的失盐状态纠正,渴感恢复,生长发育恢复正常,血浆肾素活性和血醛固酮浓度下降或恢复正常[18]。
综上所述,系统型PHAⅠ型临床特征主要为新生儿期呕吐,皮肤可有典型粟粒疹改变,实验室主要特征为高钾血症、低钠血症、代谢性酸中毒和高醛固酮血症,确认依赖于基因检测。本研究通过对目前已确诊病例的综合分析及总结,对系统型PHA I型病例进行学习及归纳,旨在提高儿科医师对本病的认识及早期识别能力,从而减少误诊、漏诊,尽可能提高患儿的存活率。
1 CHEEK DB,PERRY JW.A salt wasting syndrome in infancy.Arch Dis Child,1958,33:252-256.
2 Hanukoglu A.Type I pseudohypoaldosteronism includes two clinically and genetically distinct entities with either renal or multiple target organ defects.J Clin Endocrinol Metab,1991,73:936-944.
3 Bao M,Li P,Li Q,et al.Genetic screening for monogenic hypertension in hypertensive individuals in a clinical setting.J Med Genet,2020,57:571-580.
4 Richards S,Aziz N,Bale S,et al.Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology.Genet Med,2015,17:405-424.
5 Seyhanli M,Ilhan O,Gumus E,et al.Pseudohypoaldosteronism Type 1 Newborn Patient with a Novel Mutation in SCNN1B.J Pediatr Intensive Care,2020,9:145-148.
6 Cayir A,Demirelli Y,Yildiz D,et al.Systemic Pseudohypoaldosteronism Type 1 due to 3 Novel Mutations in SCNN1Aand SCNN1BGenes.Horm Res Paediatr,2019,91:175-185.
7 邹亮燕,曾丽春,蒋思远,等.多脏器型假性醛固酮减少症Ⅰ型1例并文献复习.中国循证儿科杂志,2017,12:378-382.
8 尹莉萍,王伟,钱丽娟,等.SCNN1G基因新发突变致假性醛固酮减少症Ⅰ型1例并文献复习.中华实用儿科临床杂志,2020,35:941-943.
9 沈烨,沈永年,王剑,等.假性醛固酮减少症Ⅰ型患儿2例临床与基因分析.临床儿科杂志,2011,29:983-987.
10 王惠霞,孙红格,张琦,等.全身型假性醛固酮减少症Ⅰ型一例并文献复习.中国小儿急救医学,2021,28:835-837.
11 杨汉华,温丽华,谢丽春,等.SCNN1B基因突变致全身型假性醛固酮减少症1型1例报告并文献复习.临床儿科杂志,2019,37:605-608.
12 龚艳,郭盛,李嫔.假性醛固酮减少症1型6例患儿的临床特征及基因结果并文献复习.中华实用儿科临床杂志,2021,36:1648-1650.
13 皮亚雷,张亚男,门欣怡,等.新发突变致常染色体隐性遗传Ⅰ型假性醛固酮减少症1例.中华实用儿科临床杂志,2018,33:625-626.
14 丁宇,李娟,沈永年,等.婴儿失盐综合征4例病因分析及基因诊断应用价值探讨.中国实用儿科杂志,2016,31:444-449.
15 Nur N,Lang C,Hodax JK,et al.Systemic Pseudohypoaldosteronism Type I:A Case Report and Review of the Literature.Case Rep Pediatr,2017,2017:7939854.
16 Kerem E,Bistritzer T,Hanukoglu A,et al.Pulmonary epithelial sodium-channel dysfunction and excess airway liquid in pseudohypoaldosteronism.N Engl J Med,1999,341:156-162.
17 Serra G,Antona V,D′Alessandro MM,et al.Novel SCNN1A gene splicing-site mutation causing autosomal recessive pseudohypoaldosteronism type 1(PHA1) in two Italian patients belonging to the same small town.Ital J Pediatr,2021,47:138.
18 綦奕颖,吴道奇.44例假性醛固酮减少症Ⅰ型临床分析并文献复习.儿科药学杂志,2021,27:14-17.
19 Ring T,Frische S,Nielsen S.Clinical review:Renal tubular acidosis-a physicochemical approach.Crit Care,2005,9:573-580.
20 Dirlewanger M,Huser D,Zennaro MC,et al.A homozygous missense mutation in SCNN1A is responsible for a transient neonatal form of pseudohypoaldosteronism type 1.Am J Physiol Endocrinol Metab,2011,301:E467-473.
21 Dogan CS,Erdem D,Mesut P,et al.A novel splice site mutation of the beta subunit gene of epithelial sodium channel(ENaC) in one Turkish patient with a systemic form of pseudohypoaldosteronism Type 1.J Pediatr Endocrinol Metab,2012,25:1035-1039.