多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄女性最常见的生殖内分泌疾病,其主要临床特征为月经紊乱和高雄激素血症,国内PCOS患病率在7.8%[1]。阻塞性呼吸睡眠暂停(obstructive sleep apnea,OSA)是一种以睡眠打鼾伴呼吸暂停和日间思睡为主要临床表现的呼吸系统疾病,以呼吸暂停低通气指数(apnea-hypopnea index,AHI)≥5次/小时为标准,OSA患病率为9%~38%,男性高于女性,PCOS患者的OSA患病率明显高于正常人群患病率且症状加重[2]。目前PCOS与OSA相互影响机制尚不明确,本文将对PCOS与OSA的关系的研究进展进行综述。
一、PCOS合并OSA的流行病学分析
许多研究发现PCOS患者中OSA患病率更高,不同的meta分析报道PCOS患者OSA患病率为22%和35%[3-4],而女性总体的患病率为6%~19%[2]。在一项针对青少年PCOS患者的研究发现,无论有无诊断OSA,PCOS患者的平均AHI值都高于对照组[5]。
研究发现[3],成年PCOS患者OSA患病率明显上升,最高达到了32%;而青少年PCOS患者OSA患病率与对照组无显著差异,仅有8%。不同国家及地区研究中,PCOS患者中OSA患病率也各不相同(表1)。基于研究方法不同,英国[6]和中国台湾[7]的研究为基于数据库的回顾性研究,患者的睡眠呼吸检测的筛查比率低于其他研究,故而PCOS患者的OSA患病率较实际情况明显偏低,但与非PCOS患者相比患病率仍显著升高。
表1 不同国家PCOS患者OSA患病率
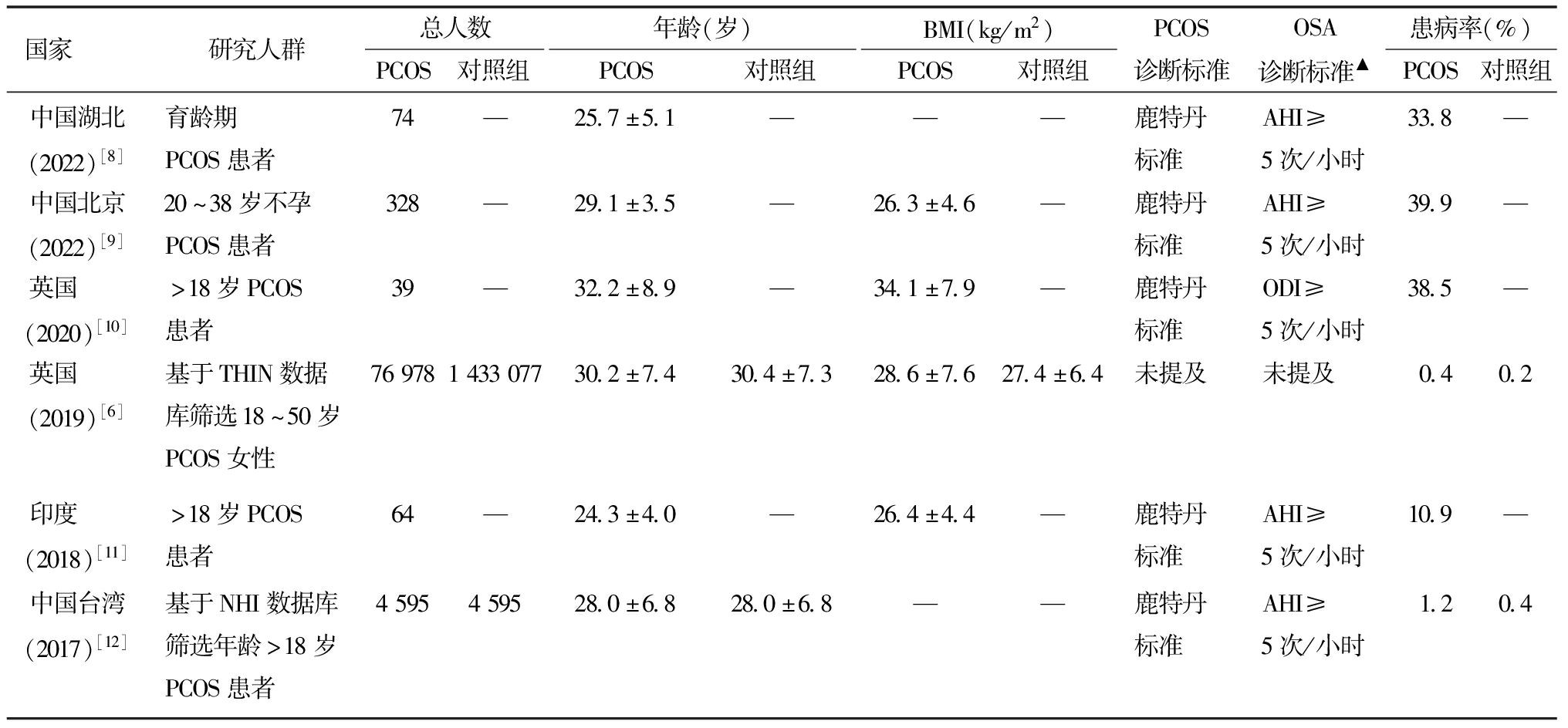
国家研究人群总人数PCOS对照组年龄(岁)PCOS对照组BMI(kg/m2)PCOS对照组PCOS诊断标准OSA诊断标准▲患病率(%)PCOS对照组中国湖北(2022)[8]育龄期PCOS患者74—25.7±5.1———鹿特丹标准AHI≥5次/小时33.8—中国北京(2022)[9]20^38岁不孕PCOS患者328—29.1±3.5—26.3±4.6—鹿特丹标准AHI≥5次/小时39.9—英国 (2020)[10]>18岁PCOS患者39—32.2±8.9—34.1±7.9—鹿特丹标准ODI≥5次/小时38.5—英国 (2019)[6]基于THIN数据库筛选18^50岁PCOS女性76978143307730.2±7.430.4±7.328.6±7.627.4±6.4未提及未提及0.40.2印度 (2018)[11]>18岁PCOS患者64—24.3±4.0—26.4±4.4—鹿特丹标准AHI≥5次/小时10.9—中国台湾(2017)[12]基于NHI数据库筛选年龄>18岁PCOS患者4595459528.0±6.828.0±6.8——鹿特丹标准AHI≥5次/小时1.20.4
▲所有研究均使用多导睡眠监测诊断OSA;ODI:oxygen desaturation index,减氧指数
不同国家针对PCOS患者的研究中,OSA的患病率为10.9%~39.9%[6,8-12],这与地域环境、BMI相关。同时有的研究患者数量少、其数据缺乏代表性,需更多大样本人群研究进一步推算OSA在PCOS患者中的患病率。
二、PCOS合并OSA的临床表现
PCOS合并OSA患者临床表现复杂多样,除了PCOS及OSA的常见临床表现还有一些其他临床表现。
1.PCOS的临床表现:PCOS的临床表现多样化,主要包括生殖、代谢和心理三方面的表现,有月经不规律、多毛、痤疮、不孕、妊娠并发症、糖脂代谢异常、心血管疾病、认知功能障碍、焦虑和抑郁等。PCOS患者常见的睡眠问题有入睡困难、易醒、白天疲倦和快速眼动睡眠时间下降[13]。
PCOS会导致女性的不孕,约80%的无排卵性不孕由PCOS引起[14]。PCOS患者在辅助生殖中,促排卵容易现低反应及过度反应两个极端,取卵中空卵泡数高,受精率、囊胚转化率低,卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)风险高[15]。
PCOS患者孕期更容易发生妊娠期糖尿病、妊娠期高血压、子痫前期、流产、早产等,剖宫产率增加,其中有高雄激素血症的PCOS患者风险更高[16]。
PCOS患者的后代更容易发生新生儿畸形(心血管系统、泌尿系统)、新生儿窒息、低血糖、围产期死亡,住院率升高,发生代谢异常、神经系统疾病及哮喘的风险增加[17]。
2.OSA的临床表现:OSA会导致白天注意力下降、认知功能减退、工作能力和生活质量下降等。临床观察和实验还表明,OSA可能影响心血管系统、内分泌系统、消化系统、精神与神经系统,导致高血压、冠心病、胰岛素抵抗、代谢综合征、胃食管反流、抑郁、焦虑和脑血管疾病等多种问题[18]。
在生育方面,有研究发现,OSA患者妊娠期高血压、子痫前期、妊娠期糖尿病、早产、剖宫产及产后出血等妊娠并发症风险明显升高,其还会影响胎儿发育,导致巨大儿、胎儿宫内生长受限、胎儿畸形甚至是死胎[19]。
3.PCOS合并OSA的临床表现:PCOS合并OSA患者的血压、BMI、雄激素、血糖、血脂水平升高,而AMH水平下降,OSA加重PCOS患者糖脂代谢异常,加剧其焦虑、抑郁情绪,降低生活质量,增加不孕及心血管疾病风险[9,20]。
三、PCOS与OSA相互影响机制
PCOS与OSA患者临床表现有诸多相似之处,但二者相互影响病生理机制尚不明确,目前推测二者相互影响的可能机制主要有以下五方面。
1.代谢异常:PCOS患者常患有代谢异常,其中包括肥胖、胰岛素抵抗、脂代谢异常,继而可能有代谢综合征(metabolic syndrome,MS)等[21]。MS是指人体的蛋白质、脂肪、碳水化合物等物质发生代谢紊乱的病理状态,其中心环节是肥胖和胰岛素抵抗。MS的主要临床表现有肥胖、血脂异常、高血压及胰岛素抵抗。肥胖是PCOS的典型临床表现之一,也是OSA的主要风险因素[22]。在对于肥胖PCOS青少年的研究中发现,其睡眠障碍的发生率、AHI指数与MS的严重程度正相关[23]。PCOS合并OSA的患者有更高的BMI、腰围及腰臀比[6];进一步对PCOS患者BMI分组后,相同BMI组PCOS患者与非PCOS患者相比的OSA发病率仍然更高[6]。除了肥胖,PCOS合并OSA患者胰岛素抵抗发生率更高,其空腹胰岛素水平、糖化血红蛋白水平显著高于无OSA患者[22];在血压、血脂方面,PCOS合并OSA患者平均收缩压更高,甘油三酯、低密度脂蛋白胆固醇水平上升,高密度脂蛋白胆固醇水平降低[24]。OSA的发病与PCOS患者代谢异常有关,但其具体的发病机制尚不明确。
2.雄激素:高雄激素血症是PCOS的重要临床表现。雄激素水平与PCOS患者OSA发病率及严重程度相关[25]。OSA的发病率在男性中明显高于女性,这被认为与男女性天生雄激素水平差异是相关的[26]。高雄激素血症可能导致腹部肥胖、咽喉部结构改变以及睡眠模式改变,从而导致OSA的发生[27]。与其他女性OSA患者相比,PCOS合并OSA患者更容易出现白日思睡,与男性OSA患者临床表现更为相似[10]。一项针对肥胖PCOS青少年的研究发现,与同BMI、同年龄的非PCOS女孩相比,PCOS女孩OSA的患病率更高,而与同BMI、同年龄的男孩发病率无明显差异[28]。故考虑 PCOS可能通过雄激素水平升高介导OSA发生并影响其严重程度。
3.雌激素和孕激素:PCOS患者不仅雄激素水平较高,而且雌激素、孕激素水平较低。在一项针对24~72岁女性研究中发现,睡眠呼吸暂停事件与低雌激素水平相关,并且绝经后雌激素替代治疗可显著减少睡眠呼吸暂停事件的发生[29]。PCOS患者的循环孕酮水平低于正常的女性,孕酮水平低可能与PCOS排卵障碍及排卵后黄体功能异常有关[30]。临床研究表明,无排卵是PCOS患者罹患OSA的高危因素也与之佐证[6]。有研究表明,孕酮水平升高对于孕期女性体重增加导致的OSA风险有保护作用[31]。孕酮可以通过刺激呼吸中枢缓解高碳酸血症和缺氧状态,同时还能够舒张上气道括约肌,降低气道阻力,从而缓解呼吸道阻塞[31]。由此可见,PCOS患者雌孕激素水平减低是OSA发病的影响因素之一。
4.氧化应激:OSA是氧化应激的主要原因之一。OSA 中反复出现的缺氧和线粒体功能障碍导致活性氧的形成,从而导致细胞和DNA损伤、氧化应激[32]。活性氧表达增加、氧化与抗氧化机制失衡介导的氧化应激损伤使卵母细胞抗氧化能力下降、卵泡发育受损,从而导致卵母细胞成熟障碍或卵泡排卵障碍[33]。除此之外,氧化应激也会加重胰岛素抵抗、引起高雄激素血症,多方面因素共同作用使患者出现月经紊乱如闭经、月经稀发、无排卵不孕等临床表现,而这正是 PCOS 的特征[34]。由此推测OSA可能通过促进氧化应激过程使PCOS临床表现更加复杂化和严重化。
5.昼夜节律异常:机体新陈代谢过程由昼夜节律调控,其神经中枢为视交叉上核(suprachiasmatic nucleus,SCN)。SCN通过时钟基因的转录-翻译-反馈环路调控昼夜节律[35],同时通过交感神经支配松果体分泌褪黑素影响机体新陈代谢[36]。在卵巢组织中,时钟基因也呈周期性表达,从而调节性激素分泌[37]。OSA的慢性缺氧状态能够增加缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)的表达,从而影响Per1、Cry1、Bmal1和CLOCK等时钟基因的表达[38],导致昼夜节律及褪黑素分泌异常,从而引起激素紊乱、代谢异常、心血管疾病及精神疾病等。Per1基因的表达与促黄体生成素(lutinizing hormone,LH)峰相关,Per1的表达异常会导致排卵障碍[39];Bmal1基因表达异常与高雄激素血症及胰岛素抵抗相关,并影响颗粒细胞的凋亡和排卵[40]。综上所述,OSA可能导致昼夜节律异常从而加重PCOS临床表现。
四、PCOS合并OSA的治疗
1.生活方式干预:PCOS及OSA首要的治疗为生活方式干预。(1)饮食方面。推荐地中海式饮食,以蔬菜水果、鱼类、五谷杂粮、豆类和橄榄油为主的饮食方式,其中蛋白质占食物中15%~20%,脂肪占20%~30%,碳水化合物占45%~60%。(2)运动方面。建议适量规律的锻炼,中等强度锻炼以有氧运动为主,保证30 min/d,每周至少5 d。(3)减重治疗。减重对于OSA和PCOS都有良好的效果。目前指南推荐所有肥胖的OSA患者减肥[41]。虽然单纯通过减肥很难治愈OSA和PCOS,但是可以降低疾病严重程度,改善胰岛素抵抗、心理健康、不孕情况,降低心血管疾病风险,在联合其他治疗情况下获益更大[42]。(4)行为干预。即养成健康的生活方式,规律作息、戒烟戒酒,培养良好的饮食、运动及睡眠习惯。(5)睡眠方面。养成规律作息习惯、保证每日6~8 h睡眠,睡前避免抽烟、喝酒、使用电子设备,可以改善睡眠质量、减轻白日思睡等症状。同时需关注患者心理状态,必要时建议心理干预及治疗。通过生活方式改变可改善患者高雄激素血症、代谢情况以及生活质量,但其对排卵及激素水平改善有限[42]。
2.药物治疗:PCOS合并OSA患者常有月经紊乱,改善月经可以应用孕激素或短效口服避孕药(雌孕激素合剂)[43]。短效口服避孕药在改善月经周期、降低雄激素的作用上优于孕激素,对于肥胖患者还可以联用二甲双胍提高治疗效果[42]。很多研究肯定了二甲双胍在改善PCOS中的作用。对于肥胖的PCOS患者,长期二甲双胍治疗可以稳定血糖、降低体重、改善月经、降低雄激素水平,改善抑郁情绪,并降低向空腹血糖升高、2型糖尿病的发病率[42,44]。同时有研究发现,二甲双胍治疗可以改善青春期肥胖PCOS患者睡眠障碍及白日思睡的发生,这可能是与二甲双胍减重、降低雄激素水平、改善胰岛素抵抗情况有关[45]。
3.持续气道正压通气:持续气道正压通气(continuous positive airway pressure,CPAP)是OSA的一线治疗方法,可以纠正睡眠中低氧,提高睡眠及生活质量,改善患者认知水平,降低OSA远期并发症及病死率[46]。研究发现,对于年轻PCOS合并OSA患者,CPAP可以改善患者的胰岛素抵抗情况、心脏代谢功能,降低血液去甲肾上腺素浓度、白天舒张压[47]。CPAP通过改善上气道梗阻、间歇缺氧,降低交感神经活性,从而降低患者的血压、胰岛素抵抗及血脂水平,减轻OSA的临床症状及代谢紊乱[48]。
4.助孕治疗:PCOS以及患者常合并不孕的问题。在促排卵方面,来曲唑为首选用药,与同为一线药物的克罗米芬相比,其可以提高活产率、临床妊娠率,缩短待孕时间[49],在肥胖的患者中联用二甲双胍可以促进排卵,但不能够预防妊娠期糖尿病的发生。对于拟行体外受精(in-vitro fertilization,IVF)的患者推荐拮抗剂方案促排卵、GnRH-a扳机,可以减少卵巢过度刺激综合征的发生[50]。对于克罗米芬抵抗但不能使用来曲唑的PCOS患者可以尝试卵巢打孔。与单用促排卵药物相比,卵巢打孔可以降低多胎妊娠及OHSS的风险,但其会降低活产率,并有手术相关并发症风险[43]。对于难治性PCOS、卵子成熟障碍及卵巢过度刺激病史患者可考虑未成熟卵母细胞体外成熟培养(in vitro maturation,IVM)助孕,即将未成熟的卵母细胞取出,在体外进行培养、受精,然后将胚胎移植到母亲子宫腔内生长。在IVF助孕期间,卵母细胞和胚胎可能会因使用卵巢刺激方案产生高水平超氧化物自由基,同时卵母细胞操作会改变内源性抗氧剂的水平[38],研究表明,口服低剂量的褪黑素可提高卵泡液中褪黑素浓度,改善卵母细胞核成熟、提高优质胚胎率[51]。
五、总结与展望
PCOS是一种涉及多系统的生殖内分泌疾病,临床表型多样化,越来越多的研究证据表明,PCOS患者易合并OSA,而OSA反向加重PCOS患者的临床表型[9],但二者关联机制仍不明确。目前的机制研究主要有代谢异常、高雄激素血症、雌孕激素水平降低、昼夜节律异常和氧化应激五方面。现有对于PCOS和OSA的临床研究都样本量较少,采用的诊断标准不统一,对于二者关系及发病率的研究依旧需要大型前瞻性队列研究。
PCOS合并OSA会使患者生活质量降低,影响长期健康,需要引起临床的注意。更好的早期识别、诊断、治疗OSA能够提升PCOS患者的生活质量及远期健康。
1 Yang R,Li Q,Zhou Z,et al.Changes in the prevalence of polycystic ovary syndrome in China over the past decade.Lancet Reg Health West Pac,2022,25:100494.
2 Senaratna CV,Perret JL,Lodge CJ,et al.Prevalence of obstructive sleep apnea in the general population:A systematic review.Sleep Med Rev,2017,34:70-81.
3 Helvaci N,Karabulut E,Demir AU,et al.Polycystic ovary syndrome and the risk of obstructive sleep apnea:a meta-analysis and review of the literature.Endocr Connect,2017,6:437-445.
4 Kahal H,Kyrou I,Uthman OA,et al.The prevalence of obstructive sleep apnoea in women with polycystic ovary syndrome:a systematic review and meta-analysis.Sleep Breath,2020,24:339-350.
5 Nandalike K,Agarwal C,Strauss T,et al.Sleep and cardiometabolic function in obese adolescent girls with polycystic ovary syndrome.Sleep Med,2012,13:1307-1312.
6 Kumarendran B,Sumilo D,O′Reilly MW,et al.Increased risk of obstructive sleep apnoea in women with polycystic ovary syndrome:a population-based cohort study.Eur J Endocrinol,2019,180:265-272.
7 Lin TY,Lin PY,Su TP,et al.Risk of developing obstructive sleep apnea among women with polycystic ovarian syndrome:a nationwide longitudinal follow-up study.Sleep Med,2017,36:165-169.
8 宋岩,何鑫,胡克.多囊卵巢综合征合并阻塞性睡眠呼吸暂停临床特征与危险因素分析.临床肺科杂志,2022,27:822-828.
9 Yang R,Gao C,Yan Y,et al.Analysis of the proportion and clinical characteristics of obstructive sleep apnea in women with polycystic ovary syndrome.Sleep Breath,2022,26:497-503.
10 Kahal H,Tahrani AA,Kyrou I,et al.The relationship between obstructive sleep apnoea and quality of life in women with polycystic ovary syndrome:a cross-sectional study.Ther Adv Endocrinol Metab,2020,11:2042018820906689.
11 Saha S,Sinha S,Sharma SK,et al.Sleep Disorders in Polycystic Ovary Syndrome(PCOS) and Their Metabolic Correlates.Am J Resp Crit Care Medicine Conference:American Thoracic Society International Conference,ATS 197(MeetingAbstracts).
12 Lin TY,Lin PY,Su TP,et al.Risk of developing obstructive sleep apnea among women with polycystic ovarian syndrome:a nationwide longitudinal follow-up study.Sleep Med,2017,36:165-169.
13 Mo L,Mansfield DR,Joham A,et al.Sleep disturbances in women with and without polycystic ovary syndrome in an Australian National Cohort.Clin Endocrinol(Oxf),2019,90:570-578.
14 Balen AH,Morley LC,Misso M,et al.The management of anovulatory infertility in women with polycystic ovary syndrome:an analysis of the evidence to support the development of global WHO guidance.Hum Reprod Update,2016,22:687-708.
15 Liu S,Lv YS,Han S,et al.A novel GnRH antagonist protocol based on LH levels versus traditional flexible GnRH antagonist protocol in PCOS patients undergoing in vitro fertilization:study protocol for a randomized controlled,non-inferiority trial.Trials,2022,23:654.
16 de Wilde MA,Lamain-de Ruiter M,Veltman-Verhulst SM,et al.Increased rates of complications in singleton pregnancies of women previously diagnosed with polycystic ovary syndrome predominantly in the hyperandrogenic phenotype.Fertil Steril,2017,108:333-340.
17 Hart R.Generational Health Impact of PCOS on Women and their Children.Med Sci(Basel),2019,7:49.
18 Osman AM,Carter SG,Carberry JC,et al.Obstructive sleep apnea:current perspectives.Nat Sci Sleep,2018,10:21-34.
19 Tayade S,Toshniwal S.Obstructive Sleep Apnea in Pregnancy:A Narrative Review.Cureus,2022,14:e30387.
20 Kahal H,Tahrani AA,Kyrou I,et al.The relationship between obstructive sleep apnoea and quality of life in women with polycystic ovary syndrome:a cross-sectional study.Ther Adv Endocrinol Metab,2020,11:2042018820906689.
21 Si M,Xu W,Qi X,et al.Metabolic Syndrome Rather Than Other Phenotypes in PCOS as a Predictive Indicator for Clinical Outcomes in IVF:Comprehensive Phenotypic Assessment across All PCOS Classifications.J Clin Med,2023,12:5073.
22 Bambhroliya Z,Sandrugu J,Lowe M,et al.Diabetes,Polycystic Ovarian Syndrome,Obstructive Sleep Apnea,and Obesity:A Systematic Review and Important Emerging Themes.Cureus,2022,14:e26325.
23 Simon S,Rahat H,Carreau AM,et al.Poor Sleep Is Related to Metabolic Syndrome Severity in Adolescents With PCOS and Obesity.J Clin Endocrinol Metab,2020,105:e1827-1834.
24 Kahal H,Kyrou I,Uthman O,et al.The association between obstructive sleep apnea and metabolic abnormalities in women with polycystic ovary syndrome:a systematic review and meta-analysis.Sleep,2018,41.
25 Bayuaji H,Nataprawira HM,Sastramihardja HS,et al The Correlation of Serum Total Testosterone,Sex Hormone Binding Globulin and Free Androgen Index with Athens Insomnia Scale Score in Polycystic Ovary Syndrome.Indones Biomed J,2018,10:46-50.
26 Hernandez CR,A on MDM,Sayar LS,et al.Differences in obstructive sleep apnea syndrome(OSA) according to gender in patients with suspected OSA.Eur Respir J,2017,50(suppl 61):PA2341.
on MDM,Sayar LS,et al.Differences in obstructive sleep apnea syndrome(OSA) according to gender in patients with suspected OSA.Eur Respir J,2017,50(suppl 61):PA2341.
27 Sam S,Ehrmann DA.Pathogenesis and Consequences of Disordered Sleep in PCOS.Clin Med Insights Reprod Health,2019,13:1179558119871269.
28 Fernandez RC,Moore VM,Van Ryswyk EM,et al.Sleep disturbances in women with polycystic ovary syndrome:prevalence,pathophysiology,impact and management strategies.Nat Sci Sleep,2018,10:45-64.
29 Polo-Kantola P,Rauhala E,Helenius H,et al.Breathing during sleep in menopause:a randomized,controlled,crossover trial with estrogen therapy.Obstet Gynecol,2003,102:68-75.
30 Zaib S,Rana N,Khan I,et al.Analyzing the Challenges,Consequences,and Possible Treatments for Polycystic Ovary Syndrome.Mini Rev Med Chem,2023,23:1975-1992.
31 Lee J,Eklund EE,Lambert-Messerlian G,et al.Serum Progesterone Levels in Pregnant Women with Obstructive Sleep Apnea:A Case Control Study.J Womens Health(Larchmt),2017,26:259-265.
32 Chattopadhayay R,Ganesh A,Samanta J,et al.Effect of follicular fluid oxidative stress on meiotic spindle formation in infertile women with polycystic ovarian syndrome.Gynecol Obstet Invest,2010,69:197-202.
33 Terao H,Wada-Hiraike O,Nagumo A,et al.Role of oxidative stress in follicular fluid on embryos of patients undergoing assisted reproductive technology treatment.J Obstet Gynaecol Res,2019,45:1884-1891.
34 Li W,Liu C,Yang Q,et al.Oxidative stress and antioxidant imbalance in ovulation disorder in patients with polycystic ovary syndrome.Front Nutr,2022,9:1018674.
35 Gabryelska A,Turkiewicz S,Karuga FF,et al.Disruption of Circadian Rhythm Genes in Obstructive Sleep Apnea Patients-Possible Mechanisms Involved and Clinical Implication.Int J Mol Sci,2022,23:709.
36 Pfeffer M,von Gall C,Wicht H,et al.The Role of the Melatoninergic System in Circadian and Seasonal Rhythms-Insights From Different Mouse Strains.Front Physiol,2022,13:883637.
37 Beroukhim G,Esencan E,Seifer DB.Impact of sleep patterns upon female neuroendocrinology and reproductive outcomes:a comprehensive review.Reprod Biol Endocrinol,2022,20:16.
38 Abou-El-Naga AM,Badawy AM,Ghanem RA,et al.Effect of oxidative stress on oocyte quality in infertile women undergoing in vitro fertilization.Biosci Res,2022,19:408-417.
39 Brzezinski A,Rai S,Purohit A,et al.Melatonin,Clock Genes,and Mammalian Reproduction:What Is the Link.Int J Mol Sci,2021,22:13240.
40 Wang W,Yin L,Bai L,et al.Bmal1 interference impairs hormone synthesis and promotes apoptosis in porcine granulosa cells.Theriogenology,2017,99:63-68.
41 Kapur VK,Auckley DH,Chowdhuri S,et al.Clinical Practice Guideline for Diagnostic Testing for Adult Obstructive Sleep Apnea:An American Academy of Sleep Medicine Clinical Practice Guideline.J Clin Sleep Med,2017,13:479-504.
42 Hoeger KM,Dokras A,Piltonen T.Update on PCOS:Consequences,Challenges,and Guiding Treatment.J Clin Endocrinol Metab,2021,106:e1071-e1083.
43 Teede HJ,Tay CT,Laven J,et al.Recommendations From the 2023 International Evidence-based Guideline for the Assessment and Management of Polycystic Ovary Syndrome.J Clin Endocrinol Metab,2023,108:2447-2469.
44 韩乔松,孙振高,宋景艳.多囊卵巢综合征临床、代谢表型及远期并发症与抑郁、焦虑关系的研究进展.中华生殖与避孕杂志,2023,43:872-877.
45 El-Sharkawy AA,Abdelmotaleb GS,Aly MK,et al.Effect of metformin on sleep disorders in adolescent girls with polycystic ovarian syndrome.J Pediatr Adolesc Gynecol,2014,27:347-352.
46 中国医师协会睡眠医学专业委员会.成人阻塞性睡眠呼吸暂停多学科诊疗指南.中华医学杂志,2018,98:1902-1914.
47 Tasali E,Chapotot F,Leproult R,et al.Treatment of obstructive sleep apnea improves cardiometabolic function in young obese women with polycystic ovary syndrome.J Clin Endocrinol Metab,2011,96:365-374.
48 周伟,王乐,张静,等.阻塞性睡眠呼吸暂停低通气综合征的治疗进展.山东医药,2021,61:112-115.
49 Franik S,Eltrop SM,Kremer JA,et al.Aromatase inhibitors(letrozole) for subfertile women with polycystic ovary syndrome.Cochrane Database Syst Rev,2018,5:CD010287.
50 Kadoura S,Alhalabi M,Nattouf AH.Conventional GnRH antagonist protocols versus long GnRH agonist protocol in IVF/ICSI cycles of polycystic ovary syndrome women:a systematic review and meta-analysis.Sci Rep,2022,12:4456.
51 Mejlhede M,Jepsen JB,Knudsen UB.Oral melatonin supplementation during in vitro fertilization treatment:a systematic PRISMA review and meta-analysis of randomized controlled trials.Gynecol Endocrinol,2021,37:1079-1085.