妊娠期高血压疾病(hypertension during pregnancy,HDP)是一类常见的妊娠并发症,主要临床表现为妊娠20周后首次出现高血压。其中妊娠期高血压(gestational hypertension,GH)和先兆子痫(preeclampsia,PE)是最常见的两种亚型[1-2]。HDP是导致流产、早产、死产和小于胎龄儿等不良妊娠结局及孕产妇死亡的主要原因之一[3],也可损害孕妇及胎儿的长期健康[4]。全球范围内约5%~10%的孕妇被诊断为HDP[5],中国HDP患病率约为6%~8%,华北地区则高达10.6%[6-8]。尽管目前已发现多种HDP的危险因素,导致HDP发病的潜在生物学机制仍未完全明确。氧化应激指活性氧(reactive oxygen species,ROS)的产生与清除间的不平衡状态,是HDP患者中普遍存在的病理改变[9]。已有证据表明氧化应激可能在HDP发病中发挥重要作用,主要途径为损害胎盘正常分化、发育和功能进而导致母体血管功能障碍[10]。
8-羟基脱氧鸟苷(8-hydroxy-2′-deoxyguanosine,8-OHdG)是体内过多的ROS造成氧化损伤后的代谢产物,被广泛应用为氧化应激的敏感生物标志物。目前已有研究探索胎盘、血液及尿液组织中的8-OHdG与HDP的关联[11-14],但较多关注PE亚型,样本检测时间多在HDP发病后,且结论不尽一致,部分研究甚至报告8-OHdG对HDP的保护作用。此外,较高的孕前体质指数(body mass index, BMI)不仅是HDP的危险因素[15],也与机体较高的氧化应激水平相关[16],可能在8-OHdG与HDP的关联中起到重要的效应修饰作用。本研究基于孕妇队列检测孕妇孕20周前血清样本中的8-OHdG浓度,并随访孕妇的妊娠结局,探讨孕期8-OHdG暴露与HDP发生风险的关联,进一步探索孕前BMI在8-OHdG与HDP关联中的潜在效应修饰作用,为阐释HDP发病的血清氧化应激机制提供依据。
对象与方法
一、研究对象
本巢式病例对照研究的研究对象来源于在北京市海淀区妇幼保健院开展的孕产妇队列。研究人员在产检期间采用方便抽样邀请符合以下纳入标准的孕妇参与队列研究:(1)在北京市区居住满1年;(2)在北京市海淀区妇幼保健院建立了孕期健康档案,并计划在该院进行后续健康管理和分娩;(3)孕周<20周;(4)年龄大于18岁。该队列在2017年10月至2018年10月间共募集2 731名妇女,在该巢式病例对照研究人群中排除无HDP病例血清和无重要妊娠结局对照血清孕妇后,本研究共纳入HDP病例150名和健康对照490名。所有研究对象均经充分知情同意后签署书面知情同意书,本研究已通过北京大学生物医学伦理委员会伦理审查(IRB00001052-20067)。
二、资料收集及相关变量定义
受过培训的研究人员在队列募集期间采用结构性问卷对研究对象进行面对面访谈,收集孕妇年龄、孕前身高和体重、民族、受教育年限、职业、产次和被动吸烟情况等信息,孕前体质指数(body mass index,BMI)根据孕前身高和体重计算,公式为孕前BMI=孕前体重(kg)/身高2(m2)。HDP诊断依据医院电子病历系统中的孕妇末次月经日期、产检日期及产检时测量的血压数据进行诊断,HDP定义为妇女妊娠20周后首次出现高血压(收缩压≥140 mmHg和(或)舒张压≥90 mmHg)[17],孕周计算公式为孕周=(产检日期-末次月经日期)/7[18]。孕20周前的静脉全血由妇幼保健院的专业医务人员在孕妇产检时抽取,分离血清后在-80℃冰箱中保存。孕妇血清中的8-OHdG浓度使用ELISA试剂盒(E01H0007)检测。在450 nm波长下使用分光光度计读取待测样本及标准品的吸光度,根据绘制的标准曲线计算8-OHdG浓度,R2=0.9995。
三、统计学分析
使用t检验和Pearson卡方检验比较HDP组与对照组孕妇的年龄、孕前BMI、民族、受教育年限、职业、产次和被动吸烟情况。采用Shapiro-Wilk法检验孕妇血清8-OHdG浓度是否服从正态分布,若不服从则采用Mann Whitney U检验比较HDP组与对照组孕妇血清8-OHdG的平均水平。将血清8-OHdG分别按照其中位数、三分位数(第33.3和66.6百分位数)和四分位数(第25、50和75百分位数)浓度进行二分类、三分类和四分类,采用Logistic回归模型计算各暴露水平组相对低暴露组发生HDP的风险大小,结果以比值比(odds ratio,OR)和95%置信区间(confidence interval,CI)表示。
进一步将四分类各暴露水平组的8-OHdG浓度按照各组中位数浓度赋值,并作为数值变量纳入回归模型,分析8-OHdG与HDP发生风险间的剂量-效应关系。将血清8-OHdG浓度标准化后作为数值变量纳入回归方程,计算每标准差的8-OHdG浓度增加导致的HDP风险改变。此外,根据孕妇孕前是否超重将研究对象分为孕前BMI<24 kg/m2和孕前BMI≥24 kg/m2两组[19],采用Logistic回归模型分别计算两组中血清8-OHdG水平与HDP发生风险的关联,并将8-OHdG浓度与孕前BMI的交互项纳入回归方程,检验血清8-OHdG与孕前BMI对HDP发生风险的交互作用。使用R 3.6.3 统计软件进行统计分析,以双侧P<0.05表示差异具有统计学意义。
结 果
一、研究对象的一般特征
本研究纳入640名孕妇,平均年龄为29.7岁,平均孕前BMI为21.8 kg/m2。其中606名孕妇(94.7%)为汉族; 595名孕妇(93.0%)受教育年限超过12年;孕妇职业以教师、技术人员及企事业单位工作人员为主,共362人,占比56.6%;544名孕妇(85.0%)为初产妇;443名孕妇(69.2%)暴露于被动吸烟。HDP组与对照组孕妇平均孕前BMI的差异无统计学意义(P=0.101),但HDP组孕前BMI≥ 24 kg/m2的比例显著高于对照组(28.0% vs. 16.5%,P=0.001)。HDP组孕妇暴露于被动吸烟的比例显著低于对照组(60.0% vs. 72.0%,P=0.008)。两组孕妇的平均年龄、民族、受教育年限、职业和产次的差异均无统计学意义。具体结果见表1。
表1 巢式病例对照研究人群的基本特征 [例(%)]
Table 1 Characteristics of participants in the nested case-control study [n(%)]

CharacteristicsTotal(n=640)Control(n=490)HDP Case(n=150)Age(years, mean ±SD) a29.7±2.429.8±2.429.6±2.5Pre-pregnancy BMI(mean ±SD a,kg/m2)21.8±6.121.6±6.722.6±3.4 <24b*477(74.5)383(78.2)94(62.7) ≥24123(19.2)81(16.5)42(28.0) NA40(6.2)26(5.3)14(9.3)Ethnic b Han606(94.7)461(94.1)145(96.7) Others34(5.3)29(5.9) 5(3.3)Education(years) b ≤1245(7.0)29(5.9)16(10.7) 13-16411(64.2)313(63.9)98(65.3) >16184(28.7)148(30.2)36(24.0)Occupation b None34(5.3)25(5.1) 9(6.0) Workers/business/services137(21.4)105(21.4)32(21.3) Public official362(56.6)283(57.8)79(52.7) Others103(16.1)75(15.3)28(18.7) NA 4(0.6) 2(0.4) 2(1.3)Parityb Primiparous544(85.0)412(84.1)132(88.0) Multiparous74(11.6)60(12.2)14(9.3) NA22(3.4)18(3.7) 4(2.7)Passive smoking b* Yes443(69.2)353(72.0)90(60.0) No152(23.8)109(22.2)43(28.7) NA45(7.0)28(5.7)17(11.3)
Note:a t test; b Pearson chi-square test; *P<0.01
二、研究人群血清8-OHdG水平
本研究中孕妇血清8-OHdG的检出限为1 ng/mL,总体检出率为93.59%。经Shapiro-Wilk法检验,孕妇血清8-OHdG浓度不服从正态分布(P<0.001)。HDP组血清8-OHdG的第25、33.3、50、66.7和75分位数浓度及最大值浓度均低于总人群和对照组。Mann Whitney U检验结果显示,HDP组孕妇血清8-OHdG水平低于对照组孕妇,差异具有统计学意义(P<0.001)。具体结果见表2。
表2 研究人群8-OHdG检出率及浓度特征(ng/mL)
Table 2 The detection rate and concentration of 8-OHdG of participants(ng/mL)
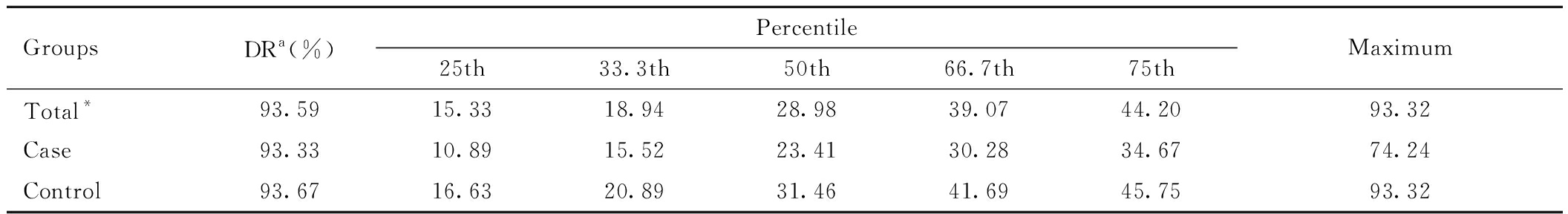
GroupsDRa(%)Percentile25th33.3th50th66.7th75thMaximumTotal*93.5915.3318.9428.9839.0744.2093.32Case93.3310.8915.5223.4130.2834.6774.24Control93.6716.6320.8931.4641.6945.7593.32
Note:a Detection rate above the limit of detection(1 ng/mL); *P value for Mann Whitney U test <0.001
三、血清8-OHdG水平与HDP的关系
表3展示了孕妇血清8-OHdG与HDP发生风险的关联结果,HDP发生率随血清8-OHdG水平升高而降低。将血清8-OHdG按照其中位数浓度进行二分类计算时,调整孕妇年龄、孕前BMI、受教育年限、职业、产次和被动吸烟情况后,8-OHdG高暴露组(Q2)较低暴露组(Q1)HDP的发生风险显著更低(aOR=0.43;95%CI:0.27,0.67)。三分类计算时,血清8-OHdG中暴露组(Q2)的HDP发生风险为低暴露组(Q1)的0.80倍,但无统计学意义(aOR=0.80;95%CI:0.49,1.31);高暴露组(Q3)较低暴露组(Q1)HDP的发生风险显著更低(aOR=0.41;95%CI:0.24,0.71)。
表3 孕妇血清8-OHdG水平与HDP风险的关联
Table 3 Association between levels of 8-OHdG in serum and HDP risk among pregnant women
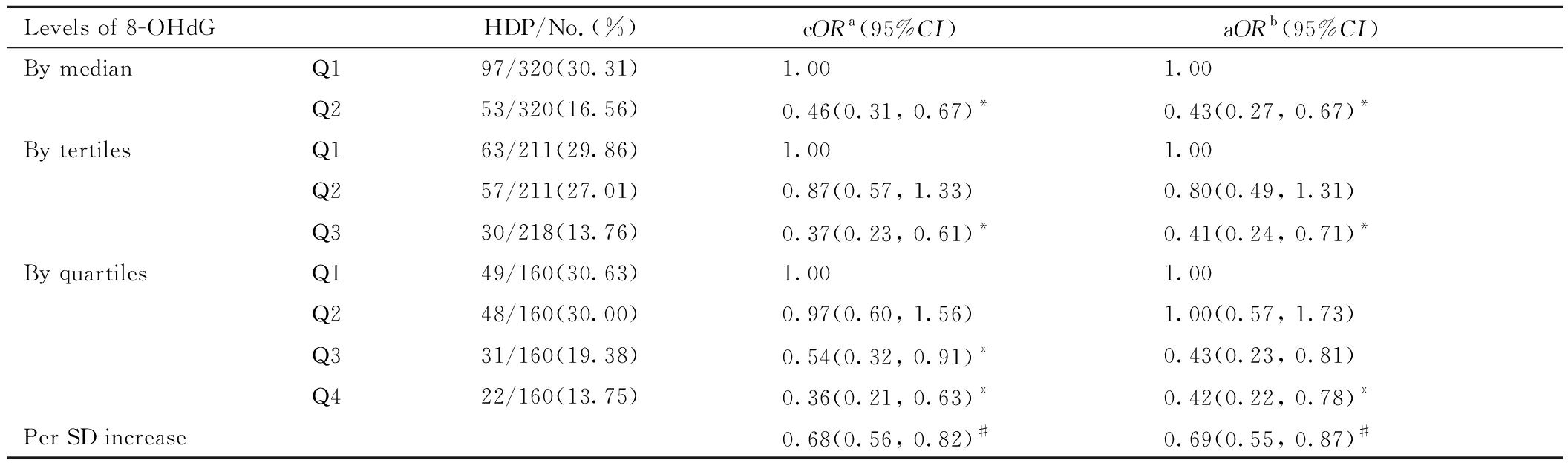
Levels of 8-OHdGHDP/No.(%)cORa(95%CI) aORb(95%CI) By medianQ197/320(30.31)1.001.00Q253/320(16.56)0.46(0.31, 0.67)*0.43(0.27, 0.67) *By tertilesQ163/211(29.86)1.001.00Q257/211(27.01)0.87(0.57, 1.33)0.80(0.49, 1.31)Q330/218(13.76)0.37(0.23, 0.61) *0.41(0.24, 0.71) *By quartilesQ149/160(30.63)1.001.00Q248/160(30.00)0.97(0.60, 1.56)1.00(0.57, 1.73)Q331/160(19.38)0.54(0.32, 0.91) *0.43(0.23, 0.81)Q422/160(13.75)0.36(0.21, 0.63) *0.42(0.22, 0.78)*Per SD increase0.68(0.56, 0.82) #0.69(0.55, 0.87) #
Note: aCrude OR without adjusting for confounders; bAdjusted for age, pre-pregnancy BMI, education level, occupation, parity and passive smoking status; *P<0.05; #P for linear trend test <0.001
进一步进行四分类计算并调整混杂因素时,血清8-OHdG中低暴露组(Q2)与低暴露组(Q1)HDP发生风险的差异无统计学意义(aOR=1.00;95% CI:0.57,1.73),而血清8-OHdG中高暴露组(Q3)和高暴露组(Q4)的HDP发生风险分别为低暴露组(Q1)的0.43倍(95%CI:0.23,0.81)和0.42倍(95%CI:0.22,0.78)。此外,血清8-OHdG水平与HDP风险间存在显著的剂量-效应关系(线性趋势检验P=0.001)。血清中每标准差浓度(18.90 ng/mL)的8-OHdG增加可导致HDP发生风险降低为0.69倍(95%CI:0.55,0.87)。
四、分层分析
按照孕前BMI将研究对象分为BMI<24 kg/m2和BMI≥24 kg/m2两组,分别计算两组血清8-OHdG水平与HDP发生风险的关联,具体结果见表4。在排除孕前BMI数据缺失的研究对象后,BMI<24 kg/m2和BMI≥24 kg/m2两组分别有477和123名孕妇纳入分析。将血清8-OHdG进行二分类计算时,孕前不同BMI的两组中HDP发生风险均随血清8-OHdG水平升高而降低,但血清高8-OHdG水平(Q2)对孕前BMI≥24 kg/m2(aOR=0.13;95%CI:0.04,0.38)组人群的保护作用较孕前BMI<24 kg/m2(aOR=0.59;95%CI:0.36,0.97)组更强。
表4 不同孕前BMI孕妇中血清8-OHdG与HDP的关联(n=600)
Table 4 Associations between 8-OHdG in serum and HDP among pregnant women by pre-pregnancy BMI(n=600)

Levels of 8-OHdGBMI<24 kg/m2(n=477)cORa (95% CI) aORb(95%CI) BMI ≥24 kg/m2(n=123)ccORa(95%CI) aORb(95%CI) By medianQ11.001.001.001.00Q20.61(0.39, 0.97)*0.59(0.36, 0.97) *0.31(0.14, 0.68) *0.13(0.04, 0.38) *By tertilesQ11.001.001.001.00Q20.87(0.52, 1.48)0.98(0.55, 1.74)0.87(0.36, 2.09)0.31(0.10, 0.99)Q30.49(0.27, 0.87) *0.55(0.29, 1.02)0.24(0.09, 0.68) *0.12(0.03, 0.44) *By quartilesQ11.00#1.001.00#1.00#Q21.00(0.55, 1.82)1.19(0.62, 2.28)0.69(0.25, 1.88)0.44(0.13, 1.50)Q30.73(0.38, 1.37)0.70(0.35, 1.42)0.35(0.12, 1.01)0.06(0.01, 0.29) *Q40.52(0.27, 1.00)0.58(0.28, 1.18)0.16(0.04, 0.56) *0.11(0.02, 0.49) *Pfor linear trend test0.0340.0700.0020.001
a Crude OR without adjusting for confounders; b Adjusted for age, education level, occupation, parity and passive smoking status; Tested by adjusted logistic regression model with the interaction term between 8-OHdG and pre-pregnancy BMI, cP=0.012; *P<0.05; #P for linear trend test <0.05
在三分类及四分类计算并调整混杂因素时,未发现孕前BMI<24 kg/m2组中血清8-OHdG水平与HDP发生风险的关联。而在孕前BMI≥24 kg/m2的人群中,三分类计算时血清8-OHdG中暴露组(Q2)(aOR=0.31;95%CI:0.10,0.99)和高暴露组(Q3)(aOR=0.12;95%CI:0.03,0.44)的HDP发生风险较低暴露组(Q1)均显著更低。四分类计算时,血清8-OHdG中高暴露组(Q3)和高暴露组(Q4)的HDP发生风险分别为低暴露组(Q1)的0.06倍(95%CI:0.01,0.29)和0.11倍(95%CI:0.02,0.49),且血清8-OHdG水平与HDP发病间存在显著的剂量-效应关系(线性趋势检验P=0.001)。此外,本研究发现血清8-OHdG与孕前BMI对HDP发病存在显著的交互作用(P=0.012)。
讨 论
HDP是一类患病率较高且危害严重的妊娠并发症,尽管目前已发现多种导致HDP发病的危险因素,其复杂的发病机制尚未被完全阐释。氧化应激可能是诱发HDP的重要生物学机制,8-OHdG是体内氧化应激敏感的生物标志物。本研究探索孕妇孕20周前血清8-OHdG水平与HDP的关联,发现血清8-OHdG高暴露对HDP具有保护作用,8-OHdG暴露与HDP风险间呈现剂量-效应关系,且孕前BMI在二者关联中具有显著的效应修饰作用。
本研究发现较高的血清8-OHdG水平可显著降低HDP的发病风险,8-OHdG高暴露组(Q4)的HDP发生风险为低暴露组(Q1)的0.42倍(95%CI:0.22,0.78),与部分既往研究的结果一致。2017年Ferguson[13]等学者在波士顿开展的巢式病例对照研究共检测50名PE孕妇及391名健康孕妇尿液中的8-OHdG浓度,发现孕15周前[adjusted hazard ratio(aHR)=0.40;95%CI:0.28,0.56]、孕18周(aHR=0.32;95%CI:0.21,0.49)、孕26周(aHR=0.53;95%CI:0.35,0.81)及孕35周(aHR=0.59;95%CI:0.37,0.95)的8-OHdG高暴露均对PE具有显著的保护作用。Stein[20]等在美国开展的队列研究发现,尿液8-OHdG浓度较低的五分位数组中PE患者的比例较高。HDP患者体内8-OHdG水平较低的可能原因是DNA切除修复功能受损,导致ROS攻击DNA形成的8-OHdG无法被释放进入血液及尿液组织[20-21];也可能HDP患者体内的8-OHdG在胎盘介质中的积聚水平较高[13],血液及尿液中的8-OHdG反应母体全身的氧化应激水平,当氧化应激仅发生于胎盘时可能无法在血液及尿液中检测到显著的8-OHdG水平改变[22]。
与本研究的结果不一致,Toljic[11]等开展的病例对照研究中GH组与对照组孕妇孕24~28周的血浆8-OHdG浓度无显著差异。Akinci[10]等的病例对照研究中同样未发现轻度及重度PE组与对照组孕妇孕25~41周的血清8-OHdG浓度存在显著差异。Hsieh[23]等学者在孕妇队列人群中发现PE病例和非病例孕妇孕24~26周尿液8-OHdG水平基本一致。以上3项研究均在HDP发病后检测孕妇体内的8-OHdG水平,可能导致真实的效应未被揭示。Anto[14]等在加纳开展的队列研究发现孕10~20周的血清8-OHdG高暴露是早发型先兆子痫(aOR=3.5;95%CI:1.3,6.3)及晚发型先兆子痫(aOR=3.3;95%CI:1.5,9.2)的危险因素,且对尿液样本的分析也得到了一致的结果;Negi[24]等在病例对照样本中发现子痫和PE孕妇脐带血中的8-OHdG水平较对照组显著更高(aOR=1.1;95%CI:1.0, 1.1);Fukushima[12]则发现HDP组胎盘中8-OHdG阳性的细胞核比例显著高于对照组;Owaki[25]还进一步发现PE组孕妇胎盘的8-OHdG水平高于GH组和对照组。以上结果提示HDP各临床亚型的发病机制不同,不同亚型具有不同的氧化应激状态,PE发生与胎盘氧化应激相关,而GH可能是继发于先前存在的亚临床血管功能障碍[26],未来仍需针对不同亚型HDP进行更全面深入的研究。
本研究进一步发现在孕前BMI≥24 kg/m2的孕妇中血清8-OHdG高暴露对HDP具有显著的保护作用,而在孕前BMI<24 kg/m2的孕妇中8-OHdG与HDP发病的相关性较低。孕妇体内8-OHdG水平会生理性地随孕周增加逐渐升高[27],孕前BMI较高者的基线氧化应激水平较高,但在整个妊娠期的变化幅度较小,体现出一定的缓冲作用[13]。动物模型中8-OHdG可能通过调节肥胖小鼠的脂肪细胞代谢抑制脂肪生成,改善脂肪组织炎症从而缓解肥胖诱导的代谢失调[28]。超重肥胖是一种慢性氧化应激状态,而氧化应激可能在HDP的病理生理学中起着重要作用[16]。本研究不仅以血清8-OHdG为标志物探索氧化应激与HDP的关联,还发现了孕前BMI在其中起到的效应修饰作用,提示未来仍需针对氧化应激、孕前BMI及HDP三者之间的关系开展更深入的研究,以全面阐释HDP发病的氧化应激机制。
本研究具有以下的优势。本研究采用巢式病例对照的研究设计,HDP组及对照组人群来源于同一队列,可比性强。本研究测定孕妇孕20周前血清样本的8-OHdG浓度,而HDP定义为孕20周后首次出现的高血压,可以确保暴露与结局的时间先后顺序,因果关联的论证强度较强。本研究的研究人群中绝大多数(94.7%)为汉族,可减少遗传背景差异导致的潜在混杂。目前有关8-OHdG暴露与HDP关联性的研究大多关注PE亚型,本研究以HDP为疾病结局,研究结果提示HDP不同亚型的发病机制可能不同,且孕前BMI在其中起到重要的效应修饰作用,为后续研究全面阐释HDP发病的氧化应激机制提供线索。然而本研究也具有以下的局限性。由于样本量的限制,本研究未能对HDP各亚型分别进行研究,可能导致对真实效应的误判。本研究仅使用血清样本对8-OHdG水平进行检测,8-OHdG可能具有胎盘聚集性,导致无法全面揭示机体真实的氧化应激暴露情况。本研究人群中HDP组的被动吸烟暴露率(60.0%)较对照组(72.0%)低,提示可能存在未被发现的残余混杂。
结论:本研究以孕妇孕20周前血清8-OHdG为氧化应激标志物,发现8-OHdG对HDP发病具有显著的保护作用,且孕前BMI可修饰二者的关联。为进一步明确HDP发病的氧化应激机制及孕前BMI在其中发挥的作用,未来还需针对HDP不同亚型,采用多种合理的生物样本,结合高质量的流行病学研究设计方案开展更深入的研究。
1 Li N,Li Z,Ye R,et al.Preconception blood pressure and risk of preterm birth:a large cohort study in China.J Hypertens,2016,34:2243-2247.
2 Li N,Li Z,Ye R,et al.Preconception blood pressure and Risk of low birth weight and small for gestational age:a large cohort study in China.Hypertension,2016,68:873-879.
3 Henry A,Canoy D.Editorial:Hypertension during pregnancy and future risk of cardiovascular and other long-term health outcomes.Front Cardiovasc Med,2020,7:569735.
4 Kajantie E,Eriksson JG,Osmond C,et al.Pre-eclampsia is associated with increased risk of stroke in the adult offspring:the Helsinki birth cohort study.Stroke,2009,40:1176-1180.
5 Umesawa M,Kobashi G.Epidemiology of hypertensive disorders in pregnancy:prevalence,risk factors,predictors and prognosis.Hypertens Res,2017,40:213-220.
6 李丽,付强强.中国妊娠期高血压疾病患病率的Meta分析.中国妇幼保健,2019,34:3378-3381.
7 Li F,Qin J,Zhang S,et al.Prevalence of hypertensive disorders in pregnancy in China:A systematic review and meta-analysis.Pregnancy Hypertens,2021,24:13-21.
8 Ye C,Ruan Y,Zou L,et al.The 2011 survey on hypertensive disorders of pregnancy(HDP) in China:prevalence,risk factors,complications,pregnancy and perinatal outcomes.PLoS One,2014,9:e100180.
9 Chiarello DI,Abad C,Rojas D,et al.Oxidative stress:Normal pregnancy versus preeclampsia.Biochim Biophys Acta Mol Basis Dis,2020,1866:165354.
10 Akinci S,Özcan HC,Balat Ö,et al.Assessment of β-hydroxydeoxyguanosine levels in patients with preeclampsia:a prospective study.Clin Exp Obstet Gynecol,2017,44:226-229.
11 Toljic M,Egic A,Munjas J,et al.Increased oxidative stress and cytokinesis-block micronucleus cytome assay parameters in pregnant women with gestational diabetes mellitus and gestational arterial hypertension.Reprod Toxicol,2017,71:55-62.
12 Fukushima K,Murata M,Tsukimori K,et al.8-Hydroxy-2-deoxyguanosine staining in placenta is associated with maternal serum uric acid levels and gestational age at diagnosis in pre-eclampsia.Am J Hypertens,2011,24:829-834.
13 Ferguson KK,Meeker JD,McElrath TF,et al.Repeated measures of inflammation and oxidative stress biomarkers in preeclamptic and normotensive pregnancies.Am J Obstet Gynecol,2017,216:527 e521-527 e529.
14 Anto EO,Coall DA,Addai-Mensah O,et al.Early gestational profiling of oxidative stress and angiogenic growth mediators as predictive,preventive and personalised(3P) medical approach to identify suboptimal health pregnant mothers likely to develop preeclampsia.EPMA J,2021,12:517-534.
15 Savitri AI,Zuithoff P,Browne JL,et al.Does pre-pregnancy BMI determine blood pressure during pregnancy? A prospective cohort study.BMJ Open,2016,6:e011626.
16 Zavalza-Gómez AB.Obesity and oxidative stress:a direct link to preeclampsia.Arch Gynecol Obstet,2011,283:415-422.
17 中华医学会妇产科学分会妊娠期高血压疾病学组.妊娠期高血压疾病诊治指南(2020).中华妇产科杂志,2020,55:227-238.
18 梁瑞英,叶荣伟,李宏田,等.浙江省嘉兴地区初孕妇女自然流产状况研究.中华流行病学杂志,2010,31:755-758.
19 Zhou A,Xiong C,Hu R,et al.Pre-pregnancy BMI,gestational weight gain,and the risk of hypertensive disorders of pregnancy:a cohort study in Wuhan,China.PLoS One,2015,10:e0136291.
20 Stein PT,Scholl TO,Schluter MD,et al.Oxidative stress early in pregnancy and pregnancy outcome.Free Radic Res,2008,42:841-848.
21 Bruner SD,Norman DP,Verdine GL.Structural basis for recognition and repair of the endogenous mutagen 8-oxoguanine in DNA.Nature,2000,403:859-866.
22 Cejvanovic V,Asferg C,Kjær LK,et al.Markers of oxidative stress in obese men with and without hypertension.Scand J Clin Lab Invest,2016,76:620-625.
23 Hsieh TT,Chen SF,Lo LM,et al.The association between maternal oxidative stress at mid-gestation and subsequent pregnancy complications.Reprod Sci,2012,19:505-512.
24 Negi R,Pande D,Karki K,et al.Association of oxidative DNA damage,protein oxidation and antioxidant function with oxidative stress induced cellular injury in pre-eclamptic/eclamptic mothers during fetal circulation.Chem Biol Interact,2014,208:77-83.
25 Owaki Y,Watanabe K,Iwasaki A,et al.Placental hypoplasia and maternal organic vascular disorder in pregnant women with gestational hypertension and preeclampsia.J Matern Fetal Neonatal Med,2021,34:353-359.
26 Nobles CJ,Williams A,Ouidir M,et al.Differential Effect of ambient air pollution exposure on risk of gestational hypertension and preeclampsia.Hypertension,2019,74:384-390.
27 Ferguson KK,McElrath TF,Chen YH,et al.Repeated measures of urinary oxidative stress biomarkers during pregnancy and preterm birth.Am J Obstet Gynecol,2015,212:208.e1-8.
28 Huh JY,Jung I,Piao L,et al.8-Hydroxy-2-deoxyguanosine ameliorates high-fat diet-induced insulin resistance and adipocyte dysfunction in mice.Biochem Biophys Res Commun,2017,491:890-896.