宫颈癌(cervical cancer,CC)是最常见的女性生殖道恶性肿瘤,据WHO数据统计,2020年全球约有604 127例宫颈癌病例和341 831例宫颈癌死亡病例[1]。女性下生殖道是体内重要的微生态区,正常的阴道微生态环境是天然的防御屏障,能有效抵御各种致病菌入侵,阴道菌群紊乱会导致多种感染性疾病的发生[2]。高危型人乳头瘤病毒(high risk human papillomavirus,hrHPV)长期持续感染是宫颈癌的主要致病因素,而阴道微环境与HPV的感染及持续感染密切相关[3]。阴道炎性疾病与HPV感染之间的关联因研究人群的特征而异,如地区、种族、检测方法和其他因素[4]。尽管中华医学会妇产科学分会感染性疾病协作组于2022年发布了《高危型人乳头瘤病毒与女性下生殖道感染联合检测专家共识》,建议HPV筛查宫颈癌同时行下生殖道感染的检查,但两种检查的联合检测在国内尤其是西北地区尚未普遍开展[5],且缺乏陕西地区基于大样本人群的相关数据。本研究探讨陕西地区10 921例女性hrHPV感染与常见阴道炎性疾病的相关性,为本地区女性HPV与阴道微生态联合筛查策略提供理论依据。
对象与方法
1.研究对象:选取2016年1月至2021年12月于西安交通大学第一附属医院妇科门诊同时行HPV和阴道微生态检测的女性为研究对象。纳入标准:(1)有性生活史;(2)非月经期。排除标准:(1)24 h内有性生活者;(2)检测前48 h内有阴道用药或冲洗者;(3)既往或已确诊宫颈癌或癌前病变病史;(4)既往因各种原因已切除子宫者。研究通过了本院伦理委员会审批(批准号:XJTU1AF2023LSK-2022-192)。最终共纳入10 921例女性,年龄15~90岁,平均年龄(37.0±9.8)岁。
2.研究方法:
(1)HPV分型检测。用HPV基因分型检测试剂盒(潮州凯普生物科技有限公司),检测用宫颈细胞收集器采集的宫颈细胞样本中21种HPV病毒亚型,本研究仅分析以下15种hrHPV类型:16、18、31、33、35、39、45、51、52、53、56、58、59、66、68。其他流程参见本课题组前期研究[6]。根据HPV结果是否为高危型,将研究对象分为hrHPV+组和hrHPV-组。
(2)阴道微生态检测。用两根无菌干棉签刮取阴道上1/3侧壁处分泌物,置入试管内迅速送检。检测方法:①生理盐水湿片高倍镜下观察是否存在滴虫,有无白细胞中毒颗粒;②分泌物涂片,干燥后固定、革兰染色,油镜下行阴道微生态形态学检查,包括菌群密集度,多样性、优势菌、病原体检测(滴虫,真菌:孢子、芽生孢子、菌丝)、Nugent评分和需氧性阴道炎(Aerobic Vaginitis,AV)评分;③检测微生物功能及炎症反应指标:PH值、H2O2浓度、白细胞酯酶、唾液酸苷酶、乙酰氨基葡萄糖苷酶及β-葡萄糖醛酸苷酶,其他流程参见本课题组前期研究[7]。
3.常见阴道炎性疾病诊断标准:依据《阴道微生态评价的临床应用专家共识》[8]判定。采用Donders提出的AV诊断标准,≥3分诊断为AV。细菌性阴道病(Bacterial Vaginosis,BV)依据Nugent评分标准:0~3分正常,4~6分为中间型BV,7~10分为BV。阴道毛滴虫病(trichomonal vaginitis,TV)检测:生理盐水湿片,在显微镜下找到活体滴虫为依据。外阴阴道假丝酵母菌病(vulvovaginal candidiasis,VVC):油镜下可见假菌丝、芽生孢子或孢子,只检见孢子为定植状态,不作为疾病判断。存在上述两种及以上的阴道炎性疾病诊断为混合性阴道炎(混合感染)。
4.统计学方法:采用SPSS 23.0统计学软件处理数据。计数资料用[n(%)]表示,比较采用χ2检验或Fisher′s精确检验。计算OR值描述hrHPV感染与各常见阴道炎性疾病发生的风险[9]。P<0.05为差异具有统计学意义。
结果
1.hrHPV感染情况:10 921例陕西女性中共检出hrHPV感染3 573例(32.7%),其中单一hrHPV亚型感染占80.4%(2 873/3 573),多种hrHPV亚型混合感染占19.6%(700/3 573)。各hrHPV亚型感染频数占前5位的依次为:HPV16(7.2%,790/10 921)、HPV52(6.7%,730/10 921)、HPV58(5.4%,592/10 921)、中国人常见亚型HPV53(3.7%,406/10 921)、HPV39(3.5%,380/10 921);HPV18感染频数排位为第7位(2.3%,250/10 921),中国人常见亚型HPV66感染频数排位为第12位(1.6%,173/10 921)。hrHPV+者中,28.4%(1 013/3 573)存在HPV16和(或)HPV18型感染,16.0%(573/3 573)存在HPV53和(或)HPV66型感染。中国人群常见的高危亚型HPV53和HPV66的单一及双重感染发生率2.6%(282/10 921;在hrHPV+中占比7.9%,282/3 573),其他hrHPV感染率30.1%(3 291/10 921;在hrHPV+中占比92.1%,3 291/3 573)。
2.两组间阴道炎性疾病发生情况的比较:hrHPV+组总阴道炎、单一BV、总BV、单一中间型BV、总中间型BV、混合感染发生率均显著高于hrHPV-组(P<0.05),优势比(odd ratio,OR)分别为:6.62(总BV)>6.61(单一BV)>5.85(总中间型BV)>5.52(单一中间型BV)>5.25(混合感染)>3.15(总阴道炎);hrHPV+组单一VVC及总VVC发生率均低于hrHPV-组,差异存在统计学意义(7.3% vs.13.0%,P<0.05;11.1% vs.13.9%,P<0.05)。hrHPV+组单一AV感染率显著低于hrHPV-组(1.4% vs.2.3%,P<0.05),而计入含AV的混合感染后,两组感染比倒置,差异存在统计学意义(10.8% vs.4.4%,P<0.05)。hrHPV+组单一TV感染率稍高于hrHPV-组,差异无统计学意义(0.4% vs.0.2%,P>0.05),计入含TV的混合感染后,hrHPV+组TV感染率显著高于hrHPV-组(4.2% vs.0.8%,P<0.05)。见表1。
表1 hrHPV+与hrHPV-组间常见阴道炎性疾病发生情况比较 [n(%)]
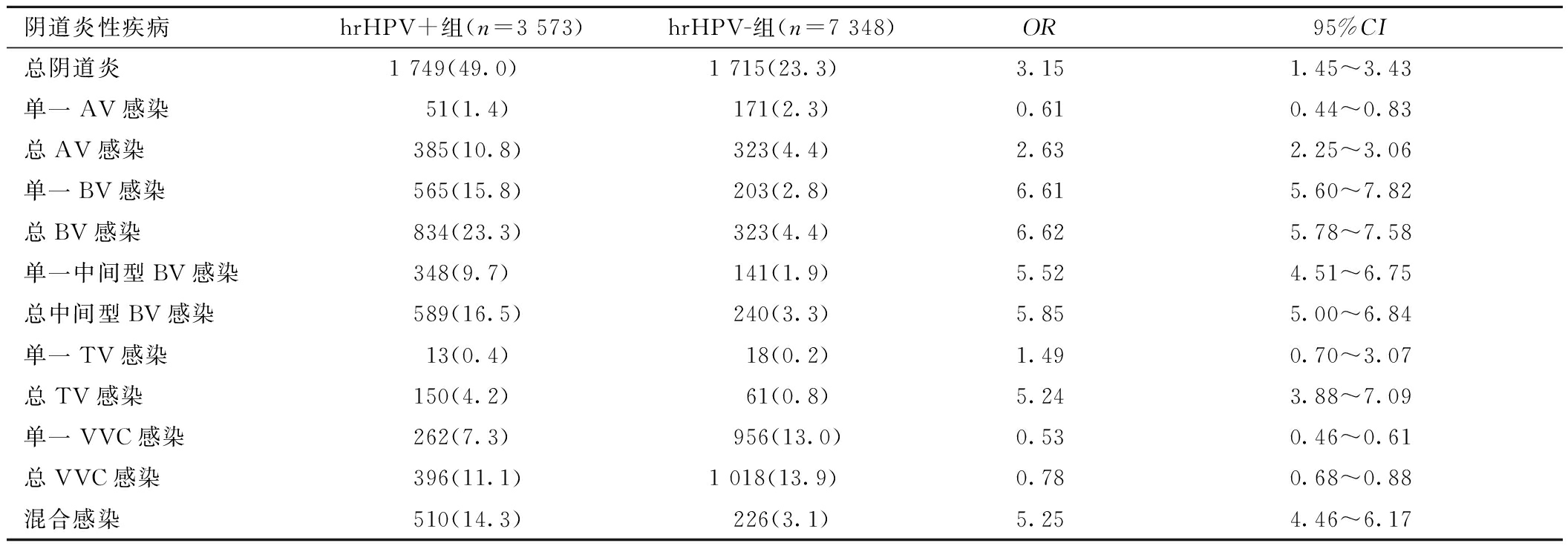
阴道炎性疾病hrHPV+组(n=3 573)hrHPV-组(n=7 348)OR95%CI总阴道炎1 749(49.0)1 715(23.3)3.151.45~3.43单一AV感染 51(1.4) 171(2.3)0.610.44~0.83总AV感染 385(10.8) 323(4.4)2.632.25~3.06单一BV感染 565(15.8) 203(2.8)6.615.60~7.82总BV感染 834(23.3) 323(4.4)6.625.78~7.58单一中间型BV感染 348(9.7) 141(1.9)5.524.51~6.75总中间型BV感染 589(16.5) 240(3.3)5.855.00~6.84单一TV感染 13(0.4) 18(0.2)1.490.70~3.07总TV感染 150(4.2) 61(0.8)5.243.88~7.09单一VVC感染 262(7.3) 956(13.0)0.530.46~0.61总VVC感染 396(11.1)1 018(13.9)0.780.68~0.88混合感染 510(14.3) 226(3.1)5.254.46~6.17
3.混合性阴道炎中hrHPV感染与各阴道炎性感染亚型相关性:混合性阴道炎共736例(6.7%,736/10 921),其中99.0%(729/736)存在BV(52.9%,389/736)或中间型BV(46.2%,340/736)感染。hrHPV+组中,含AV、BV、中间型BV、TV、VVC的混合感染发生率均显著高于hrHPV-组(P<0.05)。含AV的混合感染中,除AV+TV感染率在两组间无差异、AV+VVC未检到外,检测到的其他各含AV的混合亚型均合并了BV或中间型BV感染,且发生率均为hrHPV+组显著高于hrHPV-组(P<0.05)。含TV的混合感染中,除TV+AV感染率在两组间无差异、TV+VVC未检到外,检测到的其他各含TV的混合亚型均合并了BV或中间型BV感染,且发生率均为hrHPV+组显著高于hrHPV-组(P<0.05)。含VVC的混合感染中,除VVC+AV与VVC+TV未检到外,检测到的其他各含VVC的混合亚型均合并了BV或中间型BV感染,且发生率均为hrHPV+组显著高于hrHPV-组(P<0.05)。合并BV或中间型BV感染,均可显著提高AV、TV、VVC患者感染hrHPV的风险(P<0.05)。见表2、表3。
表2 hrHPV感染与混合性阴道炎及各亚型相关性[n(%)]
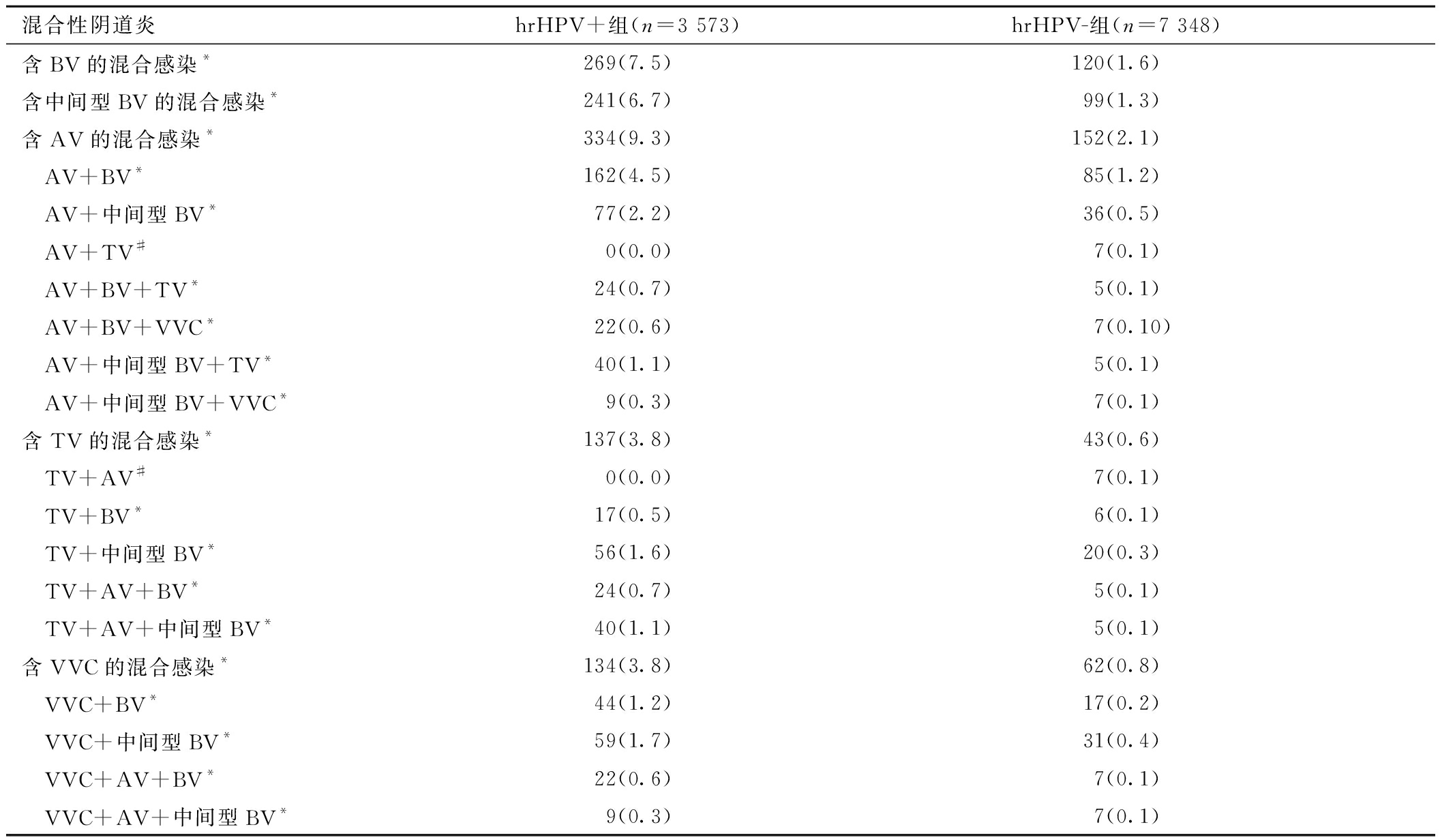
混合性阴道炎hrHPV+组(n=3 573)hrHPV-组(n=7 348)含BV的混合感染*269(7.5)120(1.6)含中间型BV的混合感染*241(6.7)99(1.3)含AV的混合感染*334(9.3)152(2.1) AV+BV*162(4.5)85(1.2) AV+中间型BV*77(2.2)36(0.5) AV+TV#0(0.0)7(0.1) AV+BV+TV*24(0.7)5(0.1) AV+BV+VVC*22(0.6)7(0.10) AV+中间型BV+TV*40(1.1)5(0.1) AV+中间型BV+VVC*9(0.3)7(0.1)含TV的混合感染*137(3.8)43(0.6) TV+AV#0(0.0)7(0.1) TV+BV*17(0.5)6(0.1) TV+中间型BV*56(1.6)20(0.3) TV+AV+BV*24(0.7)5(0.1) TV+AV+中间型BV*40(1.1)5(0.1)含VVC的混合感染*134(3.8)62(0.8) VVC+BV*44(1.2)17(0.2) VVC+中间型BV*59(1.7)31(0.4) VVC+AV+BV*22(0.6)7(0.1) VVC+AV+中间型BV*9(0.3)7(0.1)
注:两组比较,*P<0.05;#指Fisher′s精确检验
表3 合并BV或中间型BV对AV、TV及VVC患者hrHPV感染风险的影响[n(%)]

hrHPV感染AV*单一感染(n=222)合并感染#(n=479)TV*单一感染(n=31)合并感染#(n=183)VVC*单一感染(n=1218)合并感染#(n=196)hrHPV+51(23.0)334(69.7)13(41.9)137(74.9)262(21.5)134(68.4)hrHPV-171(77.0)145(30.3)18(58.1)46(25.1)956(78.5)62(31.6)
注:单一感染组与合并感染组比较,*P<0.05;#指合并BV或中间型BV感染
讨论
宫颈癌是第四大常见的女性恶性肿瘤,约90%的宫颈癌与hrHPV长期持续感染有关[5]。本研究显示陕西地区女性hrHPV感染率32.7%,与安徽省(31.3%,416/1 327)相似[10],明显高于北京、山西、浙江、福建、广东等地(10.7%~25.1%)[4,11-16]。与其他地区大样本人群研究结果[17-19]一致,陕西女性hrHPV感染以单一亚型hrHPV感染为主。与本院10年前对2 641例陕西女性的宫颈HPV感染分析[20]相比,本研究中HPV53和HPV66的感染频数显著增加(3.7% vs 1.1%,1.6% vs.0.4%;P<0.05),且均明显高于北京、武汉、江苏、福建等地[12,17-18,21]。值得注意的是,与国内多地万人以上的分析结果[17-18,21]一致,本研究显示,以HPV16、18为参照,HPV53和HPV66的感染率排序存在规律性:HPV16感染>HPV53感染> HPV18感染>HPV66感染,虽然各地不同HPV亚型感染率存在明显差异。排除中国人群常见的高危亚型HPV53和HPV66的单一及双重感染后,其他hrHPV感染率明显高于课题组对2009年5月至2016年9月期间行HPV检测(hrHPV中未纳入HPV53和HPV66)的27 053例陕西女性的分析结果(30.1% vs.26.2%,P<0.05)[6]。本研究中,hrHPV各亚型感染频数占前5位的依次为:HPV16、HPV52、HPV58、HPV53和HPV39,除第4位由HPV18变为HPV53外,十余年间其他最常见的四种亚型排位无变化,HPV18由第4位下降到第7位,但其感染率较前稍增加(2.3% vs.2.1%,P>0.05)。因此,本地区女性十余年间hrHPV感染呈明显上升趋势,常见感染亚型较为固定,亟需进一步改进临床精确诊断、准确用药的策略,以协同降低宫颈癌前病变、宫颈癌及HPV相关肿瘤在本地区的发病率[5]。
越来越多的研究发现,阴道炎性疾病在hrHPV持续感染和宫颈癌的发生发展中存在协同作用[4-5,22-23]。然而,不同研究中对常见阴道炎性疾病(BV、AV、TV和VVC)的统计方式缺乏统一标准,有些按单一感染频次进行统计[11,13],有些则按总感染频次(单一感染频次+含该阴道炎性疾病的混合感染频次)进行统计[4,10,12,14-16];有些纳入了中间型BV的分析[13-14],有些未纳入[4,10-12,15-16];有些纳入了AV的分析[10-12,14-16],有些未纳入[4,13];分析具体某种阴道炎性疾病与hrHPV相关性时,大多是在整体研究群体中分析的(比较hrHPV阳性组和阴性组中某一类阴道炎检出率),少数研究是在具体阴道炎性疾病组和正常菌群组间比较hrHPV或HPV检出率[13]。这些差异均可能造成结论的一些异质性。为进行更全面深入的分析,本研究纳入了中间型BV和AV的分析,并对常见阴道炎性疾病分别按单一感染与总感染进行统计,在整体研究群体中分析各阴道炎性疾病与hrHPV的相关性。
BV和中间型BV均是陕西女性hrHPV感染的危险因素。本研究发现,按单一感染或总感染频次计算,10 921例陕西女性中hrHPV+组BV和中间型BV发生率均显著高于hrHPV-组,OR值5.52~6.62,说明BV或中间型BV阳性均会增加本地区女性hrHPV感染风险。本研究结论与北京[11-12]、山西[13-14]、安徽[10]、浙江[15]、福建[14]、东莞[16]等多地千例以上(1 011~5 159例)按单一感染或总感染分析的关于BV的研究结果一致。纳入中间型BV的研究较少,Wang等[13]对4 449例山西女性的研究显示,中间型BV感染率在hrHPV+、lrHPV+、HPV-三组间(26.6% vs.18.5% vs.28.7%)、hrHPV+与hrHPV-两组间(26.6% vs.28.5%)均无明显差异(P>0.05);曾桢等[14]对1 972例山西女性的研究显示,中间型BV是hrHPV感染的危险因素(OR=2.05),与本研究结果一致。
本研究提示,按单一感染或总感染统计,VVC感染者发生hrHPV感染的比率均明显低于非VVC感染者,提示VVC阳性是hrHPV感染的保护因素,与王迎等[11]对VVC单一感染的研究结果一致。然而,Huang等[10]和陈士华等[15]对VVC总感染与hrHPV的相关性研究显示,按总感染进行统计,VVC是hrHPV感染的危险因素,但未进一步分析混合感染及VVC单一感染。本研究中,含VVC的196例混合感染中都存在BV或中间型BV的感染,与单一VVC感染相比,hrHPV感染率显著升高,提示合并BV或中间型BV是VVC患者感染hrHPV的危险因素。另外,虽然本研究中按总感染统计,VVC仍是hrHPV感染的保护因素,但含VVC的各混合感染类型均显示为hrHPV的危险因素,VVC总感染中单一感染与混合感染比为6.2∶1(1 218∶196)。因此,本研究猜测,按总感染统计的VVC阳性是否是hrHPV感染的危险因素取决于其中单一感染与混合感染的比率。陈锐等[12]、Wang等[13]和黄金印等[16]的研究按总感染统计进行分析,均提示VVC与hrHPV感染无关。
本研究纳入的10 921例陕西女性中,单一AV和单一TV感染率均很低(222例,2.0%;31例,0.3%),AV与TV双重感染仅0.1%(7例),除此7例外,含AV或TV的混合感染中均同时合并BV或中间型BV感染,且分别与相应的单一感染相比,hrHPV感染率均显著升高。提示合并BV或中间型BV是TV或AV患者感染hrHPV的危险因素。本研究有限的数据提示,hrHPV阳性组与阴性组中单一TV感染率无差异,与北京[11]的结果一致,但山西的一项研究[13]认为单一TV是hrHPV感染的危险因素。单一AV感染与hrHPV相关性的研究有限,王迎等[11]的数据(433例北京AV患者)显示两者间无相关性,而本研究提示单一AV阳性是hrHPV感染的保护因素,但计入含AV的混合感染后,AV却成为了hrHPV感染的危险因素。本研究中AV单一感染与混合感染比为0.5∶1(222∶486),混合感染为主。按总感染进行统计,多项研究[12,14-15]显示AV患者hrHPV感染率高于非AV患者,与本研究结果一致;另有一些研究[10,16]显示,AV阳性与hrHPV感染无关,但未进一步分析混合感染及AV单一感染。因此,按总感染统计的AV或TV阳性是否是hrHPV感染的危险因素,可能也取决于其中单一感染与混合感染的比率。
生殖道感染和阴道微生态环境的改变在宫颈癌的发生发展过程中起着重要作用,BV的特征是阴道菌群从乳酸杆菌为主转变为丰富多样的厌氧菌落,是包括HPV感染在内的许多常见性传播感染的危险因素[24]。本研究显示,BV和中间型BV均是hrHPV感染的绝对危险因素;单一VVC阳性是hrHPV感染的保护因素;由于数据有限,单一AV和TV是否与hrHPV感染相关尚存在争议;合并BV或中间型BV感染的AV、TV、VVC阳性患者,发生hrHPV感染风险均显著升高。因此,临床工作中,对于hrHPV阳性患者,应同时行阴道微生态检测,以及时发现BV或中间型BV,并予以积极处理,促进hrHPV的消退,并积累更多的支撑数据。
1 Bruni L,Serrano B,Roura E,et al.Cervical cancer screening programmes and age-specific coverage estimates for 202 countries and territories worldwide:a review and synthetic analysis.Lancet Glob Health,2022,10:e1115-e1127.
2 Anahtar MN,Gootenberg DB,Mitchell CM,et al.Cervicovaginal microbiota and reproductive health:the virtue of simplicity.Cell Host Microbe,2018,23:159-168.
3 Chao X,Sun T,Wang S,et al.Research of the potential biomarkers in vaginal microbiome for persistent high-risk human papillomavirus infection.Ann Transl Med,2020,8:100.
4 Lin W,Zhang Q,Chen Y,et al.The prevalence of human papillomavirus and bacterial vaginosis among young women in China:a cross-sectional study.BMC Womens Health,2021,21:409.
5 中华医学会妇产科学分会感染性疾病协作组.高危型人乳头瘤病毒与女性下生殖道感染联合检测专家共识.中国实用妇科与产科杂志,2022,38:524-528.
6 张涛红,王丽莎,安瑞芳,等.西安交通大学第一附属医院妇科门诊女性高危HPV感染情况.中国卫生统计,2019,36:78-80.
7 李娜,李娇,朱敏玲,等.孕妇早产与妊娠期阴道微生态环境变化的关系研究.中国医学前沿杂志(电子版),2020,12:130-134.
8 中华医学会妇产科学分会感染性疾病协作组.阴道微生态评价的临床应用专家共识.中华妇产科杂志,2016,51:721-723.
9 孟龄婷,薛艳,岳婷,等.HPV感染与BV、VVC、TV的相关性基于1261例妇科门诊患者的临床研究.中华妇产科杂志,2016,51:730-733.
10 Huang J,Yin C,Wang J.Relationship between vaginal microecological changes and oncogene E6/E7 and high-risk human papillomavirus infection.J Obstet Gynaecol,2023,43:2161349.
11 王迎,孔凡雪,游珂,等.高危型HPV感染与阴道微生态检测的相关性分析.中国生育健康杂志,2022,33:169-171.
12 陈锐,冯岩岩,吕涛,等.HR HPV感染与阴道微生态的相关性研究.现代妇产科进展,2020,29:360-362.
13 Wang W,Zhang XH,Li M,et al.Association between vaginal infections and the types and viral loads of human papillomavirus:A clinical study based on 4,449 cases of gynecologic outpatients.Can J Infect Dis Med Microbiol,2020,2020:9172908.
14 曾桢,王紫薇,李婷媛,等.阴道炎与高危型人乳头瘤病毒感染相关性横断面研究.中国实用妇科与产科杂志,2022,38:459-461.
15 陈士华,王良平,刘小香,等.阴道微生态改变与高危型人乳头状瘤病毒感染相关性分析.中国卫生检验杂志,2020,30:1050-1052.
16 黄金印,刘巍,李秋萍,等.东莞地区女性群体HPV感染现状及其与阴道微生态的关系.检验医学与临床,2022,19:2481-2485.
17 冯丹,汪莹,郑红云,等.74 590例女性HPV基因分型检测结果分析.武汉大学学报(医学版),2022,43:434-439.
18 于文芳,陈灿明,任佳,等.56434例女性人乳头瘤病毒感染与基因亚型分布情况.实用临床医药杂志,2021,25:25-28,34.
19 靳立功,张春花,刘洋,等.19665例人乳头瘤病毒感染类别、多重感染和递减顺序分析.徐州医科大学学报,2022,42:653-657.
20 侯萌,李娜,朱广霞,等.妇科门诊患者宫颈人乳头瘤病毒的感染情况分析.西安交通大学学报(医学版),2013,34:229-232,262.
21 吴雅玲.漳州市适龄妇女免费宫颈癌筛查HPV感染现状分析.妇幼护理,2023,3:2517-2520.
22 Liang Y,Chen M,Qin L,et al.A meta-analysis of the relationship between vaginal microecology,human papillomavirus infection and cervical intraepithelial neoplasia.Infect Agent Cancer,2019,14:1-8.
23 王秀芳,赵辉.人乳头瘤病毒感染和阴道微生态状况对宫颈鳞状上皮内病变的影响.中华医院感染学杂志,2021,31:268-271.
24 Usyk M,Schlecht NF,Pickering S,et al.molBV reveals immune landscape of bacterial vaginosis and predicts human papillomavirus infection natural history.Nat Commun,2022,13:233.