子宫内膜异位症(endometriosis,EMS) 是育龄妇女的一种常见病,极易复发,目前尚无根治方法[1]。为避免重复手术,寻找一种适合术后长期使用控制病情且易被患者接受的药物至关重要。本课题通过腹腔镜保守手术后联合地诺孕素治疗的患者疗效,来探讨其对EMS的疗效及对患者生生活质量的影响。
对象与方法
1.研究对象:以2021年1月—2022年6月我院就诊并接受腹腔镜保守手术的子宫内膜异位症患者为研究对象。入选标准:年龄20~45岁,由同一手术组人员手术,术后病理符合子宫内膜异位症的诊断标准;本院伦理委员会批准,患者知情同意。排除标准:术前6个月有激素治疗史;合并恶性肿瘤、严重的心脑血管疾病、肝肾功能不全者;妊娠期或哺乳期等。术后采用随机数字及随机数余数分组法,随机分为地诺孕素组(Dienogest,DNG组)和戈舍瑞林组(Gonadotropin releasing hormone agonist,GnRH-a组),每组各30例,地诺孕素组(DNG组)平均(28.3±5.7)岁;戈舍瑞林组(GnRH-a组)平均(30.2±4.3)岁,两组年龄比较,差异无统计学意义(P>0.05)。
2.研究方法:(1)DNG组,术后于月经来潮后开始每次口服1片(拜耳医药,国药准字H20180090,规格2 mg/片),1 d 1次,一直连续服用治疗半年。(2)对照组:GnRH-a组,术后于月经来潮第1~3 d皮下注射醋酸戈舍瑞林缓释植入剂(AstraZeneca UK Limited,国药准字J20100126,规格3.6 mg/支),每4周1次,每次3.6 mg 皮下注射,连续治疗3 次。
3.观察指标:(1)性激素水平及疼痛评分。两组患者给予药物治疗前于月经来潮第3 d抽血,和药物治疗后月经来潮第3天采集患者的空腹外周静脉血各5 mL,用发光免疫法检测促卵泡成熟激素(follicle-stimulating hormone,FSH)、黄体生成激素(luteinizing hormone,LH)、血清性激素雌二醇(estradio,E2)。采用视觉模拟量表(visual analogue scale,VAS):评估患者治疗前后的疼痛程度。选取10 cm的刻度尺,0端为完全无痛,10端为剧烈疼痛,无法忍受。(2)生存质量评价量表(short form 36 questionnaire,SF-36)评分[2]。对SF-36量表的9个维度进行评分。根据各个维度原始评分按量表转换公式换算最终得分。各维度转换得分= [(原始评分-最低可能评分)/一般平均可能评分]×100。经转换后量表各维度得分范围为0(最差生活状态)~100(最佳生活状态)。得分越高,提示患者生活质量相对较高。
4.统计学分析:采用SPSS 25.0进行数据统计分析,计量数据采用均数±标准差![]() 表示,t检验,P<0.05为差异有统计学意义。
表示,t检验,P<0.05为差异有统计学意义。
结果
1.性激素水平及疼痛的比较:治疗前两组外周血FSH、LH及E2水平、VAS评分比较,差异无统计学意义(P>0.05),具有可比性;治疗后,各组外周血上述指标均比治疗前显著降低(P<0.05),且地诺孕素组FSH(t=-7.850)、 E2(t=-11.460)均高于戈舍瑞林组,差异有统计学意义(P<0.05);两组VAS评分均比治疗前显著降低(P<0.05),但治疗后的两组VAS评分差异无统计学意义(P<0.05),见表1。
表1 两组患者治疗前后激素水平及VAS评分比较
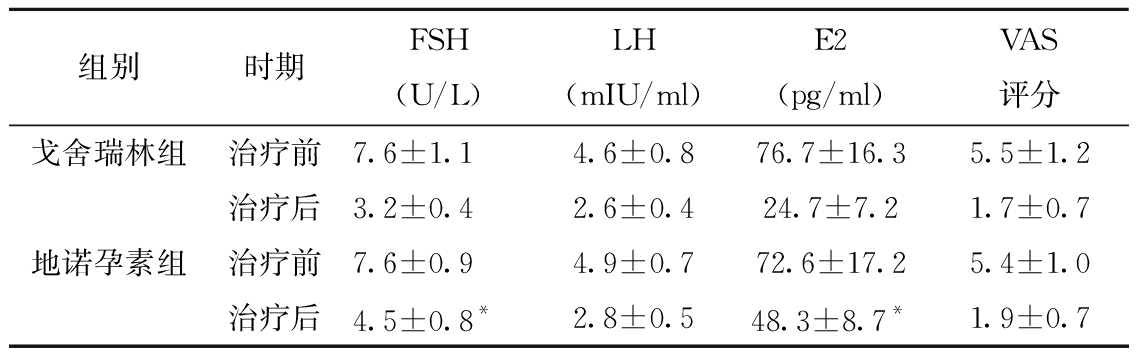
组别时期FSH(U/L)LH(mIU/ml)E2(pg/ml)VAS评分戈舍瑞林组治疗前7.6±1.14.6±0.876.7±16.35.5±1.2治疗后3.2±0.42.6±0.424.7±7.21.7±0.7地诺孕素组治疗前7.6±0.94.9±0.772.6±17.25.4±1.0治疗后4.5±0.8*2.8±0.548.3±8.7*1.9±0.7
注:*两组治疗后比较,P<0.05
2.SF-36评分的比较:治疗前,两组在SF-36评分9个项目上比较,差异均无统计学意义(P>0.05),具有可比性;与治疗前相比,治疗12周后,各组SF-36评分均显著提高,差异具有统计学意义(P<0.05),说明两组药物对于治疗子宫内膜异位症均有效果;治疗后,两组之间在社会功能(t=-4.563)、精神健康(t=-6.091)、情感职能(t=-7.838)上比较,地诺孕素组优于戈舍瑞林组,差异有统计学意义(P<0.05)(见表2)。
表2 两组患者治疗前后SF-36评分比较(均数±标准差)
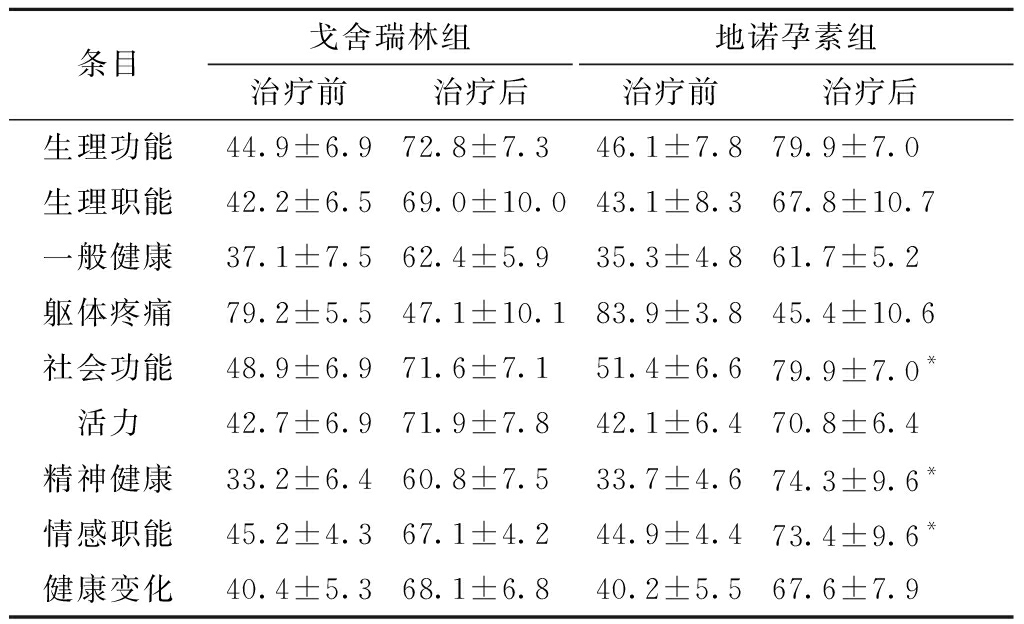
条目戈舍瑞林组治疗前治疗后地诺孕素组治疗前治疗后 生理功能44.9±6.972.8±7.346.1±7.879.9±7.0生理职能42.2±6.569.0±10.043.1±8.367.8±10.7一般健康37.1±7.562.4±5.935.3±4.861.7±5.2躯体疼痛79.2±5.547.1±10.183.9±3.845.4±10.6社会功能48.9±6.971.6±7.151.4±6.679.9±7.0*活力42.7±6.971.9±7.842.1±6.470.8±6.4精神健康33.2±6.460.8±7.533.7±4.674.3±9.6*情感职能45.2±4.367.1±4.244.9±4.473.4±9.6*健康变化40.4±5.368.1±6.840.2±5.567.6±7.9
注:*两组治疗后比较,P<0.05
讨论
目前临床上对于EMS的治疗,以手术切除病灶为主,既能够改善疼痛又能保留生育力,因EMS大部分患者处于育龄期,腹腔镜保守手术是最常采用的方式[3]。近年研究显示内异症术后复发率高,术后5年复发率可达40%~50%[4],复发症状中痛经、性交困难和慢性盆腔疼痛分别为14.5%、6%和5.4%[5]。高复发率和重复手术将远期上加剧患者的疼痛和降低生育力,影响患者生活质量并增加个人及社会经济负担。因此,腹腔镜保守手术后积极预防症状和病灶复发,才能真正的改善患者的疼痛和生育力,并提高患者的生活质量。
戈舍瑞林是一种人工合成的GnRH-a药物,能长效抑制雌激素的分泌,抑制内异症的生长及复发[6]。本研究发现戈舍瑞林组中腹腔镜保守手术术后通过补充戈舍瑞林治疗,有效降低患者的性激素水平、减少VAS疼痛评分、提高SF-36评分。但是戈舍瑞林易导致雌激素水平过低,引起低雌症状如不同程度的潮热、头痛、骨密度降低、性欲下降等,限制了其长期使用[7]。
DNG为一种19-乙烯去甲睾酮,与其他19-乙烯去甲睾酮不同,在17α位置上氰乙基团代替了乙炔基团,通过这一独特的分子结构结合了19-乙烯去甲睾酮的优点(如血浆半衰期相对较短,大约为10 h,体内不蓄积,对子宫内膜有强烈的孕激素效应,口服生物利用度>90%,与肝蛋白反应活性低对肝脏影响小)和孕酮衍生物的益处(如,抗雄激素活性和相对适度地抑制促性激素分泌,在体内几乎没有雌激素、盐皮质激素或糖皮质激素活性)[8]。DNG具有强烈的子宫内膜作用,通过内质网应激诱导调节子宫内膜异位症间质细胞凋亡、增殖和侵袭性,2 mg/d即可高效转化异位内膜[9]。多篇研究循证分析了近10余年的DNG治疗EMS的疗效,充分肯定了DNG的作用[10]。
本研究进一步证实了DNG组能有效降低性激素水平(FSH、LH、E2),但DNG组降低FSH、E2水平的程度显著低于GnRH-a组。与DNG是通过中度抑制下丘脑-垂体-卵巢轴,中度抑制促性腺激素分泌,抑制卵巢功能,维持体内雌激素水平处于治疗窗内,抑制病灶生长有关。Rie O[11]等详细测定了DNG组雌二醇为40.9±25.3(32.2~49.6)pg/mL,GnRH-a组雌二醇 16.6±19.7(10.2~23.0)pg/mL,结合雌激素阈值理论[12],DNG在治疗EMS中,雌激素水平处于最适合状态,既能缓解症状、减少复发,同时又能减少骨质疏松、头痛及潮热症状,与本研究结论一致。在SF-36评分方面,DNG组有效弥补了长期GnRH-a药物治疗诱发的低雌激素症状带来的精神健康、情感职能及社会功能不足缺陷。
在疼痛程度改善方面,DNG组及GnRH-a组均疗效显著,两组疗效差别无统计学意义。本研究使用视觉模拟评分法测量盆腔疼痛严重程度。GnRH-a可明显降低EMS患者的盆腔疼痛症状,多项系统回顾研究已达成一致结果[13]。近年,研究表明DNG对EMS患者的盆腔疼痛也有明显的缓解作用,甚至对于难治性子宫内膜异位症的相关疼痛也有很好的缓解作用[14]。
本研究提示腹腔镜保守手术联合地诺孕素治疗子宫内膜异位症的疗效显著,能有效减少复发,明显降低患者的疼痛症状,提高患者的生活质量,值得临床推广应用。在地诺孕素治疗期间的不良反应方面,如阴道不规则出血、乳房胀痛、血脂血糖改变等,虽然没有纳入本实验统计范围,但是综合多项高质量多中心回顾性研究及Mate分析数据表明[15-16],DNG治疗EMS是安全有效的,同时研究中也提示保守治疗术后GnRH-a加DNG维持治疗可能是最有效的干预措施,需要进一步行大规模临床随机对照研究来进行分析证实。
1 Falcone T,Flyckt R.Clinical management of endometriosis.Obstet Gynecol,2018,131:557-571.
2 Lins L,Carvalho FM.SF-36 total score as a single measure of health-related quality of life:Scoping review.SAGE Open Med,2016,4:1-12.
3 王惠娟.子宫内膜异位症的腹腔镜手术治疗临床进展.实用妇科内分泌杂志(电子版),2017,4:5.
4 孔东丽,郭红燕.子宫内膜异位症保守性手术后长期用药预防复发的研究进展.实用妇产科杂志,2015,31:19-22.
5 Porpora MG,Pallante D,Ferro A,et al.Pain and ovarian endometrioma recurrence after laparoscopic treatment of endometriosis:a long-term prospective study.Fertil Steril,2010,93:716-721.
6 谭先杰,郎景和.戈舍瑞林在妇科疾病中应用的疗效及安全性.中华妇产科杂志,1998,33:58-60.
7 Mohamed A B,Catherine A.Long-term medical management of endometriosis with dienogest and with a gonadotropin-releasing hormone agonist and add-back hormone therapy.Fertil Steril,2017,107:537-548.
8 金秋,韩旭.地诺孕素治疗子宫内膜异位症的临床研究进展.医学综述,2021,27:3483-3487.
9 Choi J,Jo M,Lee E,et al.Dienogest regulates apoptosis,proliferation,and invasiveness of endometriotic cyst stromal cells via endoplasmic reticulum stress induction.Mol Hum Reprod,2020,26:30-39.
10 Murji ![]() K,Leng J,et al.Use of dienogest in endometriosis:a narrative literature review and expert commentary.Curr Med Res Opin,2020,36:895-907.
K,Leng J,et al.Use of dienogest in endometriosis:a narrative literature review and expert commentary.Curr Med Res Opin,2020,36:895-907.
11 Ozaki R,Kumakiri J,Jinushi M,et al.Comparison of effect of preoperative dienogest and gonadotropin-releasing hormone agonist administration on laparoscopic cystectomy for ovarian endometriomas.Arch Gynecol Obstet,2020,302:969-976.
12 Barbieri R L.Hormone treatment of endometriosis:the estrogen threshold hypothesis.Am J Obstet Gynecol,1992,166:740-745.
13 Zakhari A,Delpero E,McKeown S,et al.Endometriosis recurrence following post-operative hormonal suppression:a systematic review and meta-analysis.Hum Reprod Update,2021,27:96-107.
14 徐冰,李华军,贾婉璐,等.地诺孕素用于难治性子宫内膜异位症疼痛的临床研究.中华妇产科杂志,2021,56:178-184.
15 Cho B,Roh JW,Park J,et al.Safety and effectiveness of dienogest(Visanne®) for treatment of endometriosis:A large prospective cohort study.Reprod Sci,2020,27:905-915.
16 C.C.Chiu,T.F.Hsu,L.Y.Jiang,et al.Maintenance therapy for preventing endometrioma recurrence after endometriosis resection surgery-A Systematic review and network meta-analysis.J Minim Invasive Gynecol,2022,29:602-612.