近年来,男性年龄对生育和子代的影响越来越受到关注,年龄与精子质量下降密切相关,高龄男性精子存在基因缺陷和染色体异常概率增加现象[1]。精液常规是男性生育能力最基本检查,但精子浓度、精子活力及精子形态等参数不能满足临床对男性生育力的评估[2]。精子DNA是胚胎父方来源遗传信息的载体,其结构的完整性是正常受精、胚胎发育及妊娠的前提。目前研究主要在年龄对精子DNA完整性影响[3],较少关注精子核成熟度,本研究主要探讨年龄与精子DNA完整性、核成熟度及精液参数的相关性。
对象与方法
1.研究对象:2022年3月—2022年6月在我院生殖医学中心门诊就诊的140例男性不育患者。纳入标准:①未避孕未育1年;②精子浓度≥15×106/mL,精子前向运动百分率≥10%,精子正常形态率高于或低于参考值。排除标准:①体检发现生殖器官畸形;②无精子症;③女方因素造成不孕;④外周血染色体核型结构或数目异常及Y染色体微缺失;⑤精液白细胞>1.0×106/mL,近期有泌尿生殖系统感染史。患者年龄分为4组:25~29岁,30~34岁,35~39岁,≥40岁。
2.方法:对精液参数、精子顶体完整率、精子DNA碎片化指数(DNA fragmentation index,DFI)、高DNA可染性精子(High DNA Stainabilty,HDS)及精子色霉素A3(Sperm chromomycinA3,CMA3)阳性率进行检测。
(1)计算机辅助精液分析(computer assisted sperm analysis,CASA):禁欲3~7 d,精液必须采集完整,使用清洁、无菌的专用取精杯,通过手淫收集一次射精的全部精液,放入37℃恒温水浴箱。按照《WHO人类精液检查与处理实验室手册(第五版)》的标准进行处理,用赛司SCA-II精液分析仪做精液分析,指标包括:精子浓度、精子前向运动百分率(progressive,PR)、精子活动率[前向运动精子(PR)+非前向运动精子(non-progressive,NP)]等;精子形态学采用快速染色液(Diff-Quik法),试剂盒由深圳市博锐德生物科技有限公司提供,并严格按照说明书进行涂片、固定与染色,按照Kruger标准法进行形态分类计数,在光学显微镜下人工计数至少 200条精子,计算正常形态精子百分率。
(2)精子染色质结构分析(sperm chromatin structure assay,SCSA) :吖啶橙染色液由深圳市博锐德生物科技有限公司提供,操作严格按照试剂说明书进行样本准备,在适用的流式细胞仪小管中加入计算后的精液量,加入试剂A 50ul,轻轻混合,再加入试剂B 100 μL,轻轻混合,计时30秒,立即加入试剂C 300 μL,轻经混合;将处理好精液样本上流式细胞仪(Mindray Bricyte E6)检测(488 nm激发光),调整精子流速,至少计数5 000条精子的荧光,采用软件分析各种荧光的精子比例,得出精子DNA碎片化指数(DNA fragmentation index,DFI)和高DNA可染性精子(high DNA stainabilty,HDS)。
(3)荧光染色法:精子色霉素A3(sperm chromomycinA3,CMA3)染色液由深圳市博锐德生物科技有限公司提供,操作严格按照试剂说明书进行样本准备,在小试管中加入洗涤后的精子2×106个(液量不要超过250 μL),加入2~8 ℃预温的固定液0.25 mL,混合,2~8 ℃固定5 min,用生理盐水离心洗涤2次,精子沉淀悬浮于100 μL CMA3荧光染剂中,混匀,室温反应50 min。用生理盐水2 000 g×5 min离心洗涤1次,弃上清,精子沉淀悬浮于0.2~0.3 mL生理盐水中,将处理好精液样本上流式细胞仪(Mindray Bricyte E6)检测(445 nm激发光),至少分析5 000个精子,分析精子CMA3染色阳性精子百分率。
(4)精子顶体染色液:精子顶体染色液【(peanut agglutinin,PNA)荧光染色法】由深圳市博锐德生物科技有限公司提供,操作严格按照试剂说明书进行样本准备,将处理后的精子悬液0.5 mL加入小管中,加入荧光染剂5 μL,37 ℃孵育15 min,将处理好精液样本上流式细胞仪(Mindray Bricyte E6)检测(488 nm激发光),至少分析5 000个精子,分析精子顶体完整率。
3.统计学分析:采用SPSS 26.0统计软件进行数据分析,计量资料用![]() 表示,组间差异采用非参数检验分析,年龄与精液参数、精子顶体完整性、活性氧(reactive oxygen species,ROS)、DFI、 HDS 及CMA3的相关性均采用spearman相关性分析,以P<0.05为差别有统计学意义。
表示,组间差异采用非参数检验分析,年龄与精液参数、精子顶体完整性、活性氧(reactive oxygen species,ROS)、DFI、 HDS 及CMA3的相关性均采用spearman相关性分析,以P<0.05为差别有统计学意义。
结果
1.研究对象一般特征:不同年龄组之间的精液体积、PR、精子活动率、精子顶体完整率、ROS、DFI及HDS差异具有统计学意义(P<0.05),不同年龄组之间精子浓度和精子正常形态率的差异无统计学意义(P>0.05),详见表1。
表1 不同年龄组精液参数、精子顶体完整率、精子DNA完整性及CMA3比较
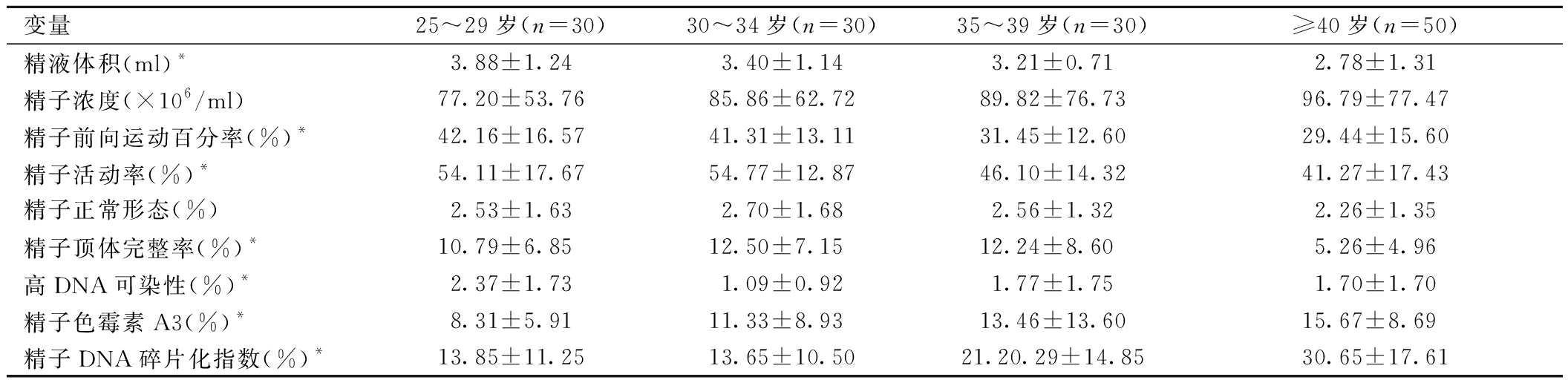
变量25~29岁(n=30)30~34岁(n=30)35~39岁(n=30)≥40岁(n=50)精液体积(ml)*3.88±1.243.40±1.143.21±0.712.78±1.31精子浓度(×106/ml)77.20±53.7685.86±62.7289.82±76.7396.79±77.47精子前向运动百分率(%)*42.16±16.5741.31±13.1131.45±12.6029.44±15.60精子活动率(%)*54.11±17.6754.77±12.8746.10±14.3241.27±17.43精子正常形态(%)2.53±1.632.70±1.682.56±1.322.26±1.35精子顶体完整率(%)*10.79±6.85 12.50±7.15 12.24±8.60 5.26±4.96高DNA可染性(%)*2.37±1.731.09±0.921.77±1.751.70±1.70精子色霉素A3(%)*8.31±5.9111.33±8.93 13.46±13.6015.67±8.69 精子DNA碎片化指数(%)*13.85±11.2513.65±10.5021.20.29±14.8530.65±17.61
*组间两两比较,P<0.05。
2.年龄与精液各参数间相关性:年龄与精液体积、PR、精子活动率(total motility,TM)和精子顶体完整率呈负相关(P<0.05);年龄与DFI和CMA3呈正相关(P<0.05);年龄与精子浓度、精子正常形态率和HDS不相关(P>0.05)。详见表2。
表2 年龄与精液参数、精子顶体完整率、CMA3及DFI的相关系数

变量年龄精液体积*-0.333精子前向运动百分率(PR)*-0.315精子活动率(TM)*-0.323精子色霉素A3(CMA3)*0.362精子DNA碎片化指数(DFI)*0.439精子顶体完整率*-0.363精子浓度0.099精子正常形态率-0.072高DNA可染性(HDS)-0.084
*P<0.05
3.精子DNA碎片化指数(DFI)与精液各参数间相关性:DFI与精液体积、PR、TM、精子正常形态率、精子顶体完整率和HDS之间呈负相关(P<0.05);DFI与年龄和CMA3之间呈正相关(P<0.05);DFI与精子浓度不相关(P>0.05),详见表3。
表3 DFI与年龄、精液参数、精子顶体完整率、CMA3及HDS的相关系数

变量DFI年龄*0.439精子前向运动百分率(PR)*-0.402精子活动率(TM)*-0.417精子正常形态率*-0.197精子顶体完整率*-0.315精子色霉素A3(CMA3)*0.234高DNA可染性(HDS)*-0.253精液体积*-0.167精子浓度0.05
*P<0.05。
4.高DNA可染性精子(HDS)与精液各参数间相关性:HDS与DFI呈负相关(P<0.05);HDS与CMA3呈正相关(P<0.05);HDS与精液体积、精子浓度、PR、TM、精子正常形态率、年龄和精子顶体完整率不相关(P>0.05),详见表4。
表4 HDS与DFI、CMA3的相关系数

变量HDS精子DNA碎片化指数(DFI)*-0.253精子色霉素A3(CMA3)*0.189精液体积0.116精子浓度-0.101精子前向运动百分率(PR)-0.056精子活动率(TM)-0.073精子正常形态率0.037年龄-0.084精子顶体完整率-0.123
*P<0.05。
5.精子色霉素A3与精液各参数间相关性:精子色霉素A3(CMA3)与年龄、HDS和DFI呈正相关(P<0.05);CMA3与TM和精子正常形态率呈负相关(P<0.05),CMA3与精液体积、精子浓度、PR及精子顶体完整率不相关(P>0.05),详见表5。
表5 CMA3与年龄、精液参数、DFI及HDS的相关系数

变量精子色霉素A3(CMA3)年龄*0.360精子活动率(TM)*-0.187精子正常形态率*-0.268高DNA可染性(HDS)*0.189精子DNA碎片化指数(DFI)*0.234精液体积-0.113精子浓度-0.141精子前向运动百分率(PR)-0.162精子顶体完整率-0.111
*P<0.05。
讨论
女性年龄与辅助生殖结局之间的关系已被证实,如女性年龄≥35岁会降低妊娠率、增加自然流产及妊娠期并发症等[4]。近年来男性生育能力与年龄间关系受到关注,男性生育能力随着年龄增长而下降,影响精子质量,在一定程度上影响受精、胚胎发育、着床和妊娠结局[5]。本研究以男性年龄≥40岁为高龄[6],发现年龄不影响精子浓度和精子正常形态率,与Park YS等[7]结论一致,其研究表明精子头部空泡不随年龄的增长而增多;王燕等[8]研究显示随着年龄增加,精子正常形态率下降,均采用快速染色法(Diff-Quick)检测精子形态,排除方法学差异,可能与样本量有关;说明年龄是否影响精子正常形态率仍存争议。
本研究发现不同年龄组之间的精液体积、PR、精子活动率、精子顶体完整率、DFI及HDS差异具有统计学意义,结论与大多数的研究一致[9-12]。从精液体积的结果可发现,年龄与精液体积之间存在负相关,≥40岁精液体积显著性减少,与国内彭浩[11]及Rosiak-Gill[12]研究报道一致,可能是高龄男性性腺分泌功能减退有关。年龄与PR、精子活动率及精子顶体完整率呈负相关,说明随着男性年龄增大,精子质量下降,生育能力下降,与Petersen[13]及王甩艳[14]研究结论类似。
精子承载着男性的遗传信息,无损伤的精子DNA是父系遗传信息完整传递给子代的前提,精子核成熟度与精子DNA 完整性密切相关,精子核成熟度异常可能会影响精子的功能,对受精和胚胎发育造成不良影响。CMA3是一种荧光染料,可与鱼精蛋白竞争性结合DNA分子中的特定区域,计数CMA3染色阳性精子所占比例,间接地反映精子核的成熟情况[15]。本研究显示CMA3阳性率与年龄、DFI及HDS呈正相关,说明男性年龄会影响精子核成熟度,鱼精蛋白与组蛋白比例异常,影响精子染色质浓缩,造成染色质包装不良,鱼精蛋白对DNA 的保护作用减弱,增加精子DNA损伤[16]。HDS指高可染性的精子即核未完全缩合的不成熟精子占总精子的百分数,HDS高即精子核成熟度低。CMA3与HDS呈低度正相关(r=0.189,P=0.025),Mohammadi[17]采用原位末端标记法(terminal deoxynucleotidyl transferase dUTP nick end labeling,TUNEL)和SCSA这两种方法检测DFI和HDS,在SCSA的检测方法中同样发现CMA3与HDS也是呈低度正相关(r=0.2,P<0.001),说明CMA3和HDS均可以反映核成熟度。同时也发现HDS与DFI呈负相关(r=-0.253,P=0.003),即DFI随年龄增长而增加,HDS随年龄增长而降低,而Deenadayal等[18]的研究中只有45岁以上的男性的精子DFI会随年龄增长而增高,但HDS最低,说明高龄是影响DFI的危险因素之一。
精液分析仍是评估男性精子质量的主要指标,其主要的参数有:精子浓度、精子活力和精子正常形态率;既往研究表明随男性年龄增大对精子形态存在不良影响,且精子DNA的损伤可能影响精子形态。本研究显示精子DFI、CMA3与精子正常形态率均呈负相关,说明随着精子DFI的升高及成熟度异常,正常形态精子百分率呈下降趋势,从而影响精子受精能力。精子DFI与PR、精子活动率及精子顶体完整率均呈负相关,与骆强翔等研究结论类似[19],提示精子DFI在一定程度上可以反映精子活力情况,但本研究显示DFI与精子浓度不相关;年龄与精子DFI及CMA3呈正相关,而与PR、精子活动率及顶体完整率呈负相关,说明年龄是影响精子DNA完整性及成熟度的因素之一,提示随着男性年龄增长,不仅影响精子活力,也影响精子DNA完整性及成熟度,从而导致男性生育能力下降。
年龄不仅对女性生育能力产生负面影响,对男性也是如此。男性年龄不仅影响精子活力、精子正常形态及精子顶体完整率,还影响精子DNA完整性及核成熟度,将会影响胚胎发育、增加出生缺陷及引起子代异常的风险,甚至还会影响辅助生殖的结局[20]。所以,针对高龄男性生育力评估,除常规精液检查外,建议需评估精子DNA完整性及核成熟度。
1 Kimura R,Yoshizaki K,Osumi N.Risk of Neurodevelopmental Disease by Paternal Aging:A Possible Influence of Epigenetic Alteration in sperm.Adv Exp Med Biol,2018,1012:75-81.
2 Gao J,Yuan R,Yang S,et al.Age-related changes in human conventional semen parameters and sperm chromatin structure assay-defined sperm DNA/chromatin integrity.Reprod Biomed Online,2021,42:973-982.
3 Deenadayal Mettler A,Govindarajan M,Srinivas S,et al.Male age is associated with sperm DNA/chromatin integrity.Aging Male,2020,23:822-829.
4 Maheshwari A,Hamilton M,Bhattacharya S.Effect of female age on the diagnostic categories of infertility.Hum Reprod,2008,23:538-542.
5 Halvaei I,Litzky J,Esfandiari N.Advanced paternal age:effects on sperm parameters,assisted reproduction outcomes and offspring health.Reprod Biol Endocrinol,2020,18:110.
6 Toriello HV,Meck JM.Statement on guidance for genetic counseling in advanced paternal age.Genet Med,2008,10:457-460.
7 Park YS,Park S,Ko DS,et al.Observation of sperm-head vacuoles and sperm morphology under light microscope.Clin Exp Reprod Med,2014,41:132-136.
8 王燕,李莉,张刘洋,等.年龄对不育男性精子DNA碎片率和精子形态的影响.武汉大学学报(医学版),2019,40:133-138.
9 Verón GL,Tissera AD,Bello R,et al.Impact of age,clinical conditions,and lifestyle on routine semen parameters and sperm kinematics.Fertil Steril,2018,110:68-75.e4.
10 Gao J,Yuan R,Yang S,et al.Age-related changes in human conventional semen parameters and sperm chromatin structure assay-defined sperm DNA/chromatin integrity.Reprod Biomed Online,2021,42:973-982.
11 彭洁,易兵,戚青林.不育患者年龄与精液常规参数及精子DNA完整性的关系研究.中国性科学,2021,30:18-21.
12 Rosiak-Gill A,Gill K,Jakubik J,et al.Age-related changes in human sperm DNA integrity.Aging(Albany NY),2019,11:5399-5411.
13 Petersen CG,Mauri AL,Vagnini LD,et al.The effects of male age on sperm DNA damage:an evaluation of 2,178 semen samples.JBRA Assist Reprod,2018,22:323-330.
14 王甩艳,张秀明,林喜荣,等.精子DFI、HDS与精子形态和患者年龄的相关性分析.国际检验医学杂志,2021,42:621-623.
15 Nasr-Esfahani MH,Razavi S,Mozdarani H,et al.Relationship between protamine deficiency with fertilization rate and incidence of sperm premature chromosomal condensation post-ICSI.Andrologia,2004,36:95-100.
16 Kim JH,Jee BC,Lee JM,et al.Histone acetylation level and histone acetyltransferase/deacetylase activity in ejaculated sperm from normozoospermic men.Yonsei Med J,2014,55:1333-1340.
17 Mohammadi Z,Tavalaee M,Gharagozloo P,et al.Could high DNA stainability(HDS) be a valuable indicator of sperm nuclear integrity.Basic Clin Androl,2020,30:12.
18 Deenadayal Mettler A,Govindarajan M,Srinivas S,et al.Male age is associated with sperm DNA/chromatin integrity.Aging Male,2020,23:822-829.
19 骆强翔,廖勇彬,黄昌平,等.精子DNA碎片指数与年龄和精液参数的相关性及其对IVF-ET的影响.中华男科学杂志,2020.
20 Evenson DP,Djira G,Kasperson K,et al.Relationships between the age of 25,445 men attending infertility clinics and sperm chromatin structure assay(SCSA®) defined sperm DNA and chromatin integrity.Fertil Steril,2020,114:311-320.