多种酰基辅酶A脱氢酶缺乏症(multiple acyl-CoA dehydrogenase deficiency,MADD)又称戊二酸血症Ⅱ型(glutaric acidemia type Ⅱ),是一种影响脂肪酸、氨基酸和胆碱代谢的常染色体隐性遗传病。本文通过对1例脂肪酸代谢障碍患儿的基因结果及临床特点进行回顾,以增加对此病的认识。
病例资料
患儿男,生后15 h,因“呼吸困难3 h”收入NICU。患儿系第4胎第4产,胎龄39周,因“其母瘢痕子宫”剖宫产娩出,出生体重2 740 g,无缺氧窒息史。母孕期无创DNA检查提示低风险,孕中期外院胎儿结构筛查提示股骨偏小孕周2周,于产前诊断中心就诊,结合患儿母亲既往2次不良生育史(第1胎足月男婴,生后3 d死亡;第3胎足月女婴,生后4 d死亡) ,建议行脐血穿刺排除胎儿染色体异常及相关单基因遗传病的可能性,家属拒绝。父母体健,非近亲结婚,第2胎姐姐8岁身体健康。
入院查体:T 36.8 ℃,P 146次/min,R 65次/min,血氧饱和度97%,右上肢血压60/45 mmHg(1mmHg=0.133 kPa),左上肢血压54/40 mmHg,左下肢血压58/69 mmHg,右下肢血压67/49 mmHg。身长48 cm,头围33.5 cm,前额稍突出,鼻扁平,气促,有三凹征,双肺呼吸音清,未闻及干湿啰音,心率146次/分,律齐,心音有力,未闻及病理性杂音。腹软不胀,肝脾肋下未及,肠鸣音正常,四肢肌张力正常,肢端暖,毛细血管再充盈时间2秒。辅助检查:血气分析:pH 7.36,PCO227 mmHg,PO2 93 mmHg,SaO2 97%,HCO3-15.8 mmol/L,Lac 9.20 mmol/L,血气分析提示代谢性酸中毒合并呼吸性碱中毒,血糖5.8 mmol/L,病原学阴性,血常规、生化、凝血功能、血氨等未见明显异常。心脏超声:室间隔缺损(膜周部5 mm),房水平左向右分流(两处,卵圆孔或小房缺,分别为2.2 mm,2 mm)主动脉弓降部发育稍差,二尖瓣、三尖瓣轻度返流;头颅、肝胆脾及肾脏超声未见明显异常。血浆氨基酸含量未见明显异常。尿气相色谱质谱(GC-MS)分析:尿中见少量己二酸、癸二酸、辛二酸,还可见微量戊二酸。血浆酰基肉碱结果显示C4,C5,C6,C8,C10,C12,C14:1,C14,C16:1,C16,C18:1,C18等多种酰基肉碱含量明显升高,提示以下脂肪酸代谢障碍:(1)多种酰基CoA脱氢酶缺乏(又名戊二酸血症II型);(2)肉碱-棕榈酰基转移酶II缺乏(CPT II);(3)肉碱-酰基肉碱转移酶缺乏(CACT)。完善CPT II型基因、肉碱SLC25A20基因未见已知致病突变。
诊疗经过:入院后予无创呼吸机辅助通气及静脉营养治疗,血气明显代谢性酸中毒,血浆酰基肉碱示多种酰基肉碱含量升高,初步诊断脂肪酸代谢障碍,予低脂高热量饮食,缩短喂养间隔,避免低血糖,加用左卡尼汀治疗,住院2周撤离呼吸机,监测肝肾心功能、血气分析、血糖等指标无异常,出院后于我院内分泌科门诊随诊,完善全外显子测序,基因分析结果显示:患儿ETFA基因(NM-000126)检出c.365G>A(p.R122K)和c.659delC(p.S220Lfs*6) 杂合变异,分别来自于母亲和父亲,Sanger测序验证结果见表1、图1。患儿明确诊断为多种酰基辅酶A脱氢酶缺乏症,应用维生素B2、辅酶Q10、左卡尼汀等治疗,生后5月龄因“发热3 d,精神倦2 d”再次就诊我院,患儿表现为呼吸困难、反应差及循环不良,腹部超声提示腹腔积脓(部分包裹),外科会诊建议行手术探查明确有无肠道穿孔,经家属同意,予患儿行腹腔镜检查,术中未见肠管坏死或穿孔,腹腔可见脓性分泌物,术后转入小儿重症监护病房,予高参数高频呼吸机辅助通气,维生素B2、辅酶Q10、左卡尼汀,血管活性药物维持循环及抗感染等治疗,仍有血流动力学不稳定,出现难以纠正的内环境紊乱,患儿病情危重,预后差,家属放弃治疗,最终死亡。
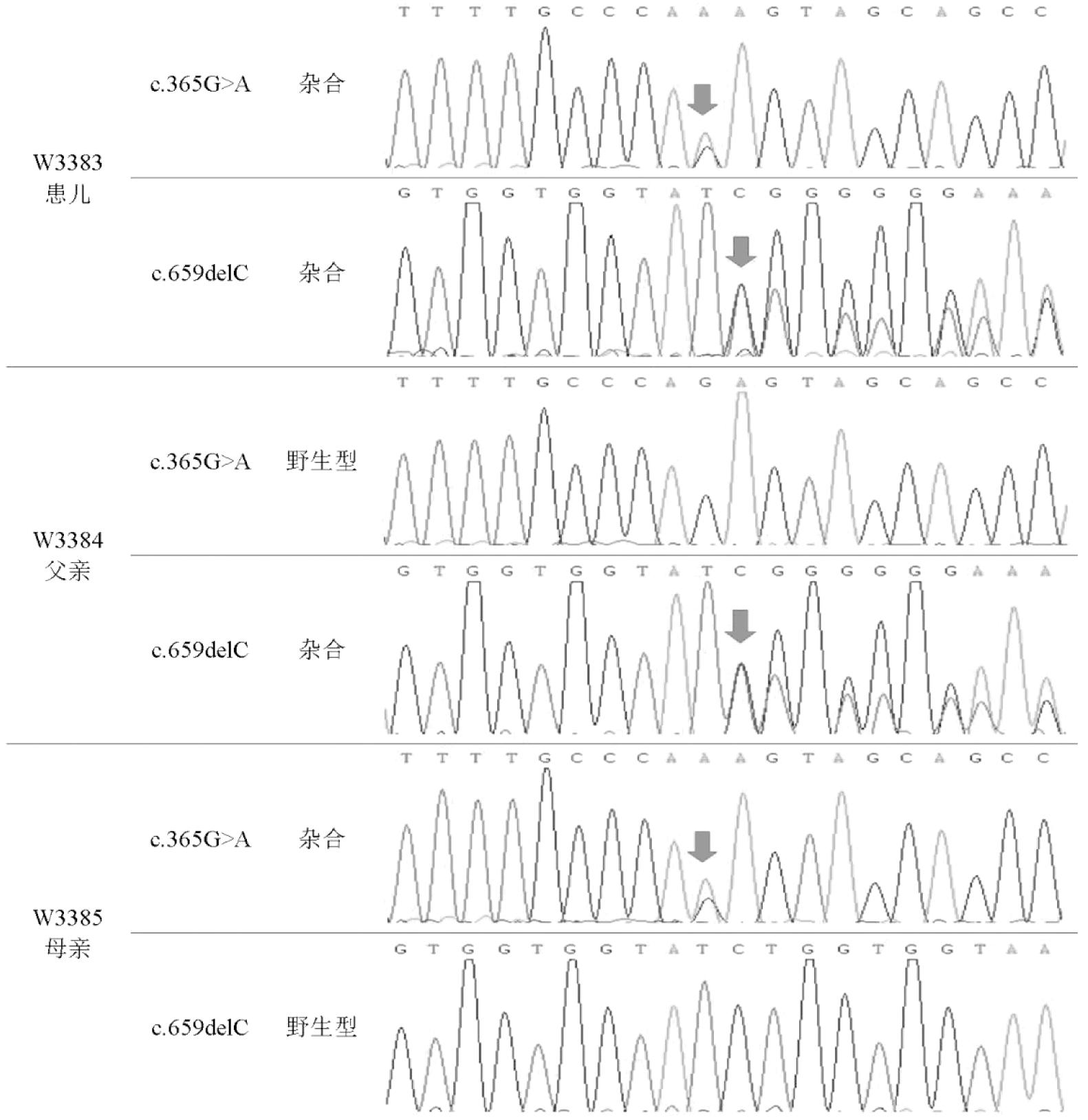
图1 患儿及其父母基因测序图:c.365G>A(p.R122K)变异遗传来自母亲,c.659delC(p.S220Lfs*6)变异来自于父亲。
表1 ETFA基因(NM-000126)变异以及家系来源

基因染色体核苷酸变化氨基酸变化变异类型致病性来源ETFA15c.365G>Ap.R122K杂合致病母亲c.659delCp.S220Lfs*6杂合致病父亲
讨论
多种酰基辅酶A脱氢酶缺乏症(multiple acyl-CoA dehydrogenase deficiency,MADD)是一种常染色体隐性遗传病,由于电子转移黄素蛋白( electron transfer flavoprotein,ETF) 或电子转移黄素蛋白脱氢酶(elecrton transfer flavoprotein dehydrogenase,ETFDH)缺陷,导致多种酰基辅酶A脱氢酶缺乏,引起线粒体内脂肪酸β氧化受阻,以脂肪酸、氨基酸及胆碱代谢紊乱为特征[1]。Przyrembel等[2]于1976年首次报道MADD,文献报道美国发病率1/378 272,土耳其发病率为1/15 000[3],国内发病率不详,Lin等[4]报道MADD在中国南方人群中的发病率约为1/79 964。MADD根据临床表现可分为三型,Ⅰ型:新生儿期起病,伴有先天畸形,主要表现为面部畸形特征(高前额,鼻梁扁平,耳位低),多囊肾、尿道下裂等;Ⅱ型:不伴有先天畸形的新生儿型;Ⅲ型:晚发型或称轻症型[5,6]。本例报道患儿有前额突出、鼻梁低的面部特征,故符合MADD I型。
1、临床表现及诊断:新生儿期发病最常见的表现是严重的代谢性酸中毒,呼吸暂停和呼吸窘迫,可伴有低血糖和高氨血症,其他特征包括肌张力减退和肝肿大,部分有心肌病、脑白质营养不良,尽管早期干预,预后非常差,大多数在新生儿期死亡,存活的患儿后期常由于肥厚性心肌病或瑞氏综合征死亡。新生儿型MADD诊断主要根据临床表现、血液酰基肉碱改变、尿GC-MS和基因检测结果。典型酰基肉碱谱表现为C4、C5、C5DC、C6、C8、C10、C12、C14:1、C16、C18:1升高,但肉碱棕榈酰转移酶II缺乏症、肉碱酰基肉碱转位酶缺乏症和极长链酰基辅酶A脱氢酶缺乏症也表现长链酰基肉碱增高。尿GC-MS分析可显示多种有机酸升高,包括:乳酸、戊二酸、2-羟基戊二酸、2-羟基丁酸、3-羟基异戊酸、乙基丙二酸、己二酸、辛二酸、癸二酸等其他二羧酸水平升高[6]。因为这些代谢产物升高不是MADD特异性的表现,所以基因检测是确诊的重要依据,基因检测可发现 ETFA、ETFB、ETFDH 等基因的突变,ETFA、ETFB基因突变多见于新生儿型[7]。本例患儿典型临床表现及酰基肉碱谱改变,基因检测证实ETFA基因杂合突变,故诊断明确。患儿c.365G>A(p.R122K)来自母亲,为已知致病变异,c.659delC(p.S220Lfs*6)遗传来自父亲,该变异导致基因编码区序列发生移码,提前出现终止密码子,目前尚未见该基因变异的相关文献报道,利用Mutation Taster软件进行蛋白功能预测,结果为有害,为致病变异。因MADD为常染色体隐性遗传,根据患儿临床特点及基因突变分析,符合MADD的诊断,提示c.659delC变异具有一定致病性。根据全外显子检测结果推测患儿母亲不良生育史中第 1 胎男婴及第3胎女婴也可能为MADD患儿,若家属有意再生育,则需要行产前诊断。
2、治疗:MADD治疗原则避免低血糖及能量代谢障碍的发生,应当低脂、高碳水化合物、中等量蛋白质饮食,避免劳累和饥饿,予核黄素(维生素B2)、左卡尼汀、辅酶Q10治疗。核黄素是体内黄素腺嘌呤二核苷酸(flavinadenine dinucleotide,FAD)前体,FAD传递电子至ETF,再转运至ETFDH,由ETFDH结合泛醌传递给呼吸链复合体III,进行氧化磷酸化产生三磷酸腺苷(Adenosini Triphosphas,ATP),ATP是体内最直接的能量来源[8]。补充核黄素可以提高FAD的含量,以稳定ETF/ETFDH,大多数晚发型MADD应用核黄素100~300mg/d可改善临床症状,被称为核黄素反应性MADD,而I型和II型核黄素治疗效果欠佳[3]。MADD合并继发性肉碱缺乏时,补充左卡尼汀可维持血液游离肉碱浓度,促进有毒酸性代谢物质排出[9]。辅酶Q10是ETF/ETFDH复合物的电子受体,连接线粒体脂肪酸β氧化和呼吸链,补充辅酶Q10 60-240mg/d,可改善线粒体能量代谢[6]。本例患儿因呼吸窘迫入院,询问家族史时发现患儿哥哥、姐姐均为生后1周内不明原因死亡,入院血气示代谢性酸中毒,结合以上表现高度怀疑遗传代谢病,予稳定呼吸循环,纠正代谢紊乱,维持血糖稳定等对症处理,立即完善代谢病筛查,尿GC-MS、血浆酰基肉碱提示脂肪酸代谢障碍,予低脂高蛋白饮食,左卡尼汀及辅酶 Q10治疗,基因结果确诊后加用维生素B2,患儿5月龄时因感染继发代谢危象,病情危重,家长因担心预后而放弃治疗。
最新研究报道应用苯扎贝特和外源性酮体3-羟基丁酸治疗MADD。苯扎贝特是一种过氧化物酶活性受体激动剂,可降低棕榈酰肉碱(C16)、辛酰基肉碱(C8)水平,提高β氧化能力,但目前尚无新生儿应用的经验。Yamaguchi等[10]报道对一名2岁携带ETFDH突变的晚发型MADD患儿进行了苯扎贝特的临床试验,治疗一年过程中其运动和认知能力显著提高,血液中C4、C8、C10和C12减少,尿有机酸明显改善。外源性酮体3-羟基丁酸是脑、骨骼肌和心脏的重要能量来源,可参与胆固醇合成,影响髓鞘化,具有信号传导功能,包括基因表达和激活羟基羧酸受体2,减少脂肪分解、抗炎及神经保护作用[11,12,13]。
综上所述,新生儿出现不明原因呼吸窘迫、代谢性酸中毒、低血糖和高氨血症、肌张力减退和肝肿大,家族兄弟姐妹中有不明原因新生儿期死亡或类似疾病患者,应高度怀疑遗传代谢病,及时行血液氨基酸及酰基肉碱、尿有机酸筛查,根据初步结果,实施适当干预治疗,基因检测可帮助明确病因,同时有利于患儿父母生育下一代进行遗传咨询。新生儿型MADD病死率高,预后不良,临床工作中需提高对此类疾病的认识,但适于新生儿型MADD的治疗还有待进一步探索。本研究发现c.659delC(p.S220Lfs*6)为新发突变,丰富了MADD的突变谱,为临床诊断提供依据。
1 Yamada K,Kobayashi H,Bo R,et al.Clinical,biochemical and molecular investigation of adult-onset glutaric acidemia type II:Characteristics in comparison with pediatric cases.Brain Dev,2016,38:293-301.
2 Przyrembel H,Wendel U,Becker K,et al.Glutaric aciduria type II:report on a previously undescribed metabolic disorder.Clin Chim Acta,1976,66:227-239.
3 Lindner M,Hoffmann GF,Matern D.Newborn screening for disorders of fatty-acid oxidation:experience and recommendations from an expert meeting.J Inherit Metab Dis,2010,33:521-526.
4 Lin Y,Zhang W,Chen Z,et al.Newborn screening and molecular features of patients with multiple acyl-CoA dehydrogenase deficiency in Quanzhou,China.J Pediatr Endocrinol Metab,2021,34:649-652.
5 Ding M,Liu R,Qiubo L,et al.Neonatal-onset multiple acyl-CoA dehydrogenase deficiency(MADD) in the ETFDH gene:A case report and a literature review.Medicine(Baltimore),2020,99:e21944.
6 Prasun P.Multiple acyl-coa dehydrogenase deficiency.In:Adam MP,Feldman J,Mirzaa GM,et al.,editors.GeneReviews®.Seattle(WA):University of Washington,Seattle;1993-2004.
7 Olsen RK,Andresen BS,Christensen E,et al.Clear relationship between ETF/ETFDH genotype and phenotype in patients with multiple acyl-CoA dehydrogenation deficiency.Hum Mutat,2003,22:12-23.
8 Janeiro P,Jotta R,Ramos R,et al.Follow-up of fatty acid β-oxidation disorders in expanded newborn screening era.Eur J Pediatr,2019,178:387-394.
9 Vasiljevski ER,Summers MA,Little DG,et al.Lipid storage myopathies:Current treatments and future directions.Prog Lipid Res,2018,72:1-17.
10 Yamaguchi S,Li H,Purevsuren J,et al.Bezafibrate can be a new treatment option for mitochondrial fatty acid oxidation disorders:evaluation by in vitro probe acylcarnitine assay.Mol Genet Metab,2012,107:87-91.
11 Koper JW,Lopes-Cardozo M,Van Golde LM.Preferential utilization of ketone bodies for the synthesis of myelin cholesterol in vivo.Biochim Biophys Acta,1981,666:411-417.
12 Newman JC,Verdin E.β-hydroxybutyrate:a signaling metabolite.Annu Rev Nutr,2017,37:51-76.
13 Puchalska P,Crawford PA.Multi-dimensionalroles of ketone bodies in fuel metabolism,signaling,and therapeutics.Cell Metab.2017;25(2):262-284.