磷脂酰肌醇-4-磷酸(phosphatidylinositol 4-phosphate,PI4P)由磷脂酰肌醇(phosphatidylinositol,PI)的肌醇环D4位置发生磷酸化反应生成,是细胞内含量最丰富的磷脂酰肌醇之一[1]。PI4P定位于质膜、高尔基体、核内体及某些囊泡,不同细胞器上的PI4P池相互独立。PI4P的动态平衡对维持细胞正常形态、信号传导、膜重塑和运输等重要生物学功能有着至关重要的作用。在神经元中,PI4P通过磷酸化形成第二信使前体磷脂酰肌醇二磷酸(phosphatidylinositol-4,5-bisphosphate,PIP2)进而形成第二信使磷脂酰肌醇三磷酸(phosphoinositide-3,4,5-triphosphate,PIP3)及三磷酸肌醇(inositol triphosphate,IP3),调节突触囊泡循环、离子通道和生长发育等重要生理功能[1]。此外,PI4P通过招募网格蛋白参与高尔基体-内吞体/质膜的转运,同时还参与鞘脂代谢、细胞自噬等过程。由此可见,PI4P在维持细胞正常功能中发挥着重要作用,本文将对PI4P在神经发育性疾病中的研究进展综述。
一、磷脂酰肌醇-4-磷酸及其调控
PI4P作为一种执行多种生理功能的磷脂酰肌醇,它的产生主要是由PI在磷脂酰肌醇-4-激酶(phosphatidylinositol 4 kinases,PI4Ks)的介导下完成肌醇环D4磷酸化。人体内存在Ⅱ型与Ⅲ型PI4Ks,两者又分为四个亚型:PI4KⅡα、PI4KⅡβ、PI4KⅢα和PI4KⅢβ[2]。PI4P在生物体内的另一个来源是由PIP2通过磷酸肌醇-5-磷酸酶(phosphoinositide 5-phosphatases,INPP5s)去磷酸化生成。INPP5s包括INPP5E,INPP5F及INPP5K等10种不同的同工酶和几种剪接变体[3]。其中,INPP5K定位于细胞质、细胞骨架、纤毛轴丝、高尔基体及外周膜蛋白等[4],可水解高尔基体膜上的PIP2生成PI4P。在生物体内PI4P的分解,一方面通过Ⅰ型磷脂酰肌醇4-磷酸5-激酶(type I phosphatidylinositol 4-phosphate 5-kinase,PIP5KIs)磷酸化其肌醇环D5位置产生PIP2。PIP5KIs磷酸化PI4P调节细胞中PI4P/PI(4,5)P2在细胞中的浓度,进而调节囊泡运输、膜动力学、离子通道功能及第二信使的产生。PIP5KIs 包括 PIP5KI α、β及γ这3 种亚型和多种剪接变体。有研究发现PI4KIIIα 和 PIP5KIγ 的协调作用维系了细胞内PI4P的含量,进而调节细胞内PI(4,5)P2的产生[5]。另一方面PI4P 肌醇环D4位置的磷酸酯键被磷脂酰肌醇磷酸酶SAC1去磷酸化生成PI,从而控制这一关键的膜信号分子的水平。研究发现SAC1可以通过调节PI4P的水平,从而调控细胞内质网稳态,继而维持果蝇视网膜底结构完整性[6]。
氧固醇结合蛋白相关蛋白(oxysterol binding protein related proteins,ORPs)是一类重要的脂转运蛋白,其N端含有结合PI4P的 PH结构域,ORP5和ORP8可以将位于质膜的PI4P转运至内质网水解[7]。PI4P招募脂转运蛋白到受损的溶酶体上,通过其反向运输作用调节溶酶体上PI4P和磷脂酰丝氨酸(phosphatidylserine,PS)的分布,进而修复受损的溶酶体[8]。钙离子诱导PI4KⅢα定位于质膜上,进而维持质膜上的PI4P水平。研究发现,在长时程突触增强(long-term synaptic potentiation,LTP)期间,通过减少细胞内钙离子的释放,可以完全消除LTP诱导质膜的PI4KⅢα增加,导致质膜上的PI4P减少[9]。此外,G蛋白偶联受体(G protein-coupled receptor,GPCRs)也能够调节细胞内PI4P的水平。研究发现在心肌细胞中,GPCR激活可导致其内膜系统中的PI4P耗竭[10];同时GPCR激动剂如内皮素-1、神经降压素等也能够诱导PI4P耗竭[1]。因此,细胞内PI4P动态平衡由其生物合成、分解、转运及胞内信号分子共同调控(图1)。
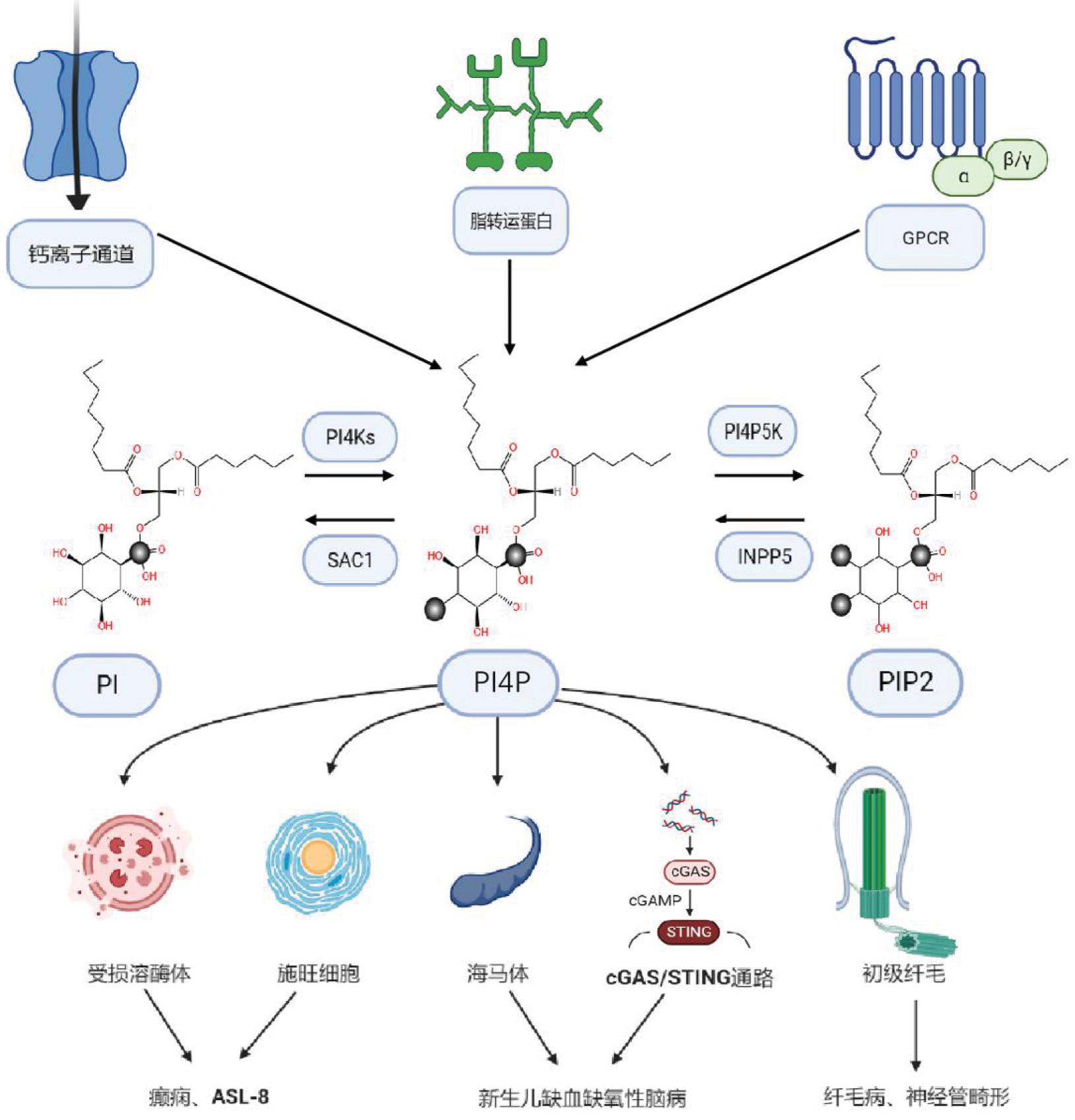
图1 PI4P的调控及其在神经发育性疾病中的作用
GPCR:G蛋白偶联受体;PI:磷脂酰肌醇PIP2:脂酰肌醇二磷酸;PI4P:磷脂酰肌醇-4-磷酸 ; PI4Ks:磷脂酰肌醇-4-激酶; SAC1:磷酸单酯水解酶;PIP5Ks:Ⅰ型磷脂酰肌醇4-磷酸5-激 酶;INPP5:磷酸肌醇-5-磷酸酶;ORP:氧固醇结合蛋白相关蛋白; cGAS:环鸟苷单磷酸腺苷合酶; cGAMP:环鸟苷单磷酸腺苷; ASL:肌肉萎缩侧索硬化症
二、神经发育性疾病
人类的神经发育是一个漫长的过程,始于胚胎发育时期,此时神经外胚层被诱导并折叠进入神经管,前神经管形成大脑,后神经管形成脊髓。在神经发育过程中,初级纤毛调控神经细胞的增殖、神经元轴突导向以及神经元迁移等重要生理功能,初级纤毛的功能异常将会导致一系列神经系统发育障碍疾病。位于背侧神经管表面外胚层的Wnt(wingless/integrated,Wnt)信号蛋白,它在神经管发育过程中同样起着重要的作用[11],Wnt信号通路通过调控干细胞更新、细胞增殖和细胞分化等作用,进而在胚胎神经发育和成体组织维持中起到重要作用。在此过程中,神经胶质细胞同样起着支持性生理作用,已有研究证实施旺细胞在周围神经发育、损伤及修复中起着重要作用[12],一旦神经胶质细胞出现发育障碍,周围神经元在发育中易出现损伤,将导致严重的神经发育障碍疾病,如肌肉萎缩侧索硬化症等。研究发现脑部缺血可导致海马形态、功能改变[13],神经元在缺血缺氧环境下发生广泛性的水肿、坏死,导致其功能异常,出现脑瘫、智力低下等一系列神经发育障碍症状。故研究PI4P在神经发育性疾病中的作用对于儿童神经发育性疾病的预防、早期诊断及治疗有着重要意义。
三、磷脂酰肌醇-4-磷酸与神经发育性疾病
1.神经管畸形等神经发育相关疾病
PI4P与神经发育性疾病密切相关,初级纤毛已被证实可以特异性协调信号传导途径,从而控制发育过程中细胞的生理过程和组织稳态。初级纤毛发育不良将导致一系列如智力和生长迟缓等神经发育障碍疾病。研究发现通过PI4P能够调节纤毛发生[14]。神经管畸形(neural tube defects,NTDs),指胚胎发育早期神经管闭合失败导致的出生缺陷,是中枢神经系统最常见的出生缺陷[15]。NTDs包括无脑儿、脊髓脊膜膨出、脑膨出、脊柱裂等[16],其中脊柱裂常常出现皮肤异常,下肢感觉运动功能障碍、大小便功能障碍等症状[17]。在啮齿动物胚胎的研究中发现肌醇缺乏会导致胚胎出现脑膨出,此外,补充肌醇可以减少与高血糖、糖尿病和叶酸缺乏相关的NTDs发生[18],表明肌醇在神经管闭合中起着至关重要的作用。最近有研究发现由于PI4KA双等位基因变异引起PI4P水平变化与神经发育障碍、脑畸形、脑白质营养不良相关[19]。Wnt信号通路已被证实在神经管发育中有着至关重要的作用,研究证明依赖于PI4KⅡβ合成的PI4P是Wnt信号的调节因子[2],因此维持细胞内的PI4P水平可以调节Wnt信号通路。综上所述,调控PI4P对于神经发育相关疾病的治疗和预后有重要作用。
2.新生儿缺血缺氧性脑病
新生儿缺血缺氧性脑病(hypoxic-ischemic encephalopathy,HIE)是一种新生儿常见疾病,主要表现为意识障碍,肌张力及原始反射发生改变,严重时会出现惊厥和脑干功能障碍等症状[20]。由于新生儿脑部严重缺氧,及脑供血能力明显减少甚至中断,导致新生儿脑部出现严重损伤,约20~25%的患儿在新生儿期死亡,另有25%的患儿出现远期后遗症,其中脑瘫、癫痫、自闭症谱系障碍和感觉障碍等最为常见[21]。有研究证实,环磷酸鸟苷-腺苷酸合成酶 (cyclic GMP-AMP synthase,cGAS)-干扰素刺激基因 (stimulator of interferon gene,STING)信号通路参与神经元的缺氧缺血损伤,阻断这种内源性通路可以限制缺血缺氧性脑病后神经变性的进展[22],Fang等[23]证明了PI4KⅢβ合成的PI4P对于STING的初始和持续激活至关重要。已有研究发现脑部缺血可导致海马形态、功能改变[13],Guo等[9]发现在海马神经元树突中PI4P富集,依赖PI4KIIIα合成的PI4P是形成记忆必需的物质。故PI4P在新生儿缺血缺氧性脑病的预防治疗中有重要意义。
3.癫痫
儿童是癫痫的高发时期,18岁以下儿童占全部癫痫患者的60%以上,其中婴儿期发病率最高,为109/10万[24]。癫痫发作时会出现暂时性意识混乱、肌肉僵硬、四肢无法控制地抽搐等症状,此外,癫痫持续性发作后会出现海马损伤、严重发育或记忆障碍、内侧颞叶硬化症等后遗症[25]。张帆等[26]阐述了自噬与癫痫发作的相关性,并且认为在癫痫发作的病理过程中,抑制自噬对神经元具有保护作用。有研究发现PI4KⅡα调节自噬溶酶体内的PI4P含量,继而调节自噬溶酶体重建[27,28]。人类和局灶性癫痫动物模型中经常发生脱髓鞘,严重脱髓鞘会导致癫痫发作并且维持癫痫的发生[27]。PI4P在小鼠施旺细胞中参与髓鞘的生成,研究报道 PIP5KI 通过调节少突神经胶质细胞前体(oligodendrocyte precursors,OLPs)发育和再生髓鞘分化,参与调控缺氧损伤后的髓鞘再生[28]。因此PI4P对癫痫的预防和治疗有重要意义。
4.肌肉萎缩性侧索硬化症
肌肉萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)是一种进展的运动神经元退行性疾病,导致随意肌无力恶化,直到因呼吸衰竭而死亡[29]。ALS包括ALS1、ALS3、ALS4、ALS7、ALS8等在内有许多基因突变类型[30],其中ALS8型由位于染色体20q13.3的VAPB基因显性突变所致[31],内质网驻留蛋白VAPA和VAPB可以与脂转运蛋白结合介导内质网和高尔基体/内体之间的脂质交换,参与维持PI4P水平的稳定。秀丽隐杆线虫ALS8模型中,运动神经元中过表达VAPB导致随年龄增长而加重的运动缺陷,而在运动神经元中减少VAPB同源蛋白表达,导致PI4P稳态失调,导致运动神经元后向运动减少和进行性退化[32]。Cathal等[33]发现在蠕虫中抑制PI4KIIIβ表达后PI4P含量减少,从而维持运动神经元功能和活力。当细胞内与自噬相关的PI4P稳态改变时,会导致严重的进行性肌肉疾病,并且伴随明显的溶酶体耗竭和自噬抑制[34]。由于依赖PI4KⅢα合成的PI4P已被认为是驱动PS从内质网到质膜并影响其合成的主要因素,Alejandro等[35]发现施旺细胞特异性PI4KⅢα缺陷的小鼠髓鞘脂质含量显著下降,其中组成髓鞘最重要的成分PS减少最为严重,继而出现神经病变运动症状。因此,PI4P改变与肌肉萎缩性侧索硬化症有密切关系。
四、展望
长久以来,磷酸肌醇在细胞内的膜转运、代谢生长、信号调节等方面起着核心作用,PI4P常被看作是进一步生成复杂磷酸肌醇的前体分子,或是囊泡转运中的相关因素,而忽略了PI4P自身的功能。在近几年开始逐渐报道PI4P在神经元发育、信号转导、细胞自噬等方面中无法忽视的作用,探究影响PI4P的不同的分子机制与深入理解其在儿童神经发育性疾病发生发展中的作用有着密切的联系,影响PI4P的分子机制将可以作为新的治疗靶点及预后指标,为儿童神经发育性疾病的预防、早期诊断及治疗提供新的方向。
1 Batrouni AG,Baskin JM.The chemistry and biology of phosphatidylinositol 4-phosphate at the plasma membrane.Bioorg Med Chem,2021,40:116190.
2 Li YP,Mikrani R,Hu YF,et al.Research progress of phosphatidylinositol 4-kinase and its inhibitors in inflammatory diseases.Eur J Pharmacol,2021,907:174300.
3 Zhou Q,Lin J,Yan Y,et al.INPP5F translocates into cytoplasm and interacts with ASPH to promote tumor growth in hepatocellular carcinoma.J Exp Clin Cancer Res,2022,41:13.
4 Dong R,Zhu T,Benedetti L,et al.The inositol 5-phosphatase INPP5K participates in the fine control of ER organization.J Cell Biol,2018,217:3577-3592.
5 de la Cruz L,Riquelme R,Vivas O,et al.Dishevelled coordinates phosphoinositide kinases PI4KIIIα and PIP5KIγ for efficient PtdInsP2 synthesis.J Cell Sci,2022,135:jcs259145.
6 Griffiths NW,Del Bel LM,Wilk R,et al.Cellular homeostasis in the Drosophila retina requires the lipid phosphatase Sac1.Mol Biol Cell,2020,31:1183-1199.
7 Kawasaki A,Sakai A,Nakanishi H,et al.PI4P/PS countertransport by ORP10 at ER-endosome membrane contact sites regulates endosome fission.J Cell Biol,2022,221:e202103141.
8 Tan JX,Finkel T.A phosphoinositide signalling pathway mediates rapid lysosomal repair.Nature,2022,609:815-821.
9 Guo Z,Jiang CH,Tong C,et al.Activity-dependent PI4P synthesis by PI4KIIIα regulates long-term synaptic potentiation.Cell Rep,2022,38:110452.
10 Zewe JP,Wills RC,Sangappa S,et al.SAC1 degrades its lipid substrate PtdIns4P in the endoplasmic reticulum to maintain a steep chemical gradient with donor membranes.Elife,2018,7:e35588.
11 Suciu SK,Caspary T.Cilia,neural development and disease.Semin Cell Dev Biol,2021,110:34-42.
12 Cristobal CD,Lee HK.Development of myelinating glia:An overview.Glia,2022,70:2237-2259.
13 徐彩娜,石亚志,武桂平.大鼠脑缺血性神经损伤后脑红蛋白对受损神经元轴突生长能力的调控作用及其机制.临床内科杂志,2020,37:187-190.
14 Zhang R,Tang J,Li T,et al.INPP5E and coordination of signaling networks in cilia.Front Mol Biosci,2022,9:885592.
15 Wang X,Yu J,Wang J.Neural tube defects and folate deficiency:is DNA repair defective? Int J Mol Sci,2023,24:2220.
16 梁颖超,王建华.初级纤毛通过信号通路调控胚胎神经发育的研究进展.中国生育健康杂志,2022,33:287-290.
17 修波.脊柱裂诊治专家共识.中国修复重建外科杂志,2021,35:1361-1367.
18 D′souza SW,Copp AJ,Greene NDE,et al.Maternal inositol status and neural tube defects:a role for the human yolk sac in embryonic inositol delivery? Adv Nutr,2021,12:212-222.
19 Dafsari HS,Pemberton JG,Ferrer EA,et al.PI4K2A deficiency causes innate error in intracellular trafficking with developmental and epileptic-dyskinetic encephalopathy.Ann Clin Transl Neurol,2022,9:1345-1358.
20 林夕诗,罗琼.新生儿缺血缺氧性脑病的相关危险因素以及诊疗方法的研究进展.浙江医学,2022,44:2349-2354.
21 Dumbuya JS,Chen L,Wu JY,et al.The role of G-CSF neuroprotective effects in neonatal hypoxic-ischemic encephalopathy (HIE):current status.J Neuroinflammation,2021,18:55.
22 Hu X,Zhang H,Zhang Q,et al.Emerging role of STING signalling in CNS injury:inflammation,autophagy,necroptosis,ferroptosis and pyroptosis.J Neuroinflammation,2022,19:242.
23 Fang R,Jiang Q,Jia X,et al.ARMH3-mediated recruitment of PI4KB directs Golgi-to-endosome trafficking and activation of the antiviral effector STING.Immunity,2023,56:500-515.e6.
24 朱登纳,牛国辉.儿童癫痫的长程管理.临床儿科杂志,2023,41:235-240.
25 Pujar SS,Martinos MM,Cortina-Borja M,et al.Long-term prognosis after childhood convulsive status epilepticus:a prospective cohort study.Lancet Child Adolesc Health,2018,2:103-111.
26 张帆,肖飞,徐祖才.自噬流参与癫痫发作的研究进展.遵义医科大学学报,2022,45:692-698.
27 de Curtis M,Garbelli R,Uva L.A hypothesis for the role of axon demyelination in seizure generation.Epilepsia,2021,62:583-595.
28 Lee HK,Chaboub LS,Zhu W,et al.Daam2-PIP5K is a regulatory pathway for Wnt signaling and therapeutic target for remyelination in the CNS.Neuron,2015,85:1227-1243.
29 Al-Chalabi A,Hardiman O.The epidemiology of ALS:a conspiracy of genes,environment and time.Nat Rev Neurol,2013,9:617-628.
30 Tripathi P,Guo H,Dreser A,et al.Pathomechanisms of ALS8:altered autophagy and defective RNA binding protein (RBP) homeostasis due to the VAPB P56S mutation.Cell Death Dis,2021,12:466.
31 Mejzini R,Flynn LL,Pitout IL,et al.ALS genetics,mechanisms,and therapeutics:where are we now? Front Neurosci,2019,13:1310.
32 Zhang H,Zhou J,Xiao P,et al.PtdIns4P restriction by hydrolase SAC1 decides specific fusion of autophagosomes with lysosomes.Autophagy,2021,17:1907-1917.
33 Wilson C,Venditti R,De Matteis MA.Deregulation of phosphatidylinositol-4-phosphate in the development of amyotrophic lateral sclerosis 8.Adv Biol Regul,2021,79:100779.
34 McGrath MJ,Eramo MJ,Gurung R,et al.Defective lysosome reformation during autophagy causes skeletal muscle disease.J Clin Invest,2021,131:e135124.
35 Alvarez-Prats A,Bjelobaba I,Aldworth Z,et al.Schwann-cell-specific deletion of phosphatidylinositol 4-kinase alpha causes aberrant myelination.Cell Rep,2018,23:2881-2890.