随着二胎政策的放开,许多35岁以上的妇女开始重新考虑生育问题。2017年1月22日国家卫生计生委指出,目前生育二胎的目标人群达到9 000多万对夫妇,其中60%年龄大于35岁,50%年龄大于40岁[1]。这个阶段的女性已经处于生育高龄期, 即卵巢储备功能减退(diminished ovarian reserve, DOR) 的状态[2]。同时,结婚和生育年龄拖后,造成初次生育年龄增加。现代社会工作生活压力加大,作息不规律导致一部分年轻妇女同样存在卵巢功能的下降。这些现状使得逆转卵子老化问题成为生殖领域的当务之急[3]。辅助生殖技术解决了包括排卵困难、内分泌异常、少、弱精子症等患者的受孕难题。可是, 对于卵巢功能减退患者的辅助受孕结局一直不乐观[4]。蒲公英(taraxacum mogonon)是药食同源的菊科多年生草本植物,被卫生部列入既是食品又是药品的名单[5]。T1口服液的主要成分为蒲公英提取物,现在已作为口服液在中国和日本进行产品化推广。本文将从小鼠动物模型和体外颗粒细胞培养实验两方面,探讨T1口服液治疗女性卵巢功能减退的治疗作用和初步机制。
材料与方法
一、动物实验
经复旦大学附属中山医院实验动物伦理委员会批准,本实验以绝经过渡期(menopausal transition)11~12月龄 雌性小鼠(C57BL/6J)为卵巢功能衰退的研究对象,选取阴道脱落细胞涂片表现为动情间期延长、动情周期紊乱者纳入实验。实验分组及方法参照文献[6],选取符合绝经过渡期标准的小鼠20只,随机分为对照组(10只)和T1治疗组(10只);另选取4~6月龄雌性小鼠(C57BL/6J)10只,作为阳性对照组(青年小鼠组)。对照组、青年组分别给予生理盐水;T1治疗组给予T1口服液灌胃给药,灌胃针插入深度为3 cm左右,每日灌胃两次,每次灌胃药量 0.2 mL,连续给药30 d。末次给药禁食不禁水24 h后,用10%水合氯醛(0.4 mL/100 g)腹腔注射麻醉,确认麻醉生效后,小鼠脱臼处死。摘取卵巢组织,福尔马林溶液固定过夜后,石蜡包埋,3 μm厚度进行连续切片,常规HE染色,光学显微镜下观察小鼠卵巢组织切片,每个标本观察10个高倍镜视野,进行窦状卵泡数量计数。
二、方法
1.细胞培养及流式细胞仪凋亡检测:人来源的颗粒细胞系KGN细胞,含10%胎牛血清(fetal bovine serum,FBS)的高糖RPMI Medium Modified Medium培养, 37℃细胞培养箱培养,当细胞增殖至80%时经胰酶消化传代,每2~3 d换液或传代1次。实验分为三组,即(1)对照组,0.5%FBS培养;(2)血清培养组,5%FBS培养;(3)T1处理组,0.5% FBS培养液中添加T1口服液孵育。将KGN细胞接种于6孔板,细胞融合至80%时静止24 h,培养液作用36 h后,胰酶消化收集所有漂浮细胞及贴壁细胞,按照细胞凋亡检测试剂盒说明书操作,PBS洗3次,用100 μL Binding buffer重悬,再分别加APC-Annexin V 5 μL及PI 10 μL室温避光孵育15 min后,加400 μL Binding buffer终止反应,300目尼龙网过滤后上流式细胞仪进行检测。
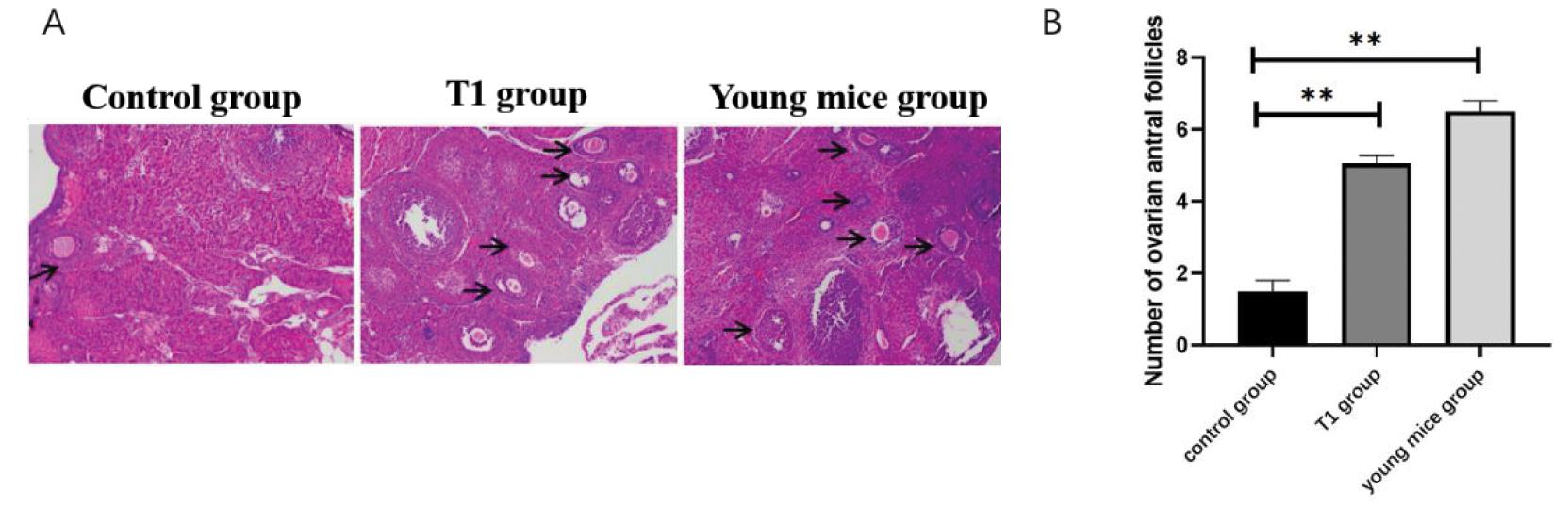
A. The morphology of ovarian antral follicles in three groups (indicated by arrows) after HE staining; B. Bar chart analysis of the number of ovarian antral follicles in the control group, T1 group, and young mouse group. Compared with the control group,**P<0.01.
图1 T1口服液对于绝经过渡期小鼠卵巢功能的影响
Figure 1 Effect of Shawkea T-1 on Ovarian Function in Menopausal Transition Mice

A. Flow cytometry analysis of apoptosis in three groups of KGN cells; B. Statistical analysis of the percentage of apoptosis in three groups of KGN cells using bar charts.*P<0.05
图2 流式细胞仪检测T1口服液对于人颗粒细胞系KGN细胞的凋亡影响
Figure 2 Flow cytometry detection of the effect of Shawkea T-1 on apoptosis of human granulosa cell line KGN cells
2.TUNEL法染色检测细胞凋亡:实验分组及处理同流式细胞仪凋亡检测,制备细胞爬片,用4%多聚甲醛固定后进行 TUNEL 染色,具体步骤按照TUNEL试剂盒说明书进行操作。染色后在显微镜下镜检,凋亡细胞核呈现绿色荧光;采用 Imatest Master 3.10 软件进行凋亡细胞的计数,于400倍显微镜下随机选取5个不同的视野,记录每个视野凋亡细胞数及所见细胞总数,两者的比率计算即为细胞凋亡率,取平均值进行统计。
3.细胞凋亡PCR芯片检测 Apoptosis PCR Array: 实验分为三组,即(1)对照组,0.5%FBS培养; (2)T1处理组,0.5%FBS培养液中添加T1口服液孵育。每组设三个复孔,孵育结束后,在培养皿中加入 1mL TRIZOL 试剂(invitrogen)裂解细胞,按照说明书步骤提取待测细胞的总RNA。使用NanoDrop© ND-1000测RNA浓度和纯度,测定RNA溶液的A 260 / A280 的比值后,进行1%变性琼脂糖凝胶电泳,紫外透射光下观察并拍照。采用细胞凋亡PCR芯片(Cat:DHSE0500S)进行检测,real-time PCR按照SYBR© Premix Ex TaqTM II的说明书步骤进行实验,采用2-ΔΔCt 法计算mRNA表达,以ACTB,B2M,HPRT1,RPLP1作为内参基因。
4.统计学处理:统计学分析应用SPSS 17.0软件进行。数据以均值±标准差表示,采用t检验用于比较组间差异,以P<0.05表示差异具有统计学意义。
结 果
一、T1口服液对于绝经过渡期小鼠卵巢功能的影响
将三组小鼠的卵巢组织进行HE染色,高倍镜下计数窦状卵泡数量(ntral follicle count,AFC),以评估小鼠的卵巢功能。与青年小鼠的窦状卵泡数量(6.7±0.3)比较,绝经过渡期小鼠的窦状卵泡数量(1.3±0.3)明显减少(P<0.01);而经T1口服液饲养后,绝经过渡期小鼠的卵巢窦状卵泡数量(5.2±0.4)显著提高(P<0.01)。见图1。
二、T1口服液对于人颗粒细胞系KGN细胞的凋亡影响
应用0.5%FBS细胞培养液(对照组),5%FBS细胞培养液和添加T1口服液培养液,分别培养人卵巢颗粒细胞细胞系KGN细胞36 h后,用流式细胞仪和TUNEL法检测颗粒细胞凋亡率。发现与对照组和5%FBS细胞培养液孵育组相比较,T1口服液孵育KGN细胞36 h后,两种方法均显示,T1口服液可显著降低颗粒细胞的凋亡率(P<0.05,P<0.01)。见图2、图3。
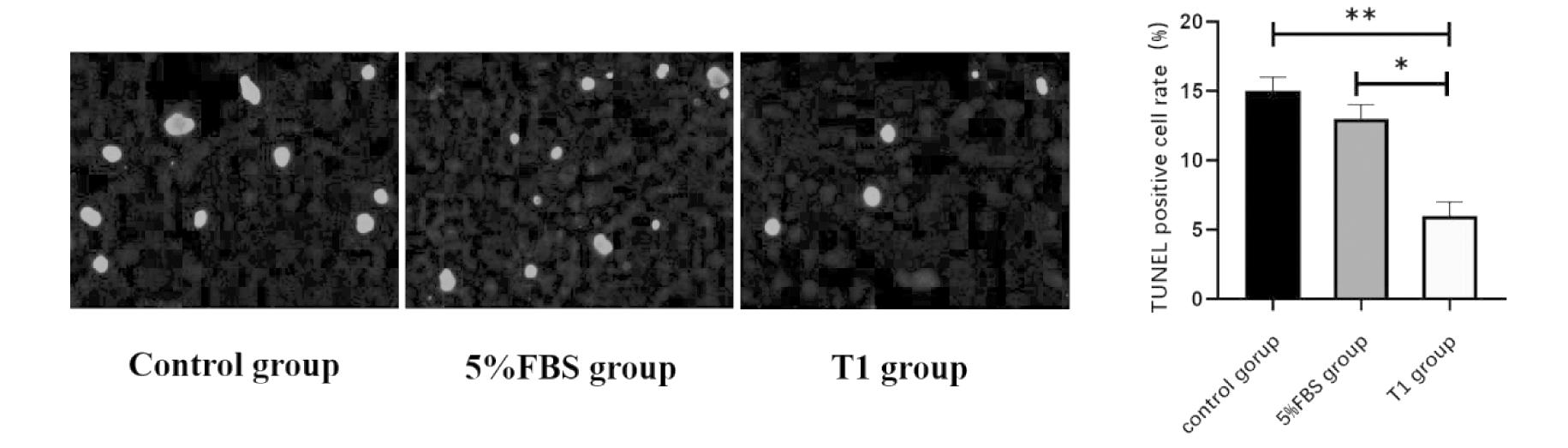
Left figure: Fluorescence image after TUNEL staining; Right figure: Statistical analysis of the percentage of TUNEL positive cells in three groups of KGN cells using bar charts. **P<0.01,*P<0.05
图3 TUNEL法检测T1口服液孵育前后人颗粒细胞系KGN细胞的凋亡情况
Figure 3 TUNEL detection of apoptosis in human granulosa cell line KGN cells before and after incubation with Shawkea T-1
三、 细胞凋亡PCR芯片筛选T1口服液孵育前后的差异性表达基因
提取细胞RNA后进行琼脂糖凝胶电泳,结果表明,提取的RNA溶液A260/A280比值均在1.8到2.1范围内,说明提取的RNA的完整性好,没有降解。紫外透射光下观察到,28S和18S核糖体RNA带明亮,28S带的密度大约是18S带的2倍;下面还可观察到一个较弱的带,它由低分子量RNA(tRNA和5S核糖体RNA)组成。见图4。
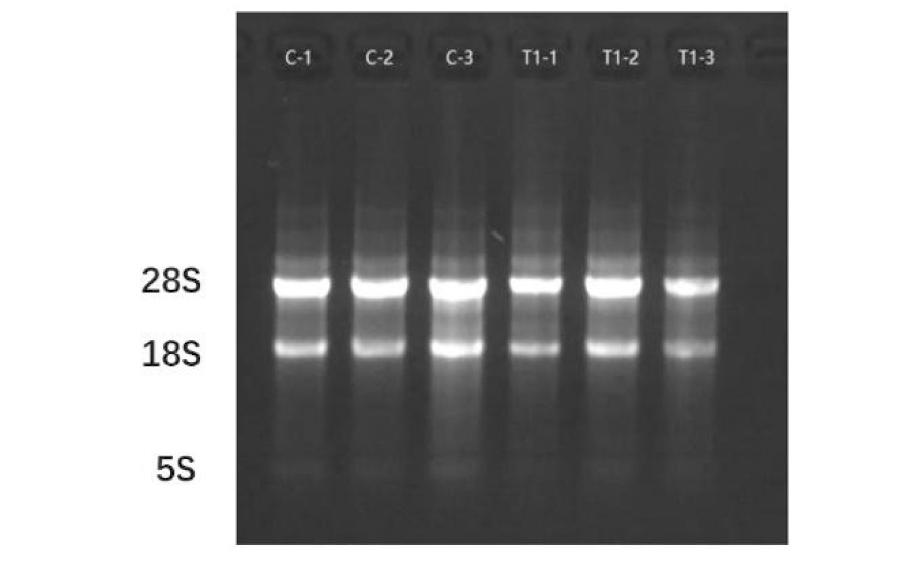
Under UV transmitted light, detection of the quality and integrity of RNA. Three clear RNA bands were detected: 28 s, 18 s, and 5 s from top to bottom, respectively. C1, C2, and C3 are the control groups, while T1-1, T1-2, and T1-3 are theShawkea T-1 incubation groups (with three replicates in each group).
图4 1%变性琼脂糖凝胶电泳
Figure 4 1% denatured agarose gel electrophoresis
细胞凋亡PCR 芯片可同时测定 84个与凋亡细胞程序性死亡有关的关键基因。其中包括 TNF 配基及受体、IAP、TRAF、CARD、死亡效应结构域和 CIDE 家族等,同时还包括p53和ATM信号通路相关的基因,如图5所示。
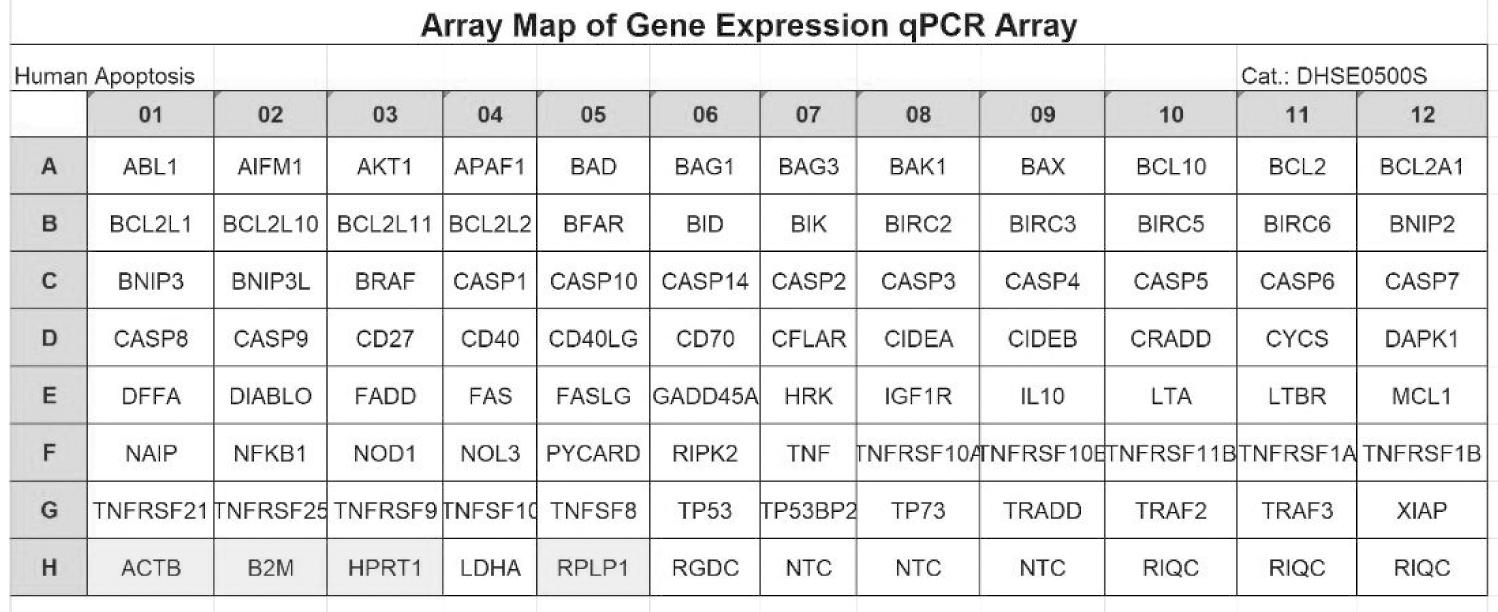
图5 PCR芯片检测的84个凋亡相关基因 Figure 5 84 apoptosis related genes detected by PCR array
T1口服液孵育组与对照组相比较,在84个检测的靶基因中,有24个基因的表达改变具有统计学意义(14.3%;P<0.05)。其中20个基因表达下调,包括TNFRSF1B,BIRC5,CYCS等;4个基因表达上调,包括BAG1,TNFSF10,BNIP3,CASP5。见表1。
表1 T1孵育组与对照组相比表达改变具有统计学意义的凋亡相关基因
Table 1 Apoptosis related genes with statistically significant expression changes in the Shawkea T-1 group compared to the control group
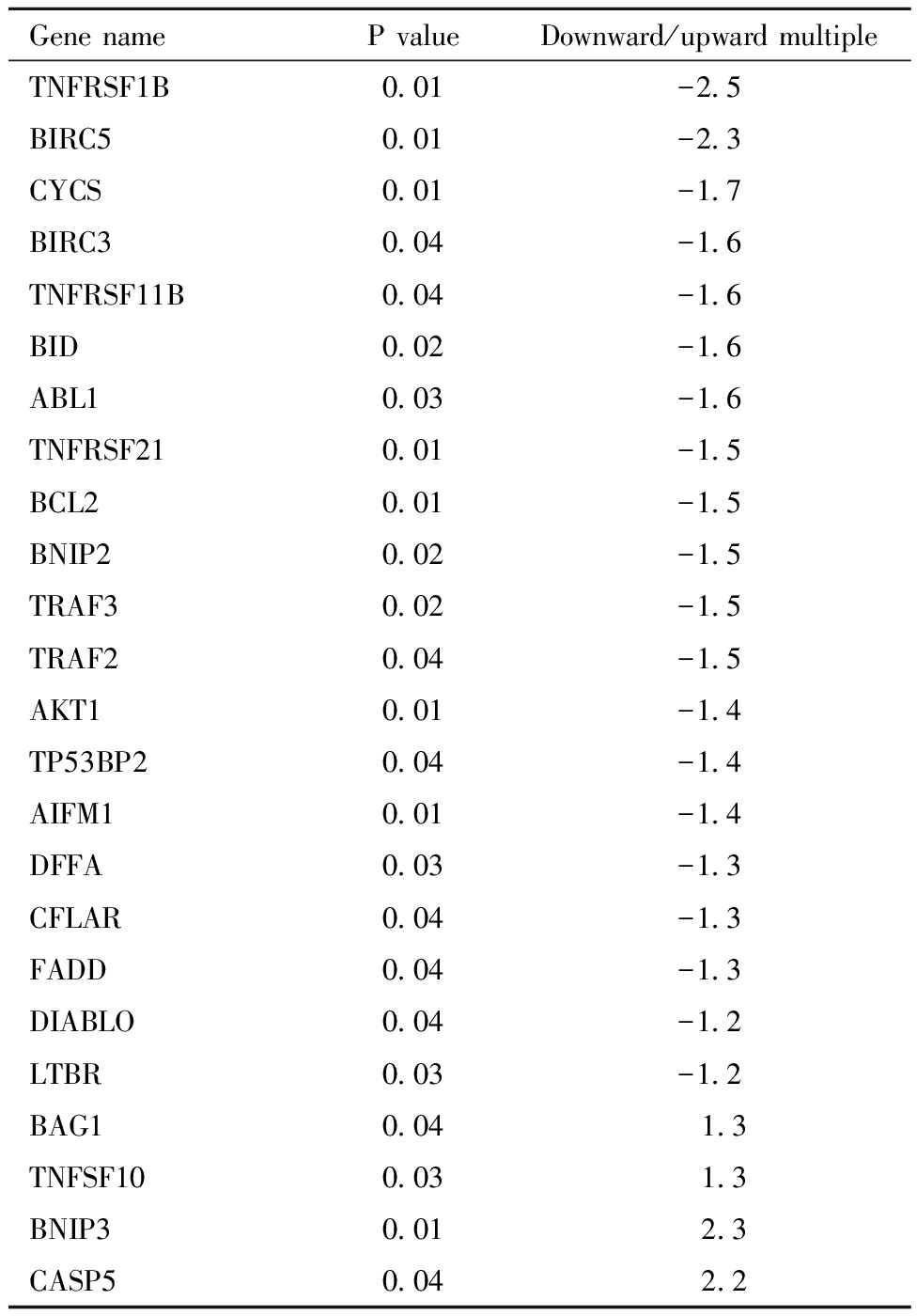
Gene nameP valueDownward/upward multipleTNFRSF1B0.01-2.5BIRC50.01-2.3CYCS0.01-1.7BIRC30.04-1.6TNFRSF11B0.04-1.6BID0.02-1.6ABL10.03-1.6TNFRSF210.01-1.5BCL20.01-1.5BNIP20.02-1.5TRAF30.02-1.5TRAF20.04-1.5AKT10.01-1.4TP53BP20.04-1.4AIFM10.01-1.4DFFA0.03-1.3CFLAR0.04-1.3FADD0.04-1.3DIABLO0.04-1.2LTBR0.03-1.2BAG10.04 1.3TNFSF100.03 1.3BNIP30.01 2.3CASP50.04 2.2
讨 论
对于卵巢功能减退,目前临床上缺乏针对性、有效性的治疗方式。现在西医的主要治疗方案是雌孕激素替代疗法[7],激素替代治疗短期内可以取得一定的疗效,但从长远看对卵巢本身的功能无明显改善,对于卵巢功能衰竭的治疗效果并不理想,而且长期运用雌孕激素有可能增加病人罹患卵巢癌、子宫内膜癌、乳腺癌等疾病的风险[8]。蒲公英始载于《唐本草》,菊科多年生草本植物,是中国药典收载的常用中草药之一。作为中药,蒲公英具有清热解毒、消肿散结等功效,国内临床上常用于急性炎症和肿瘤的辅助治疗[9]。
本文采用自然衰老的围绝经期小鼠作为研究对象,观察蒲公英提取物(T1口服液)饲养前后,小鼠卵巢窦状卵泡数量的改变,以评估蒲公英提取物对于治疗卵巢功能减退的疗效。AFC是指阴道超声下卵巢内可见的直径2~9 mm的卵泡,能反映卵巢储备功能,是用于预测卵巢储备的较好一项临床指标[10]。本研究发现,经T1口服液饲养后,围绝经期小鼠的窦状卵泡数量明显增加,说明T1口服液可以改善临床上卵巢功能减退症状,其有望成为一种安全、有效的临床治疗方法。
蒲公英提取物可以起到部分逆转卵子老化的作用,那其中的机理何在呢?颗粒细胞是卵泡内最重要的载体细胞,对卵母细胞起着重要的支持、调控和营养作用,颗粒细胞发生凋亡会引起卵泡闭锁,尤其在早期卵泡闭锁中发挥重要作用,如何有效地抑制颗粒细胞凋亡对促进卵泡发育及改善卵子质量具有重要意义[10-11]。本研究通过改变人颗粒细胞系KGN细胞的培养条件,来观察T1口服液对于颗粒细胞凋亡的影响。正常情况下,KGN细胞的培养条件是含10%FBS的细胞培养液,本研究把细胞培养的血清浓度降至0.5%和5%,发现两组细胞的凋亡率并无显著差异。而当在培养液中添加蒲公英提取物干预后,却可以显著降低KGN细胞的凋亡率,说明蒲公英提取物可以通过抑制颗粒细胞凋亡,来达到促进卵细胞发育的目的。
细胞凋亡是维持正常组织形态和功能的细胞主动自杀过程,是在基因控制下按照一定程序进行的细胞死亡。研究已证明,细胞凋亡为卵泡闭锁的主要机制,在卵巢早衰的发生过程中,颗粒细胞的凋亡为其主要的发病机制[12-13]。近年来,中医药在治疗卵巢功能减退方面取得了较好疗效,其他学者的研究也支持,中药能够通过抑制卵巢颗粒细胞凋亡,影响局部调节因子而改善卵巢功能、提高卵母细胞质量[14-15]。本研究通过细胞学实验证实,蒲公英提取物作为一种有效的中药成分,可以有效抑制颗粒细胞的凋亡率。另外,国外学者用T1口服液饲养雌性小鼠,发现T1口服液饲养组的小鼠,无论是卵巢组织、子宫组织还是脂肪组织,雌激素受体α和β的表达量均高于对照组,也是蒲公英提取物能够提高卵巢功能的机理之一[16]。
细胞凋亡在正常生物过程中发挥重要作用,如分化、发育和体内平衡。应激反应,如热休克、缺血、非折叠蛋白和病毒感染,会引起细胞严重受损甚至细胞凋亡。人细胞凋亡PCR芯片可用于研究参与细胞程序性死亡的84个关键基因的表达,结合了实时定量PCR的优点和芯片的高通量,这一芯片包含了TNF配体及受体、半胱天冬酶、Bcl-2 家族成员、caspase、IAP、TRAF、CARD、死亡域、死亡效应域、CIDE家族,以及参与p53和DNA损伤通路的基因。在检测的84个凋亡相关基因中,T1口服液孵育组和对照组相比,有24个基因的表达改变具有统计学意义,其中20个基因表达下调, 4个基因表达上调,包括BAG1,TNFSF10,BNIP3,CASP5。说明T1口服液可能通过这些基因的表达调控改变来抑制了卵母细胞的凋亡从而改善了卵巢功能,而具体的调控通路还需要后续进一步的实验验证。
蒲公英可以通过免疫调节和抗氧化的作用,达到抗肿瘤的功效。而在卵母细胞成熟过程中,胞浆中线粒体发生了剧烈变化,线粒体的功能被证实与卵母细胞的成熟、受精和发育潜能密切相关[17]。因此,T1口服液是否可以通过抗线粒体氧化的作用来逆转卵巢功能的下降,也有待于进一步证实。本研究期望通过蒲公英提取物对于卵巢功能改善的研究及其机制的探讨,为西药治疗效果欠佳的卵巢功能低下患者寻找新的治疗方法和研究思路。
1 谢增毅.二孩政策与社会法及其制度的完善.北京工业大学学报(社会科学版),2019,19:69-76.
2 王凤阳,李春光,王凤娟,等.卵巢储备功能低下的病因病机及干预策略.长春中医药大学学报,2022,38:226-231.
3 刘嘉茵.高龄妇女卵巢储备功能减退的再生育策略.中国计划生育和妇产科,2017,9:1-3.
4 韦梦洁,魏艳,冯光恩,等.年龄≤35岁卵巢储备功能低下女性的冻融胚胎移植周期获得活产的围产期结局分析.中华生殖与避孕杂志,2022,42:791-801.
5 何雨柔,黄玉迪,林培伟,等.蒲公英抗肿瘤作用的研究进展.肿瘤药学,2019,9:371-375.
6 陈玥,陈思,张蕾,等.基于雌激素受体途径探讨补肾活血汤干预免疫性卵巢早衰小鼠模型机制研究.陕西中医,2023,44:556-561.
7 丁桂英,余晓.小剂量雌孕激素替代疗法治疗围绝经期综合征的疗效及激素变化探析.中国性科学,2019,28:104-107.
8 Hodis HN,Mack WJ.Menopausal Hormone Replacement Therapy and Reduction of All-Cause Mortality and Cardiovascular Disease:It Is About Time and Timing.Cancer J,2022,28:208-223.
9 田苗苗,刘扬,刘树民.蒲公英治疗乳腺癌的活性成分及作用机制研究概况.中国药房,2019,30:1864-1867.
10 徐春雨,张翠莲,田沛哲,等.卵巢储备功能降低女性行辅助生育治疗的适宜方案.中国计划生育和妇产科,2022,14:14-19.
11 Wang X,Wang L,Xiang W.Mechanisms of ovarian aging in women:a review.J Ovarian Res,2023,16:67.
12 Asghari MH,Abdollahi M,de Oliveira MR,et al.A review of the protective role of melatonin during phosphine-induced cardiotoxicity:focus on mitochondrial dysfunction,oxidative stress and apoptosis.J Pharm Pharmacol,2017,69:236-243.
13 May-Panloup P,Boucret L,Chao de la Barca JM,et al.Ovarian ageing:the role of mitochondria in oocytes and follicles.Hum Reprod Update,2016,22:725-743.
14 杨贞,郭新宇,李海霞,等.益气血法对超排卵大鼠卵巢颗粒细胞Bcl-2、Bax、Caspase3表达的影响.实用医学杂志,2017,33:2105-2108.
15 王文静,刘金星.补肾养精颗粒调节早发性卵巢功能不全模型大鼠卵泡颗粒细胞凋亡机制研究.山东中医药大学学报,2019,43:87-91.
16 Zhi X,Honda K,Ozaki K,et al.Dandelion T-1 extract up-regulates reproductive hormone receptor expression in mice.Int J Mol Med,2007,20:287-292.
17 Ji H,Zhang Q,Ding L,et al.Structural and metabolic cumulus cell alteration affects oocyte quality in underweight women.Zygote,2024,32:77-86.