子痫前期(preeclampsia,PE)是造成孕产妇、围产儿发病率和死亡率升高的一种严重妊娠期高血压疾病,具体的病因和发病机制至今仍未完全阐明[1]。子痫前期胎盘滋养细胞功能不良被认为是子痫前期的发病原因之一,其特点是母体血压高、蛋白尿[2]。表观遗传学是在基因组 DNA 序列不发生变化的条件下,基因表达发生改变并导致可遗传的表现型变化。目前发现的表观遗传学调节主要包括 DNA甲基化作用、组蛋白修饰作用、染色质重塑、基因印迹、小分子 RNA 调控等。在哺乳动物中,DNA 甲基化由 DNA 甲基转移酶(DNMTs)催化,S 腺苷甲硫氨酸(SAM)作为甲基供体,主要发生在CpG 二核苷酸的胞嘧啶部位,将其甲基化为5-甲基胞嘧啶,最终导致转录抑制及表型改变。研究证实,人类基因组中CpG岛的异常甲基化与相关基因沉默相关,滋养细胞分化过程中,一些基因启动子区CpG岛甲基化及非甲基化状态可以改变基因表达状态,继而影响滋养细胞生理功能来参与子痫前期的发病[3]。
子痫前期胎盘滋养细胞STAT3基因的表达和凋亡、增殖及侵袭功能性调控可能与该基因启动子区域CpG岛的甲基化状态有关[4]。甲基化转移酶抑制剂5-氮杂-2-脱氧胞苷(5-aza-2 -deoxycytidine,5-AZA-DC)可以抑制转录因子STAT3启动子区DNA甲基化的程度,所以本研究应用5-AZA-DC干预滋养细胞的甲基化水平,深入分析5-AZA-DC STAT3基因甲基化对子痫前期滋养细胞凋亡、增殖、侵袭与迁移的作用和影响。
对象与方法
一、对象
选择2023年2月至2024年2月在广州市花都区妇幼保健院产科和广东省第二人民医院产科住院分娩的孕妇,共计80例,其中40例正常足月妊娠被纳入正常妊娠组,40例子痫前期妊娠被纳入子痫前期(PE)组。所有孕妇健康体健,无心脏病等系统性疾病、传染性疾病和家族性疾病史,无妊娠高血压、胎盘早剥或前置胎盘等妇产科疾病史,患者均剖腹产。本研究方案获得医院伦理委员会批准(编号:2022130),患者均签订知情同意书并签署同意捐献组织标本协议书。
二、方法
1.所需材料:HTR8/SVneo购自上海科学院上海生命科学院细胞资源中心。JEG-3、JAR、BeWo滋养细胞株购自美国模式培养物集存库(American type culture collection, ATCC)。HTR8/SVneo和JAR细胞的培养液是RPMI1640、JEG-3,BeWo细胞的培养液是DMEM/F12,细胞培养液中均需要加入10%胎牛血清以及双抗(100 U/mL 青霉素和100 μg/mL链霉素)。所有细胞均放置于37℃,5% CO2的孵箱中培养。
2.主要仪器和试剂:精密电子天平(Mettler Toledo 公司,瑞士);电泳装置 (Bio-Rad 公司,美国);Mx3000 PTM Real-time PCR System系统 (Stratagene 公司,美国);Hi Seq2000 测序仪(Illumina 公司,美国);凝胶电泳成像系统 (Synoptics Ltd,英国);STAT3 一抗为兔抗人多克隆抗体(稀释度为 1∶100,Abcam公司,美国);PTEN一抗为兔抗人单克隆抗体 (稀释度为1∶100,Abcam公司,美国);β-actin 兔抗人单克隆抗体 (Sigma-Alorich 公司,美国);DNMT1 抗体(Abcam,美国);抗 PTEN 抗体 (Cell Signaling Technology 公司,美国);TSC2抗体以及辣根过氧化物酶偶联的二抗(抗兔、抗鼠,Santa Cruz公司,美国)。
3.HE染色观察胎盘病理结构:取胎盘组织1 cm3,用4%多聚甲醛固定4~6 h,50%酒精浸洗×2次,每次30 min,再经85%酒精2 h×1脱水,石蜡包埋后切片4 μm,38℃~42℃烤片后用苏木精-伊红染色,加盖玻片置于光学显微镜下观察。
4.胎盘组织中全基因组甲基化测序(WGBS):取胎盘组织(母胎界面、绒毛、胎盘体部各约10 mg)匀浆后放入EP管中。应用基因组DNA提取试剂盒提取胎盘组织DNA,用Nano DropND-2000检测DNA浓度及吸光度值(A260/A280),所有样品在Illumina Hi Seq2000测序仪上完成测序。
5.细胞株低氧处理和慢病毒转染:各细胞株取一半在1% O2的混合气体(1% O2,5% CO2 和94% N2)中进行培养。置于37℃细胞培养箱中,通入1% O2 的低氧混合气体15 min。培养孔加入无血清培养基500 μL/孔,每孔加入目的慢病毒(STAT3-cDNA)和空载慢病毒20 μL,37℃孵育24 h。
6.细胞株分组:未予任何处理的HTR8/SVneo、JEG-3、JAR、Be Wo细胞株为空白对照组(Control组);低氧处理的HTR8/SVneo、JEG-3、JAR、BeWo细胞株分为慢病毒转染后诱导的子痫前期STAT3基因沉默组(shSTAT3组)、子痫前期STAT3 过表达组(STAT3OE组)。
7.5-AZA-DC处理细胞:接种2×105子痫前期各组细胞于六孔板中。次日加入含5μM 5-AZA-DC(Sigma,St.Louis,MO,USA)的新鲜培养基,并每日更换。72 h后收获细胞。空白对照组用0.01% DMSO的培养液进行处理。
8.CCK8检测细胞增殖实验:细胞株按3 000个/孔的量加入96孔板中,37℃,5% CO2培养箱过夜。PBS洗涤细胞后加入100 μL新的培养基和10 μL的CCK8 增殖检测试剂。取24 h、36 h、48 h、60 h、72 h时间段进行检测。全自动酶标仪上进行检测,45 nm波长,测量各孔的吸光度(OD)值。
9.流式细胞技术检测细胞凋亡:取5×105个细胞,4℃,1 000 rpm 离心5 min。10 μL Annexin V-FITC 荧光探针,轻轻混匀。继续每管加入5 μL的碘化丙锭(PI)于细胞液中,加入400 μL结合缓冲液(1×Binding Buffer),流式细胞仪检测。
10.Transwell侵袭实验:各组HTR8/SVneo 细胞中加入丝裂霉素C(mitomycin C)使其终浓度为10 μg/mL,37℃孵育2 h。小室下层的24孔板中加入含15% 胎牛血清的DMEM-F12培养基,加入到含有0.1% 结晶紫的新孔中,倒置显微镜20倍镜下照相并细胞计数分析。
11.细胞划痕实验:用marker笔在24孔板的每个孔底部划2条间隔为5 mm的横线,去除刮除掉的细胞。加入含2%胎牛血清的DMEM-F12培养基,37℃孵育箱培养48 h。分别在0 h和24 h使用倒置显微镜10倍镜下照相,使用Image J软件进行分析。
12.统计学处理:采用Prism 8统计学软件分析,正态分布的计量资料用![]() 表示。多组间比较采用单因素方差分析,组间比较采用t检验,P<0.05为差异有统计学意义。
表示。多组间比较采用单因素方差分析,组间比较采用t检验,P<0.05为差异有统计学意义。
结 果
一、临床资料比较
与正常妊娠组相比,PE组身高、吸烟、心脏病和子痫前期家族史,甘油三酯、总胆固醇、低密度脂蛋白、葡萄糖指标、胰岛素无显著差异(P>0.05)。年龄、体重、BMI、肥胖、饮酒、初次分娩、产后再次分娩间隔时间、分娩孕周、胎儿出生体重、胎盘重量、Apgar 评分(1 min和5 min)、高密度脂蛋白、收缩压、舒张压、平均动脉压组间差异显著(P<0.05)。见表1。
表1 基线临床资料比较
Table 1 Comparison of baseline clinical characteristics between PE group and normal pregnancy group
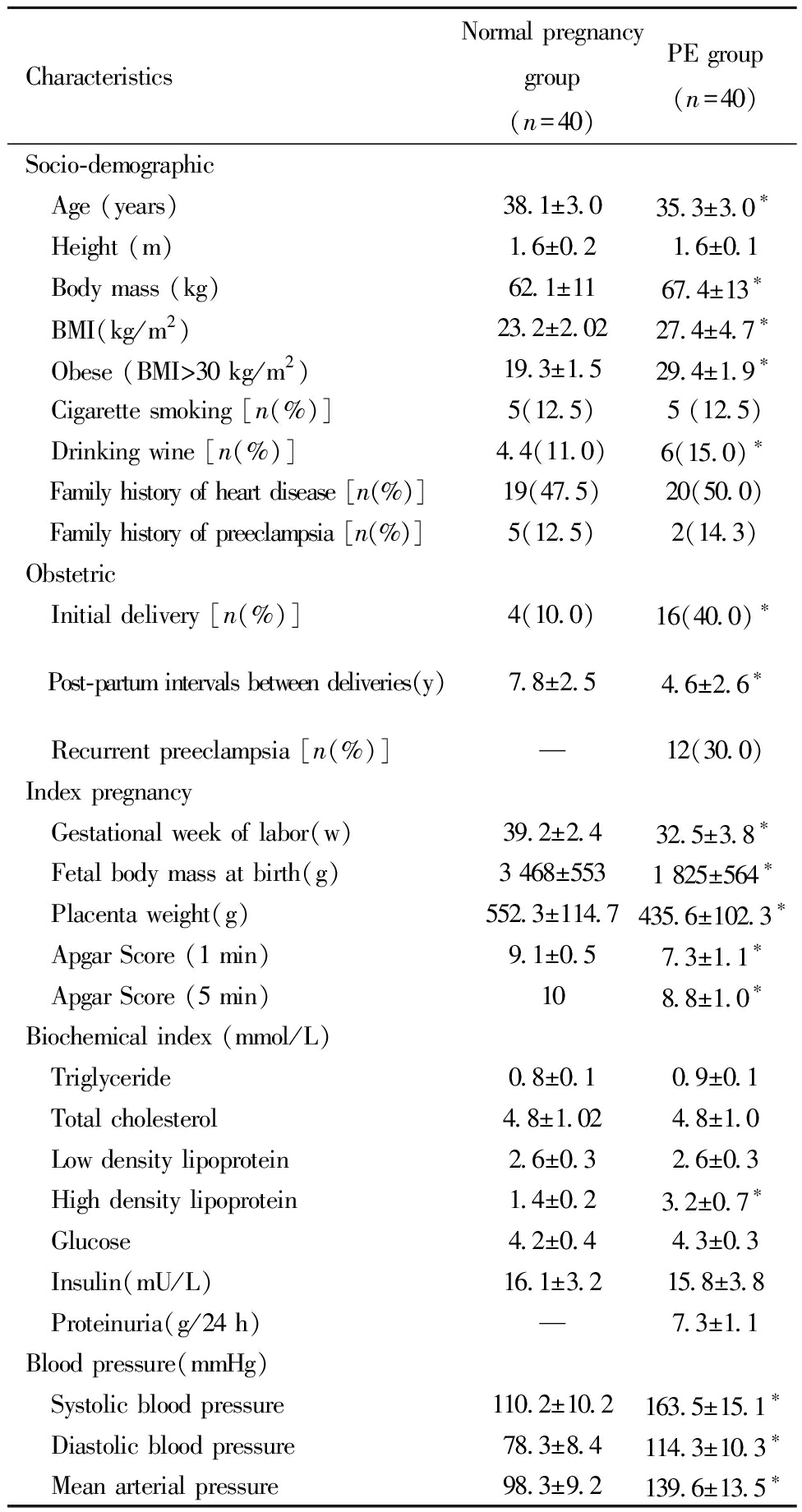
CharacteristicsNormal pregnancygroup(n=40)PE group(n=40)Socio-demographic Age (years)38.1±3.035.3±3.0∗ Height (m)1.6±0.21.6±0.1 Body mass (kg)62.1±1167.4±13∗ BMI(kg/m2)23.2±2.0227.4±4.7∗ Obese (BMI>30 kg/m 2)19.3±1.529.4±1.9∗ Cigarette smoking [n(%)]5(12.5)5 (12.5) Drinking wine [n(%)]4.4(11.0)6(15.0) ∗ Family history of heart disease [n(%)]19(47.5)20(50.0) Family history of preeclampsia [n(%)]5(12.5)2(14.3)Obstetric Initial delivery [n(%)]4(10.0)16(40.0) ∗ Post-partum intervals between deliveries(y)7.8±2.54.6±2.6∗ Recurrent preeclampsia [n(%)]—12(30.0)Index pregnancy Gestational week of labor(w)39.2±2.432.5±3.8∗ Fetal body mass at birth(g)3 468±5531 825±564∗ Placenta weight(g)552.3±114.7435.6±102.3∗ Apgar Score (1 min)9.1±0.57.3±1.1∗ Apgar Score (5 min)108.8±1.0∗Biochemical index (mmol/L) Triglyceride0.8±0.10.9±0.1 Total cholesterol4.8±1.024.8±1.0 Low density lipoprotein2.6±0.32.6±0.3 High density lipoprotein1.4±0.23.2±0.7∗ Glucose4.2±0.44.3±0.3 Insulin(mU/L)16.1±3.215.8±3.8 Proteinuria(g/24 h)—7.3±1.1Blood pressure(mmHg) Systolic blood pressure110.2±10.2163.5±15.1∗ Diastolic blood pressure78.3±8.4114.3±10.3∗ Mean arterial pressure98.3±9.2139.6±13.5∗
Compared with the normal pregnancy group, *P<0.05
二、胎盘组织HE染色结果
正常妊娠组镜下结果显示,胎盘组织具有正常足月胎盘的形态学特点,胎盘绒毛周围滋养细胞正常;绒毛间质组织结构完整,血管腔大、壁薄,血流量丰富。绒毛灌注良好,绒毛中可见较多红细胞。PE组镜下结果显示,血管腔变小,血管闭塞,血流量少;绒毛间质间纤维蛋白沉积,绒毛可见梗死、玻璃样变,部分胎盘绒毛水肿。见图1。
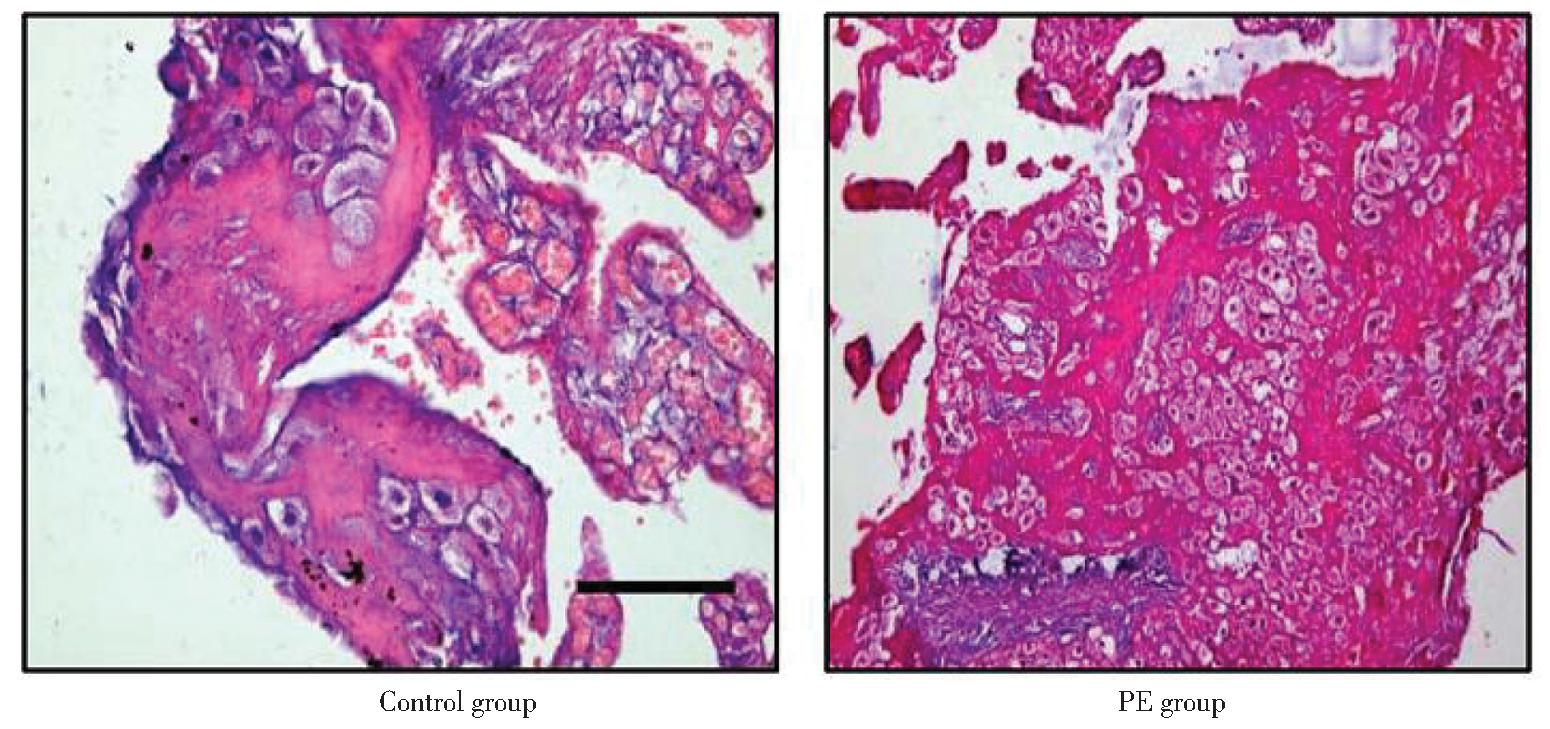
图1 正常妊娠组及PE组胎盘组织HE染色(×200)
Figure 1 HE staining of placenta in control group and PE group (×200)
三、WGBS检测胎盘组织DNA甲基化区域与DNA甲基化水平差异
WGB结果显示为平均甲基化水平,其中STAT3、PTEN和TSC2基因CpG位点甲基化水平显著改变。在胎盘组织中,DNMT1、STAT3、PTEN和TSC2均为DMR关联基因,PE组DNMT1甲基化水平上调,STAT3、PTEN、TSC2甲基化水平下调,两组比较,甲基化水平差异显著,差异有统计学意义,见表2、图2~图3。
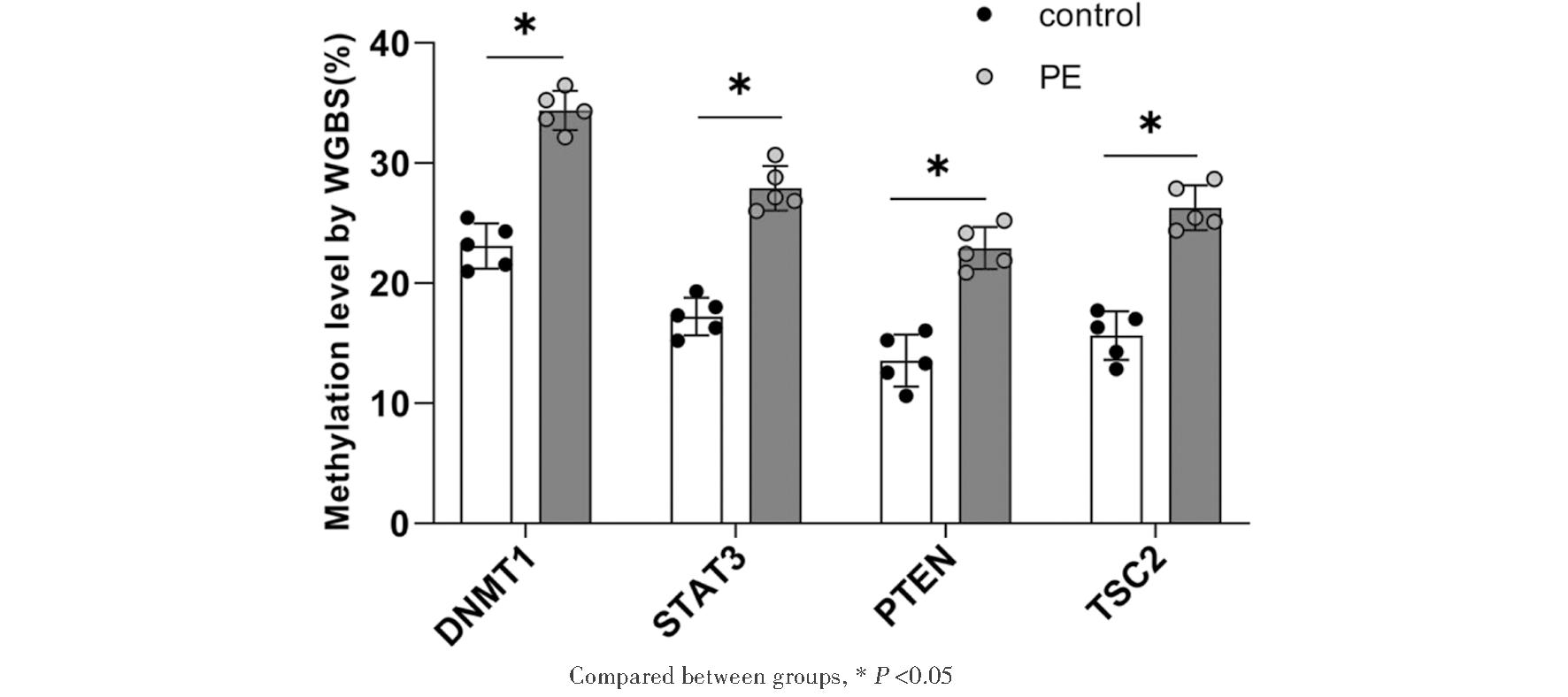
图2 WGBS显示DMR关联基因DNMT1、STAT3、PTEN、TSC2甲基化水平
Figure 2 Methylation of DNMT1, STAT3, PTEN, TSC2 of the DMR-associated gene revealed by WGBS
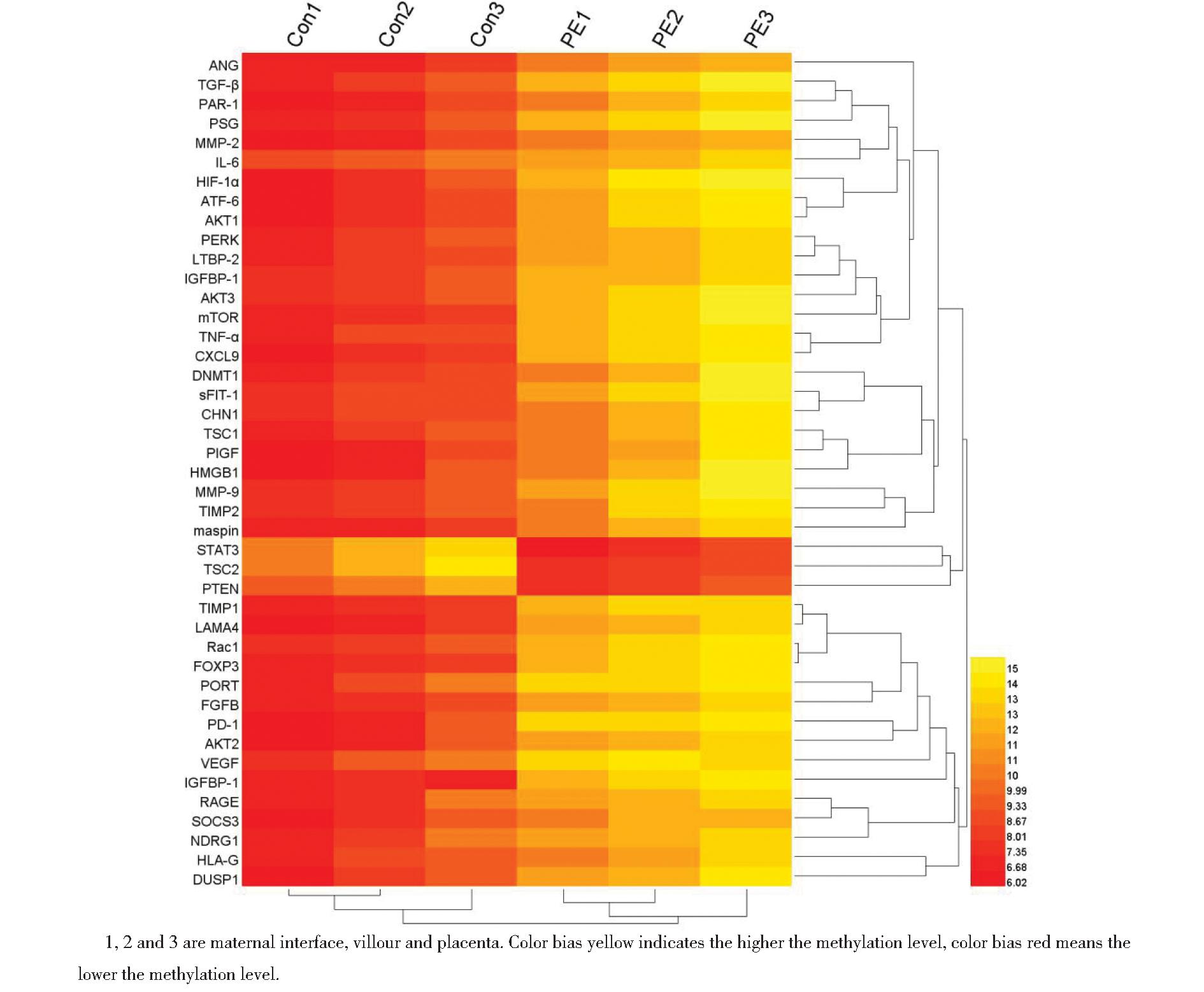
图3 两组差异甲基化区域的甲基化水平DMRs聚类分析热图
Figure 3 Thermal map of methylation level DMRs cluster analysis of differential methylation regions in two groups
表2 WGBS显示DMR关联基因DNMT1、STAT3、PTEN、TSC2甲基化水平![]()
Table 2 Methylation of DNMT1, STAT3, PTEN, TSC2 of the DMR-associated gene revealed by ![]()

GroupDNMT1STAT3PTENTSC2P ValueNormal pregnancy 22.31±1.2417.25±1.0513.33±0.7115.28±1.430.024PE34.32±1.16∗28.36±1.33∗23.05±1.17∗26.53±1.15∗0.023
Compared to the normal pregnancy group,*P<0.05
四、CCK8 检测细胞增殖
在5-AZA-DC干预和未干预的空白对照组、shSTAT3组和STAT3OE组中,5-AZA-DC干预对空白对照组无影响,无显著差异(P>0.05)。5-AZA-DC未干预中shSTAT3和STAT3OE组增殖能力均降低,shSTAT3组增殖能力下降最显著(P<0.05)。5-AZA-DC干预后shSTAT3和STAT3OE组增殖能力均较未干预显著改善,其中STAT3OE组改善最显著,差异有统计学意义,见图4。
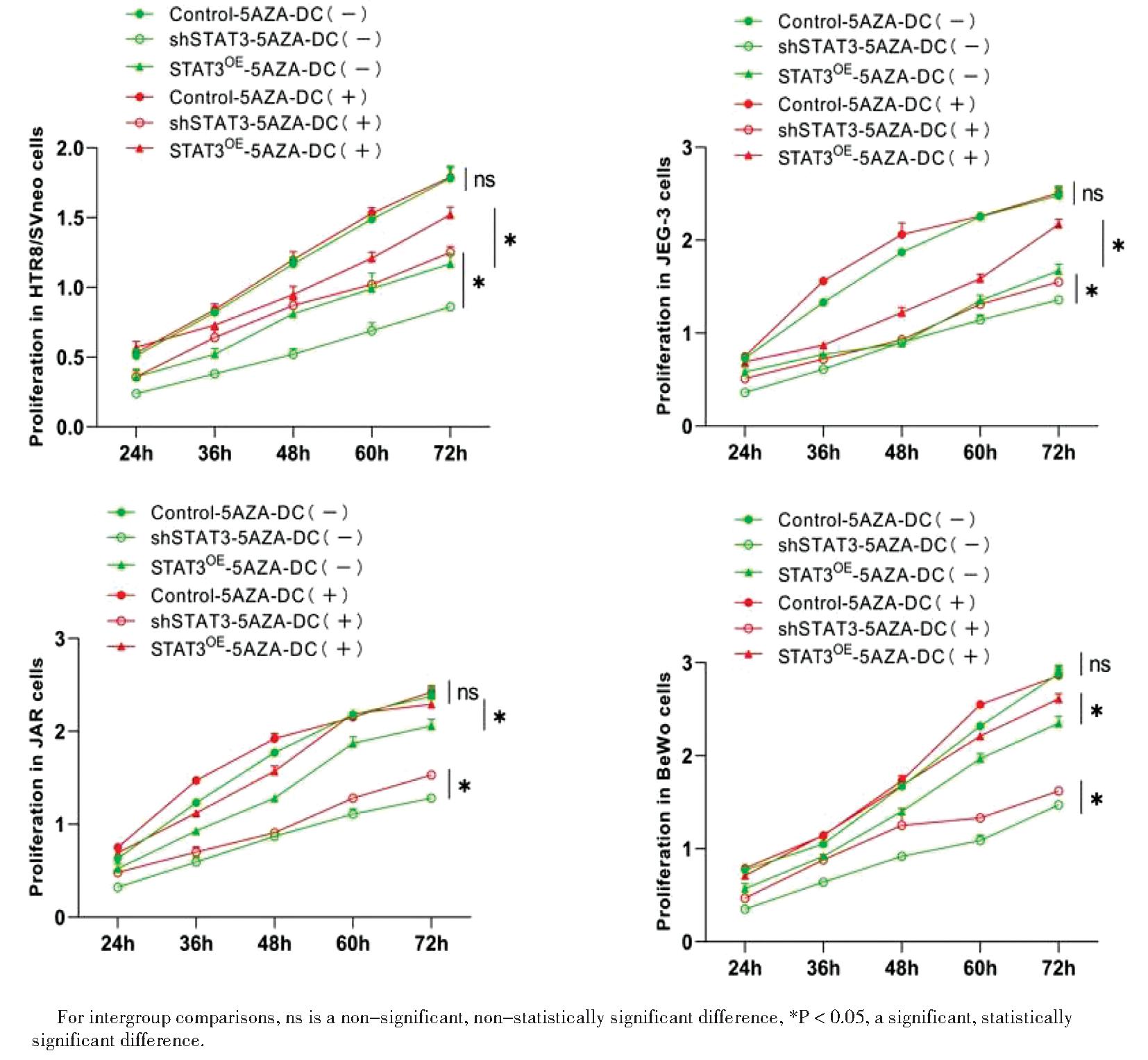
图4 CCK8 检测各组5-AZA-DC干预细胞增殖结果
Figure 4 CCK8 Detection of proliferation of 5-AZA-DC interfering cells in each group
表3 流式细胞仪检测各组细胞凋亡率(%)
Table 3 Detection of apoptosis rate in each group by flow cytometry(%)
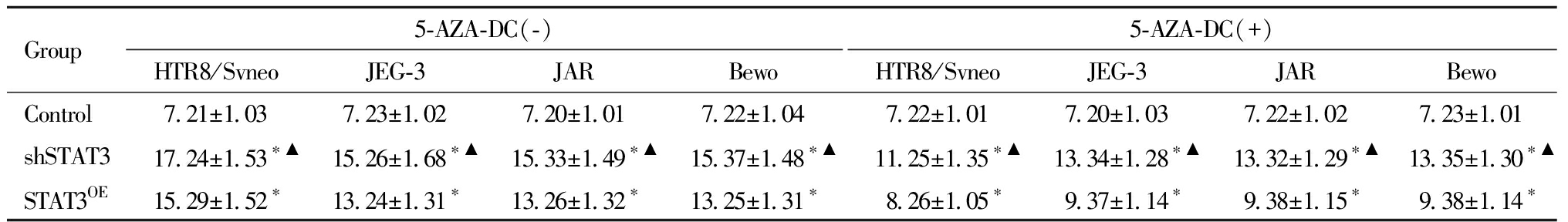
Group5-AZA-DC(-)HTR8/SvneoJEG-3JARBewo5-AZA-DC(+)HTR8/SvneoJEG-3JARBewoControl7.21±1.037.23±1.027.20±1.017.22±1.047.22±1.017.20±1.037.22±1.027.23±1.01shSTAT317.24±1.53∗▲15.26±1.68∗▲15.33±1.49∗▲15.37±1.48∗▲11.25±1.35∗▲13.34±1.28∗▲13.32±1.29∗▲13.35±1.30∗▲STAT3OE15.29±1.52∗13.24±1.31∗13.26±1.32∗13.25±1.31∗8.26±1.05∗9.37±1.14∗9.38±1.15∗9.38±1.14∗
shSTAT3 group and STAT3OE group comparison with control group,*P<0.05; shSTAT3 group comparison with STAT3OE group,▲P<0.05
表4 Transwell 检测5-AZA-DC 干预对HTR8/Svneo细胞的侵袭结果![]()
Table 4 Transwell Detection results of 5-AZA-DC intervention on HTR8/Svneo ![]()
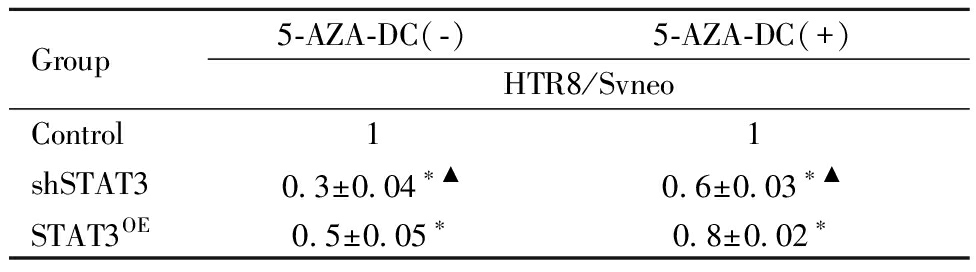
Group5-AZA-DC(-) 5-AZA-DC(+) HTR8/SvneoControl11shSTAT30.3±0.04∗▲0.6±0.03∗▲STAT3OE0.5±0.05∗0.8±0.02∗
shSTAT3 group and STAT3OE group comparison with Control group,*P<0.05; shSTAT3 group comparison with STAT3OE group, ▲P<0.05
表5 细胞划痕实验检测5-AZA-DC 干预对HTR8/Svneo细胞的迁移结果![]()
Table 5 migration of HTR8/Svneo cells by 5-AZA-DC ![]()

Group5-AZA-DC(-)0 h24 h5-AZA-DC(+)0 h24 hControl30.15±1.5671.32±1.8830.20±1.4871.33±1.87shSTAT330.18±1.53∗▲40.25±1.17∗▲30.19±1.50∗▲53.79±1.68∗▲STAT3OE30.19±1.54∗52.36±1.69∗30.21±1.47∗64.76±1.53∗
shSTAT3 group and STAT3OE group comparison with control group,*P<0.05; shSTAT3 group comparison with STAT3OE group,▲P<0.05
五、流式细胞仪检测各组细胞凋亡率
从Annexin V-FITC和PI荧光双参数点图可见,5-AZA-DC处理可使各组HTR8/Svneo、JEG-3、JAR、Bewo细胞株的凋亡率显著改变。5-AZA-DC干预后空白对照组细胞凋亡率无显著差异(P>0.05)。shSTAT3和STAT3OE组凋亡率下降,其中HTR8/Svneo细胞下降最显著,差异均有统计学意义,见表3。
六、Transwell 检测HTR8/Svneo细胞的侵袭功能
Transwell 侵袭实验的结果表明,5-AZA-DC干预HTR8/SVneo 细胞后,shSTAT3和STAT3OE组侵袭能力均显著提高,shSTAT3低于STAT3OE组,差异有统计学意义。5-AZA-DC是否干预对空白对照组没有影响,无显著差异(P>0.05),见表4、图5~图6。
图5 Transwell 检测HTR8/Svneo细胞侵袭结果
Figure 5 The HTR8/Svneo cell invasion result was detected by Transwell
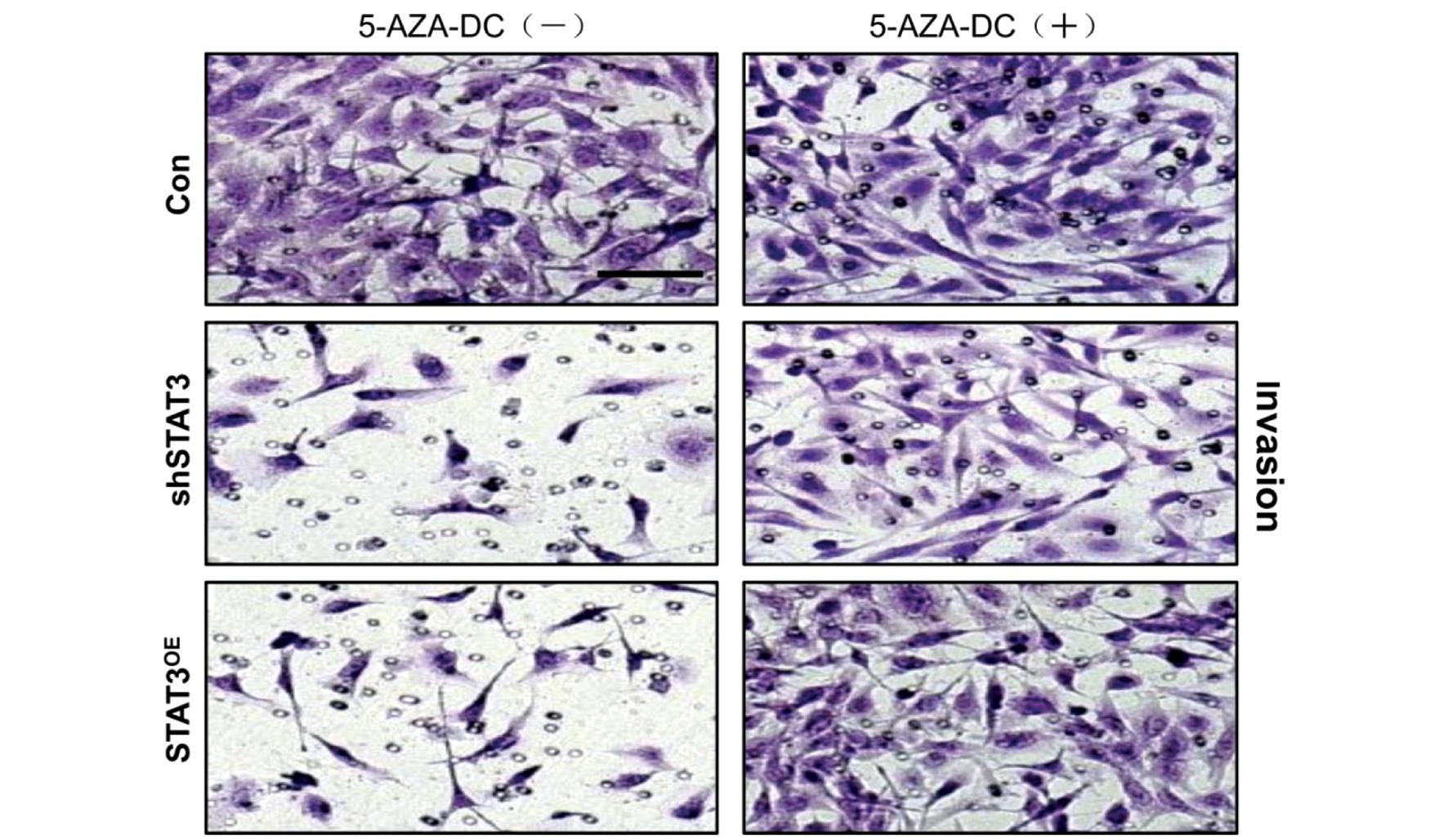
图6 Transwell 检测5-AZA-DC干预对HTR8/Svneo细胞的侵袭结果(染色方法×200)
Figure 6 Results of transwell detection of 5-AZA-DC intervention on HTR8/Svneo cells (×200)
七、细胞划痕实验检测HTR8/Svneo细胞的迁移功能
细胞划痕实验的结果表明,5-AZA-DC干预HTR8/SVneo细胞后,shSTAT3和STAT3OE组迁移能力均显著提高,shSTAT3组低于STAT3OE组,差异有统计学意义。5-AZA-DC是否干预对空白对照组没有影响,无显著差异(P>0.05)。见表5、图7~图8。
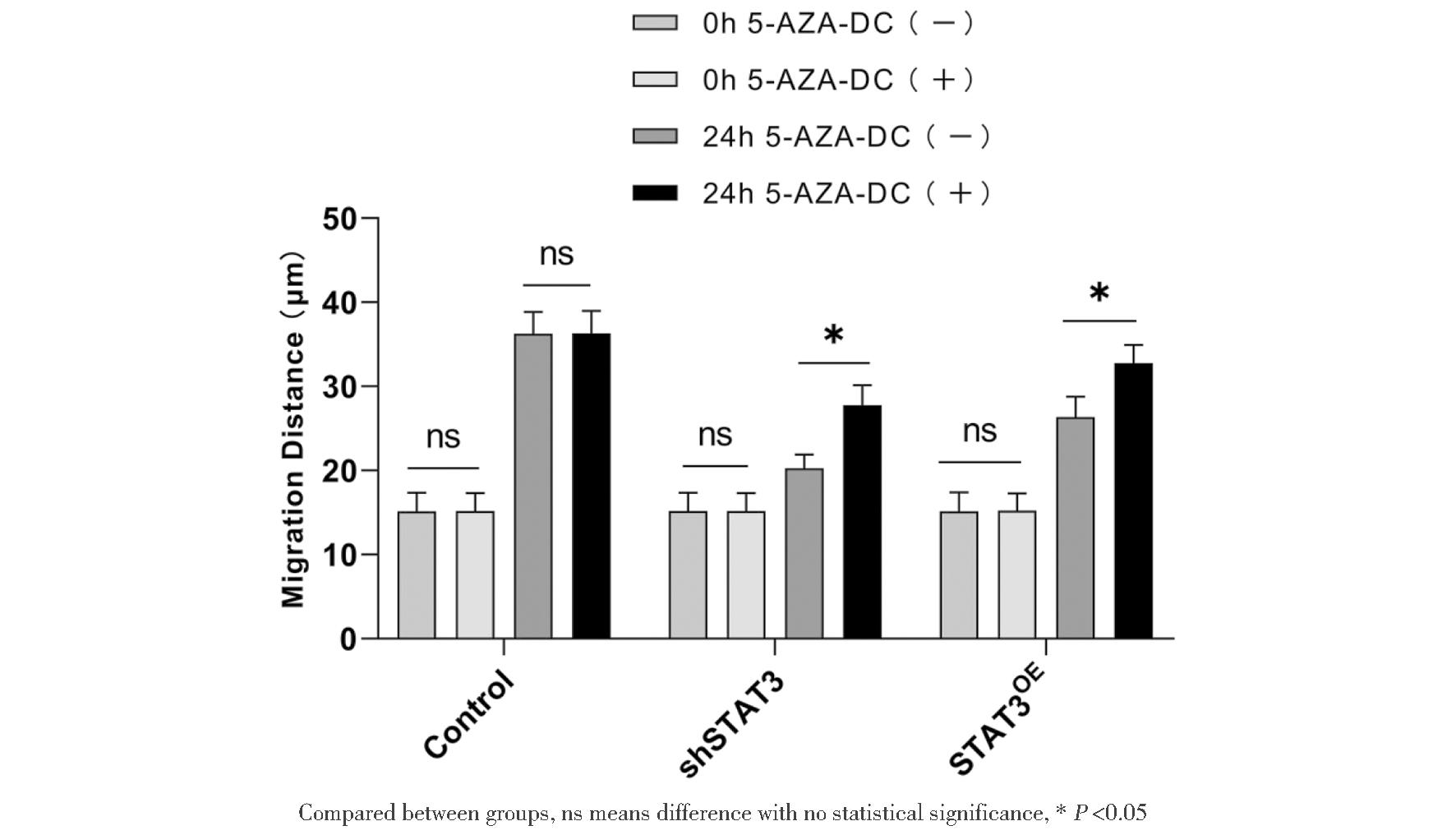
图7 图7细胞划痕实验检测HTR8/Svneo细胞迁移结果
Figure 7 HTR8/Svneo cell migration results
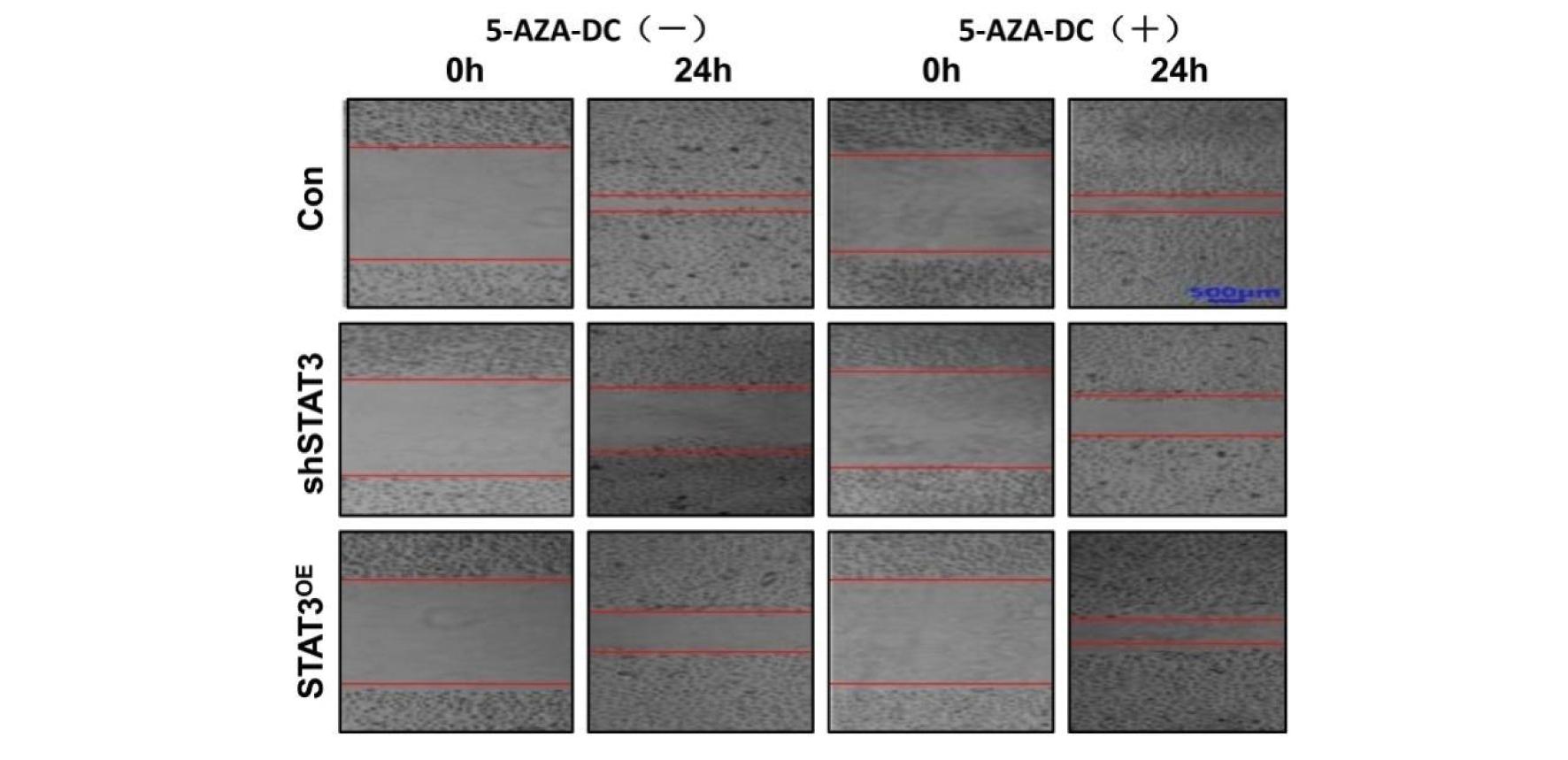
图8 细胞划痕实验检测5-AZA-DC干预对HTR8/Svneo细胞的迁移
Figure 8 Detection of 5-AZA-DC intervention on migration of htr8/svneo cells by wound healing assay
讨 论
PE是妊娠期特有疾病,可引起母体多系统器官损伤疾病,是目前导致围产期母婴高死亡率的主要原因之一,其发病原因及发病机制至今尚不明确[5-6]。近年来,越来越多的学者认为,PE是母体对妊娠的一种过度炎性反应[7]。研究表明,胎盘功能缺陷的发生可能源于配子早期的表观遗传学异常,有观点认为表观遗传学调控异常发生在妊娠前或妊娠中均增加PE的易感性[8]。本研究结果证实,DNMT1在PE胎盘组织中表达明显高于正常足月胎盘组织,STAT3表达明显低于正常足月胎盘组织。通过甲基化抑制剂处理后DNMT1表达明显下调,而STAT3表达显著上调,说明STAT3的表达程度受DNA甲基化的调控[9]。
研究发现,在人类胎盘发育过程中,STAT3基因也有可能参与滋养细胞迁移、侵袭等生物学功能的调控[10]。因此,本研究收集了正常妊娠和子痫前期妊娠孕妇的胎盘组织来进行WGBS研究,研究结果也揭示了STAT3基因在胎盘发育过程中的甲基化情况。
在早期母胎界面STAT3可能作为一个重要的负性调节因子参与调控滋养细胞的迁移和侵袭、增殖和凋亡能力,这种调控作用可能是通过直接或间接地调控PTEN和TSC2的活性来实现的[11]。这表明甲基化转移酶抑制剂5-AZA-DC可以显著抑制滋养细胞的增殖和迁移能力,和明显促进其凋亡。去甲基药物可以通过改变STAT3基因启动子区甲基化状态,使滋养细胞STAT3 mRNA表达增加,改善其增殖和迁移能力,和明显抑制其凋亡。
本研究在临床样本研究中得出,指标参数中的身高、吸烟、心脏病和子痫前期家族史,甘油三酯、总胆固醇、低密度脂蛋白、葡萄糖指标、胰岛素对子痫前期无影响,而年龄、体重、BMI、肥胖、饮酒、初次分娩、产后再次分娩间隔时间、分娩孕周、胎儿出生体重、胎盘重量、Apgar 评分(1 min和5 min)、高密度脂蛋白、收缩压、舒张压、平均动脉压在子痫前期患者中变化显著。PE组胎盘组织HE染色镜下示:血管腔变小,血管闭塞,血流量少;绒毛间质间纤维蛋白沉积,绒毛可见梗死、玻璃样变,部分胎盘绒毛水肿。本研究考虑为胎盘血管侵袭不足,发育障碍所致。WGBS检测胎盘组织DNMT1、STAT3、PTEN和TSC2基因的DNA甲基化水平,PE组的甲基化水平上调,DNMT1基因表现为高甲基化,而STAT3、PTEN和TSC2基因表现为低甲基化。由此, 本研究推论子痫前期发病可能为甲基化调控异常所引发。在体外的细胞学研究中,本研究应用甲基化转移酶抑制剂5-AZA-DC干预处理不同组别的滋养细胞株。本研究发现,5-AZA-DC对STAT3基因沉默和过表达的滋养细胞中增殖、凋亡、侵袭和迁移作用显著,其中STAT3基因过表达滋养细胞中的增殖上调、凋亡减少、侵袭增强和迁移下降最为显著。本研究考虑5-AZA-DC改善了滋养细胞的生物学功能[12-13]。
WGBS比较两组胎盘组织中甲基化水平差异,若差异显著性大于2倍,且P≤0.05的区域即为差异DNA甲基化区域(DMR)[14]。差异甲基化区域DMR需满足三个条件:(1)有差异的C碱基占总 C 碱基的比例大于 50%;(2)DMR 长度大于50 bp;(3)DMR区域内最少含5个碱基[15]。本研究WGBS结果显示,在胎盘组织中,STAT3、PTEN、TSC2均为DMR关联基因,其甲基化水平最为显著。DMR聚类分析可以明确不同组别胎盘组织间的相关关系和差异趋势。本研究结果显示,正常妊娠组各个样品间DMR差异较小,但是正常妊娠组与PE组相比较,DMR差异较大,差异有统计学意义。
现考虑5-AZA-DC对不同细胞株干预效果不一致原因如下:(1)不同的细胞株有不同的特点和功能,对药物的敏感性也不同。(2)细胞的生长状态和生理状态对药物的药效有一定的影响。(3)细胞内环境对药物的吸收、转运和代谢等过程有重要的影响,细胞内环境的差异可能导致药物在不同细胞中的药效不同[16-17]。在各组的细胞中,5-AZA-DC是否干预对空白对照组增殖能力影响不大,未干预中shSTAT3和STAT3OE组增殖能力均降低,shSTAT3组增殖能力下降最显著。5-AZA-DC干预后shSTAT3和STAT3OE组增殖能力均较未干预显著改善,其中STAT3OE组改善最显著。5-AZA-DC处理可使各组HTR8/Svneo、JEG-3、JAR、Be Wo细胞株的凋亡率显著改变。5-AZA-DC干预后sh STAT3和STAT3OE组凋亡率下降,其中HTR8/Svneo细胞下降最显著。本研究Transwell侵袭实验的结果表明,5-AZA-DC干预HTR8/SVneo细胞后,shSTAT3和STAT3OE组侵袭能力均显著提高,shSTAT3低于STAT3OE组,5-AZA-DC干预对Con组侵袭能力没无显著差异。本研究细胞划痕实验的结果表明,5-AZA-DC干预HTR8/SVneo细胞后,shSTAT3和STAT3OE组迁移能力均显著提高,shSTAT3低于STAT3OE组,5-AZA-DC干预对Con组迁移能力影响无显著差异。
综上所述,本研究证实,应用甲基化转移酶抑制剂5-AZA-DC干预,可以通过抑制DNMT1的活性,使STAT3、PTEN、TSC2基因启动子去甲基化,上调STAT3、PTEN、TSC2基因表达。从而调控滋养细胞增殖、凋亡、侵袭与迁移能力。本研究推测5-AZA-DC介导可能对子痫前期滋养细胞的功能性调控有重要的影响,也为运用表观遗传学方法研究子痫前期治疗机制提供全新的实验依据和干预靶点。本研究通过临床样本研究和体外HTR8/Svneo、JEG-3、JAR、BeWo滋养细胞株相关实验结合分析,为阐明子痫前期的发病表观遗传学机制开辟了新的思路,也为子痫前期的靶向治疗提供潜在的药物。
1 Roberts JM,Cooper DW.Pathogenesis and genetics of pre-eclampsia.Lancet,2020,357:53-56.
2 Di Cristofano A,Pandolfi PP.The multiple roles of PTEN in tumor suppression.Cell,2000,100:387-390.
3 Park E,Park J,Han SW,et al.NVP-BKM120,a novel PI3K inhibitor,shows synergism with a STAT3 inhibitor in human gastric cancer cells harboring KRAS mutations.Int J Oncol,2012,40:1259-1266.
4 Szpera-Gozdziewicz A,Breborowicz GH.Endothelial dysfunction in the pathogenesis of pre-eclampsia.Front Biosci (Landmark Ed),2014,19:734-746.
5 Mascaró M,Pibuel MA,Lompardía SL,et al.Low molecular weight hyaluronan induces migration of human choriocarcinoma JEG-3 cellsmediated by RHAMM as well as by PI3K and MAPK pathways.Histochem Cell Biol,2022,148:173-187.
6 Cudmore MJ,Ahmad S,Sissaoui S,et al.Loss of Akt activity increases circulating soluble endoglin release in preeclampsia:identification of inter-dependency between Akt-1 and heme oxygenase-1.Eur Heart J,2012,33:1150-1158.
7 Li M,Cheng W,Luo J,et al.Loss of selenocysteine insertion sequence binding protein 2 suppresses the proliferation,migration/invasion and hormone secretion of human trophoblast cells via the PI3K/Akt andERKsignaling pathway.Placenta,2021,55:81-89.
8 Barsh GS,Butler G,Copenhaver GP,et al.Endless microbes most beautiful and most wonderful.PLoS Genet,2023,19:e1010695.
9 Laird PW.Principles and challenges of genomewide DNA methylation analysis.Nat Rev Genet,2010,11:191-203.
10 Pomraning KR,Smith KM,Freitag M.Genome-wide high throughput analysis of DNA methylation in eukaryotes.Methods,2009,47:142-150.
11 Wen SW,Chen XK,Rodger M,et al.Folic acid supplementation in early second trimester and the risk of preeclampsia.Am J Obstet Gynecol,2022,198:45.el-7.
12 Perri F,Longo F,Giuliano M,et al.Epigenetic control of gene expression:Potential implications for cancer treatment.Crit Rev Oncol Hematol,2017,111:166-172.
13 Zhou J,Wulfkuhle J,Zhang H,et al.Activation of the PTEN/mTOR/STAT3 pathway in breast cancer stem-like cells is required for viability and maintenance.Proc Natl Acad Sci U S A,2007,104:16158-16163.
14 Cheung LW,Yu S,Zhang D,et al.Naturally occurring neomorphic PIK3R1 mutations activate the MAPK pathway,dictating therapeutic response to MAPK pathway inhibitors.Cancer Cell,2014,26:479-494.
15 Choudhury M,Friedman JE.Obesity:childhood obesity--methylate now,pay later.Nat Rev Endocrinol,2011,7:439-440.
16 Laplante M,Sabatini DM.mTOR signaling in growth control and disease.Cell,2012,149:274-293.
17 Irminger-Finger I,Jastrow N,Irion O.Preeclampsia:a danger growing in disguise.Int J Biochem Cell Biol,2008,40:1979-1983.