复发性流产(recurrent spontaneous abortion, RSA)是指与同一性伴侣连续发生自然流产2次及2次以上,在妊娠28周之前的胎儿丢失[1]。RSA的平均患病率估计占所有怀孕妇女的 1%~4% 之间[2-3]。按照RSA的病因筛查指南流程,45%的患者中发现母体或父方异常,并可能解释妊娠丢失的原因[4],这类RSA又称为原因明确的RSA(explained RSA, ERSA)[5],而未发现明确原因的称为不明原因RSA(unexplained RSA,URSA)[1]。近年来,文献报道RSA患者往往伴随着卵巢储备功能的下降,推测卵巢储备功能的下降是RSA发生的一种可能病因[5]。抗缪勒管激素(anti-müller hormone, AMH)认为是反映卵巢储备功能最可靠的指标之一[6]。本文通过分析 RSA患者血清AMH水平变化与疾病临床特征的关系,并对URSA与Th细胞因子的相关性进行了分析,以期为RSA患者开展卵巢储备功能评估的必要性提供依据。
资料与方法
1.一般资料:收集2020年10月—2022年7月来本院就诊的共105例RSA患者作为RSA组,RSA组最近一次流产的平均孕周为7+5周(4+5周~12周),同期在本院生殖中心因男方因素或输卵管因素行辅助生殖技术助孕,且无自然流产史的136例健康女性作为正常对照组,两组人群均排除饮酒及吸烟史,年龄定义在20~40岁之间。
(1)RSA组。纳入标准:①临床资料完整;②既往妊娠丢失是与同一性伴侣发生的;③曾连续性发生2次及2次以上的自然流产包括生化妊娠;④患者本人进行了常规病因筛查,包括生殖系统异常、内分泌(甲状腺功能、泌乳素水平、血糖)、抗核抗体谱检查、抗磷脂抗体谱检查、遗传性易栓症以及RSA患者及性伴侣的染色体核型检查。将其有无出现上述结果任何一个异常的RSA定义为ERSA和URSA。排除标准:①卵巢疾病和卵巢手术史;②男方精液以及精子化验异常;③男方染色体异常。
(2)正常对照组。纳入标准:①临床资料完整;②男方精液以及精子化验异常;③男方染色体异常;④输卵管阻塞。排除标准:①卵巢疾病和卵巢手术史;②应用辅助生殖用药。
根据年龄将研究对象分为≤30岁、30<~≤35岁、>35岁三组。根据筛查病因的阳性结果将RSA组分为ERSA和URSA两组。根据文献[7-8],按照患者最近一次早期妊娠丢失类型,患者被分为生化、空囊、卵黄囊流产(小于 10 孕周,未见胎心可见卵黄囊)、胚胎丢失(小于 10 孕周,可见胎心)4组。RSA组及正常对照组所有研究对象均对本研究知情同意,本研究经本院伦理委员会审查通过(伦理批号:2022083)
2.AMH检测:抽取研究对象空腹时外周血5 mL于标准试管内,按照抗缪勒管激素检测试剂盒(电化学发光法,罗氏诊断公司)操作说明,cobas e 801罗氏全自动电化学发光免疫分析仪测量AMH浓度,测量范围为0.01~23 ng/mL。卵巢储备功能减退(decline of ovarian reserve function,DOR)定义为血清AMH水平 <1.1 ng/mL[9]。
3.外周血淋巴细胞(Th)因子测定:抽取研究对象空腹时外周血5 mL于EDTA抗凝管内,按照人Th1/Th2亚群检测试剂盒(流式荧光法,诺德医疗公司)操作说明,选用BD FACSCalibur流式细胞仪(美国BD公司)测量。
4.临床资料收集:记录研究对象的年龄、BMI、流产次数、流产孕周、胚胎发育、流产病因筛查情况等。
5.统计学处理:应用SPSS 25.0软件统计分析数据,符合正态分布的计量资料以![]() 表示,两组间比较采用成组t检验;不符合正态分布的计量资料以 M(P25,P75)表示,两组间比较采用 Mann-Whitney U 检验;计数资料以相对数表示,组间比较采用χ2检验;两组以上的比较用非参数检验。绘制AMH预测 RSA的工作特征曲线(ROC 曲线),并计算 ROC 曲线下面积(AUC)、灵敏度、特异度、约登指数,P<0.05为差异具有统计学意义。
表示,两组间比较采用成组t检验;不符合正态分布的计量资料以 M(P25,P75)表示,两组间比较采用 Mann-Whitney U 检验;计数资料以相对数表示,组间比较采用χ2检验;两组以上的比较用非参数检验。绘制AMH预测 RSA的工作特征曲线(ROC 曲线),并计算 ROC 曲线下面积(AUC)、灵敏度、特异度、约登指数,P<0.05为差异具有统计学意义。
结果
1.RSA组与正常组年龄、BMI相比较:两组BMI、年龄无差异,年龄≤30岁、30<年龄≤35岁及年龄>35岁三个年龄段均无差异,见表1。RSA组和正常组AMH水平与年龄均呈负相关,且RSA组间有显著相关性(r=-0.290,P=0.003)。
表1 RSA组与正常组间年龄对比

组别年龄(岁)≤30nM(P25,P75)30<~≤35nM(P25,P75)>35nM(P25,P75)合计NM(P25,P75)BMI(kg/m2)RSA组4628(24,29)3633(32,34)2339(37,40)10531(28,35)22.80±3.01对照组5328(25,29)5233(31,34)3138(37,39)13632(29,35)22.73±3.11
2.两组AMH水平及DOR发生率比较:RSA组整体AMH值中位数水平较正常组低,组间差异有统计学意义。在年龄≤30岁、30<年龄≤35和年龄>35岁三个组中,RSA组AMH值均较正常组低,其中在年龄≤30岁和>35岁组中,差异具有统计学意义。两组各自年龄段之间AMH水平的比较显示,正常组间AMH值无显著性差异,RSA组间AMH值差异具有统计学意义,见表2。
表2 RSA组与正常组间AMH水平(ng/mL)对比

组别年龄(岁)≤30nM(P25,P75)30<~≤35nM(P25,P75)>35nM(P25,P75)合计NM(P25,P75)RSA组462.83(1.91,3.81)363.03(1.68,4.13)231.2(0.43,2.98)1052.75(1.39,3.58)对照组533.37(2.70,4.32)523.21(2.64,3.80)313.09(2.49,4.49)1363.185(2.59,4.25)
RSA组DOR发生率显著高于正常组[(20.95%,22/105)vs.0,P<0.001;OR=37.51,95%CI:4.97~282.91,P<0.001]。
3.ERSA与URSA两组AMH水平比较:105例RSA患者中,57.1%(60/105)未发现原因,42.9%(45/105)发现导致复发性流产的可解释原因,24.8%(26/105)抗核抗体谱阳性和/或抗磷脂抗体谱阳性,10.5%(11/105)内分泌异常,包括5.7%(6/105)甲状腺功能异常,1.0%(1/105)血糖异常,2.9%(3/105)泌乳素升高及1.0%(1/105)多囊卵巢综合征,生殖系统和夫妻双方染色体核型异常发生率分别为3.8%(4/105)和2.9%(3例),1.0%(1/105)患遗传性易栓症。
与正常组相比,URSA组和ERSA组的年龄均与正常组无明显差异;URSA组与ERSA组的AMH水平均低于正常组,URSA组AMH值与正常组比较的差异性具有统计学意义。URSA组与ERSA组的年龄无差异, URSA组AMH值低于ERSA组(P<0.05)。见表3。
表3 ERSA与URSA两组间的年龄及AMH水平(ng/mL)比较

组别例数年龄(岁)AMH水平[M(P25,P75),ng/mL]URSA6032.5(28,35)2.28(1.05,3.36)ERSA4530.0(28,35)2.97(1.77,4.43)
4.不同早期妊娠丢失类型间AMH水平比较:RSA患者中有88.6%(93/105)早期妊娠丢失,中位孕周为7+1周(5+2周~8周),其中生化中位孕周为5+1周(4+6周~5+2周),空囊中位孕周为7+3周(7周~8周),卵黄囊流产中位孕周为7+1周(7周~8周),胚胎流产中位孕周为8+1周(7+4周~8+4周)。4组年龄无差异,P>0.05;不同妊娠丢失类型间的AMH水平有差异(P<0.05)见表4。
表4 RSA组不同流产类型间的年龄及AMH水平对比
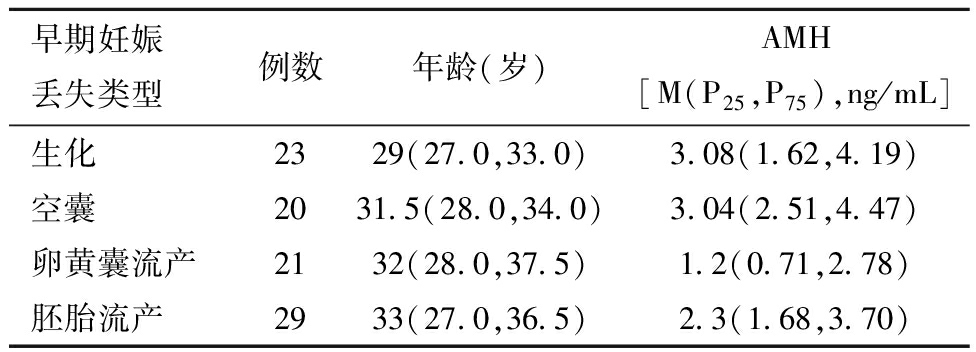
早期妊娠丢失类型例数年龄(岁)AMH[M(P25,P75),ng/mL]生化2329(27.0,33.0)3.08(1.62,4.19)空囊2031.5(28.0,34.0)3.04(2.51,4.47)卵黄囊流产2132(28.0,37.5)1.2(0.71,2.78)胚胎流产2933(27.0,36.5)2.3(1.68,3.70)
卵黄囊流产的AMH值与生化妊娠、空囊妊娠和胚胎流产比较,差异均具有统计学意义;其余两两组间比较,差异无统计学意义。
5.流产次数与血清AMH水平的关系比较:根据RSA患者的流产次数将其分为流产2次及流产≥3次两组,两组间年龄无差异。与流产2次相比,流产≥3次的RSA患者AMH水平降低(P<0.05),见表5。
表5 不同流产次数患者的年龄及AMH水平对比

流产次数例数年龄(岁)AMH[M(P25,P75),ng/mL]流产2次6330(27.0,34.0)2.97(1.85,3.93)流产≥3次4233(29.5,36.3)2.04(0.72,3.19)
DOR发生率显著升高[31.0%(13/42)vs.14.3%(9/63),P=0.04; OR=2.69,95%CI:1.03-7.04, P=0.044]。
6.AMH值预测RSA的价值:绘制AMH预测RSA诊断价值的ROC曲线,AMH预测RSA的AUC为0.647 (95%CI:0.57~0.72),最佳截断值为1.7 ng/mL,灵敏度100%,特异度33.3%,约登指数为0.333%,P<0.01。
7.Th因子与AMH的相关性:105例RSA组有57例进行了Th因子检测,28例为URSA患者,29例ERSA患者。总体分析显示,AMH均与TNF-α、TNF-α/IL-4、TNF-α/IL-10呈显著负相关(P<0.05),其余均无统计学意义。ERSA组AMH与所有Th因子水平无相关性。URSA组中,AMH与TNF-α、IFN-γ/IL-4、IFN-γ/IL10、TNF-α/IL-4、TNF-α/IL-10均呈显著负相关,与IL-4显著正相关,其余均无统计学意义。见表6。
表6 RSA和URSA患者外周血Th因子与AMH水平的相关性
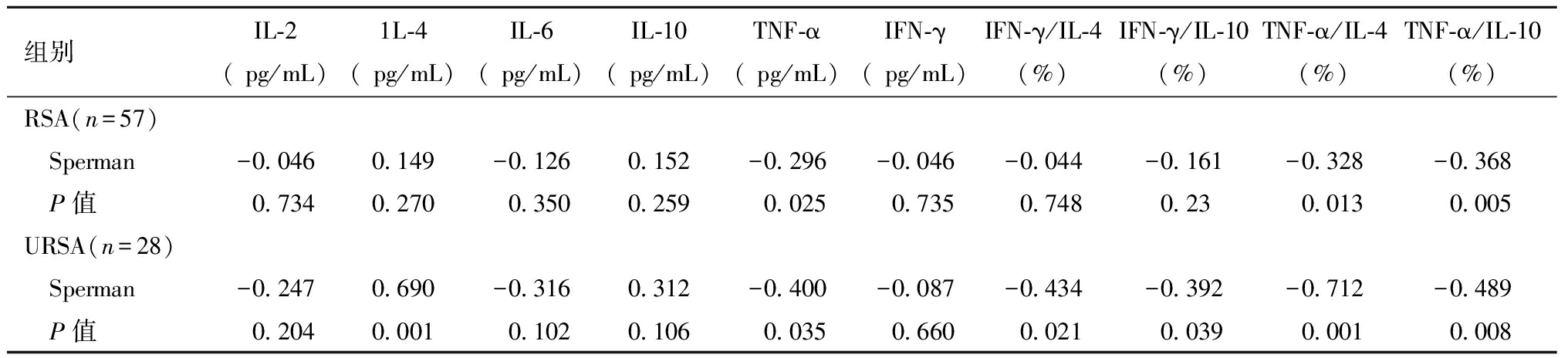
组别IL-2( pg/mL)1L-4( pg/mL)IL-6( pg/mL)IL-10( pg/mL)TNF-α( pg/mL)IFN-γ( pg/mL)IFN-γ/IL-4(%)IFN-γ/IL-10(%)TNF-α/IL-4(%)TNF-α/IL-10(%)RSA(n=57) Sperman-0.0460.149-0.1260.152-0.296-0.046-0.044-0.161-0.328-0.368 P值0.7340.2700.3500.2590.0250.7350.7480.230.0130.005URSA(n=28) Sperman-0.2470.690-0.3160.312-0.400-0.087-0.434-0.392-0.712-0.489 P值0.2040.0010.1020.1060.0350.6600.0210.0390.0010.008
讨论
AMH是转化生长因子-β超家族的一种糖蛋白,主要由卵巢中生长卵泡的颗粒细胞产生,可以反映原始卵泡池的大小,被认为是预测卵巢储备最准确的生物标志物,广泛应用于不同的临床领域。一项中国大样本研究显示,随着年龄的增长,尤其是35岁以上人群AMH的下降速度加快[10]。因此,本研究把35岁以上的女性划分在>35岁年龄段中统计分析,结果显示无论是RSA患者还是健康对照人群,随着年龄的增加AMH水平逐渐降低,在年龄≤30岁及35岁以上这两个年龄段,RSA患者较正常人AMH值显著降低。35岁以上RSA患者AMH水平的降低可能是与年龄增大卵巢储备降低有关,但在≤30岁年龄段的RSA患者表现出异常低的水平,值得进一步探讨。
AMH是代表卵巢储备功能的重要生物标志,流产通常被视为生殖能力的一种替代衡量,流产率被提议作为生育能力的一种可能衡量标准[11]。降低的AMH(卵巢储备功能降低)和流产的关系一直是尚未研究和解决的关键问题。最近一篇系统回顾和荟萃分析研究中[12],13项结果显示,与针对辅助生殖技术(assisted reproductive technology,ART)妊娠的回顾性研究血清中高浓度AMH的妇女相比,低AMH水平的妇女流产率明显更高;两项前瞻性研究数据显示,血清AMH水平低的女性流产风险显著增加;纳入研究对象的年龄并不影响AMH水平与流产风险之间的关系。RSA是一独特的不良妊娠结局疾病谱的代表,病因复杂,异质性强,临床治疗具有挑战性和不确定性,近10多年的研究[11,13]提示卵巢储备功能的降低可能同样参与了RSA的病理发病过程。
RSA患者存在血AMH的降低这一现象,最早由Trout和Seifer两位学者[13],通过检测月经周期第三天外周血FSH和E2发现,URSA患者中存在卵巢储备功能的降低,URSA患者FSH或E2水平升高的可能性大约是ERSA女性的6倍。2020年,Bunnewell等[12]系统回顾和荟萃分析了RSA风险妇女与卵巢储备功能减少(DOR)之间的关系,共纳入15项研究,基于AMH水平检测结果,与没有流产的女性相比,RSA女性有更高的DOR发生风险(OR=2.77,95%CI:1.41~5.46);与ERSA女性相比,URSA女性低AMH水平与DOR的相关性似乎更高(OR=3.23,95%CI:1.81~5.76)。本研究发现,早期妊娠丢失类型和前次流产次数大于等于3次的RSA患者的AMH降低趋势与已有的报道类似[5, 14],随着流产次数的增多和患者的年龄增加,AMH水平逐渐降低,DOR的发生率增加,尤其是URSA患者的AMH水平显著低。因此,RSA患者存在卵巢储备功能降低的依据充分,不是偶发事件。
AMH水平的降低是否是非特指RSA人群早期妊娠丢失的预测因素一直存在争议[15-17]。AMH水平与RSA患者的再次妊娠早期流产无关[18-19],与RSA患者自然受孕后活产降低有关,可能是比年龄更强的预测因子[20]。本研究AMH预测诊断RSA的AUC仅为0.647,最佳截断值为1.7 ng/mL,特异度不高,提示RSA与AMH的关系可能受到其他未知因素的影响。
针对RSA患者尤其是URSA患者明显存在卵巢储备功能降低这一关联,一些研究认为是由于降低的卵巢储备功能影响卵子质量,导致卵子和胚胎的非整倍体率增高[21],致使早期流产的风险增加。研究发现,低AMH并不能预测RSA患者的再次妊娠流产风险[18-19],体外受精胚胎移植前基因的检测并没有显示低AMH(DOR)和非整倍体胚胎发生率之间显著关系[16, 22],早孕期空囊流产胚胎非整倍体的发生率低于有胚胎流产者[23],随着流产次数的增加,胚胎非整倍体的可能性逐渐降低[24]。因此,推测卵巢储备功能降低不是RSA的原因,两者的共同出现可能是生殖功能受损的结局呈现。
为探讨URSA卵巢储备功能降低的原因,本研究分析RSA患者的外周血Th因子水平与AMH之间的关系。结果显示,AMH细胞因子RSA患者TNF-α、IFN-γ水平呈显著的负相关。TNF-α、IFN-γ是重要细胞毒性因子,与URSA的发生密切相关[25],TNF-α、IFN-γ水平在卵巢早衰患者外周血及生化早衰患者的卵泡液及颗粒细胞中显著增加,外周血TNF-α、IFN-γ的水平与卵巢早衰的严重程度相关,二者可共同促进颗粒细胞的凋亡并抑制其类固醇生成[26]。DOR患者的卵泡液中IFN-γ阳性的CD8T淋巴细胞增多[27]。因此,可以推断升高的TNF-α、IFN-γ通过毒性细胞因子作用,参与RSA和DOR的病理生理过程,为RSA患者伴随AMH水平降低的解释提供依据。
综上所述,本研究和文献报道均证明早期RSA患者血清AMH水平显著降低,卵巢储备功能的降低与RSA存在关联,但不一定是因果关系,二者可能是生殖功能受损的共同结果,建议在RSA的原因筛查中增加卵巢储备功能的评估。
志谢:王国倩、崔金全(文章的构思与设计,负责文章的质量控制及审校,对文章整体负责,监督管理),王国倩、邵文嘉、李诗雅(负责数据收集与整理),王国倩(统计学处理、结果分析与解释、撰写论文)。
本文无利益冲突。
1 自然流产诊治中国专家共识编写组.自然流产诊治中国专家共识(2020年版).中国实用妇科与产科杂志,2020,36:1082-1090.
2 Magnus MC,Wilcox AJ,Morken NH,et al.Role of maternal age and pregnancy history in risk of miscarriage:prospective register based study.BMJ,2019,364:l869.
3 Rasmark Roepke E,Matthiesen L,Rylance R,et al.Is the incidence of recurrent pregnancy loss increasing? A retrospective register-based study in Sweden.Acta Obstet Gynecol Scand,2017,96:1365-1372.
4 Popescu F,Jaslow CR,Kutteh WH.Recurrent pregnancy loss evaluation combined with 24-chromosome microarray of miscarriage tissue provides a probable or definite cause of pregnancy loss in over 90% of patients.Hum Reprod,2018,33:579-587.
5 Pils S,Stepien N,Kurz C,et al.Anti-Mullerian hormone is linked to the type of early pregnancy loss in idiopathic recurrent miscarriage:a retrospective cohort study.Reprod Biol Endocrinol,2017,15.
6 Jiang X,Yan J,Sheng Y,et al.Low anti-Müllerian hormone concentration is associated with increased risk of embryonic aneuploidy in women of advanced age.Reprod Biomed Online,2018,37:178-183.
7 Kolte AM,Bernardi LA,Christiansen OB,et al.Terminology for pregnancy loss prior to viability:a consensus statement from the ESHRE early pregnancy special interest group.Hum Reprod,2015,30:495-498.
8 Dimitriadis E,Menkhorst E,Saito S,et al.Recurrent pregnancy loss:98.
9 程萌,孔令伶俐,许良智,等.卵巢储备功能减退临床诊治专家共识解读.实用妇产科杂志,2022,38:743-745.
10 Hao Y,Yang R,Li J,et al.Age-specific random day serum antimüllerian hormone reference values for women of reproductive age in the general population:a large Chinese nationwide population-based survey.Am J Obstet Gynecol,2022,227:883.e1-883.e18.
11 Lyttle Schumacher BM,Jukic A,Steiner AZ.Antimüllerian hormone as a risk factor for miscarriage in naturally conceived pregnancies.Fertil Steril,2018,109:1065-1071.e1.
12 Bunnewell SJ,Honess ER,Karia AM,et al.Diminished ovarian reserve in recurrent pregnancy loss:a systematic review and meta-analysis.Fertil Steril,2020,113:818-827.e3.
13 Trout SW,Seifer DB.Do women with unexplained recurrent pregnancy loss have higher day 3 serum FSH and estradiol values.Fertil Steril,2000,74:335-337.
14 Tan J,Luo L,Jiang J,et al.Decreased Ovarian Reserves With an Increasing Number of Previous Early Miscarriages:A Retrospective Analysis.Front Endocrinol (Lausanne),2022,13:859332.
15 Hong S,Chang E,Han EJ,et al.The anti-Mullerian hormone as a predictor of early pregnancy loss in subfertile women.Syst Biol Reprod Med,2020,66:370-377.
16 Cedars MI.Evaluation of Female Fertility-AMH and Ovarian Reserve Testing.J Clin Endocrinol Metab,2022,107:1510-1519.
17 Liu X,Han Y,Wang X,et al.Serum anti-Müllerian hormone levels are associated with early miscarriage in the IVF/ICSI fresh cycle.BMC Pregnancy Childbirth,2022,22:279.
18 Leclercq E,de Saint Martin L,Bohec C,et al.Blood anti-Müllerian hormone is a possible determinant of recurrent early miscarriage,yet not conclusive in predicting a further miscarriage.Reprod Biomed Online,2019,39:304-311.
19 Pils S,Stepien N,Kurz C,et al.Does anti-Mullerian hormone predict the outcome of further pregnancies in idiopathic recurrent miscarriage? A retrospective cohort study.Arch Gynecol Obstet,2019,299:259-265.
20 Murugappan G,Shahine L,Lathi RB.Antimullerian hormone is a predictor of live birth in patients with recurrent pregnancy loss.Fertil Res Pract,2019,5:2.
21 Shahine LK,Marshall L,Lamb JD,et al.Higher rates of aneuploidy in blastocysts and higher risk of no embryo transfer in recurrent pregnancy loss patients with diminished ovarian reserve undergoing in vitro fertilization.Fertil Steril,2016,106:1124-1128.
22 Moolhuijsen L,Visser JA.Anti-Müllerian Hormone and Ovarian Reserve:Update on Assessing Ovarian Function.J Clin Endocrinol Metab,2020,105:3361-3373.
23 聂庆文,华芮,周瑶,等.不同类型早期稽留流产的绒毛染色体分析.广东医学,2017,38:3580-3583.
24 Ogasawara M,Aoki K,Okada S,et al.Embryonic karyotype of abortuses in relation to the number of previous miscarriages.Fertil Steril,2000,73:300-304.
25 李萌.TH1和TH2型细胞因子对于早孕期复发性流产患者妊娠结局的预测价值.郑州大学,2021.
26 Jiao X,Zhang X,Li N,et al.T(reg) deficiency-mediated T(H) 1 response causes human premature ovarian insufficiency through apoptosis and steroidogenesis dysfunction of granulosa cells.Clin Transl Med,2021,11:e448.
27 Zhao N,Zhang C,Ding J,et al.Altered T lymphocyte subtypes and cytokine profiles in follicular fluid associated with diminished ovary reserve.Am J Reprod Immunol,2022,87:e13522.