不孕症是指无避孕性生活至少12个月而未孕[1]。不孕症是一种病因复杂的综合性疾病,其病因有生活方式、解剖异常、内分泌异常、男方因素、遗传因素、以及环境与遗传共同作用。在不孕症的群体中,由遗传因素导致的多为染色体结构畸变和数目异常,如果把染色体多态性都计算在内,其发生率在1.3%~15.0%[2-4]。在数目异常的患者中又以性染色体数目异常居多,通常表现为嵌合型性染色体数目异常。患者表型的正常与否取决于嵌合的比例与嵌合的发生是否在重要部位[5]。
生殖中心门诊工作的临床医生常遇到一类遗传问题,即这类女性患者因不孕症就诊,因常规染色体检查,发现性染色体的数目异常,其表现形式有45,X/46,XX或是45,X/46,XX/47,XXX。面对这类患者,由于性染色体嵌合比例的不同,尤其是嵌合比例<10%的低比例嵌合时,临床医生常感到困惑,无法对其嵌合状态给出恰当的解释。
目前,对于低比例嵌合的定义并没有十分明确和统一的标准,有的学者把6%以下[6]看做低比例嵌合,有学者则认为<10%以下[2-3, 7]。欧洲细胞遗传学家协会指南(European Cytogeneticists Association guidelines)把<10%定义为低比例嵌合,把嵌合比例达到15%定为真性嵌合[8]。低比例嵌合患者通常会有正常的月经初潮年龄、规律的月经周期和生殖器官正常的解剖生理结构,只是在生育期表现出反复流产或不孕。这类患者在生殖门诊中比较常见,辅助生殖技术助孕后其妊娠结局是否受到X染色体非整倍体嵌合的影响,是临床医生和患者所关心的问题,对临床医生做出准确的遗传咨询和判断预后及是否必须做产前诊断都有重要指导意义。
对象与方法
1.对象:选取2017年1月至2019年6月在北医三院生殖中心就诊的门诊患者,均为需要接受体外授精胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)助孕的夫妇,共计247对。女方通过一系列常规检查,如超声检查、输卵管造影、实验室评估,及配偶的精液检查,其中83例女性均存在不同程度的X染色体非整倍体嵌合作为嵌合组,年龄24~45岁,平均年龄(35.1±4.3)岁。根据欧洲细胞遗传学家协会指南的标准[8],将嵌合<10%的X染色体嵌合定义为低比例嵌合。其中嵌合<10%的X染色体嵌合,71例;嵌合>10%的X染色体嵌合,12例。
对照组:根据“年龄+治疗年份+移植胚胎数”三个匹配条件,进行1:2匹配。嵌合<10%的X染色体嵌合组,选取同期142对夫妇;嵌合>10%的X染色体嵌合组,选取同期24对夫妇。对照组夫妇双方染色体均正常、且需要IVF-ET助孕的患者。
2.IVF-ET相关信息收集:对所有IVF-ET助孕患者,记录患者基本信息,如年龄、身高、BMI、不孕原因和不孕年限, 及患者月经第2~3天的激素水平,包括基础卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、催乳素(prolactin,PRL)、雌二醇(estradiol,E2)、孕酮(progesterone,P)、睾酮(testosterone,T)。统计IVF-ET周期的相关信息,双侧窦卵泡数、 IVF用药方案、当周期移植率、周期取消率、当周临床妊娠率、持续妊娠率、流产率。
IVF-ET方案:所有病例均根据其情况选择4种常规促排方案中的1种,即超长方案、长方案、短方案、拮抗剂方案。
3.染色体核型分析:根据标准的实验流程,采用吉姆萨常规染色体核型分析[9],在常规计数的20个分裂相中,若发现1个丢失或多余性染色体的情况,增加计数到50个,若再发现相同的异常性染色体时,增加计数到100个,发现3个相同的异常核型作为报告的标准。G显带染色体分析水平为500条带,核型描述按照ISCN2009规范[10]。对于染色体多态,例如1、9、16结构易染色质增大不在报告之列。
4.结果:流产率作为主要结果,其定义为妊娠28周之前的妊娠丢失[1]。临床妊娠率和活产率作为次要结果,把移植后30 d、超声下探及胎心作为临床妊娠的标准。把满28周之后活产胎儿定义为活产[1]。所有患者均通过电话随访完成。
5.统计学处理:统计结果采用IBM SPSS 23.0统计软件进行分析。根据病例组和对照组统计基础信息,如身高、BMI、不孕原因和不孕年限,基础FSH、LH、E2、PRL、P、T、基础双侧窦卵泡数、 IVF用药方案采用配对t检验;对于病例组内嵌合<10%和嵌合>10%的各项指标比较,采用独立样本t检验。对于变量不符合正态分布的数据,如不孕年限、获卵总数、LH、E2、PRL,采用中位数(四分位间距)[M(P25,P75)]表示,用Mann Whitney U检验进行组间比较。对于周期取消移植率、流产率、持续妊娠率等指标,采用皮尔森和爱费社精确卡方检验。P<0.05为差异有统计学意义。
结果
病例组共计83例,其中嵌合比例<10%组有71例(85.5%),嵌合比例>10%组有12例(14.5%)。从嵌合类型上看,45,X/46,XX和45,X/47,XXX/46,XX分别为38例(各占45.8%),其余类型共占8.2%,见表1。
表1 83例不同X染色体嵌合组成的比例

核型例(%)45,X/46,XX38(45.8)45,X/47,XXX/46,XX38(45.8)47,XXX/46,XX2(2.4)45,X/48,XXXX/49,XXXXX/46,XX1(1.2)45,X/47,XXX/48,XXXX/46,XX3(3.6)45,X/51,XXXXXXX/46,XX1(1.2)
对病例组与对照组的基本信息进行比较,年龄、不孕年限、基础FSH、LH、E2、PRL、P、T、基础双侧窦卵泡总数,用药方案、周期取消率、获卵总数组间差异均没有统计学意义。而两组间,即X染色体嵌合比例<10%和嵌合比例>10%的嵌合组,BMI差异有统计学意义。见表2。
表2 不同嵌合比例病例组与对照组的基础信息比较

组别例数年龄(岁)不孕年限[M(P25,P75),年]BMI(kg/m2)原发不孕[例(%)]男性因素[例(%)]输卵管因素[例(%)]PCOS[例(%)]嵌合<10% 嵌合组7136.3±5.45.0(1,17)22.4±2.739(54.9)22(31.0)21(29.6)5(7.0) 对照组14236.3±5.44.0(1,18)22.1±2.762(43.7)60(42.3)63(44.4)7(4.9)嵌合>10% 嵌合组1238.3±4.93.5(1,21) 24.7±3.3∗7(58.3)3(25.0)3(25.0)2(16.7) 对照组2438.3±4.93.0(1,15)22.6±3.3 8(33.3)10(41.7)8(33.3)1(4.2)
表2(续)
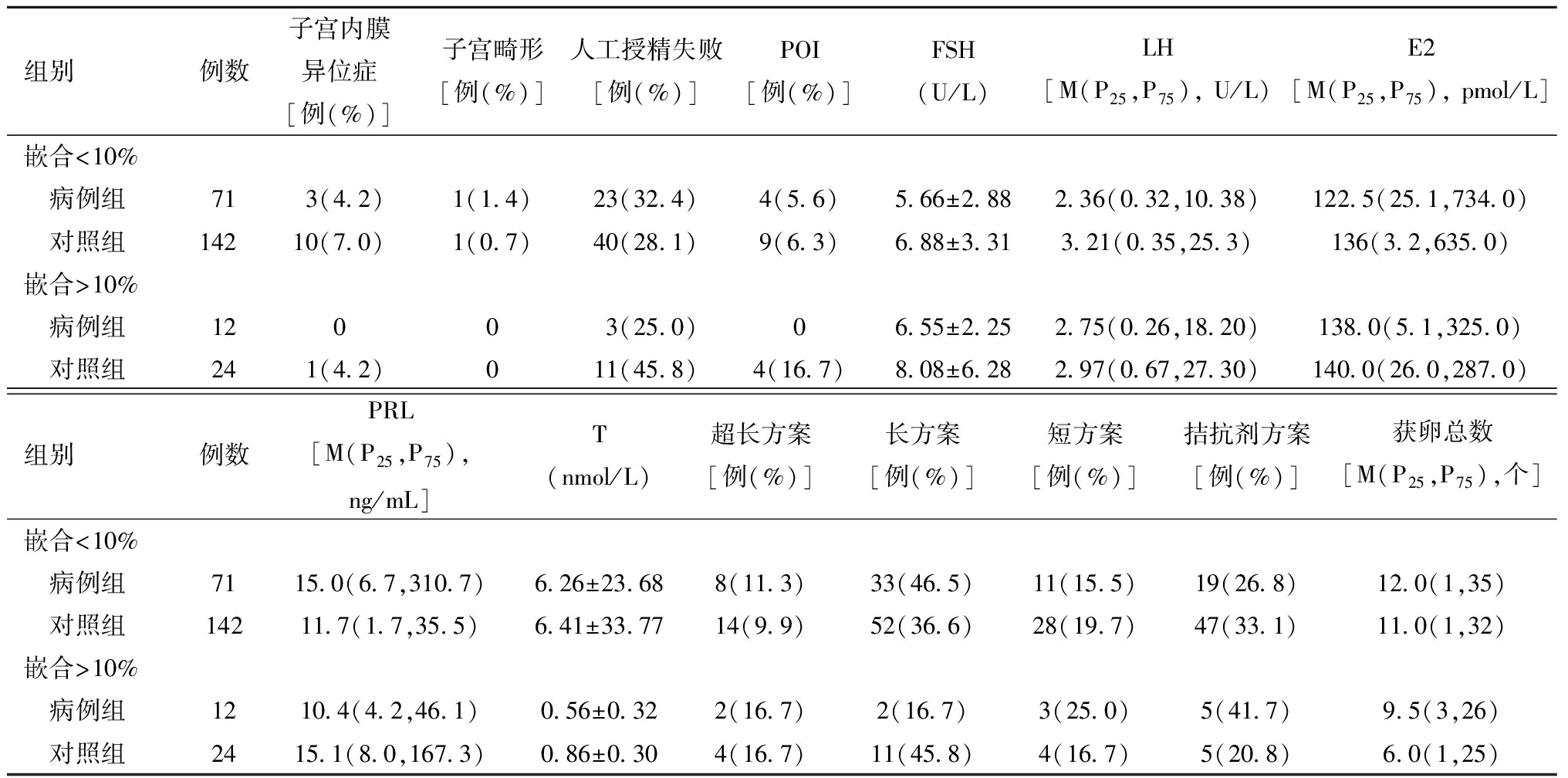
组别例数子宫内膜异位症[例(%)]子宫畸形[例(%)]人工授精失败[例(%)]POI[例(%)]FSH(U/L)LH[M(P25,P75), U/L)E2[M(P25,P75), pmol/L]嵌合<10% 病例组713(4.2)1(1.4)23(32.4)4(5.6)5.66±2.882.36(0.32,10.38)122.5(25.1,734.0) 对照组14210(7.0)1(0.7)40(28.1)9(6.3)6.88±3.313.21(0.35,25.3)136(3.2,635.0)嵌合>10% 病例组12003(25.0)06.55±2.25 2.75(0.26,18.20)138.0(5.1,325.0) 对照组241(4.2)011(45.8)4(16.7)8.08±6.282.97(0.67,27.30)140.0(26.0,287.0)组别例数PRL[M(P25,P75),ng/mL]T(nmol/L)超长方案[例(%)]长方案[例(%)]短方案[例(%)]拮抗剂方案[例(%)]获卵总数[M(P25,P75),个]嵌合<10% 病例组7115.0(6.7,310.7)6.26±23.688(11.3)33(46.5)11(15.5)19(26.8)12.0(1,35) 对照组14211.7(1.7,35.5)6.41±33.7714(9.9)52(36.6)28(19.7)47(33.1)11.0(1,32)嵌合>10% 病例组1210.4(4.2,46.1)0.56±0.322(16.7)2(16.7)3(25.0)5(41.7)9.5(3,26) 对照组2415.1(8.0,167.3) 0.86±0.304(16.7)11(45.8)4(16.7)5(20.8)6.0(1,25)
与嵌合比例<10%嵌合组比较,*P<0.05
从妊娠结局的情况来看,在嵌合比例<10%的组中,嵌合组和对照组的临床妊娠率差异没有统计学意义,而流产率、活婴分娩率组间差异均有统计学意义。见表3。
表3 不同嵌合比例病例组与对照组妊娠结局比较[例(%)]
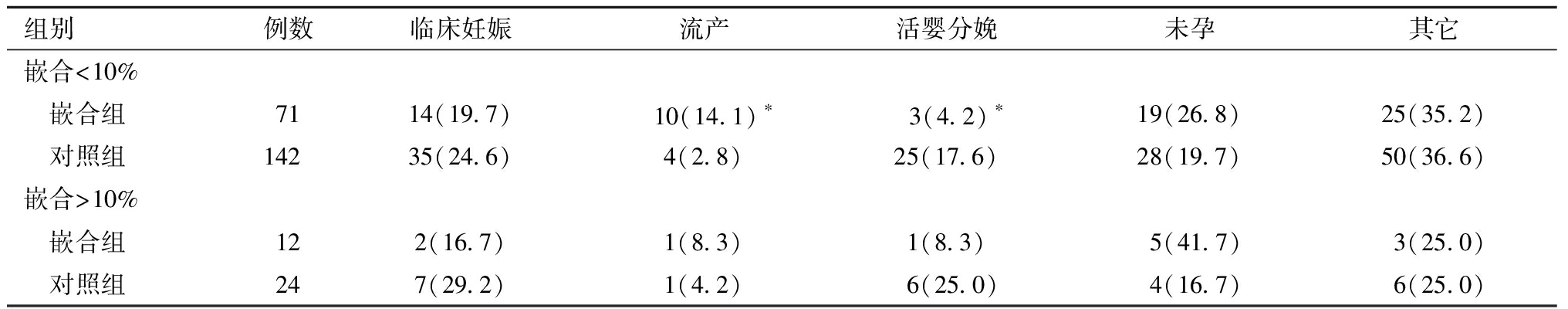
组别例数临床妊娠流产活婴分娩未孕其它嵌合<10% 嵌合组7114(19.7) 10(14.1)∗ 3(4.2)∗19(26.8)25(35.2) 对照组14235(24.6)4(2.8)25(17.6)28(19.7)50(36.6)嵌合>10% 嵌合组122(16.7)1(8.3)1(8.3)5(41.7)3(25.0) 对照组247(29.2)1(4.2)6(25.0)4(16.7)6(25.0)
与嵌合比例<10%嵌合组比较,*P<0.05
83例X染色体非整倍体嵌合患者中有10例患者选择植入前遗传学诊断(preimplantation genetic diagnosis, PGD),检测囊胚50枚,其中非整倍体胚胎数为34枚(68.0%)。
讨论
本研究采用回顾性临床随机对照方法,目的在于通过不同比例的X染色体嵌合与正常对照组之间的参数比较,探讨低比例X染色嵌合是否对生育产生影响,以便为医生的临床遗传咨询提供有力的理论依据。
以往的研究显示,在不孕症人群中,低比例X嵌合女性发生率约为2.77%~16.00%[8],发病率差异巨大的原因是由于样本的选择标准及方法不同造成的,如计数细胞数量、非整倍体细胞最小数量被认为是有意义的标准不同。女性中存在性染色体低比例嵌合现象被很多文献报道,原因尚不清楚。有学者认为,高龄女性是低比例性染色体嵌合的主要因素[11-12]。本组研究对象的平均年龄为(35.1±4.3)岁,属于高龄,也支持这一结论。
染色体异常大都来源于母亲减数分裂期的错误。几个研究小组对家族内自然流产和活产的三体活产婴儿的研究表明,这些异常主要发生在母亲的减数分裂1期[13-15]。研究还表明,高龄导致普通的三体比率的增加,是由于减数分裂重组下降、导致永久性的二价体不分离和染色体的不分离。可能与高龄女性的纺锤体功能下降,粘连蛋白功能下降、增加了的染色体分离错误相关。
Bakalov等[16]研究了性染色体嵌合与体重指数(BMI)之间的关系,发现8%以上的嵌合型45,X/46,XX的BMI与同龄正常核型的女性有显著性差异。这一点可以用Bakalov等的研究结论解释[17],即X染色体上存在胰岛素B细胞基因位点,而X染色体的单倍剂量不足使得胰岛素B细胞比例减少。而这个假设由于研究例数的限制,无法得到进一步的证实,在本研究中,嵌合比例>10%的一组中BMI组间差异有统计学意义,但也不排除是随机的变异。事实上身高与BMI成负相关,小的身高的变化在平方之后都会对BMI产生较大的影响[18],扩大样本例数的前瞻性研究,才能进一步得到验证。
本研究的数据显示,嵌合病例组流产率(71.4%)远高于正常对照组(11.4%),而分娩率远远低于对照组。分析其原因,嵌合核型的女性由于自身染色体分离容易造成错误,导致其受精卵在分裂过程中更加容易出错,造成不平衡配子,导致较高的流产率。众所周知,X染色体在体细胞中是随机失活的,但是2条X染色体对于女性的卵母细胞生成正常配子的发育是十分重要的,而且几个关于卵巢功能相关的基因位于X染色体上[19]。为了平衡男性和女性的遗传物质的剂量,女性的1条X染色体在胚胎早期的原肠胚阶段失活[20]。在配子形成过程中,失活的X染色体在减数分裂时会恢复活性,因此,女性的X染色体嵌合会增加染色体不稳定的风险和非整倍体配子的几率[21]。
Kuo等[22]的研究认为X染色体嵌合的女性由于卵巢处于发育中的次优状态,因此容易导致胚胎致死。根据Burgoyne等[23]研究认为,带有嵌合型细胞的配子在减数分裂,染色体配对过程中45,X和47,XXX的核型导致配子过早凋亡,卵子的质量会受到不足的或过多的X染色体剂量的基因产物的影响,X染色体嵌合是一种染色体不分离基因调控受损的表现,主要的伤害在减数或有丝分裂过程中导致性腺的损伤,包括异常的减数分裂和卵母细胞的凋亡。X染色体嵌合型的女性会导致卵巢早衰或复发性流产[22]。
近些年,随着植入前遗传学检测(preimplantation genetic testing,PGT)技术的成熟与应用,这类患者希望通过PGT技术,降低流产率。本研究中的83例X染色体非整倍体嵌合患者中有10例患者选择植入前遗传学诊断(preimplantation genetic diagnosis,PGD),共检测囊胚50枚,其中非整倍体胚胎数为34枚(68.0%)。而Capalbo等[24]对213例常规IVF患者的956枚胚胎的PGD检测结果,其非整倍体胚胎数为531枚(55.5%)。虽然本研究的例数少,但嵌合体患者中,胚胎非整倍体率有增高趋势,进而增加了流产风险。目前,国内外文献中对PGD用于低比例嵌合的研究尚不多见,因此性染色体低比例嵌合希望通过PGD方法降低流产率,仍需进一步验证,这也是本研究的局限性。
虽然外周血染色体核型分析只能代表个体中胚层的情况,并不能代表其生殖细胞的染色体情况,而在嵌合型的核型中,异常细胞的比例决定个体的表型。但女性生殖腺细胞采集较为困难,染色体核型分析仍然是一种有效的技术。
1 谢幸,孔北华,段涛,主编.妇产科学.第9版.北京:人民卫生出版社,2019:361.
2 Sonntag B,Meschede D,Ullmann V,et al.Low-level sex chromosome mosaicism in female partners of couples undergoing ICSI therapy does not significantly affect treatment outcome.Hum Reprod,2001,16:1648-1652.
3 Meschede D,Lemcke B,Exeler JR,et al.Chromosome abnormalities in 447 couples undergoing intracytoplasmic sperm injection-prevalence,types,sex distribution and reproductive relevance.Hum Reprod,1998,13:576-582.
4 Morel F,Gallon F,Amice V,et al.Sex chromosome mosaicism in couples undergoing intracytoplasmic sperm injection.Hum Reprod,2002,17:2552-2555.
5 Otter M,Schrander-Stumpel CT,Curfs LM.Triple X syndrome:a review of the literature.Eur J Hum Genet,2010,18:265-271.
6 Peschka B,Leygraaf J,Van der Ven K,et al.Type and frequency of chromosome aberrations in 781 couples undergoing intracytoplasmic sperm injection.Hum Reprod,1999,14:2257-2263.
7 Gekas J,Thepot F,Turleau C,et al.Chromosomal factors of infertility in candidate couples for ICSI:an equal risk of constitutional aberrations in women and men.Hum Reprod,2001,16:82-90.
8 Zachaki S,Kouvidi E,Pantou A,et al.Low-level X Chromosome Mosaicism:A Common Finding in Women Undergoing IVF.In Vivo,2020,34:1433-1437.
9 Guttenbach M,Koschorz B,Bernthaler U,et al.Sex chromosome loss and aging:in situ hybridization studies on human interphase nuclei.Am J Hum Genet,1995,57:1143-1150.
10 Eds Shaffer LG &Tommerup N.ISCN.An International System for Human Cytogenetic Nomenclature.Basel Switzerland:S.Karger,2005.
11 Nowinski GP,Van Dyke DL,Tilley BC,et al.The frequency of aneuploidy in cultured lymphocytes is correlated with age and gender but not with reproductive history.Am J Hum Genet,1990,46:1101-1111.
12 Guttenbach M,Koschorz B,Bernthaler U,et al.Sex chromosome loss and aging:in situ hybridization studies on human interphase nuclei.Am J Hum Genet,1995,57:1143-1150.
13 Hassold T,Merrill M,Adkins K,et al.Recombination and maternal age-dependent nondisjunction:molecular studies of trisomy 16.Am J Hum Genet,1995,57:867-874.
14 Sherman SL,Petersen MB,Freeman SB,et al.Non-disjunction of chromosome 21 in maternal meiosis I:evidence for a maternal age-dependent mechanism involving reduced recombination.Hum Mol Genet,1994,3:1529-1535.
15 Petersen MB,Mikkelsen M.Nondisjunction in trisomy 21:origin and mechanisms.Cytogenet Cell Genet,2000,91:199-203.
16 Gersak K,Veble A.Low-level X chromosome mosaicism in women with sporadic premature ovarian failure.Reprod Biomed Online,2011,22:399-403.
17 Bakalov VK,Cooley MM,Quon MJ,et al.Impaired insulin secretion in the Turner metabolic syndrome.J Clin Endocrinol Metab,2004,89:3516-3520.
18 Homer L,Le Martelot MT,Morel F,et al.45,X/46,XX mosaicism below 30% of aneuploidy:clinical implications in adult women from a reproductive medicine unit.Eur J Endocrinol,2010,162:617-623.
19 Gersak K,Veble A.Low-level X chromosome mosaicism in women with sporadic premature ovarian failure.Reprod Biomed Online,2011,22:399-403.
20 LYON MF.Gene action in the X-chromosome of the mouse (Mus musculus L.).Nature,1961,190:372-373.
21 Cimadomo D,Fabozzi G,Vaiarelli A,et al.Impact of Maternal Age on Oocyte and Embryo Competence.Front Endocrinol (Lausanne),2018,9:327.
22 Kuo PL,Guo HR.Mechanism of recurrent spontaneous abortions in women with mosaicism of X-chromosome aneuploidies.Fertil Steril,2004,82:1594-1601.
23 Burgoyne PS,Baker TG.Meiotic pairing and gametogenic failure.Symp Soc Exp Biol,1984,38:349-362.
24 Capalbo A,Rienzi L,Cimadomo D,et al.Correlation between standard blastocyst morphology,euploidy and implantation:an observational study in two centers involving 956 screened blastocysts.Hum Reprod,2014,29:1173-1181.