子宫内膜异位症(endometriosis,EMs),简称内异症,是指具有活性的子宫内膜组织(间质和腺体)出现在子宫腔被覆内膜及宫体肌层以外的部位[1],是临床中引起女性盆腔疼痛和不孕的原因之一,严重影响患者的健康和生活质量[2]。EMs在育龄期女性的发病率约为5%~10%,在低生育力的女性中,其发病率增加到20%~30%,此外该病在患有疼痛和不孕症的女性中,其发病率增加到40%~60%[3]。迄今为止,该病具体的发病机制尚不清楚[4],其诊断仍然仅靠腹腔镜检查实现。因此,探索用于EMs早期诊断的无创生物标志物有助于本病的早期发现和早期治疗[5],探索本病的基因相关的研究有助于进一步明确其发病机制[6]。
郎景和院士[7]提出,异位的内膜在盆腹腔能够成为病变,必须经过黏附、侵袭和血管形成的“三部曲”即“3A”模式,得以达到“生根、生长、生病”。这其中,在位内膜的分子生物学特点起到重要作用,其他的激素、免疫等因素只是影响内膜命运或者是否能在异地容受的附加条件。因此,在位内膜是决定因素。基于这一理论,本研究采用RNA-seq对EMs患者在位内膜及其异位内膜组织与非EMs患者在位内膜组织转录组基因进行分析,探索与EMs发生相关的关键基因及信号通路,有助于进一步明确EMs的发病机制,寻找新的治疗靶点,进而为EMs的治疗提供参考依据。
资料与方法
1.一般资料:本研究纳入北京中医药大学第三附属医院2021年8月—2023年2月的18例患者,其中9例为腹腔镜下明确诊断为卵巢EMs的患者作为EMs组,9例为腹腔镜下诊断为除EMs外的其他良性肿瘤的非EMs患者作为对照组。EMs入组标准为年龄18~49岁,符合EMs临床诊断标准及病理诊断标准,即(1)凡育龄期妇女有痛经进行性加剧或伴不孕史、妇科检查可触及盆腔内有固定性包块或痛性结节者;(2)实验室检查卵巢癌相关抗原(CA125)值测定或抗子宫内膜抗体(EMAb)血清水平含量高于正常值;(3)腹腔镜、B型超声检查、磁共振成像或子宫输卵管碘油造影证实异位病灶的存在[8]。对照组入组标准为因良性原因接受子宫内膜活检或子宫切除术的非EMs患者。排除标准为(1)3个月内接受激素治疗;(2)月经周期不规律或使用宫内节育器;(3)患有妇科其他恶性肿瘤[宫颈上皮内瘤变(CIN)等患者] 。本研究经北京中医药大学第三附属医院伦理委员会批准,伦理批准号为(BZYSY-2021KYKTPJ-12),并获得患者知情同意。
2.样本采集与预处理:选取EMs组9例及对照组9例患者,获取EMs组在位内膜及其异位内膜组织和对照组的在位子宫内膜组织,放入RNA组织保存液(北京翱擎生物科技有限公司,货号:AQ575)中充分渗透后,置于液氮中迅速冷冻,以备后续RNA-seq检测。
3.总RNA提取及RNA测序:提取EMs组在位内膜及其异位内膜组织、对照组在位内膜组织总RNA,根据制造商的说明书,使用TRIzol©试剂从组织中提取总RNA,使用DNA酶I(TaKara)去除基因组DNA。然后使用2100生物分析仪(安捷伦)测定RNA质量,并使用ND-2000(NanoDrop技术),获得高质量RNA样品(OD260/280=1.8~2.0,OD260/230≥2.0,RIN≥6.5,28S:18S≥1.0,>10 μg),构建测序文库。
对所提取的RNA完成质量检测,质量检测合格后进行下一步的RNA富集及cDNA合成,完成文库制备,见图1。文库检测合格后,上机进行测序,测序由上海凌恩生物科技有限公司完成。
图1 文库制备流程
4.测序数据分析:
(1)数据筛选。原始下机数据经过过滤及质量控制后得到Clean Reads,然后通过软件 Hisat2(网址http://ccb.jhu.edu/software/hisat2/faq.shtml)比对至人类参考基因组(版本:GRCh38.p13),且需满足对比到人类参考基因组的唯一比对率均超过90%的标准。
(2)DEGs筛选。通过三种R软件包(DESeq2、edgeR、limma)进行基因表达差异分析,并将FDR值≤0.05且|log2(Fold Change,FC)|≥1作为DEGs的筛选条件。最终将三种R包同时筛选出的DEGs用于后续分析,并使用R包ggplot2将最终筛选的DEGs绘制成可视化火山图。
(3)功能及通路富集分析。本分析使用软件GOatools(https://github.com/tanghaibao/GOatools)进行富集分析,使用方法为Fisher精确检验。为控制计算的假阳性率使用FDR多重检验方法对P值进行了校正,通常情况下,当P值≤0.05时,认为此GO功能存在显著富集情况。
对于KEGG通路富集分析使用KOBAS(http://kobas.cbi.pku.edu.cn/kobas3/?t=1)进行KEGGPATHWAY富集分析,计算原理同GO功能富集分析,使用Fisher精确检验进行计算。为控制计算假阳性率,采用BH(FDR)方法进行多重检验,计算公式同上,P值以0.05为阈值,满足此条件的KEGG通路定义为在差异表达基因中显著富集的KEGG通路。
(4)蛋白相互作用(protein-protein interaction,PPI)网络分析。将DEGs比对到STRING蛋白质相互作用数据库,通过STRING数据库(https://cn.string-db.org/)预测DEGs的蛋白相互作用关系,在Cytoscape中可视化PPI网络,利用MCODE插件对整个PPI网络进行聚类分析,筛选出差异显著的核心模块。
结果
1.两组患者临床特征比较:两组患者年龄、身高、体重、BMI水平比较,差异均无统计学意义。见表1。两组患者均行腹腔镜手术治疗,其病理结果如下,见表2。
表1 两组患者临床特征比较

组别 例数年龄(岁)身高(m)体重(kg)BMI(kg/m2)对照组934.11±8.771.64±0.0459.33±7.0522.15±3.02EMs组933.00±6.891.61±0.0354.44±5.4621.08±1.82
表2 两组患者的病理结果

样本代码病理结果EMs组 EZ-1/EY-1子宫腺肌瘤、右卵巢囊肿(符合子宫内膜异位囊肿) EZ-2/EY-2(双侧卵巢囊肿)符合双侧子宫内膜异位囊肿 EZ-3/EY-3(左、右侧卵巢)病变符合子宫内膜异位囊肿 EZ-4/EY-4右卵巢子宫内膜异位囊肿 EZ-5/EY-5右卵巢子宫内膜异位囊肿 EZ-6/EY-6(左、右侧卵巢)病变符合子宫内膜异位囊肿 EZ-7/EY-7右卵巢子宫内膜异位囊肿 EZ-8/EY-8左卵巢子宫内膜异位囊肿 EZ-9/EY-9左卵巢子宫内膜异位囊肿伴、右侧输卵管积水对照组 C1左侧卵巢冠囊肿、双侧输卵管系膜囊肿 C2子宫肌瘤(平滑肌瘤) C3子宫肌瘤(平滑肌瘤) C4卵巢浆液性囊腺瘤 C5子宫肌瘤(平滑肌瘤) C6子宫肌瘤(平滑肌瘤) C7子宫肌瘤(平滑肌瘤) C8子宫肌瘤(平滑肌瘤) C9子宫肌瘤(平滑肌瘤)
EY指异位内膜,EZ指在位内膜,C指对照内膜
2.相关性分析及差异表达基因的筛选:三组数据的主成分分析(principal component analysis,PCA)结果如图2所示,EMs组和对照组在转录水平能得到很好的线性分离。以|log2(FC)|≥1和FDR≤0.05为筛选标准,异位内膜与在位内膜相比,共获得3 191个差异基因;与在位内膜相比,异位内膜组织中上调表达基因1 486个,下调表达基因1 705个。在位内膜与对照内膜相比,共获得1 126个差异基因;与对照内膜相比,在位内膜组织中上调表达基因603个,下调表达基因523个。异位内膜与对照内膜相比,共获得3 204个差异基因;与对照内膜相比,在位内膜组织中上调表达基因1 586个,下调表达基因1 618个。由此构建部分差异基因表达火山图,如图3所示。
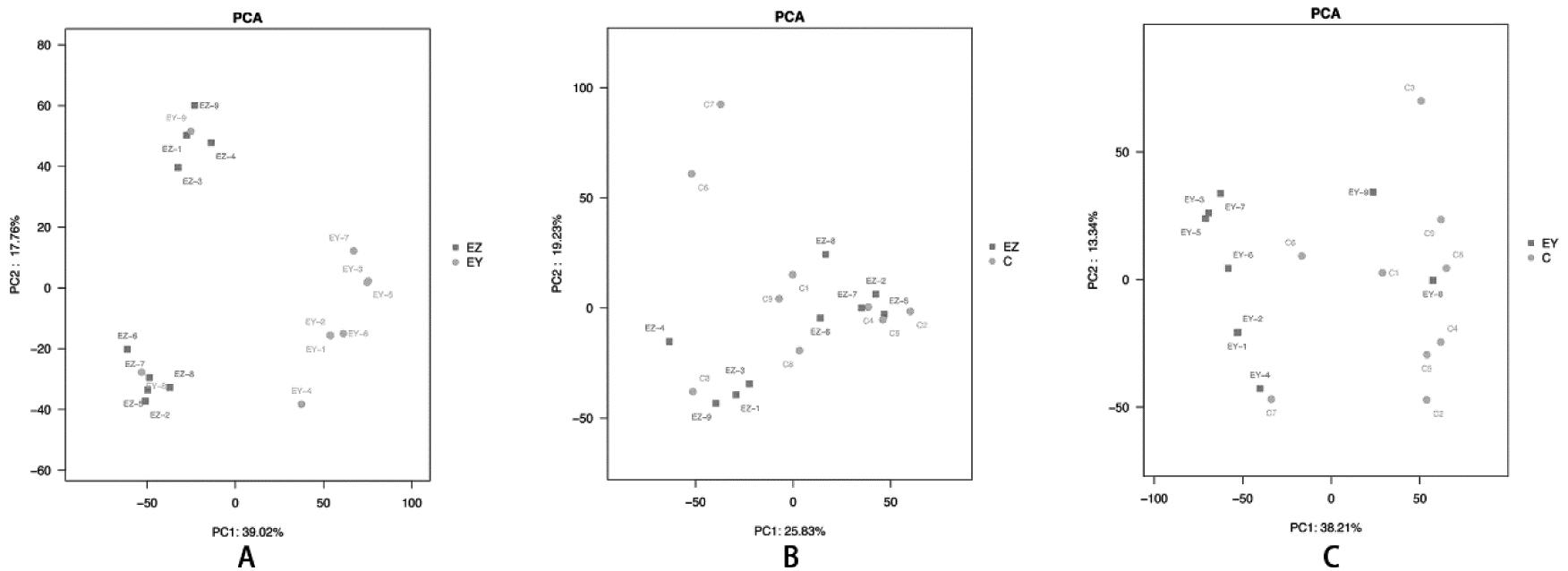
A表示异位内膜与在位内膜对比;B表示在位内膜与对照内膜对比;C表示异位内膜与对照内膜对比。图中每一个点代表一个样本,样本在空间中所处的位置由其中所含有的基因的表达差异决定。EY指异位内膜,EZ指在位内膜,C指对照内膜
图2 子宫内膜组织RNA测序数据主成分分析
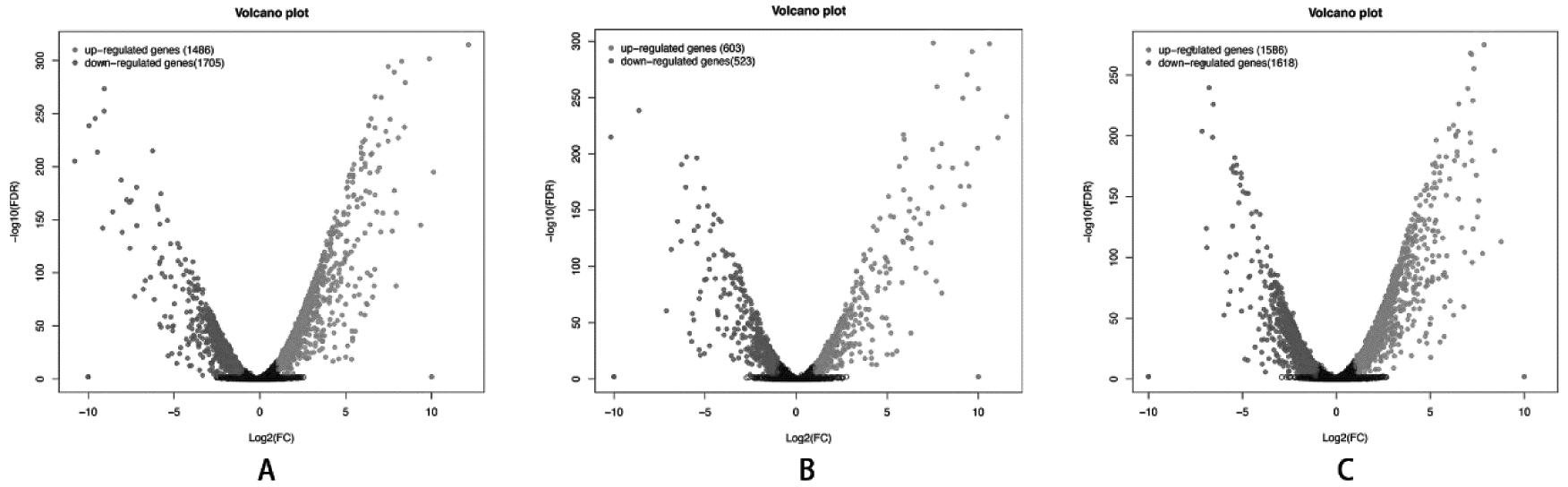
A表示异位内膜与在位内膜对比;B表示在位内膜与对照内膜对比;C表示异位内膜与对照内膜对比。横坐标为基因或转录本在两个样本间表达差异的倍数变化值,纵坐标为基因或转录本表达量变化差异的统计学检验值,即P值,P值越高则表达差异越显著。图中每个点代表一个特定的基因或转录本,以横坐标中“0”所在的位置为中心,右侧点表示显著上调的基因,左侧点表示显著下调的基因,中间点为非显著差异基因
图3 差异表达基因的火山图
结果显示,异位内膜与在位内膜相比,NR5A1(nuclear receptor subfamily 5 group A member 1)显著上调(P<0.05),SPRR3(small proline rich protein 3)显著下调(P<0.05)。在位内膜与对照内膜相比,在在位内膜样本中,SPRR1B(small proline rich protein 1B)基因显著上调(P<0.05),NR5A1基因显著下调(P<0.05)。异位内膜与对照内膜相比,在异位内膜样本中,上调最明显的基因是CHIT1(chitinase 1)(P<0.05),下调最明显的基因是OPRPN(opiorphin prepropeptide)(P<0.05)。将有显著差异的基因进行表达模式聚类分析,可以有效地发现不同基因间表达上的共同点,可以根据表达上的相似性推测基因功能的相似性。见图4。

A表示异位内膜与在位内膜对比;B表示在位内膜与对照内膜对比;C表示异位内膜与对照内膜对比。分析结果中的热图是取P值最小的前100个基因进行绘图展示。其中横坐标为样本,纵坐标为筛选出来的差异表达基因,不同颜色表示不同的基因表达水平,颜色由灰色经由白色至黑色表示表达量从低到高,黑色表示高表达基因,灰色表示低表达基因
图4 表达差异基因聚类图
3.差异表达基因富集分析:异位内膜与在位内膜相比,对3 191个DEGs进行功能注释和通路富集分析,列举了前30个显著的GO条目。GO功能富集显示,DEGs主要参与炎症反应(inflammatory response)、多细胞生物发育的调控(regulation of multicellular organismal development)、对刺激反应的调节(regulation of response to stimulus)、细胞或亚细胞成分的运动(movement of cell or subcellular component)、积极调节生物过程(positive regulation of biological process)、细胞群体增殖的调控(regulation of cell population proliferation)等生物学过程。KEGG通路富集分析显示,DEGs显著富集在肾素分泌(renin secretion)、补体和凝血级联(complement and coagulation cascades)、细胞黏附分子(cell adhesion molecules)、破骨细胞分化(osteoclast differentiation)等与黏附、免疫有关的信号通路。在位内膜与对照内膜相比,对1 126个DEGs进行功能注释和通路富集分析,列举了前30个显著的GO条目。GO功能富集显示,DEGs主要参与多细胞有机体过程(multicellular organismal process)或对外部刺激的反应(response to external stimulus)、防御反应(defense response)、内肽酶活性的负调控(negative regulation of endopeptidase activity)、生物黏附(biological adhesion)等生物学过程。KEGG通路富集分析显示,DEGs显著富集在细胞色素P450对外源性药物的代谢作用(metabolism of xenobiotics by cytochrome P450)、药物代谢-细胞色素P450(drug metabolism-cytochrome P450)、细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction)、化学致癌作用(chemical carcinogenesis)、视黄醇的新陈代谢(retinol metabolism)等与细胞代谢有关的信号通路。异位内膜与对照内膜相比,对3 204个DEGs进行功能注释和通路富集分析,列举了前30个显著的GO条目。GO功能富集显示,DEGs主要参与积极调节生物过程(positive regulation of biological process)、白细胞-细胞黏附的调节(regulation of leukocyte cell-cell adhesion)、多细胞生物发育的调控(regulation of multicellular organismal development)、白细胞活化的调节(regulation of leukocyte activation)、白细胞的迁移(leukocyte migration)、刺激反应(response to stimulus)或炎症反应(inflammatory response)等与炎症反应相关的生物学过程。KEGG通路富集分析显示,DEGs显著富集在造血细胞谱系(hematopoietic cell lineage)、补体和凝血级联(complement and coagulation cascades)、吞噬体(phagosome)、细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction)、细胞黏附分子(cell adhesion molecules)等与黏附、侵袭有关的信号通路。见图5和图6。

A表示异位内膜与在位内膜对比;B表示在位内膜与对照内膜对比;C表示异位内膜与对照内膜对比。横轴表示富集因子,即富集到某个GO term的差异基因个数占测序得到的背景基因个数的比值;纵坐标表示该GO term富集到的功能:圆圈越大代表富集到此功能的差异基因个数相对越多。从上到下的色谱代表未修正的P-value值
图5 差异表达基因GO富集分析
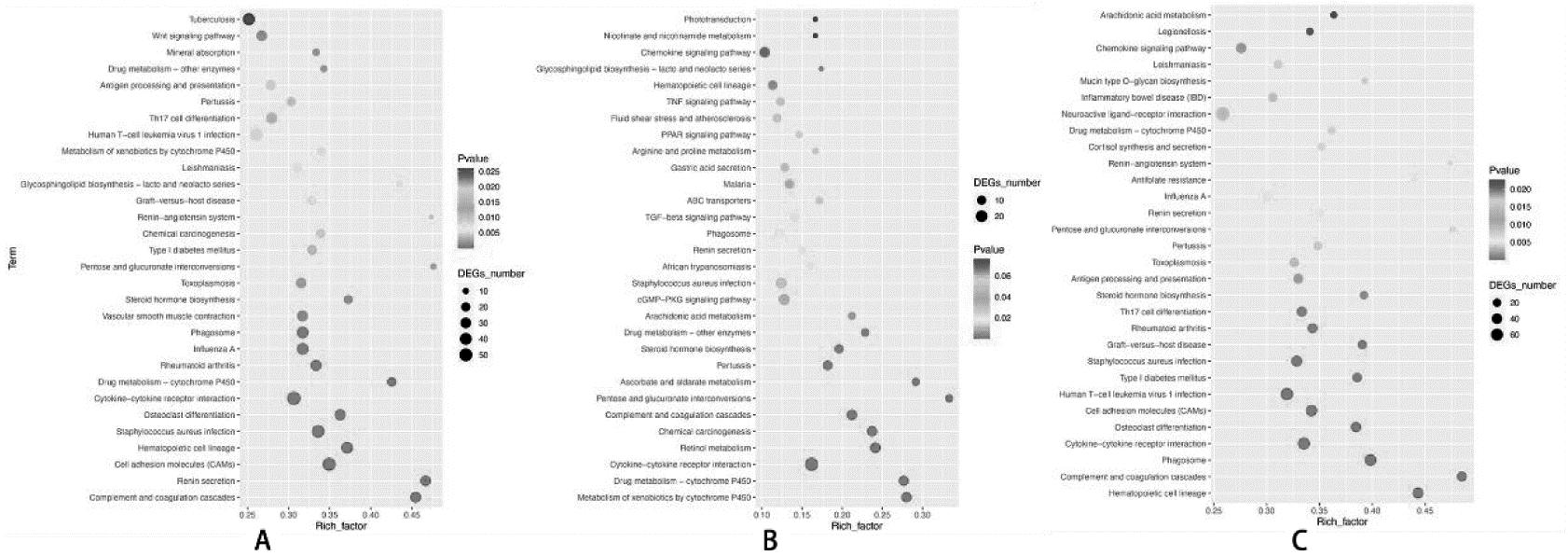
A表示异位内膜与在位内膜对比;B表示在位内膜与对照内膜对比;C表示异位内膜与对照内膜对比。横轴表示富集因子,即富集到某个KEGG通路的差异基因个数占测序得到的背景基因个数的比值;纵坐标表示该KEGG通路富集到的功能:圆圈越大代表富集到此功能的差异基因个数相对越多。从上到下的色谱代表未修正的P-value值
图6 KEGG分析差异表达基因参与的信号通路
4.PPI网络分析:异位内膜与在位内膜对比,其中贡献度排名前30的节点基因有C3、NCAPG、SMC4、NCAPH、SMC2、CCR5、LCK、SERPINE1、PLAU、TREM2、RAD51、ESR1、BRIP1、BARD1、FANCD2、H2AX、HLA-DRA、MET、KLRG1、RAD51AP1、CHEK1、BLM、NGF、NTRK2、BDNF等。在位内膜与对照内膜对比,其中贡献度排名前30的节点基因有C3、NTRK2、NTRK1、IL2RG、IL15、PRF1、LCN2、PPARG、IL1B、ZFPM2、NR0B1、S100A9、NTF3、CCL3、S100A4、NTRK1、HBB、NTF3、ZP3、CD55等。异位内膜与对照内膜对比,其中贡献度排名前30的节点基因有C3、ICAM1、ITGB2、NCAPG、NCAPH、SMC2、CXCR4、CCR5、LCK、SERPINE1、VTN、PLAU、TREM2、RAD51、ESR1、BRIP1、BARD1、FANCD2、H2AX、IGFBP4、IGFBP1、HLA-DRA、TNF、MMP2等。见图7。
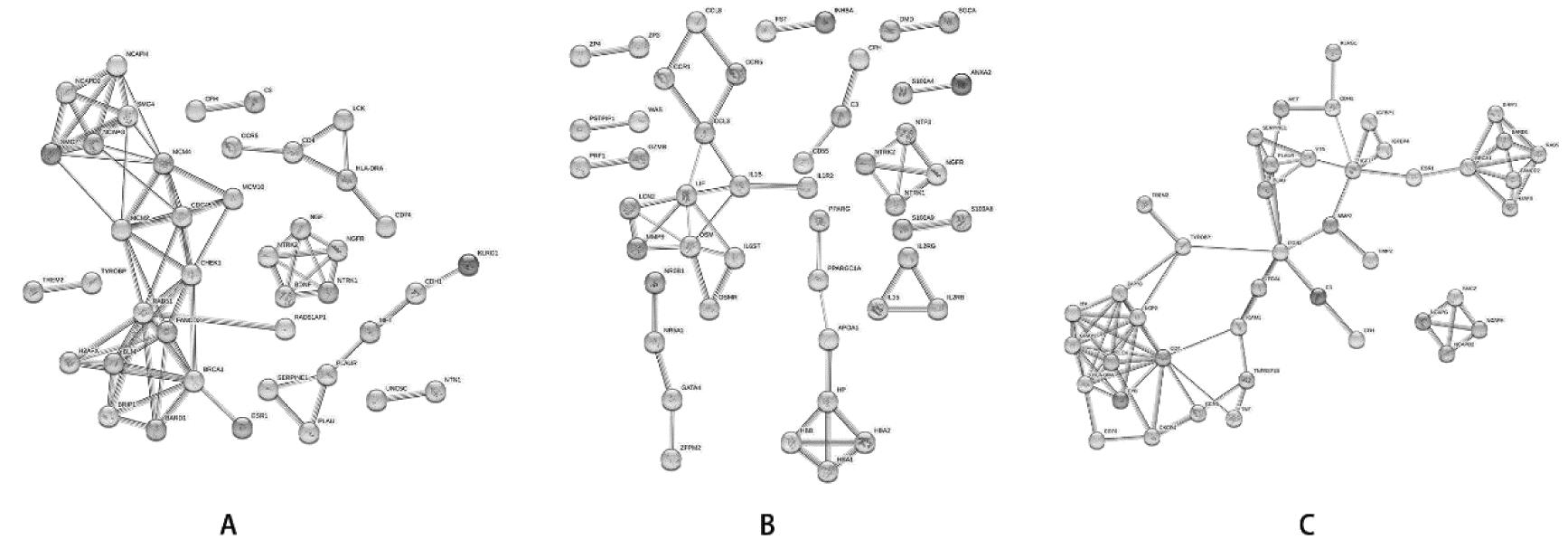
注:A表示异位内膜与在位内膜对比;B表示在位内膜与对照内膜对比;C表示异位内膜与对照内膜对比。圆点代表蛋白质节点,直线代表蛋白质之间相互作用,线段粗细代表相互作用强弱,越粗代表相关性越强
图7 PPI网络分析图
5.实时逆转录聚合酶链反应验证RNA-seq结果:根据相关差异基因筛选结果及文献检索,选取7个差异基因NR5A1、SMC2、C3、ICAM1、ITGB2、NCAPG、NCAPH,以测序用得RNA样本进行cDNA合成,以GAPDH为内参mRNA,通过RT-qPCR对测序结果进行验证,RT-PCR扩增循环方案为95℃预变性5 min,95℃变性10 s,55℃~60℃退火20 s,72℃延伸20 s,40个循环基于参考基因GAPDH的水平标准化靶mRNA表达水平,随后使用2-△△Ct数据分析方法对NR5A1、SMC2、C3、ICAM1、ITGB2、NCAPG、NCAPH mRNA表达进行相对定量分析计算。表3所示的引物序列由北京擎科生物科技股份有限公司(北京,中国)设计。结果显示,与对照内膜相比,异位内膜组织中NR5A1、SMC2、C3、ICAM1、ITGB2、NCAPH mRNA的表达上调,在位内膜组织中NR5A1、SMC2、C3、ICAM1、ITGB2、NCAPG、NCAPH mRNA的表达显著上调。异位内膜组织中有6个差异基因的表达趋势与转录组学结果一致,在位内膜组织中有7个差异基因的表达趋势与转录组学结果一致。具体结果见图8和图9。
表3 引物序列

引物 序列(5′-3′)长度(/bp)NR5A1上游CTACCTCTAGGCCCCAGCA105下游ACTCAGACTTGATGGCACGGSMC2上游TGCAGCCTTGGATCTTTCTCA114下游TGAGTACGCAGCATCATACCTTC3上游CGGAGAAGCGAATTCAGGTG87下游GCCGACTTTGTCCATTCGCTICAM1上游CCCATCGGGGAATCAGTGAC94下游GATCTCGAGTGGTGACCTCCITGB2上游TGTCAAGAAGCTAGGTGGCG154下游CACGGTCTTGTTGGGGCATNCAPG上游GTGTTCTTCCCCGTGTTTGC110下游AAGCATTCAGATGCAGGGGCNCAPH上游ACGATGAACCTGACCACACC117下游CCTTCCAGCTCCTGCCAAGGAPDH上游GTCAAGGCTGAGAACGGGAA158下游AAATGAGCCCCAGCCTTCTC
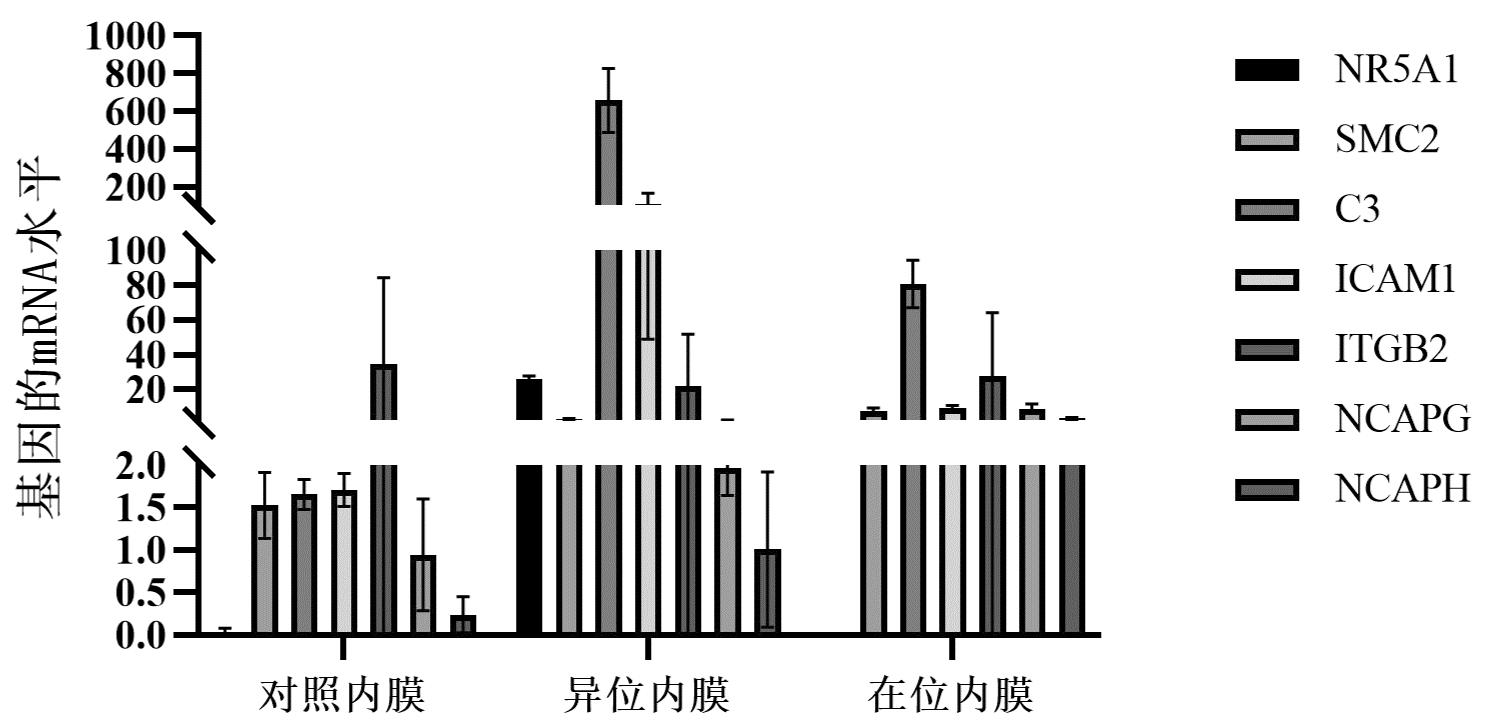
图8 差异基因表达的RNA-seq分析
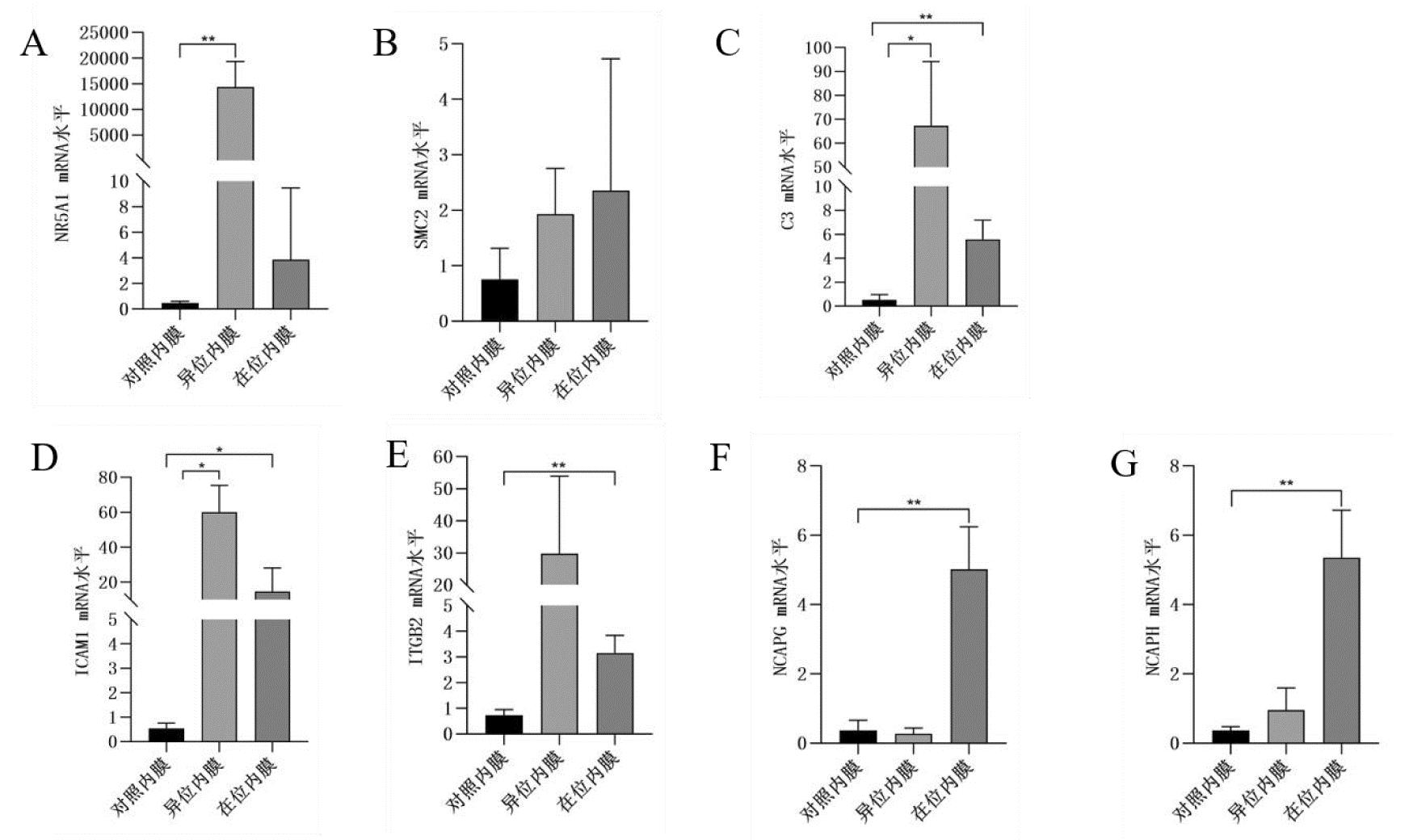
*P<0.05,**P<0.01
图9 差异表达基因的qRT-PCR验证结果
讨论
EMs是当前临床病因复杂且难治的疾病,发病机制复杂。RNA-seq最常见的应用之一是分析差异基因表达[9],相关研究已经报道,在EMs的发展过程中各类基因表达水平存在变化[10-11]。因此,研究EMs患者在位内膜及其异位内膜组织和对照组的在位内膜组织的基因表达差异有助于寻找影响EMs发病的潜在靶点,对EMs的治疗有潜在价值。
本研究对EMs患者的在位内膜及其异位内膜组织、对照组的在位内膜组织进行RNA测序分析,DEGs分析结果发现,EMs患者的异位内膜组织与其在位内膜组织相比,核心DEGs有NR5A1、SPRR3、C3、NCAPG、SMC4、NCAPH、SMC2、CCR5、LCK、SERPINE1、PLAU、TREM2等。NR5A1对于生殖系统的类固醇产生腺体的发育和功能至关重要,其失调与EMs有关[12]。本研究发现,NR5A1在对照内膜、在位内膜、异位内膜组织中的表达依次增多,因此推测,EMs患者内膜的异位种植可能与NR5A1的上调有关。本研究中,内异症患者的在位内膜组织与对照组相比,核心DEGs有SPRR1B、NR5A1、C3、NTRK2、NTRK1、IL2RG、IL15、PRF1、LCN2、PPARG、IL1B、ZFPM2。SPRR1B显著上调,NR5A1显著下调。目前,有研究[13]显示,SPRR1B可作为子宫内膜癌的尿蛋白当中的诊断标志物。结合本研究结果,认为SPRR1B的上调可能与EMs的发生相关。同时,有研究[14]表明,脂钙蛋白2(LCN2)作为一种诱导应激源,可促进上皮间充质转化(EMT),从而参与EMs的发生,结合本研究,考虑LCN2在EMs的发生过程中起到重要作用。另有一项横断面研究报道[15]指出,补体C3具有高特异性和敏感性,可作为EMs患者血清中的早期诊断标志物,在育龄期女性EMs早期诊断中具有重要意义,亦有一项研究也通过RT-qPCR证实了这一理论[16]。此外,本研究发现,内异症患者的异位内膜组织与对照组相比,核心DEGs有C3、ICAM1、ITGB2、NCAPG、NCAPH、SMC2、CXCR4、CCR5、LCK、SERPINE1。CHIT1是一种在巨噬细胞生物学中扮演多种角色的酶,其活性和表达的增加与各种炎症性疾病有关[17]。测序结果显示,CHIT1显著上调,因此认为CHIT1在EMs的发病中可能参与黏附过程。综上所述结果表明,这些基因可能成为参与EMs发生发展的新靶点。
本研究对差异表达基因进行GO富集分析,结果提示,与对照内膜相比,异位内膜和在位内膜的DEGs主要富集在黏附、炎症反应、积极调节生物过程、多细胞生物发育的调控、白细胞活化的调节等生物学过程。诸多研究[18-19]表明,EMs是一种慢性炎症性疾病,EMs患者的异位病变和腹腔液中含有许多炎症细胞、细胞因子和趋化因子,形成炎症微环境。KEGG通路富集分析显示,DEGs显著富集在细胞色素P450对外源性药物的代谢作用、细胞因子-细胞因子受体相互作用、视黄醇的新陈代谢、补体和凝血级联、吞噬体、细胞因子-细胞因子受体相互作用等与细胞代谢有关的信号通路。有研究报道[20-21],细胞色素P450即CYP1A1,CYP1A1是负责参与异生素 I 期解毒的酶的基因,该基因位于15q22-24,编码一种同工酶,可催化酚类化合物和环氧化物中存在的多环芳烃的氧化,其多态性与子宫内膜异位症密切相关。2021年一项多组学分析研究显示,补体系统与凝血级联反应的相互作用可能在EMs的病理生理学中发挥作用[22],与本研究结果一致。
综上所述,本研究不仅对EMs患者自身的异位内膜和在位内膜进行了差异基因的筛选,同时还结合“在位内膜决定论”,纳入了非EMs患者的内膜组织,进行差异基因筛选和功能富集分析,筛选出潜在的与EMs发病相关的关键基因及主要信号通路。NR5A1、SMC2、C3、ICAM1、ITGB2、NCAPG、NCAPH等基因及关键通路主要涉及抑制细胞代谢、促进炎症反应等过程,它们可能使得EMs患者的免疫状态及微环境状态被破坏,这些发现可能在EMs发病、防控等方面具有进一步的研发意义。但是本研究选用非EMs良性肿瘤患者的在位内膜组织作为对照组,纳入群体广泛性不足,由于伦理及实施的局限性,没有纳入健康女性。同时由于本研究所收临床样本较少,且未进行相关体内外实验验证,后续可进一步结合体内外实验验证,为EMs的分子机制研究提供新的理论依据和潜在的治疗靶点。
(图4~图6见封三)
1 杜慧兰.中西医结合妇产科学.北京:中国中医药出版社,2021:143.
2 Xie Z,Ding X,Wang Y,et al.The rs2275913 polymorphism of the interleukin-17A gene is associated with the risk of ovarian endometriosis.J Obstet Gynaecol,2023,43:2199852.
3 Arosh JA,Sivakumar KK,Lee J,et al.Effects of selective inhibition of prostaglandin E2 receptors EP2 and EP4 on the miRNA profile in endometriosis.Mol Cell Endocrinol,2022,558:111728.
4 Kirmizi DA,Baser E,Okan A,et al.Receptivity,autophagy,and implantation in endometriosis; does antioxidant work? An experimental study.J Food Biochem,2022,46:e14276.
5 Chen CC,Chou YC,Hsu CY,et al.Transcriptome Profiling of Eutopic and Ectopic Endometrial Stromal Cells in Women with Endometriosis Based on High-Throughput Sequencing.Biomedicines,2022,10:2432.
6 田鑫.基于RNA-seq技术的子宫内膜异位症转录组学分析.江苏大学,2018:5.
7 郎景和.对子宫内膜异位症认识的历史、现状与发展.中国实用妇科与产科杂志,2020,36:193-196.
8 中华医学会妇产科学分会子宫内膜异位症协作组.子宫内膜异位症的诊治指南.中华妇产科杂志,2015,50:161-169.
9 Zubovic L,Piazza S,Tebaldi T,et al.The altered transcriptome of pediatric myelodysplastic syndrome revealed by RNA sequencing.J Hematol Oncol,2020,13:135.
10 Zhao L,Gu C,Ye M,et al.Identification of global transcriptome abnormalities and potential biomarkers in eutopic endometria of women with endometriosis:A preliminary study.Biomed Rep,2017,6:654-662.
11 殷米诺.转录组数据驱动的卵巢子宫内膜异位症靶点识别和药物筛选及实验验证.华中科技大学,2021:6.
12 Cattenoz PB,Delaporte C,Bazzi W,et al.An evolutionary conserved interaction between the Gcm transcription factor and the SF1 nuclear receptor in the female reproductive system.Sci Rep,2016,6:37792.
13 Njoku K,Pierce A,Geary B,et al.Quantitative SWATH-based proteomic profiling of urine for the identification of endometrial cancer biomarkers in symptomatic women.Br J Cancer,2023,128:1723-1732.
14 Liao CJ,Li PT,Lee YC,et al.Lipocalin 2 induces the epithelial-mesenchymal transition in stressed endometrial epithelial cells:possible correlation with endometriosis development in a mouse model.Reproduction,2014,147:179-187.
15 Malik F,Hanif MM,Mustafa G.Combination of Oral Tranexamic Acid with Topical 3% Tranexamic Acid versus Oral Tranexamic Acid with Topical 20% Azelaic Acid in the Treatment of Melasma.J Coll Physicians Surg Pak,2019,29:502-504.
16 He Y,Li J,Qu Y,et al.Identification and Analysis of Potential Immune-Related Biomarkers in Endometriosis.J Immunol Res,2023,2023:2975581.
17 Sklepkiewicz P,Dymek B,Mlacki M,et al.Inhibition of Macrophage-Specific CHIT1 as an Approach to Treat Airway Remodeling in Severe Asthma.Int J Mol Sci,2023,24:4719.
18 Song SY,Jung YW,Shin W,et al.Endometriosis-Related Chronic Pelvic Pain.Biomedicines,2023,11:2868.
19 Foidart JM,Gemzell-Danielsson K,Kubba A,et al.The benefits of estetrol addition to drospirenone for contraception.AJOG Glob Rep,2023,3:100266.
20 Barbosa AM,de Souza SR,Frare AB,et al.Association of CYP1A1(cytochrome P450) MspI polymorphism in women with endometriosis.Genet Mol Res,2016,15.
21 Ivashchenko TE,NIu S,Kramareva NA,et al.[Analysis of the polymorphic alleles of genes encoding phase 1 and phase 2 detoxication enzymes in patients with endometriosis].Genetika,2003,39:525-529.
22 Yu L,Shen H,Ren X,et al.Multi-omics analysis reveals the interaction between the complement system and the coagulation cascade in the development of endometriosis.Sci Rep,2021,11:11926.