妊娠期高血压疾病(hypertensive disorders of pregnancy,HDP)是重要的妊娠并发症之一,全球范围患病率约15%[1],是导致孕产妇和婴幼儿死亡的重要因素,也是引发流产、早产和小于胎龄儿等不良妊娠结局的重要原因之一[2]。妊娠期高血压(gestational hypertension,GH)和子痫前期(preeclampsia,PE)是HDP最常见的亚型,GH以妊娠20周后新发高血压为主要临床特征,PE患者除出现新发高血压临床症状外还伴发蛋白尿及多器官损伤[3]。HDP的病因和发病机制尚未完全被阐明,越来越多的研究者关注环境污染物暴露与HDP发病风险间的关联[4]。
全氟和多氟化合物(per- and polyfluoroalkyl substances,PFAS)是一类合成化学品,被广泛应用于各种工业生产和消费品中,主要包括防火泡沫、不粘炊具和食品包装等[5]。PFASs在环境中难以降解,是持久存在的环境污染物之一,体内半衰期约为3.8年~8.5年[6]。人体中的PFAS可以扰乱机体正常代谢,是影响人群健康的一类重要内分泌干扰物[7]。越来越多的流行病学研究探索了孕期PFASs暴露与HDP间的关联,但尚未得出一致结论[8-10]。动物模型[11]及体外实验研究[7]均表明PFAS具有子宫及胎盘毒性,可能在HDP发病机制中发挥重要作用。有必要进行Meta分析整合现有人群流行病学研究证据,对PFAS暴露与HDP及其重要临床亚型发病风险间的关联进行全面深入探讨,为进一步从降低机体PFAS甚至内分泌干扰物水平角度预防和控制HDP发病提供理论依据。
一、文献检索策略及纳入排除标准
1.文献检索策略:检索PubMed、Web of Science、Embase、中国知网及万方电子数据库,系统性回顾截至2024年12月有关孕期PFAS暴露与HDP相关性的研究。以全氟及多氟化合物、全氟和多氟化合物、全氟及多氟烷基化合物、全氟和多氟烷基化合物、全氟烷基物质、多氟烷基物质、全氟化合物、多氟化合物、PFAS、妊娠期高血压、GH、妊高症、子痫、HDP、妊娠合并高血压和妊娠高血压为中文检索词。以中国知网为例,采用专业检索,中英文扩展,检索式为TKA=′全氟及多氟化合物′+′全氟和多氟化合物′+′全氟及多氟烷基化合物′+′全氟和多氟烷基化合物′+′全氟烷基物质′+′多氟烷基物质′+′全氟化合物,′+′多氟化合物′+′PFAS′ AND TKA=′妊娠期高血压′+′GH′+′妊高症′+′子痫′+′HDP′+′妊娠合并高血压′+′妊娠高血压′。
英文检索词包括PFAS、PFASs、PFCs、PFOA、PFOS、PFNA、PFDA、PFHxS、PFUnA、PFDeA、per- and polyfluoroalkyl substances、perfluoroalkyl and polyfluoroalkyl substances、perfluorinated、polyfluorinated、perfluoroalkyl compounds、perfluoroalkyl substances、fluorocarbons、perfluorochemicals、polyfluorocarbons、perfluorocarbons、hypertensive disorders of pregnancy、gestational hypertension、hypertension during pregnancy、pregnancy induced hypertension、gestational hypertensive disorders和preeclampsia,以PubMed为例,采用高级检索,检索式为(′per- and polyfluoroalkyl substances[ALL]′ OR ′perfluoroalkyl and polyfluoroalkyl substances[ALL]′ OR ′perfluorinated[ALL]′ OR ′polyfluorinated[ALL]′ OR ′perfluoroalkyl compounds[ALL]′ OR ′perfluoroalkyl substances[ALL]′ OR ′fluorocarbons[ALL]′ OR ′perfluorochemicals[ALL]′ OR ′polyfluorocarbons[ALL]′ OR ′perfluorocarbons[ALL]′ OR ′PFAS[ALL]′ OR ′PFASs[ALL]′ OR ′PFCs[ALL]′ OR ′PFOA[ALL]′ OR ′PFOS[ALL]′ OR ′PFNA[ALL]′ OR ′PFDA[ALL]′ OR ′PFHxS[ALL]′ OR ′PFUnA[ALL]′ OR ′PFDeA[ALL]′) AND(′hypertensive disorders of pregnancy[ALL]′ OR ′gestational hypertension[ALL]′ OR ′hypertension during pregnancy[ALL]′ OR ′pregnancy induced hypertension[ALL]′ OR ′gestational hypertensive disorders[ALL]′ OR ′preeclampsia[ALL]′)。
2.纳入排除标准:文献的纳入标准包括:研究内容为评估孕期PFAS暴露与HDP相关性的观察性研究;对结局变量HDP及各亚型有明确定义和诊断方法;对PFAS内暴露量有明确的测定方法和测定时间;报告了比值比(odds ratio,OR)及95% 置信区间(confidence interval,CI)等效应指标。排除标准包括:文献类型为综述、Meta分析、评论、信件及会议纪要等;研究设计类型为横断面调查;动物模型及体外实验研究;非中英文文献;未检测孕期PFAS内暴露水平。
二、文献筛选、资料提取及质量评价
由两名研究员独立进行文献检索,后交叉核对,如有分歧则通过第三方协助解决,直至各数据库的检索结果一致。对检索到的文献根据标题及摘要进行初步筛选后,对符合纳入标准的文献下载全文进行仔细审核以明确是否纳入。纳入的文献由两名研究员按照预定的数据模板独立提取相关资料,包括作者、年份、地区、研究设计类型、样本量、年龄、是否单胎妊娠、PFAS检测方法、检测的生物样本、检测时间、HDP诊断方法、涉及的PFAS组分、调整的混杂因素、统计模型及效应指标等,后交叉核对。
由两名评价员使用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)对纳入的研究独立进行质量评价,然后交叉核对。NOS量表共9个得分点,研究对象的选择部分共4个得分点,组间可比性部分共2个得分点,3个得分点用于评价病例对照研究的暴露评估或队列研究的结局评估方法。得分最终范围为0~9分,7分及以上的研究为高质量,4~6分为中等质量,3分及以下为低质量。本研究中纳入的巢式病例对照研究及病例队列研究采用病例对照研究的NOS量表进行质量评价。
三、统计学分析
采用R 4.3.1软件进行Meta分析,如果至少3项研究均关注了同一PFAS组分,则对该组分进行合并分析,计算其对GH、PE及HDP的汇总效应值。根据Cochran′ s Q检验的P值和I2统计量对纳入的文献进行异质性检验,P≤0.01或I2≥30%表示异质性较高,采用随机效应模型进行合并分析并谨慎解释结果;P>0.01且I2<30%表示异质性较小,可采用固定效应模型进行合并分析。Meta分析结果以汇总OR值及95% CI表示。绘制漏斗图并进行Egger检验以判别是否存在发表偏倚。
四、结果
1.检索结果及文献特征:本研究初检文献共328篇,其中PubMed、Embase、Web of Science、中国知网和万方数据库分别79篇、76篇、152篇、8篇和13篇,去除重复记录后剩余160篇。初筛标题及摘要后排除动物模型或体外实验研究20篇、非原始研究40篇、内容不相关的研究63篇及重复发表的学位论文2篇。对剩余35篇文献审核全文后,共14项研究符合纳入Meta分析的标准,包括8项队列研究[8-10,12-16]、3项病例对照研究[17-19]、2项巢式病例对照研究[20-21]和1项病例队列研究[22],具体筛选流程见图1。纳入文献的发表年限为2014年—2024年,研究地区包括中国[13,16-17,20-21](5/14)、美国[12,15,19](3/14)、加拿大[8-9](2/14)、瑞典[10,18](2/14)、丹麦[14](1/14)和挪威[22](1/14)。7项研究[8-9,12-13,16,19,22]以母体血浆为生物样本检测PFAS内暴露量,另外7项研究检测母体血清。10项研究的PFAS检测时间在孕早期,1项病例队列研究[22]、1项巢式病例对照研究[20]和1项队列研究[9]在孕中期检测PFAS暴露量,另有1项病例对照研究[17]检测时间在分娩前。纳入文献关注的主要PFAS组分包括全氟辛酸(perfluorooctanoic acid,PFOA)、全氟辛烷磺酸(perfluorooctane sulfonate,PFOS)、全氟己烷磺酸(perfluorohexane sulfonate,PFHxS)、全氟壬酸(perfluorononanoate,PFNA)、全氟辛酸(perfluorooctanoic acid,PFDA)、全氟庚酸(perfluoroheptanoic acid,PFHpA)、全氟十二酸(perfluorododecanoic acid,PFDoA)和全氟十一酸(perfluoroundecanoic acid,PFUnDA)。各项纳入分析的研究的基本特征和质量评价结果见表1。
表1 纳入文献的基本特征

作者,年份地区研究设计样本量年龄(岁)是否单胎妊娠PFAS检测方法生物样本检测时间HDP诊断方法PFAS组分NOS质量评分Borghese等,2020[8]加拿大队列研究127 GH49 PE1 739总 - -32.1±5.1是UPLC-MS母体血浆孕早期医院测量血压、蛋白尿及其他PE并发症情况PFOA,PFOS,PFHxS8Preston等,2022[12]美国队列研究106 GH56 PE1 558总31.3±5.230.6±6.231.9±5.1未说明LC-MS母体血浆孕早期医疗记录PFOA,PFOS,PFHxS,PFNA,EtFOSAA,Me-FOSAA8Huo等,2020[13]中国队列研究64 GH+71 PE3 220总56.3%<3061.4%<30是HPLC-MS母体血浆孕早期医疗记录PFOA,PFOS,PFHxS,PFNA,PFDA,PFUnDA,PFHpA,PFBS,PFDoA9Birukov等,2021[14]丹麦队列研究49 GH104 PE1 436总 - -30.3±4.5是LC-MS母体血清孕早期医院测量血压、蛋白尿PFOA,PFOS,PFHxS,PFNA,PFDA5Tian等,2023[17]中国病例对照研究82 PE169对照31.0±4.0730.2±3.85未说明UPLC-MS母体血清分娩前医疗记录PFOA,PFOS,PFHxS,PFNA,PFDA,PFUnDA,PFDoA,PFTrDA,PFDS,4:2FTS,ADONA,6:2FTS,6:2Cl-PFESA,8:2Cl-PFESA8
表1(续)
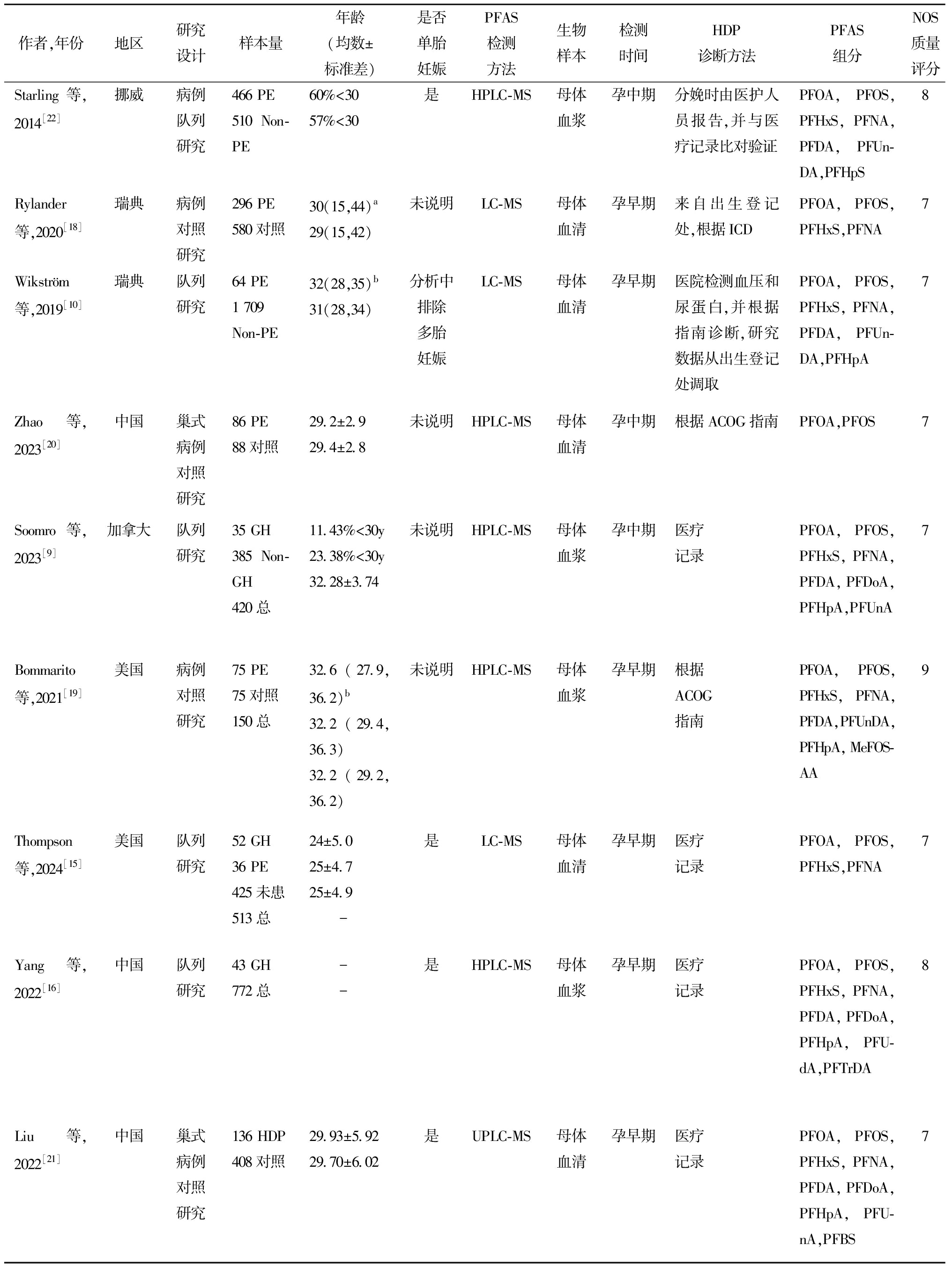
作者,年份地区研究设计样本量年龄(均数±标准差)是否单胎妊娠PFAS检测方法生物样本检测时间HDP诊断方法PFAS组分NOS质量评分Starling等,2014[22]挪威病例队列研究466 PE510 Non-PE60%<3057%<30是HPLC-MS母体血浆孕中期分娩时由医护人员报告,并与医疗记录比对验证PFOA,PFOS,PFHxS,PFNA,PFDA,PFUn-DA,PFHpS8Rylander等,2020[18]瑞典病例对照研究296 PE580对照30(15,44)a29(15,42)未说明LC-MS母体血清孕早期来自出生登记处,根据ICDPFOA,PFOS,PFHxS,PFNA7Wikström等,2019[10]瑞典队列研究64 PE1 709 Non-PE32(28,35)b31(28,34)分析中排除多胎妊娠LC-MS母体血清孕早期医院检测血压和尿蛋白,并根据指南诊断,研究数据从出生登记处调取PFOA,PFOS,PFHxS,PFNA,PFDA,PFUn-DA,PFHpA7Zhao等,2023[20]中国巢式病例对照研究86 PE88对照29.2±2.9 29.4±2.8未说明HPLC-MS母体血清孕中期根据ACOG指南PFOA,PFOS7Soomro等,2023[9]加拿大队列研究35 GH385 Non-GH420总11.43%<30y23.38%<30y32.28±3.74未说明HPLC-MS母体血浆孕中期医疗记录PFOA,PFOS,PFHxS,PFNA,PFDA,PFDoA,PFHpA,PFUnA7Bommarito等,2021[19]美国病例对照研究75 PE75对照150总32.6(27.9,36.2)b32.2(29.4,36.3)32.2(29.2,36.2)未说明HPLC-MS母体血浆孕早期根据ACOG指南PFOA,PFOS,PFHxS,PFNA,PFDA,PFUnDA,PFHpA,MeFOS-AA9Thompson等,2024[15]美国队列研究52 GH36 PE425未患513总24±5.025±4.725±4.9 -是LC-MS母体血清孕早期医疗记录PFOA,PFOS,PFHxS,PFNA7Yang等,2022[16]中国队列研究43 GH772总 - -是HPLC-MS母体血浆孕早期医疗记录PFOA,PFOS,PFHxS,PFNA,PFDA,PFDoA,PFHpA,PFU-dA,PFTrDA8Liu等,2022[21]中国巢式病例对照研究136 HDP408对照29.93±5.9229.70±6.02是UPLC-MS母体血清孕早期医疗记录PFOA,PFOS,PFHxS,PFNA,PFDA,PFDoA,PFHpA,PFU-nA,PFBS7
a 均数(最小值,最大值),b 中位数(四分位距)
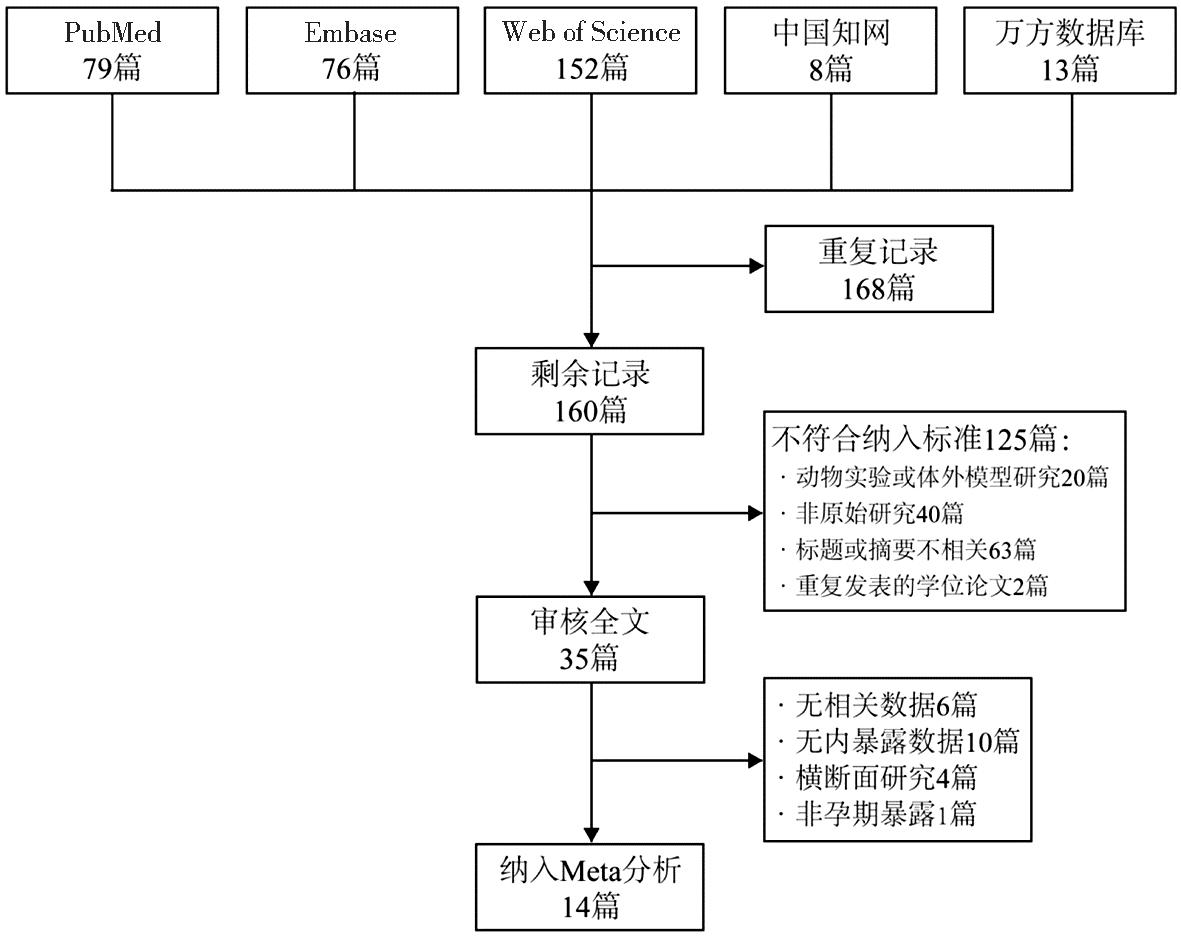
图1 文献筛选流程图
共7项研究[8-9,12-16]报告了PFAS暴露与GH的关联,其中3项队列研究分别发现了PFOS(OR=1.37,95% CI:1.04~1.82)、PFOA(OR=1.50,95% CI:1.12~2.02)、PFHxS(OR=1.27,95% CI:1.05~1.53)[12],PFHpA(OR=1.38,95% CI:1.01~1.87)[13],和PFHpA(OR=1.88,95% CI:1.19~2.96)、PFNA(OR=1.29,95% CI:1.03~1.62)、PFDA(OR=2.01,95% CI:1.03~3.89)[9]连续暴露与GH的显著关联。11项研究[8,10,12-15,17-20,22]报告了PFAS与PE的关联,其中2项队列研究和1项病例对照研究分别发现了PFHxS(OR=1.32,95% CI:1.03~1.70)[8],PFOS(OR=1.53,95% CI:1.07~2.20)、PFNA(OR=1.38,95% CI:1.01~1.89)[10]和PFOA(OR=5.29,95% CI:1.05~26.7)、PFUnDA(OR=1.48,95% CI:1.10~1.98)[17]连续暴露与PE的显著关联。另有一项巢式病例对照研究[20]发现PFOS高暴露组(>7.1 ng/mL)较低暴露组(<7.1 ng/mL)PE发生风险更高(OR=7.7,95% CI:3.8~15.7)。4项研究[13-15,21]报告了PFAS与HDP的关联结果,其中仅1项巢式病例对照研究[21]发现了PFOS(OR=2.91,95% CI:1.63~5.20)和PFNA(OR=3.88,95% CI:1.71~8.80)与HDP的显著关联。
2.Meta分析结果:本文纳入的研究中不同PFAS组分与各HDP亚型间异质性检验的结果不尽一致。各研究关于PFOA、PFHpA和PFDoA的结果异质性较小,PFNA与GH 及PE的关联结果、PFDA与PE及HDP的关联结果异质性较小,其余组分均检测到显著的异质性,因此采用随机效应模型进行合并分析。Meta分析结果显示孕期PFOA(OR=1.11,95% CI:1.01~1.23)和PFHpA(OR=1.43,95% CI:1.15~1.78)暴露与GH发病显著相关,PFOS暴露可增加PE的发生风险(OR=1.28,95% CI:1.01~1.62)。未发现PFHxS、PFNA、PFDoA和PFUnDA与HDP及各亚型发病间存在统计学显著关联。具体结果见图2~图4。
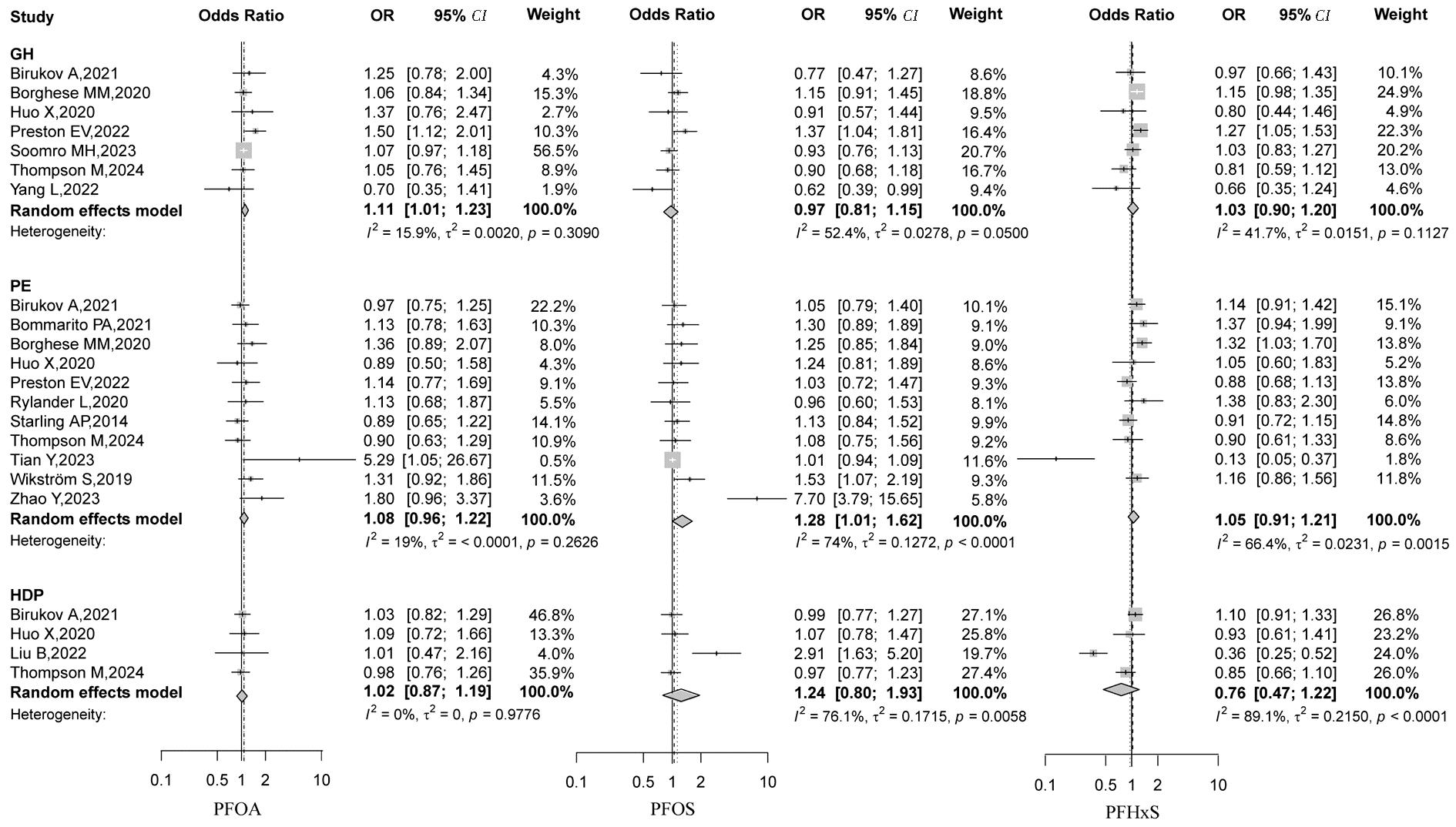
图2 PFOA,PFOS和PFHxS与妊娠期高血压疾病的Meta分析结果
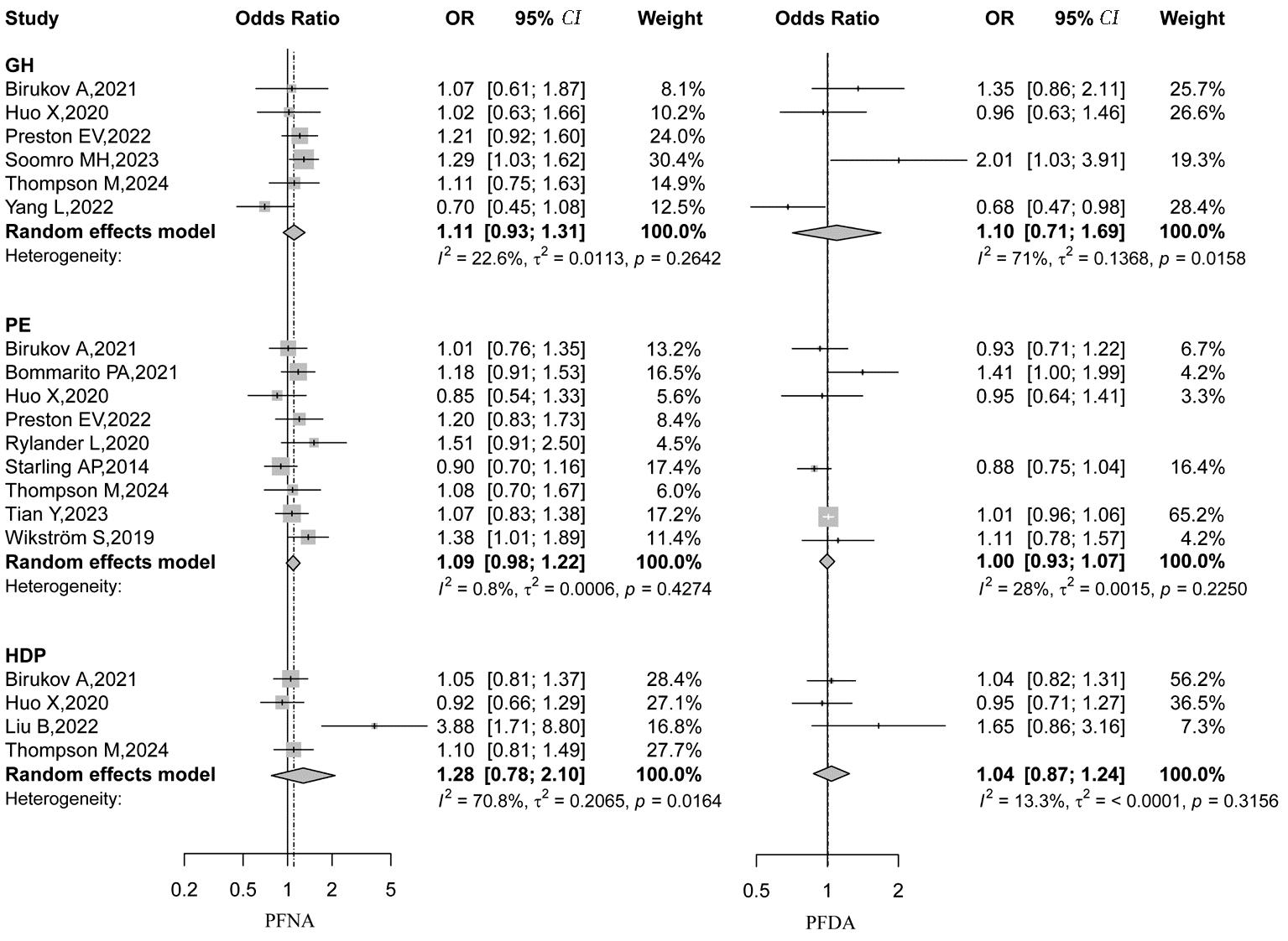
图3 PFNA和PFDA与妊娠期高血压疾病的Meta分析结果
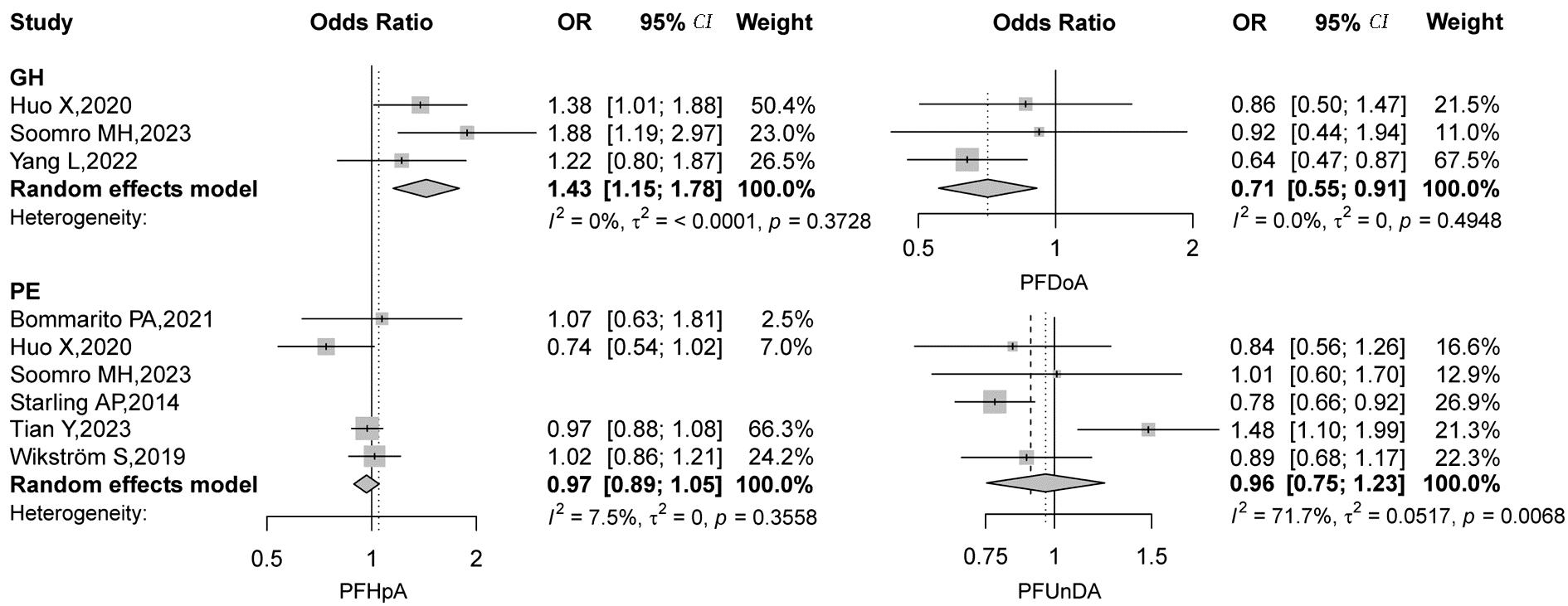
图4 PFHpA,PFDoA和PFUnDA与妊娠期高血压疾病的Meta分析结果
3.发表偏倚:根据不同HDP亚型和各PFAS组分绘制漏斗图(图5)并进行Egger检验,结果显示部分组分可能存在发表偏倚。对于GH亚型,组分PFHxS和PFDA的Egger检验P值分别为0.009和0.003;对于PE亚型,组分PFOA、PFOS和PFHxS的Egger检验P值分别为0.016、0.003和0.017;对于HDP,组分PFOS和PFNA的Egger检验P值分别为0.001和0.004。这提示在解释如上PFAS组分与HDP及各亚型的汇总关联结果时候需要更加谨慎,其余组分P值均大于0.05。
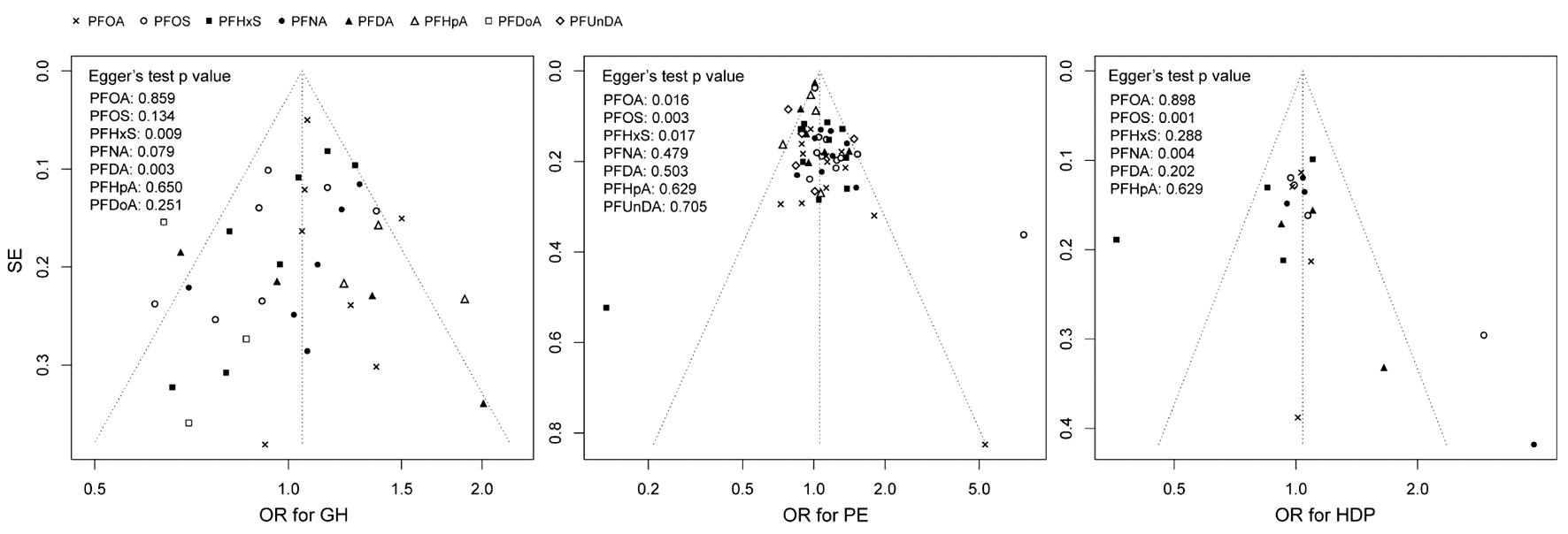
图5 漏斗图
五、讨论
HDP是常见且危害严重的妊娠并发症之一,可能导致孕产妇死亡及多种不良妊娠结局发生[2],还可能影响孕妇及子代的近期甚至长期健康[23-24],目前其病因及发病机制尚未被完全阐明。孕妇是对环境因素暴露易感的特殊人群,其中PFAS广泛存在且不易被降解[6]。已有研究关注其对HDP的潜在影响,但未能得出一致结论。本项研究系统性回顾了既往关于孕期PFAS暴露与HDP关联的研究,Meta分析结果显示孕期PFAS暴露是HDP及其各临床亚型风险增加的潜在危险因素,其中PFOA、PFHpA和PFOS是潜在重要危险组分。
在本研究的Meta分析结果中,孕期PFOA暴露与GH发病显著相关(汇总OR=1.11,95% CI:1.01~1.23),与Preston等研究者[12]在美国开展的队列研究结果一致。该研究检测孕早期母体血浆中的PFOA暴露量,共发现106例GH病例(患病率约为6.80%)。然而另外2项分别在丹麦[14]和美国[15]开展的队列研究并未发现孕早期母体血清中的PFOA暴露与GH存在统计学显著关联。这2项研究人群中的PFOA暴露水平(中位暴露浓度1.68 ng/mL和0.71 ng/mL)相对Preston等[12]的研究(中位暴露浓度5.9 ng/mL)更低,提示PFOA低水平暴露不是HDP发生的独立危险因素。另1项来自加拿大的队列研究[9]检测孕中期母体血浆PFAS含量,未发现PFOA暴露对GH具有显著影响。已有研究表明[25],血样中的PFOA组分会随孕周增加逐渐转移并累积于胎盘中,因此研究结果可能受到取样时间的影响。2项开展于中国[13,16]和1项开展于加拿大[8]的队列研究以孕早期母体血浆为生物样本,并未观察到PFOA对GH的显著影响,可能由于开展于中国的研究[13]中GH发病率较低(64/3 220=1.99%),且不同遗传背景的人群可能存在差异。本研究发现了PFHpA与GH发生风险的显著关联(汇总OR=1.43,95% CI:1.15~1.78),与2项分别开展于中国[13]和加拿大[9]的队列研究结果一致。另1项开展于中国的队列研究[16]并未发现PFHpA对GH的显著影响,需要进一步在不同的人群开展高质量研究以明确二者的关联。
本研究的Meta分析结果显示,PFOS暴露可增加PE的发生风险(汇总OR=1.28,95% CI: 1.01~1.62)。在汇总分析的11项有关PFOS与PE 关联的研究中,仅1项在瑞典开展的队列研究[10]和1项开展于中国的巢式病例对照研究[20]报告了显著结果。考虑到该项巢式病例对照研究[20]报告PFOS高暴露组(>7.1 ng/mL)相对低暴露组(<7.1 ng/mL)PE的发生风险,可能对PFOS连续暴露的汇总效应值产生影响,本研究进一步剔除这项研究后进行了敏感性分析。结果显示文献间的异质性显著下降(I2=0.0%,P=0.505),PFOS暴露与PE风险间不再具有统计学显著关联(汇总OR=1.09,95% CI: 0.99~1.20)。这一结果提示PFOS在较高浓度暴露时产生的影响可能达到病理变化的水平,在较低浓度暴露时无法检测到与PE间的剂量-效应关系。
PFAS暴露与HDP关联的潜在机制尚未被完全阐明,其中氧化应激和炎症反应可能是重要途径[26]。有研究表明PFAS可诱导内皮细胞的氧化应激[10]并产生免疫毒性[27],氧化应激和炎症反应可导致动脉损伤及内皮功能障碍,进一步引发血压升高和血管异常疾病[13],其中PE亚型的发病与胎盘氧化应激以及促炎细胞因子的释放有关[28]。体外实验研究表明PFAS暴露可能与控制滋养层分化的PPAR核受体相互作用干扰相关信号通路,引发滋养层细胞浸润不足,导致胎盘形成不良和胎盘氧化应激反应[7]。此外,一些毒理学证据还表明PFAS暴露可能通过抑制胎盘滋养细胞内芳香化酶活性产生潜在的胎儿性别特异性影响[29]。未来仍需基于人群开展进一步的研究以深入阐释PFAS诱发HDP的潜在重要机制。
本研究Meta分析中进行了较系统全面的文献检索,采取严格的纳入排除标准,并利用NOS量表对文献质量进行了客观评价,最终筛选出14篇文献可为所研究问题提供直接证据。纳入分析的14项研究质量均为中等及以上,均利用生物样本检测PFAS内暴露水平,由专业医护人员检测血压或通过医院诊断记录详细确定疾病结局,能够一定程度上避免回忆及报告偏倚。然而,本研究对部分PFAS组分的结果检测出了显著异质性,可能由检测的生物样本、研究设计类型及人群差异导致。因此,本研究采用随机效应模型进行合并分析并谨慎解读研究结果。本研究纳入的研究中有1项[17]取样时间在分娩前,3项[9,20,22]在孕中期,可能无法明确暴露与结局的时序性。对于部分PFAS组分和HDP亚型的结果本研究检测出了发表偏倚,因此需要谨慎解读本研究关于PFOS与PE的显著Meta分析结果。
六、结论
本文就孕期PFAS暴露与HDP及各亚型发病风险间的关联进行了Meta分析,结果表明孕期PFAS暴露与HDP发病存在显著关联,其中PFOA、PFHpA和PFOS可能是重要组分。本研究未发现PFHxS、PFNA、PFDoA和PFUnDA与HDP及各亚型发病风险间存在显著相关性。为进一步揭示PFAS暴露与HDP间的关联并阐明具体机制,未来工作仍需进一步开展高质量、大样本的前瞻性研究加以探索。
1 Liu X,Na J,Liu X,et al.Co-exposure to phthalates and polycyclic aromatic hydrocarbons and the risk of gestational hypertension in Chinese women.Environ Int,2024,185:108562.
2 Wu P,Green M,Myers JE.Hypertensive disorders of pregnancy.BMJ,2023,381:e071653.
3 Metoki H,Iwama N,Hamada H,et al.Hypertensive disorders of pregnancy:definition,management,and out-of-office blood pressure measurement.Hypertens Res,2022,45:1298-1309.
4 Mazumder H,Rimu FH,Shimul MH,et al.Maternal health outcomes associated with ambient air pollution:An umbrella review of systematic reviews and meta-analyses.Sci Total Environ,2024,914:169792.
5 Manzano-Salgado CB,Casas M,Lopez-Espinosa MJ,et al.Transfer of perfluoroalkyl substances from mother to fetus in a Spanish birth cohort.Environ Res,2015,142:471-478.
6 Kingsley SL,Eliot MN,Kelsey KT,et al.Variability and predictors of serum perfluoroalkyl substance concentrations during pregnancy and early childhood.Environ Res,2018,165:247-257.
7 Szilagyi JT,Avula V,Fry RC.Perfluoroalkyl Substances(PFAS) and Their Effects on the Placenta,Pregnancy,and Child Development:a Potential Mechanistic Role for Placental Peroxisome Proliferator-Activated Receptors(PPARs).Curr Environ Health Rep,2020,7:222-230.
8 Borghese MM,Walker M,Helewa ME,et al.Association of perfluoroalkyl substances with gestational hypertension and preeclampsia in the MIREC study.Environ Int,2020,141:105789.
9 Soomro MH,England-Mason G,Liu J,et al.Associations between the chemical exposome and pregnancy induced hypertension.Environ Res,2023,237:116838.
10 Wikström S,Lindh CH,Shu H,et al.Early pregnancy serum levels of perfluoroalkyl substances and risk of preeclampsia in Swedish women.Sci Rep,2019,9:9179.
11 Dangudubiyyam SV,Mishra JS,Kumar S.Perfluorooctane sulfonic acid modulates expression of placental steroidogenesis-associated genes and hormone levels in pregnant rats.Reprod Toxicol,2023,118:108390.
12 Preston EV,Hivert MF,Fleisch AF,et al.Early-pregnancy plasma per- and polyfluoroalkyl substance(PFAS) concentrations and hypertensive disorders of pregnancy in the Project Viva cohort.Environ Int,2022,165:107335.
13 Huo X,Huang R,Gan Y,et al.Perfluoroalkyl substances in early pregnancy and risk of hypertensive disorders of pregnancy:A prospective cohort study.Environ Int,2020,138:105656.
14 Birukov A,Andersen LB,Andersen MS,et al.Exposure to perfluoroalkyl substances and blood pressure in pregnancy among 1436 women from the Odense Child Cohort.Environ Int,2021,151:106442.
15 Thompson M,Eatman JA,Dunlop AL,et al.Prenatal exposure to per- and polyfluoroalkyl substances(PFAS) and associations with hypertensive disorders of pregnancy in the Atlanta African American Maternal-Child cohort.Chemosphere,2024,357:142052.
16 Yang L,Ji H,Liang H,et al.Associations of perfluoroalkyl and polyfluoroalkyl substances with gestational hypertension and blood pressure during pregnancy:A cohort study.Environ Res,2022,215:114284.
17 Tian Y,Zhou Q,Zhang L,et al.In utero exposure to per-/polyfluoroalkyl substances(PFASs):Preeclampsia in pregnancy and low birth weight for neonates.Chemosphere,2023,313:137490.
18 Rylander L,Lindh CH,Hansson SR,et al.Per- and Polyfluoroalkyl Substances in Early Pregnancy and Risk for Preeclampsia:A Case-Control Study in Southern Sweden.Toxics,2020,8:43.
19 Bommarito PA,Ferguson KK,Meeker JD,et al.Maternal Levels of Perfluoroalkyl Substances(PFAS) during Early Pregnancy in Relation to Preeclampsia Subtypes and Biomarkers of Preeclampsia Risk.Environ Health Perspect,2021,129:107004.
20 Zhao Y,Zhou J,Xu H,et al.Prenatal exposure to perfluorooctane sulfonate and perfluorooctanoate and the risk of preeclampsia:a nested case-control study in Shanghai,China.Chin Med J(Engl),2023,136:857-859.
21 Liu B,Wei B,Mo M,et al.Exposure to perfluoroalkyl substances in early pregnancy and the risk of hypertensive disorders of pregnancy:A nested case-control study in Guangxi,China.Chemosphere,2022,288:132468.
22 Starling AP,Engel SM,Richardson DB,et al.Perfluoroalkyl substances during pregnancy and validated preeclampsia among nulliparous women in the Norwegian Mother and Child Cohort Study.Am J Epidemiol,2014,179:824-833.
23 Bellamy L,Casas JP,Hingorani AD,et al.Pre-eclampsia and risk of cardiovascular disease and cancer in later life:systematic review and meta-analysis.BMJ,2007,335:974.
24 Kajantie E,Eriksson JG,Osmond C,et al.Pre-eclampsia is associated with increased risk of stroke in the adult offspring:the Helsinki birth cohort study.Stroke,2009,40:1176-1180.
25 Mamsen LS,Björvang RD,Mucs D,et al.Concentrations of perfluoroalkyl substances(PFASs) in human embryonic and fetal organs from first,second,and third trimester pregnancies.Environ Int,2019,124:482-492.
26 Phoswa WN,Khaliq OP.The Role of Oxidative Stress in Hypertensive Disorders of Pregnancy(Preeclampsia,Gestational Hypertension) and Metabolic Disorder of Pregnancy(Gestational Diabetes Mellitus).Oxid Med Cell Longev,2021,2021:5581570.
27 Granum B,Haug LS,Namork E,et al.Pre-natal exposure to perfluoroalkyl substances may be associated with altered vaccine antibody levels and immune-related health outcomes in early childhood.J Immunotoxicol,2013,10:373-379.
28 Juan-Reyes SS,Gómez-Oliván LM,Juan-Reyes NS,et al.Women with preeclampsia exposed to air pollution during pregnancy:Relationship between oxidative stress and neonatal disease - Pilot study.Sci Total Environ,2023,871:161858.
29 Gorrochategui E,Pérez-Albaladejo E,Casas J,et al.Perfluorinated chemicals:differential toxicity,inhibition of aromatase activity and alteration of cellular lipids in human placental cells.Toxicol Appl Pharmacol,2014,277:124-130.