中国是农药生产和使用大国,农药使用量每年可达130万吨左右[1]。其中,有机磷农药(organophosphorus pesticides, OPs)是目前国内使用最广泛的农药之一,被普遍应用于水果、蔬菜等农作物的生产中。OPs的广泛使用导致其在环境介质中普遍残留,一般人群主要通过呼吸、皮肤接触和饮食摄入等多种途径持续暴露于低剂量的OPs [2],并导致生殖功能障碍、肿瘤、神经行为功能异常等一系列不良健康影响[3-4]。目前,已在人体尿液、头发、血液、乳汁等生物样本中普遍检出OPs的各种代谢产物[5]。
孕产妇由于其特殊的生理状态,属于高敏感人群,孕早期又是胎儿生长发育的关键时期,因此孕早期农药暴露对孕产妇的健康影响不容忽视。已有多项动物实验[6-7]和人群流行病学研究[8-10]提示,孕期农药暴露会增加自然流产、死胎、出生缺陷、低出生体重和小于胎龄儿等不良妊娠结局的发生风险,但目前尚缺乏针对孕早期妇女的准确检测其内暴露水平的人群研究。本研究以2018年—2020年在北京市妇产医院产检的孕早期妇女为研究对象, 检测其尿液中OPs暴露水平并对可能的影响因素进行分析, 为今后开展孕期农药暴露研究并采取相应的干预措施提供科学依据。
对象与方法
一、研究对象
本研究依托于在北京市妇产医院建立的北京市出生队列[11](注册号:ChiCTR2200058395),该前瞻性队列于2018年7月至2020年10月期间共募集32 496名孕产妇。队列的纳入标准为:(1)年龄在18~44岁;(2)计划在北京妇产医院进行常规产前检查和分娩;(3)首次孕检时孕周<14周;(4)签署知情同意书,同意参与本研究。本研究从该队列中排除未成功随访、出生缺陷、死产、双/多胎妊娠、早产、妊娠并发症的孕妇后,最终从临床资料信息完整且具有足够生物样本的孕妇中随机选择232名孕产妇纳入本研究进行分析。根据观察性研究中的样本量计算公式[12],假定孕妇孕早期OPs暴露率为50%,允许误差为P的0.2倍,取检验水平α=0.05,则N=150,本研究共纳入232名孕妇,满足统计学要求。
其中,U表示置信水平下的U统计量,P0为目标总体的比例期望值,d表示允许误差。
二、方法
1.问卷调查:原项目中,在征得研究对象的知情同意后,符合标准的孕产妇在妊娠8~13周时被纳入队列,孕产妇进入队列时通过基线调查问卷收集孕妇的基本人口学特征,包括研究对象的年龄、孕前体重指数(body mass index, BMI)、教育背景、经济状况、生育情况(孕产次)、家族病史、既往不良妊娠结局和既往病史。
2.尿液样本采集和OPs代谢产物浓度测定:用一次性无菌尿杯收集孕早期孕妇中段晨尿20~30 mL,于-80℃冰箱保存(全程冷链转运),由山西省农业科学院农产品质量安全与检测研究所专业实验员进行检测。采用超高效液相色谱串联质谱仪(Waters ACQUITY UPLCI-Class/美国SCIEX Triple Quad 4500)对研究对象尿液中OPs的6种非特异性代谢产物二烷基磷酸酯类物质(dialkyl phosphates, DAPs)进行检测,包括二甲基磷酸酯(dimethylphosphate,DMP)、二甲基一硫代磷酸酯(dimethylthiophosphate,DMTP)、二甲基二硫代磷酸酯(dimethyldithiophosphate,DMDTP)、二乙基磷酸酯(diethylphosphate,DEP)、二乙基一硫代磷酸酯(diethylthiophosphate,DETP)和二乙基二硫代磷酸酯(diethyldithiophosphate,DEDTP)[13]。正式实验过程中设置空白对照样品和标准质控样品以保证实验结果的准确性和可靠性。
3.尿肌酐检测:由于DAPs浓度受尿液的稀释或浓缩程度影响较大,本研究采用尿肌酐(creatinine, Cre)作为校正因子,将各DAPs肌酐校正后的浓度(ng/mg Cre)作为研究对象孕早期OPs的暴露指标。采用肌氨酸氧化酶法,将预处理后的尿样放入全自动生化分析仪进行尿液肌酐浓度的测定。
4.判断标准:本研究中DMP、DMDTP、DEP的最低定量限(limit of determination, LOQ)分别为1 ng/mL、0.5 ng/mL、2.5 ng/mL,DMTP、DETP和DEDTP的LOQ均为 0.05 ng/mL。低于LOQ的视为未检出,根据既往文献支持,使用![]() 替换未检出的样本浓度以减少偏差[14-15]。
替换未检出的样本浓度以减少偏差[14-15]。
5.统计学处理:采用均值±标准差和百分比(%)描述研究对象的基本人口学特征。由于尿液中DAPs浓度呈偏态分布,因此采用几何均数(geometric mean,GM)和中位数M及四分位间距(P25, P75)分别描述研究对象肌酐校正前后尿液中DAPs的水平。除6种DAPs外,还进一步计算总二甲基磷酸酯(∑DMs,DMP、DMTP、DMDTP之和)、总二乙基磷酸酯(∑DEs,DEP、DETP、DEDTP之和)和总二烷基磷酸酯(∑DAPs,6种DAPs之和)的浓度。采用Mann-Whitney U检验和Kruskal-Wallis H检验比较不同特征组间孕妇DAPs浓度水平的差异。以∑DAPs浓度自然对数转换后作为因变量,孕妇年龄(连续变量)、民族、孕前BMI(连续变量)、文化程度、经济水平、孕次、产次、胎儿性别作为可能影响尿液中DAPs水平的因素,采用多元线性回归分析,使用逐步回归法筛选尿液中DAPs浓度的影响因素。P<0.05被视为差异具有统计学意义,所有的数据分析均采用R 4.3.1统计软件。
结 果
一、研究对象基本情况
本研究共纳入232名孕早期妇女,其中216人(91.3%)为汉族,平均年龄为(31.1 ± 3.8)岁;平均BMI为(21.2 ± 2.4)kg/m2,孕前BMI正常的孕妇占所有研究对象的75.4%(175/232);平均分娩孕周为(39.7±0.8)周。80.2%(186/232)的孕妇为本科及以上文化程度,53.0%(123/232)的孕妇为首次妊娠。
二、研究对象OPs暴露水平
本研究关注的OPs的6种代谢产物DAPs浓度均呈偏态分布,经对数转换后近似服从正态分布。其中DEP的检出率最高(95.3%),DMDTP和DEDTP的检出率较低(<50%)。DEP和DMP为尿液中OPs代谢产物的主要成分,经肌酐校正后,其几何均值浓度分别为17.28 ng/mg Cre和6.46 ng/mg Cre。DMTP、DMDTP、DETP、DEDTP的肌酐校正后几何均值浓度分别为1.78 ng/mg Cre、0.14 ng/mg Cre、1.94 ng/mg Cre、0.07 ng/mg Cre。见表1。
表1 孕产妇孕早期尿液中DAPs浓度及分布特征(n=232)
Table 1 Concentration and distribution characteristics of DAPs in urine among pregnant women in their first trimester(n=232)
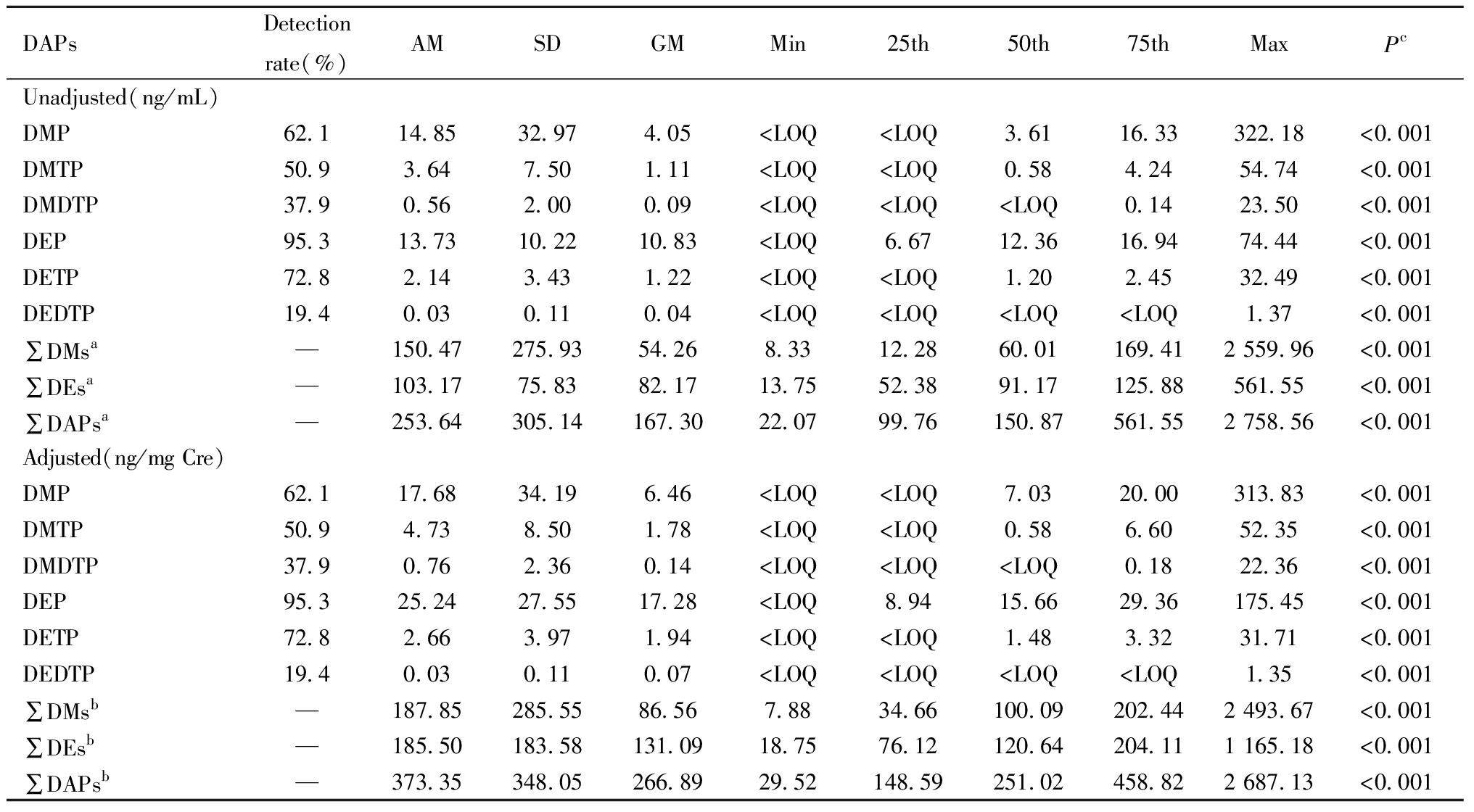
DAPsDetectionrate(%)AMSDGMMin25th50th75thMaxPcUnadjusted(ng/mL)DMP62.114.8532.974.05 AM:arithmetical mean;SD:standard deviation;GM:geometric mean;Min:minimum;Max:maximum. a The unadjusted concentrations of ∑DMs, ∑DEs, and ∑DAPs are in units of nmol/L; b the creatinine-adjusted concentrations of ∑DMs, ∑DEs, and ∑DAPs are in units of nmol/g Cre; c normality test(Shapiro-Wilk method)
与既往研究相比,本研究中孕妇孕早期尿液中DAPs的浓度整体处于中等水平,各研究中报告的具体水平见表2。
表2 既往研究中不同国家地区孕产妇人群尿液中OPs暴露水平(ng/mg Cre)
Table 2 Organophosphate urinary metabolite concentration of pregnant women by countries and regions in previous published studies(ng/mg Cre)
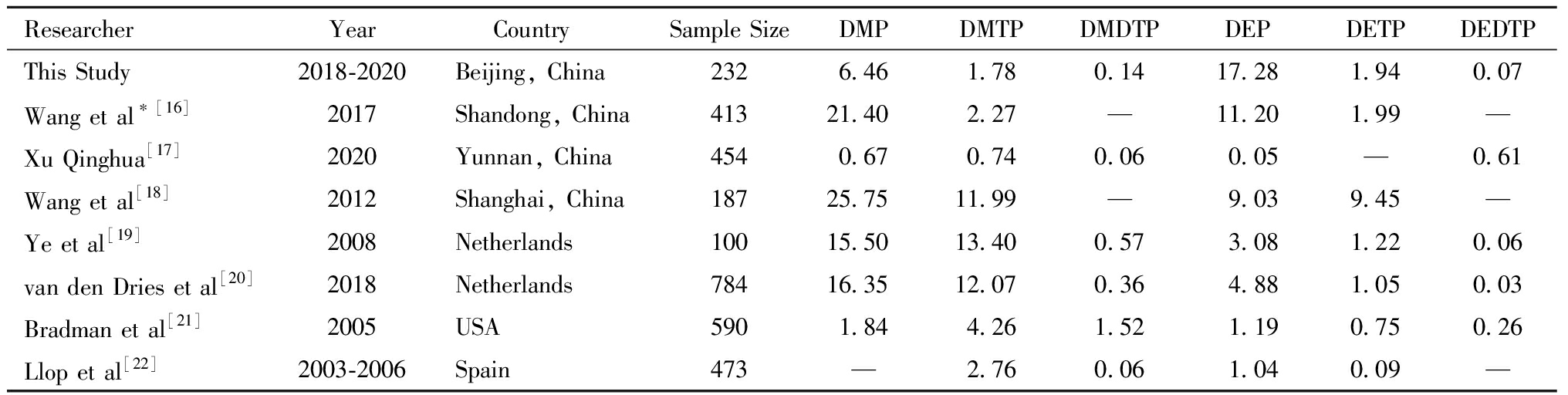
ResearcherYearCountry Sample SizeDMPDMTPDMDTPDEPDETPDEDTPThis Study2018-2020Beijing, China2326.461.780.1417.281.940.07Wang et al∗[16]2017Shandong, China 41321.402.27—11.201.99—Xu Qinghua[17]2020Yunnan, China4540.670.740.060.05—0.61Wang et al[18]2012Shanghai, China18725.7511.99—9.039.45—Ye et al[19]2008Netherlands10015.5013.400.573.081.220.06van den Dries et al[20]2018Netherlands78416.3512.070.364.881.050.03Bradman et al[21]2005USA5901.844.261.521.190.750.26Llop et al[22]2003-2006Spain473—2.760.061.040.09—
*Only this study, which reported median concentrations, all other studies reported geometric mean concentrations
三、不同特征孕妇OPs暴露水平差异
不同孕前BMI的孕妇尿液中∑DAPs浓度不同, 且差异具有统计学意义,孕前BMI≤18.4 kg/m2的孕妇尿液中OPs代谢产物的水平远远高于孕前BMI正常和偏高的孕妇。而不同年龄、民族、文化程度、经济水平、孕次、产次、胎儿性别的孕妇尿中∑DAPs浓度差异无统计学意义。见表3。
表3 不同特征孕妇孕早期尿液中∑DAPs浓度差异比较
Table 3 Comparison of ∑DAPs concentrations in urine among pregnant women during their first trimester by maternal and infant characteristics
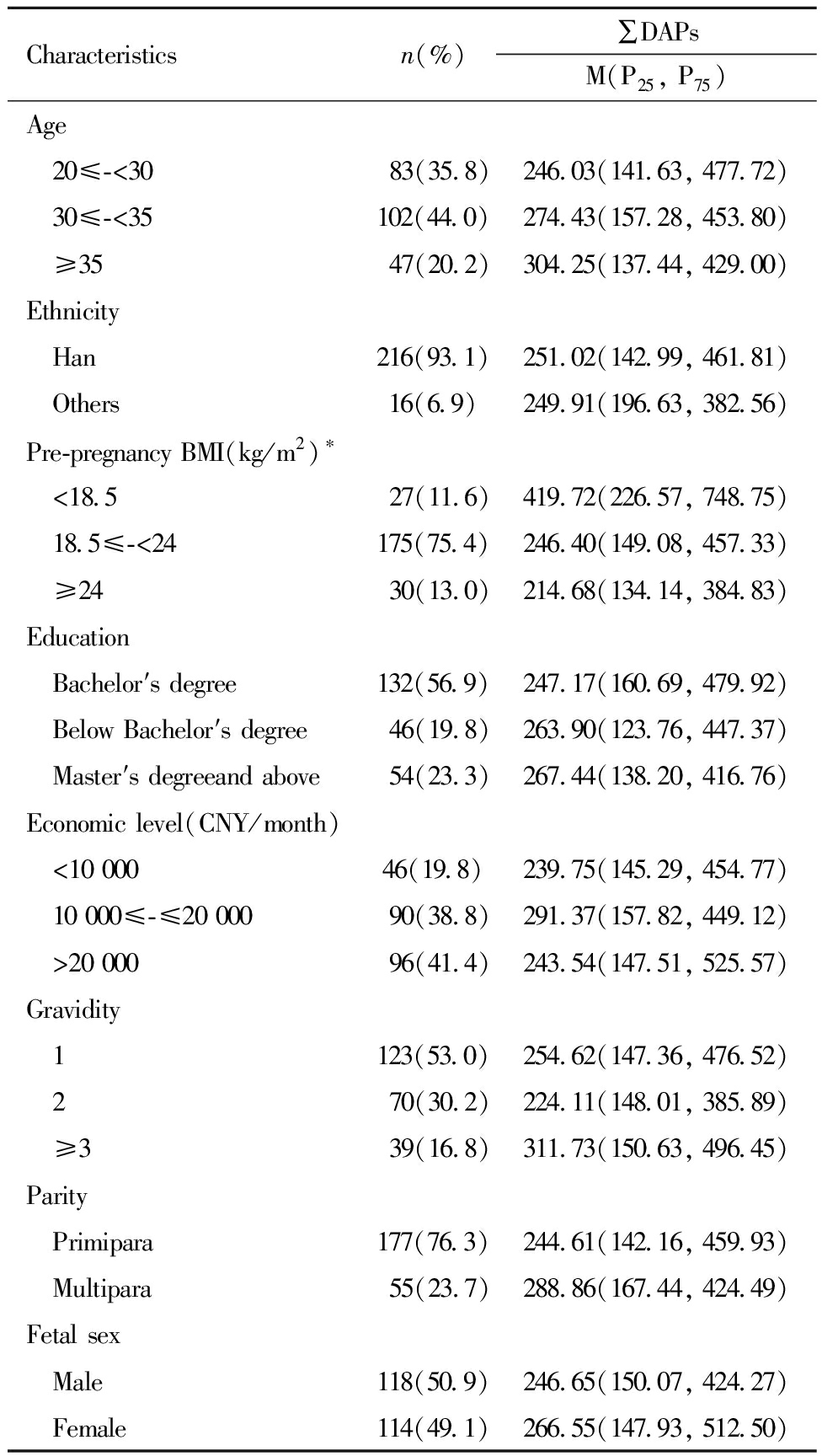
Characteristicsn(%)∑DAPsM(P25, P75)Age 20≤-<3083(35.8)246.03(141.63, 477.72) 30≤-<35102(44.0)274.43(157.28, 453.80) ≥3547(20.2)304.25(137.44, 429.00)Ethnicity Han216(93.1)251.02(142.99, 461.81) Others16(6.9)249.91(196.63, 382.56)Pre-pregnancy BMI(kg/m2)∗ <18.527(11.6)419.72(226.57, 748.75) 18.5≤-<24175(75.4)246.40(149.08, 457.33) ≥2430(13.0)214.68(134.14, 384.83)Education Bachelor′s degree132(56.9)247.17(160.69, 479.92) Below Bachelor′s degree46(19.8)263.90(123.76, 447.37) Master′s degreeand above54(23.3)267.44(138.20, 416.76)Economic level(CNY/month) <10 00046(19.8)239.75(145.29, 454.77) 10 000≤-≤20 00090(38.8)291.37(157.82, 449.12) >20 00096(41.4)243.54(147.51, 525.57)Gravidity 1123(53.0)254.62(147.36, 476.52) 270(30.2)224.11(148.01, 385.89) ≥339(16.8)311.73(150.63, 496.45)Parity Primipara177(76.3)244.61(142.16, 459.93) Multipara55(23.7)288.86(167.44, 424.49)Fetal sex Male118(50.9)246.65(150.07, 424.27) Female114(49.1)266.55(147.93, 512.50)
*P<0.05
四、影响孕妇孕早期OPs暴露水平的因素
本研究发现,在可能影响孕妇孕早期OPs暴露水平的因素中,孕妇年龄与孕早期尿液中∑DAPs浓度成正相关;文化程度和经济水平较高的孕妇∑DAPs浓度更高;首次怀孕的孕妇∑DAPs浓度高于非首次怀孕孕妇,但初产妇∑DAPs浓度低于经产妇;以上因素对∑DAPs浓度的影响均无统计学意义。而与分组比较的结果一致,孕前BMI与∑DAPs浓度成负相关(P<0.05),即孕前BMI是影响孕妇孕早期OPs暴露水平的主要因素。见表4。
表4 孕妇孕早期尿液中∑DAPs浓度的影响因素分析
Table 4 Analysis of influencing factors on ∑DAPs concentrations in urine among pregnant women in their first trimester
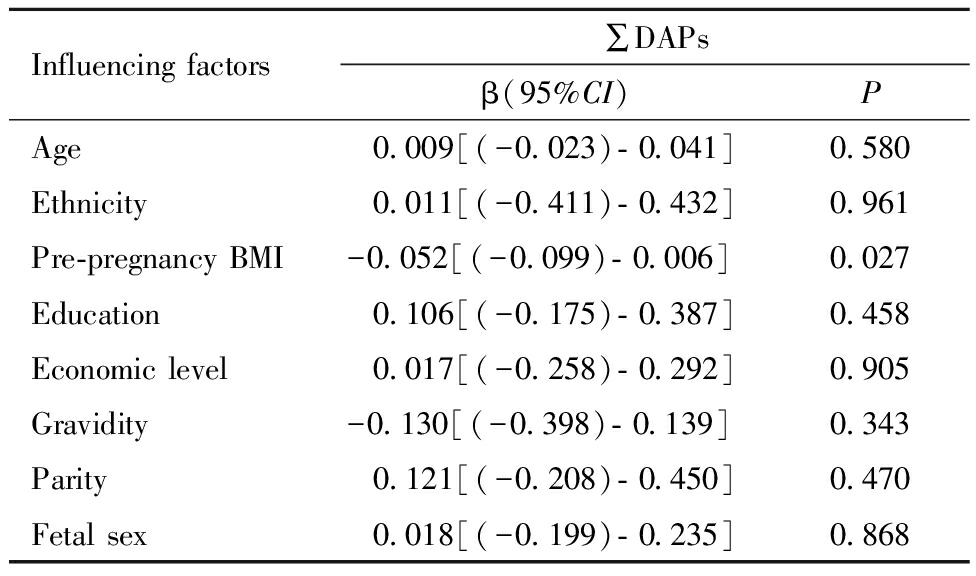
Influencing factors∑DAPsβ(95%CI)PAge0.009[(-0.023)- 0.041]0.580Ethnicity0.011[(-0.411)- 0.432]0.961Pre-pregnancy BMI-0.052[(-0.099)- 0.006] 0.027Education 0.106[(-0.175)- 0.387]0.458Economic level 0.017[(-0.258)- 0.292]0.905Gravidity -0.130[(-0.398)- 0.139] 0.343Parity0.121[(-0.208)- 0.450]0.470Fetal sex0.018[(-0.199)- 0.235]0.868
Age(continuous variable); ethnicity(han=0, others=1); pre-pregnancy BMI(continuous variable); education(below bachelor′s degree=0, bachelor′s degree or above=1); economic Level(<10,000 CNY/month=0; ≥10,000 CNY/month=1); gravidity(first pregnancy=0; not first pregnancy=1); parity(primipara=0; multipara=1); fetal sex(male=0; female=1)
讨 论
一、暴露水平
OPs在人体内的生物半衰期较短[23],进入人体后迅速代谢通过尿液排出体外,尿液中DAPs的浓度可同时反映80%以上的OPs通过多种暴露途径在个体内的暴露水平,DAPs也因此成为目前国内外大多数研究中评价人群OPs暴露水平的主要指标[24-26]。本研究中孕妇孕早期尿液中DAPs的浓度与既往研究相比整体处于中等水平,表2展示了本研究及既往国内外研究中报告的孕产妇人群OPs暴露水平。本研究孕产妇尿液中DAPs主要成分为DEP,GM浓度为17.28 ng/mg Cre,远高于荷兰[19-20]、美国[21]、西班牙[22]等国家之前报告的水平(1.04~3.08 ng/mg Cre),与既往国内研究中所报告的DEP水平(中国山东和上海地区报告的孕产妇尿液中DEP的GM浓度分别为11.20 ng/mg Cre和9.03 ng/mg Cre)相比也较高,可能是由于本研究中DEP 的方法检出限较高(2.5 ng/mL)。DEP在其方法检出限较高的情况下,检出率仍高达96.2%,提示研究对象广泛暴露于代谢产物为DEP的有机磷类农药。
关于本研究所关注的其他DAPs,不同地区报告的水平差异较大。本研究中DMP水平(6.95 ng/mg Cre)远低于中国山东(21.40 ng/mg Cre)、中国上海(25.75 ng/mg Cre)和国外荷兰(15.50~16.35 ng/mg Cre)等地区的孕产妇人群。DMTP与DMP类似,本研究中的DMTP水平(1.80 ng/mg Cre)也低于既往研究中报告的DMTP水平(2.27~13.40 ng/mg Cre)。而DMDTP、DETP和DEDTP的暴露水平则与其他研究所报告的水平较为接近。
综上所述,既往研究中国内外不同地区所报告的孕产妇人群的OPs暴露水平有较大差异。造成这种差异的可能原因为不同测样方法对于OPs代谢产物的敏感性不同,不同地区在不同时间段使用的OPs种类、用量不同,以及不同研究人群的饮食习惯、生活环境不同。本研究中研究对象为北京地区的孕产妇, 属于经济水平和文化程度相对较高的人群。与既往研究相比,本研究人群中DEP水平较高,DMP和DMTP水平较低,其余DAPs均属于一般暴露水平,OPs整体暴露处于中等水平,与既往研究所报告的OPs暴露水平持平。
二、OPs暴露水平的影响因素
影响农药暴露水平的因素较多, 既往研究证据[27-28]提示孕妇,年龄、职业、居住环境、经济水平、孕期饮食习惯均会影响孕期农药暴露水平,但本研究未发现上述因素对OPs暴露水平的影响。本研究发现孕前BMI≤18.4 kg/m2的孕妇尿液中DAPs浓度水平远高于孕前BMI正常和偏高的孕妇,孕前BMI是影响孕早期OPs暴露水平的主要因素。孕妇属于非职业暴露人群,食物中(尤其是蔬菜水果)的农药残留经口摄入是孕妇暴露的主要途径[29],本研究中孕前BMI偏低的孕妇暴露水平显著更高,可能是因为该孕妇群体孕早期饮食习惯与其他孕妇不同,导致其暴露水平更高。
本研究存在以下优势。首先,本研究通过检测孕产妇尿液样本中OPs代谢产物的浓度水平,以生物样本中的检测结果作为生物标志物来表征孕产妇孕早期农药的内暴露水平,相较于环境样本的检测更加真实有效,相较于自我报告和问卷调查则更加准确,减少了回忆偏倚。其次,本研究同时测定了OPs的6种代谢产物的浓度,可获得较为全面的暴露和健康风险评估信息。本研究的局限性在于,由于原项目队列设计的原因,在孕产妇纳入队列时未能收集到一些孕早期生活及行为习惯特征信息(居住环境、饮食、运动),无法探究这部分因素对OPs暴露水平的影响。
综上所述, 本研究发现北京地区孕早期妇女广泛暴露于OPs,其暴露整体处于中等水平,暴露水平与孕妇孕前BMI有关,为今后开展孕期农药暴露研究并采取相应的干预措施提供科学依据。孕期暴露于OPs不仅影响妊娠结局,还会对儿童后期健康产生长远的影响,应加强对孕产妇的健康教育,减少家庭杀虫剂的使用,食用果蔬前仔细清洗,减少农药残留造成的不良健康影响。
1 束放,熊延坤,韩梅.2015年我国农药生产与使用概况.农药科学与管理,2016,37:1-6.
2 Katsikantami I,Colosio C,Alegakis A,et al.Estimation of daily intake and risk assessment of organophosphorus pesticides based on biomonitoring data-The internal exposure approach.Food Chem Toxicol,2019,123:57-71.
3 Woskie S,Kongtip P,Thanasanpaiboon W,et al.A pilot study of maternal exposure to organophosphate pesticides and newborn neurodevelopment in Thailand.Int J Occup Environ Health,2017,23:193-201.
4 Hu Y,Ji L,Zhang Y,et al.Organophosphate and pyrethroid pesticide exposures measured before conception and associations with time to pregnancy in Chinese couples enrolled in the Shanghai birth cohort.Environ Health Perspect,2018,126:077001.
5 Kavvalakis MP,Tsatsakis AM.The atlas of dialkylphosphates;assessment of cumulative human organophosphorus pesticides′ exposure.Forensic Sci Int,2012,218:111-122.
6 Jain S,Banerjee BD,Ahmed RS,et al.Possible role of oxidative stress and brain derived neurotrophic factor in triazophos induced cognitive impairment in rats.Neurochem Res,2013,38:2136-2147.
7 Venerosi A,Ricceri L,Scattoni ML,et al.Prenatal chlorpyrifos exposure alters motor behavior and ultrasonic vocalization in CD-1 mouse pups.Environ Health,2009,8:12.
8 Kalliora C,Mamoulakis C,Vasilopoulos E,et al.Association of pesticide exposure with human congenital abnormalities.Toxicol Appl Pharmacol,2018,346:58-75.
9 Razi S,Rezaeian M,Dehkordi FG,et al.Exposure to pistachio pesticides and stillbirth:a case-control study.Epidemiol Health,2016,38:e2016016.
10 Lin S,Li J,Yan X,et al.Maternal pesticide exposure and risk of preterm birth:A systematic review and meta-analysis.Environ Int,2023,178:108043.
11 Wang J,Zheng W,Wang Y,et al.Cohort Profile:The Beijing Birth Cohort Study(BBCS).Int J Epidemiol,2024,53:dyad155 [pii].
12 彭明春,陈其新.生物统计学.第2版.武汉:华中科技大学出版社,2022.
13 Dulaurent S,Saint-Marcoux F,Marquet P,et al.Simultaneous determination of six dialkylphosphates in urine by liquid chromatography tandem mass spectrometry.J Chromatogr B Analyt Technol Biomed Life Sci,2006,831:223-229.
14 Hornung RW,Reed LD.Estimation of Average Concentration in the Presence of Nondetectable Values.App Occup Env Hyg,1990,5:46-51.
15 Barkoski J,Bennett D,Tancredi D,et al.Variability of urinary pesticide metabolite concentrations during pregnancy in the MARBLES Study.Environ Res,2018,165:400-409.
16 Wang Y,Chen L,Wang C,et al.Association Between Organophosphate Pesticide Exposure and Thyroid Hormones in Pregnant Women.Epidemiology,2017,28 Suppl 1:S35-S40.
17 梁毅然.农药对代谢综合征的影响及其代谢机理研究.2017.
18 Wang P,Tian Y,Wang XJ,et al.Organophosphate pesticide exposure and perinatal outcomes in Shanghai,China.Environ Int,2012,42:100-104.
19 Ye X,Pierik FH,Hauser R,et al.Urinary metabolite concentrations of organophosphorous pesticides,bisphenol A,and phthalates among pregnant women in Rotterdam,the Netherlands:the Generation R study.Environ Res,2008,108:260-267.
20 van den Dries MA,Pronk A,Guxens M,et al.Determinants of organophosphate pesticide exposure in pregnant women:A population-based cohort study in the Netherlands.Int J Hyg Environ Health,2018,221:489-501.
21 Bradman A,Eskenazi B,Barr DB,et al.Organophosphate urinary metabolite levels during pregnancy and after delivery in women living in an agricultural community.Environ Health Perspect,2005,113:1802-1807.
22 Llop S,Murcia M,I iguez C,et al.Distributions and determinants of urinary biomarkers of organophosphate pesticide exposure in a prospective Spanish birth cohort study.Environ Health,2017,16:46.
iguez C,et al.Distributions and determinants of urinary biomarkers of organophosphate pesticide exposure in a prospective Spanish birth cohort study.Environ Health,2017,16:46.
23 Ratelle M,C té J,Bouchard M.Toxicokinetics of permethrin biomarkers of exposure in orally exposed volunteers.Toxicol Lett,2015,232:369-375.
té J,Bouchard M.Toxicokinetics of permethrin biomarkers of exposure in orally exposed volunteers.Toxicol Lett,2015,232:369-375.
24 Duggan A,Charnley G,Chen W,et al.Di-alkyl phosphate biomonitoring data:assessing cumulative exposure to organophosphate pesticides.Regul Toxicol Pharmacol,2003,37:382-395.
25 Hardt J,Angerer J.Determination of dialkyl phosphates in human urine using gas chromatography-mass spectrometry.J Anal Toxicol,2000,24:678-684.
26 Lu C,Bravo R,Caltabiano LM,et al.The presence of dialkylphosphates in fresh fruit juices:implication for organophosphorus pesticide exposure and risk assessments.J Toxicol Environ Health A,2005,68:209-227.
27 孙琳,肖霞,李燕,等.云南农村妇女孕早期拟除虫菊酯类农药暴露及影响因素.昆明医科大学学报,2018,39:39-43.
28 苏微,张莹,梁多宏,等.沈阳市产妇孕期有机磷农药暴露水平及其影响因素.中国公共卫生,2017,33:279-283.
29 Santos IS,Matijasevich A,Domingues MR,et al.Late preterm birth is a risk factor for growth faltering in early childhood:a cohort study.BMC Pediatr,2009,9:71.