1型糖尿病(type 1 diabetes mellitus, T1DM)是一种由胰腺β细胞受损引起的慢性自身免疫性疾病,主要表现为胰岛素缺乏和高血糖[1]。T1DM是儿童最常见的糖尿病类型,可引起患儿发生低血糖和酮症酸中毒、微血管病变等并发症,胰岛素治疗是目前T1DM治疗的主要方式[2]。研究表明,在糖尿病发生过程中,胰岛β细胞损伤可能与应激、氧化/抗氧化失衡产生的大量自由基密切相关。在氧化应激状态下,氧自由基超出抗氧化酶的清除能力可能导致细胞功能障碍,包括能量代谢受损,细胞信号传导和细胞周期控制改变,细胞运输机制受损以及整体生物活性功能失调[3]。
研究表明,早产会增加儿童T1DM的风险,因此探究T1DM相关基因表达情况,有助于实现T1DM的早期预防,以避免不良出生结局[4]。研究发现,T1DM 患者中发现了两种与β细胞损伤相关的 miRNA 生物标志物(miR-1225-5p 和 miR-320c)[5]。另外, T1DM患儿和新发T1DM成人血清中CXCL9和CXCL10的水平升高[6-7] 及胰岛巨噬细胞和β细胞本身表达toll样受体(TLR)和其他模式识别受体[8],导致其对微生物和微生物结构(如近距离环境中的病毒)产生反应。然而有关氧化应激和糖尿病致病机制之间的研究主要集中在成人糖尿病中[9],有关其在儿童T1DM中的生物标志需要进一步研究。
本研究基于生物信息学研究手段,利用多水平公共转录组学T1DM相关数据,分析儿童T1DM的氧化应激相关基因(OS related differentially expressed genes,OS-DEGs),通过对(gene expression omnibus, GEO)来源的儿童T1DM测序数据集GSE33440进行深入分析,并结合数据集GSE9006的验证结果,发现TLR4、PTGS2、IKBKG与儿童1型糖尿病氧化应激相关,其中TLR4与IKBKG显著相关。本研究进一步结合单细胞数据集GSE141784,对三个候选基因的细胞类型特异性表达和调控进行分析,为儿童T1DM的研究提供新思路。
资料与方法
一、数据获取及差异基因筛选
从GEO获得GSE33440 和GSE9006 mRNA-Seq数据集,以及GSE141784单细胞转录组数据集。其中,GSE33440用于分析数据,GSE9006用于独立验证。使用“limma”R包(|logFC| >0.3 和P<0.05)[10-12]筛选DEGs。使用关键词“氧化应激” “Oxidative stress”从Genecards数据库获取相关性评分>6.5的OS相关基因。OS-DEGs是通过OS相关基因与GSE33440 DEGs相交来鉴定的。利用 “ggplot2”R 包绘制热图。利用“Seurat”包对单细胞转录组数据进行分析和可视化。
二、方法
1.分组:利用Genecards数据库获取“氧化应激(OS)”相关基因,利用GEO数据集GSE33440,该数据集分析了16 名近期发作的 1 型糖尿病儿童(T1DM组)和 6 名成人健康对照者(健康受试者组)的外周血单核细胞基因表达,确定T1DM相关的基因表达变化。
2.富集分析:利用“ClusterProfiler”R包,对OS-DEGs和差异表达基因列表进行GO分析和KEGG通路富集分析。
3.PPI 网络分析和核心基因验证:利用STRING数据库和Cytoscape程序,对43个OS-DEGs进行PPI网络构建。根据网络分析degree指标选择TNF、TLR4、TFRC、HSPA8、IDH1、CPT2、IKBKG、PTGS2、MAPK1、HSP90B1作为前10个核心基因(hub genes)。利用 GSE9006数据集验证了前10个核心 OS-DEGs 的可靠性,筛选出TLR4、PTGS2、 IKBKG三个基因;将OS-DEG导入STRING数据库,鉴定基因之间的关联。同时,在GSE33440数据集中筛选出排名前10的枢纽基因并进一步验证。
4.统计学处理:使用R软件(4.2.3)进行数据处理,使用Graphpad Prism 9进行t检验,比较T1DM及健康受试组差异。P<0.05表示差异有统计学意义。
结 果
一、氧化应激相关差异基因筛选及差异基因富集分析
如图1A所示,在数据集GSE33440中,基于健康受试者组和T1DM组基因之间的表达比较,获得差异基因546个,相较于健康受试者组,T1DM组上调基因250个,下调基因296个。从GeneCards数据库中筛选1 104个相关性评分>6.5的OS相关基因。将它们进一步与DEG相交,确定了43个OS-DEGs。对43个 OS-DEG 进行富集分析。GO富集分析(图1B)表明,对于生物过程(biological process,BP),OS-DEGs主要富集在氧化应激、细胞对化学应激的反应、脂质分子代谢和细胞对脂多糖的反应等方面。在细胞组分(cellular component,CC)中,OS-DEGs 大量存在于初级内体、线粒体基质、富含 ficolin-1 的颗粒、膜筏、膜微结构域等。在分子功能(molecular function,MF)中,OS-DEGs主要富集于肽结合、酰胺结合、蛋白酶结合、作用于供体硫基的氧化还原活性和抗氧化活性。KEGG富集分析表明,OS-DEGs往往高度参与C型凝集素受体信号通路、脂质与动脉粥样硬化通路、沙门氏菌感染通路和弓形虫病通路(图1C)。
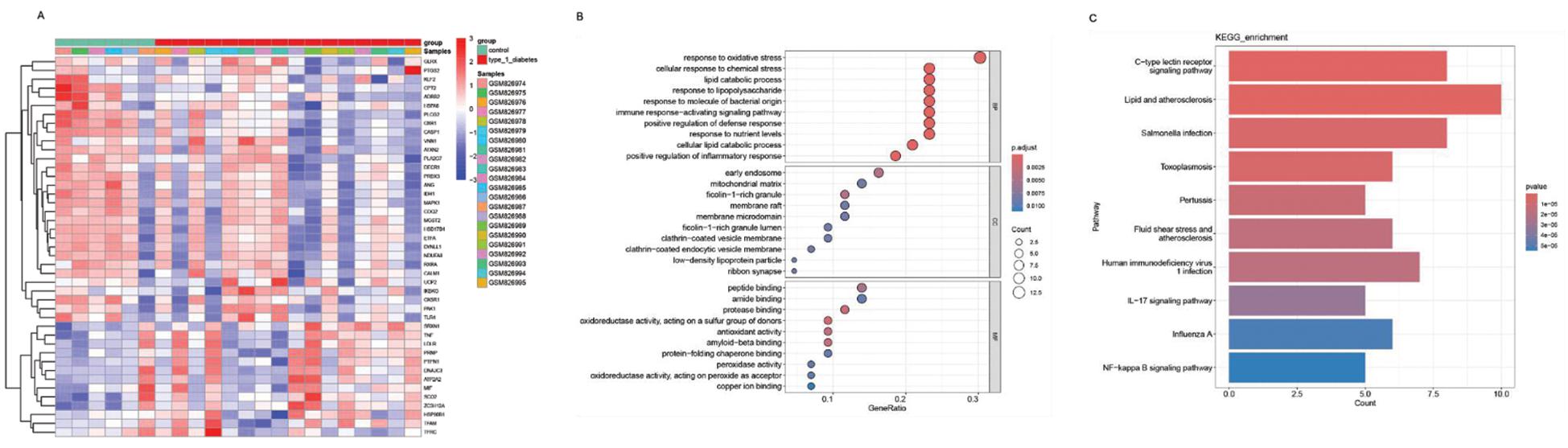
A:heatmap of 43 oxidative stress-related differentially expressed genes(OS-DEGs); B:gene ontology(GO) analysis of the 43 OS-DEGs; C:kyoto encyclopedia of genes and genomes(KEGG) analysis of the 43 OS-DEGs
图1 氧化应激相关差异基因筛选及相关差异基因富集分析
Figure 1 Screening of differential genes associated with oxidative stress and enrichment analysis of related differential genes
二、PPI 网络构建与枢纽基因验证
利用STRING数据库和Cytoscape程序,共对43个OS-DEGs进行了PPI网络构建(图2A)。利用degree指标选择了TNF、TLR4、TFRC、HSPA8、IDH1、CPT2、IKBKG、PTGS2、MAPK1、HSP90B1作为前10个核心基因。此外,还利用 GSE9006数据集验证了前10个枢纽 OS-DEGs 的可靠性,筛选出TLR4、PTGS2、IKBKG(图2B)。相关性分析显示,TLR4与IKBKG成高度正相关(R=0.729, P<0.001)(图 2C-E)。
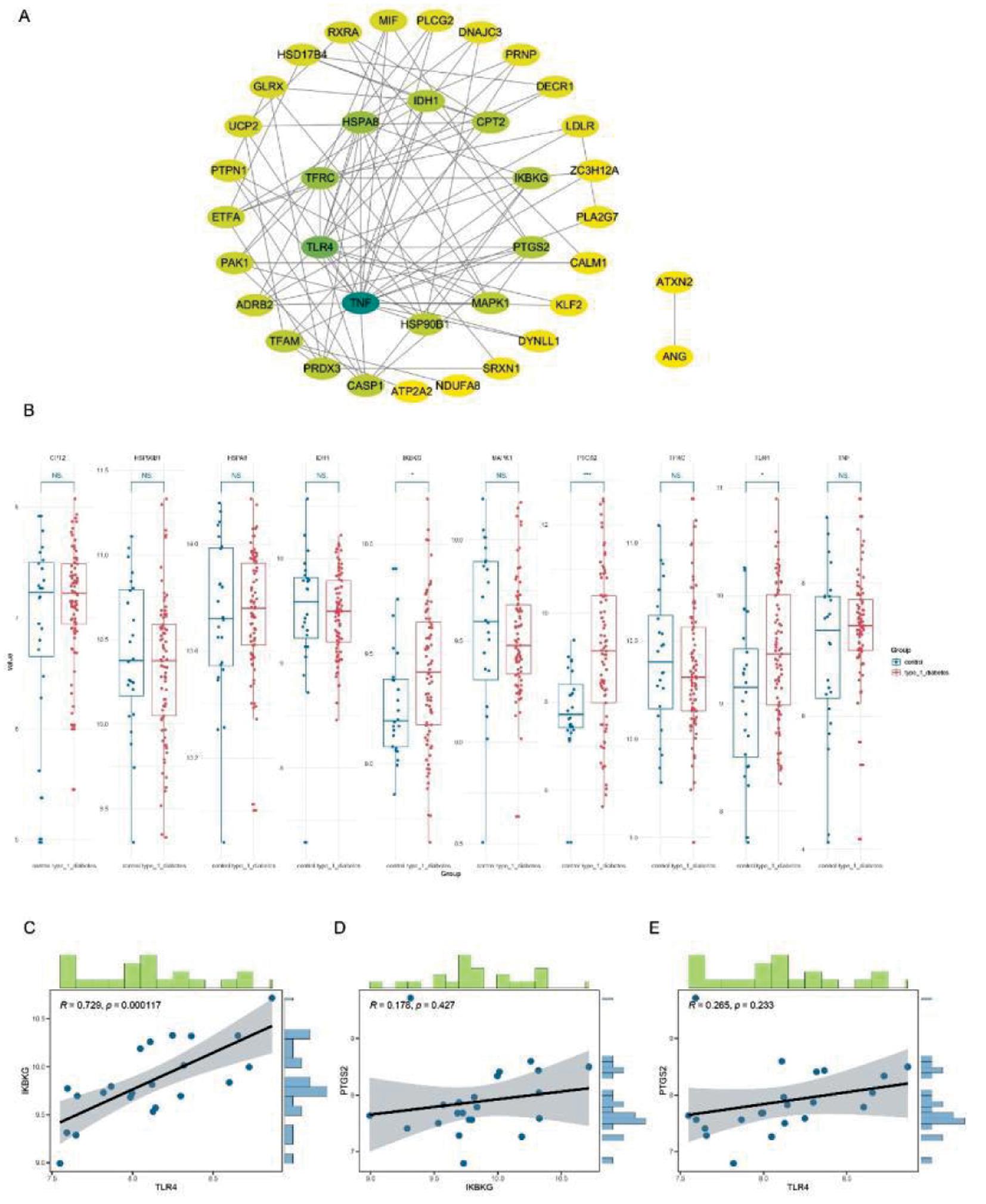
A:protein-protein interaction(PPI) network analysis; B:validation using the GSE9006 dataset; C-E:gene correlation analysis
图2 PPI 网络构建与枢纽基因验证
Figure 2 PPI network and validation of hub genes
三、单细胞数据分析
为了进一步探索T1DM发病过程中TLR4, PTGS2和IKBKG 的作用,本研究分析了T1DM小鼠胰岛单细胞数据集 GSE141784。根据各细胞群的不同maker基因,tSNE降维聚类得到7群细胞(图3A,3B,3D)根据该数据集,取4周、8周、12周三个时间点对不同月龄小鼠进行细胞比例分析发现,T1DM小鼠胰岛的T细胞和B细胞比例随着月龄增加明显增加,而内皮细胞占比逐渐减少(图3C)。另外,研究发现,T1DM发生后,TLR4与IKBKG均匀高表达于各群细胞(图 3E, 3F),而PTGS2主要高表达于经典树突状细胞和巨噬细胞中(图 3G)。
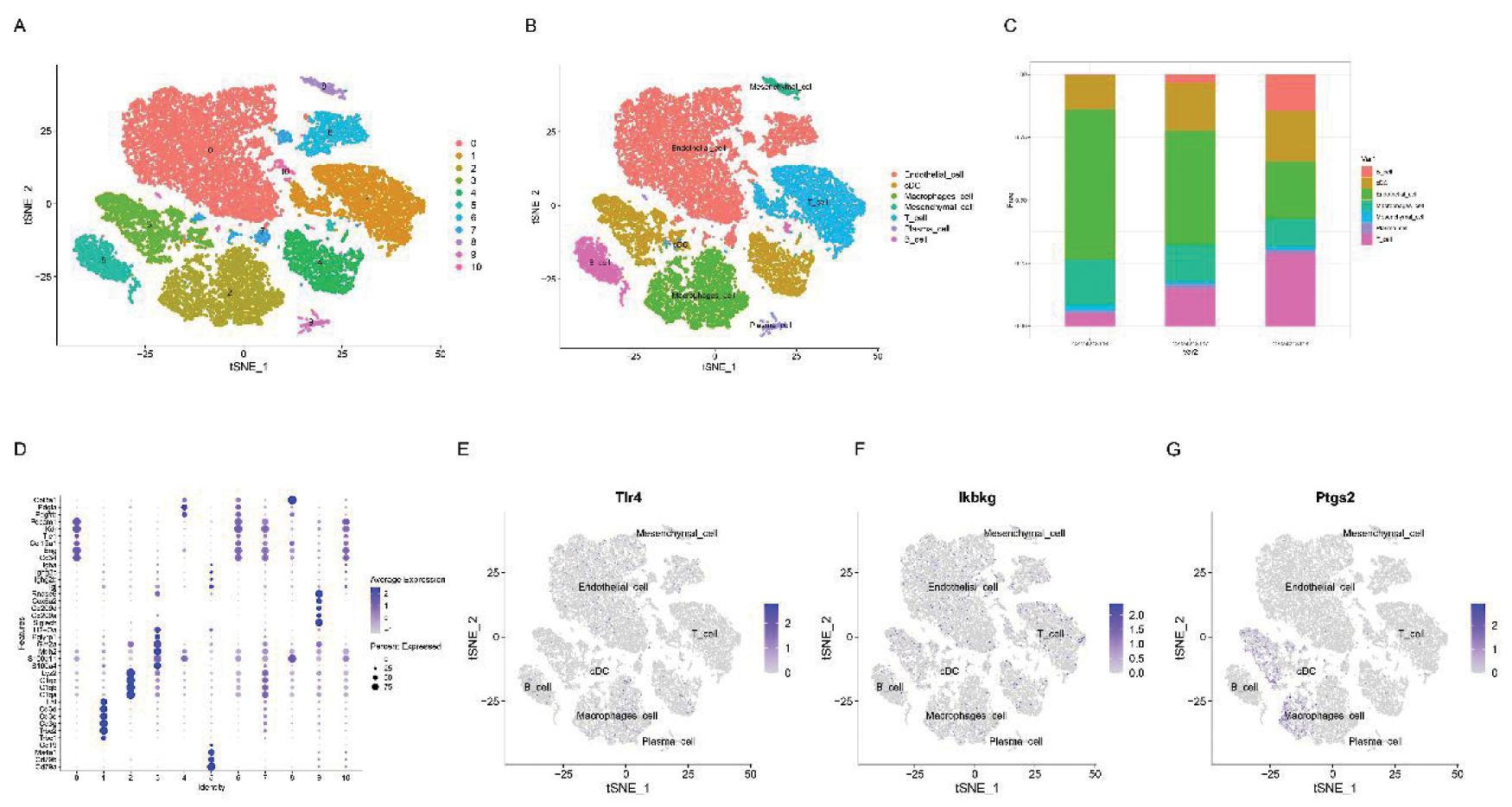
A:t-SNE dimensionality reduction and clustering plot; B:proportions of different cell types at various time points(4 weeks, 8 weeks, 15 weeks); C:localization analysis of the Tlr4; D:localization analysis of the ikbkg; E:localization analysis of the Ptgs2
图3 单细胞数据集GSE141784的验证
Figure 3 Validation of the single-cell dataset GSE141784
讨 论
尽管学界对于儿童T1DM的研究不断深入,但其治疗手段仍然有限,T1DM急性并发症以及高致死率亟待解决。本研究通过对数据集GSE33440 和GSE9006进行生物信息学的分析及验证,发现TLR4、PTGS2和IKBKG可能在儿童T1DM氧化应激相关病理过程中发挥重要作用。进一步使用单细胞数据集GSE141784,发现TLR4可能与IKBKG存在相互作用影响糖尿病患儿氧化应激水平,从而影响T1DM的疾病进程。
高血糖导致糖尿病患者氧化应激水平增加机制复杂,包括线粒体中活性氧(reactive oxygen species,ROS)的产生增加、多元醇途径增强和晚期糖化终产物(advanced glycation end-products, AGE)的形成等[13],具体机制尚不明确。氧化应激通过激活不同转录因子来刺激多种信号通路, 如NF-κB , JNK/SAPK, p38 MAPK等[14]。NF-κB也被称为主要ROS敏感核因子,氧化应激反应可致NF-κB易位至细胞核,并诱导有害基因转录[15],导致胰岛素抵抗和糖尿病发生[16]。遗传学研究表明,IKBKG(nuclear factor kappa-B essential modulator,NEMO)在调节NF-κB的激活中起着重要作用。IKBKG细胞质IκBα 激酶(inhibitor of nuclear factor kappa B alpha,IKK)复合物的一部分,该复合物对大多数细胞外信号(包括 TNF-α 和 IL-1β)的 NF-κB 激活至关重要[17]。研究表明SENP1介导的脂肪细胞NEMO去SUM化限制炎症反应和1型糖尿病进展[18]。同时,TLR4是NF-κB信号通路的上游组分,Toll样受体4(TLR4)是先天免疫应答的关键组成部分[19]。越来越多的证据表明,TLR4与高血压和糖尿病等心血管疾病有关[20]。此外,最近有人提出 TLR4 信号转导可以促进糖尿病发生发展,TLR4的缺失已被证明可以预防高脂肪饮食诱导的胰岛素抵抗和血管炎症[21]。另外,抑制TLR4信号通路的下游分子MyD88(髓系分化因子88)也被证明可以减少ROS诱导的糖尿病视网膜并发症[22]。然而,关于糖尿病期间高血糖、ROS 生成和 TLR4 激活之间直接关系尚有待探索。
环氧合酶2(cyclooxygenase-2,COX2),又名前列腺素内过氧化物酶合酶2(prostaglandin-endoperoxide synthase 2,PTGS2),通常在生理条件下以非常低的水平表达[23]。对肥胖小鼠的研究表明,COX2通路的功能障碍可导致胰岛素抵抗。同时,对这些小鼠施用选择性COX2抑制剂塞来昔布(celecoxib)可以降低胰岛素抵抗[24]。一项随机对照试验表明,2 型糖尿病和肥胖症患者使用塞来昔布3个月可减少炎症标志物并降低胰岛素抵抗[25]。PTGS2/COX2还与在体外存在促炎细胞因子的情况下增强小鼠和人胰岛存活有关[26]。值得关注的是,PTGS2/COX2在其启动子区域表现出特定的NF-κB结合位点,因此,在PTGS2/COX2激活状态下可能发生涉及PTGS2/COX2表达和进一步内源性PGE2合成的反馈回路,导致NF-κB信号传导增加[27]。NF-κB,IKBKG(NEMO),Toll样受体(toll-like receptors,TLR)TLR4, 以及PTGS2(即都与细胞内免疫反应及炎症通路密切相关,且集中于NF-κB通路上下游。提示在儿童T1DM病理过程中氧化应激反应可能与炎症反应密切相关,NF-κB信号通路可能在儿童1型糖尿病发病过程中发挥重要作用。
目前,尚不能明确差异基因与T1DM的因果关系,其上下游机制仍需要进一步研究。此外,缺乏细胞实验及动物实验数据从外部验证生物信息学分析得到的结果。这是本研究局限性所在。未来将从TLR4、PTGS2和IKBKG出发,结合NF-κB通路,探究其在T1DM氧化应激反应中的具体作用机制。综上所述,本研究通过对GEO数据库来源的样本进行生物信息学分析,确定了与T1DM相关的氧化应激基因,探索了可能相关的细胞通路,并进行了单细胞数据集分析。发现TLR4、PTGS2和IKBKG可能通过调节氧化应激反应,在T1DM的发生发展中起到重要作用。
1 ElSayed NA,Aleppo G,Aroda VR,et al.2.Classification and Diagnosis of Diabetes:Standards of Care in Diabetes-2023.Diabetes Care,2023,46:S19-S40.
2 王静,刘莉,程安娜,等.儿童糖尿病酮症酸中毒的临床特征及相关影响因素分析.临床儿科杂志,2024,42:333-338.
3 Dinic′ S,Arambašic′ Jovanovic′ J,Uskokovic′ A,et al.Oxidative stress-mediated beta cell death and dysfunction as a target for diabetes management.Front Endocrinol(Lausanne),2022,13:1006376.
4 Huang K,Si S,Chen R,et al.Preterm birth and birth weight and the risk of type 1 diabetes in Chinese children.Front Endocrinol(Lausanne),2021,12:603277.
5 Liu L,Yan J,Xu H,et al.Two novel microRNA biomarkers related to β-cell damage and their potential values for early diagnosis of type 1 diabetes.J Clin Endocrinol Metab,2018,103:1320-1329.
6 Pöysti S,Silojärvi S,Brodnicki TC,et al.Gut dysbiosis promotes islet-autoimmunity by increasing T-cell attraction in islets via CXCL10 chemokine.J Autoimmun,2023,140:103090.
7 Nicoletti F,Conget I,Di Mauro M,et al.Serum concentrations of the interferon-gamma-inducible chemokine IP-10/CXCL10 are augmented in both newly diagnosed Type I diabetes mellitus patients and subjects at risk of developing the disease.Diabetologia,2002,45:1107-1110.
8 Wen L,Peng J,Li Z,et al.The effect of innate immunity on autoimmune diabetes and the expression of Toll-like receptors on pancreatic islets.J Immunol,2004,172:3173-3180.
9 赵永鑫,辛颖.1型糖尿病儿童氧化应激水平的研究.中国儿童保健杂志,2017,25:675-678.
10 Huang B,Xin C,Yan H,et al.A machine learning method for a blood diagnostic model of pancreatic cancer based on microRNA signatures.Crit Rev Immunol,2024,44:13-23.
11 Nuruddin S,Krogenæs A,Brynildsrud OB,et al.Peri-pubertal gonadotropin-releasing hormone agonist treatment affects sex biased gene expression of amygdala in sheep.Psychoneuroendocrinology,2013,38:3115-3127.
12 Su Y,Wang J,Quan M.Novel insights into the molecular mechanisms underlying the beneficial effects of exercise training on pulmonary arterial hypertension.J Sports Med Phys Fitness,2019,59:1584-1592.
13 Bhatti JS,Sehrawat A,Mishra J,et al.Oxidative stress in the pathophysiology of type 2 diabetes and related complications:Current therapeutics strategies and future perspectives.Free Radic Biol Med,2022,184:114-134.
14 Wronka M,Krzemińska J,M ynarska E,et al.The influence of lifestyle and treatment on oxidative stress and inflammation in diabetes.Int J Mol Sci,2022,23:15743.
ynarska E,et al.The influence of lifestyle and treatment on oxidative stress and inflammation in diabetes.Int J Mol Sci,2022,23:15743.
15 Manoharan RR,Prasad A,Pospíšil P,et al.ROS signaling in innate immunity via oxidative protein modifications.Front Immunol,2024,15:1359600.
16 Baker RG,Hayden MS,Ghosh S.NF-κB,inflammation,and metabolic disease.Cell Metab,2011,13:11-22.
17 Maubach G,Schmädicke AC,Naumann M.NEMO links nuclear factor-κB to human diseases.Trends Mol Med,2017,23:1138-1155.
18 Shao L,Zhou HJ,Zhang H,et al.SENP1-mediated NEMO deSUMOylation in adipocytes limits inflammatory responses and type-1 diabetes progression.Nat Commun,2015,6:8917.
19 Zhang Y,Liang X,Bao X,et al.Toll-like receptor 4(TLR4) inhibitors:Current research and prospective.Eur J Med Chem,2022,235:114291.
20 Carrillo-Sepulveda MA,Spitler K,Pandey D,et al.Inhibition of TLR4 attenuates vascular dysfunction and oxidative stress in diabetic rats.J Mol Med(Berl),2015,93:1341-1354.
21 Kim F,Pham M,Luttrell I,et al.Toll-like receptor-4 mediates vascular inflammation and insulin resistance in diet-induced obesity.Circ Res,2007,100:1589-1596.
22 Tang J,Allen Lee C,Du Y,et al.MyD88-dependent pathways in leukocytes affect the retina in diabetes.PLoS One,2013,8:e68871.
23 Alexanian A,Sorokin A.Cyclooxygenase 2:protein-protein interactions and posttranslational modifications.Physiol Genomics,2017,49:667-681.
24 Cao E,Watt MJ,Nowell CJ,et al.Mesenteric lymphatic dysfunction promotes insulin resistance and represents a potential treatment target in obesity.Nat Metab,2021,3:1175-1188.
25 El-Bahrawy HA,Hegazy SK,Farrag WF,et al.Targeting inflammation using celecoxib with glimepiride in the treatment of obese type 2 diabetic Egyptian patients.Int J Diabetes Dev Ctries,2017,37:97-102.
26 Carboneau BA,Breyer RM,Gannon M.Regulation of pancreatic β-cell function and mass dynamics by prostaglandin signaling.J Cell Commun Signal,2017,11:105-116.
27 Kellogg AP,Cheng HT,Pop-Busui R.Cyclooxygenase-2 pathway as a potential therapeutic target in diabetic peripheral neuropathy.Curr Drug Targets,2008,9:68-76.