病例资料
患者,女,57岁,汉族,2021年4月8日因“阴道流液1+月”于北京大学第三医院治疗,查体外阴及阴道视诊正常,宫颈增粗呈桶状,直径4 cm,宫颈表面未见新生肿物,双合诊宫颈质地硬,子宫活动欠佳,右侧宫旁组织增厚,未达盆壁,三合诊右侧骶韧带缩短,直肠黏膜光滑。行宫颈管诊刮+宫颈活检术,病理提示“非角化型鳞状细胞癌,部分伴神经内分泌表型”,免疫组化结果:P16(弥漫+),Ki-67(80%),PMS2(+),MLH1(+),MSH2(+),MSH6(+),P53(野生型),CK5/6(部分细胞+),Syn(60%细胞弱阳性)。
患者既往妊娠8次,剖宫产2次,自然分娩1次,人工流产5次,无肿瘤家族病史。HPV检测阴性,TCT提示意义不明的非典型鳞状上皮细胞(ASC-US),不除外高度鳞状上皮内病变(ASC-H)。血肿瘤标记物提示癌胚抗原(CEA)明显升高(39.6 ng/mL),鳞状上皮细胞癌抗原(SCC)及神经元特异性烯醇化酶(NSE)均正常。完善PET/CT(图1A)提示宫颈恶性肿瘤可能,向上累及宫体,右侧输尿管下段受累,胰尾部上缘、双侧髂血管旁淋巴结转移。完善CT及核磁(图1B~图1D)提示宫颈明显增大,可见软组织肿块影,3.7 cm×3.2 cm×3.4 cm,病变压迫右侧输尿管远端,其上右侧输尿管及右侧肾盂扩张,胰尾部可见1.3 cm低密度结节。结合患者查体及辅助检查,考虑诊断为“宫颈非角化型鳞状细胞癌(部分神经内分泌表型)IVB期”(FIGO)。患者进一步完善基因检测,微卫星稳定,PD-L1表达阴性,肿瘤突变负荷13.33 Muts/Mb,肿瘤新生抗原负荷中I型HLA杂合性高(6.67 neo-peptide/Mb)。
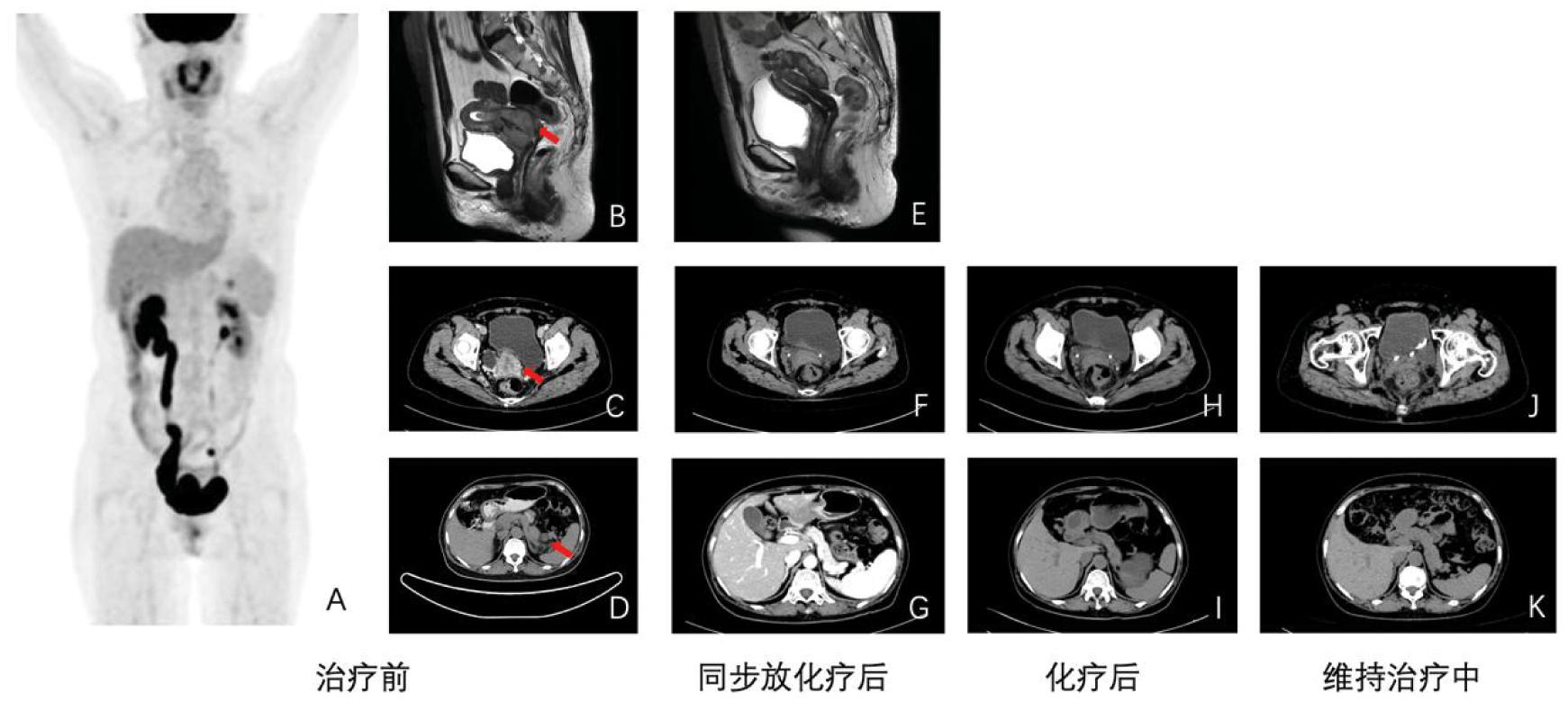
A:治疗前PET/CT;B:治疗前盆腔核磁;C:治疗前宫颈病灶CT;D:治疗前胰尾部病灶CT;E:同步放化疗后盆腔核磁;F:同步放化疗后宫颈病灶CT;G:同步放化疗后胰尾部病灶CT;H:化疗后宫颈病灶CT;I:化疗后胰尾部病灶CT;J:维持治疗中宫颈病灶CT;K:维持治疗中胰尾部病灶CT
图1 患者治疗前后PET/CT、核磁及CT图像
根据美国国家综合癌症网络(NCCN)指南[1],IVB期或有远处转移的患者,一般情况适合局部治疗者,可以选择个体放化疗±全身系统治疗。考虑到该患者有远处转移的情况,建议患者在同步放化疗结束后继续接受全身化疗。患者于2021年4月13日行双侧输尿管支架置入术,缓解泌尿系梗阻,于2021年4月23日至2021年6月19日行盆腔放疗28次(放疗范围:阴道上段+宫颈肿瘤+子宫+盆腔淋巴引流区,DT50.4 Gy/1.8 Gy/28 f)及后装补充治疗6次(DT36 Gy/6 Gy/6 f 2 f/w 3 w),期间行顺铂40 mg/m2+尼妥珠单抗200 mg周疗共6次。同步放化疗期间,患者最高出现II度骨髓抑制(白细胞2.06×109/L,中性粒细胞绝对值1.03×109/L,血红蛋白93 g/L),腹泻7~8次/日,有脱发,未出现其他副反应,予升白细胞等支持治疗后好转。同步放化疗结束后复查CT及核磁(图1E~图1G),宫颈软组织肿块影较前明显缩小,右侧泌尿系扩张较前减轻,原胰尾部病变未见明确显示,盆腔未见明显肿大淋巴结,CEA下降至正常(3.56 ng/mL)。
患者于2021年7月9日至2021年10月9日行白蛋白结合型紫杉醇(260 mg/m2)+顺铂(70~75 mg/m2)+帕博利珠单抗200 mg静脉化疗共4疗程,化疗期间最高出现骨髓III度抑制(中性粒细胞绝对值0.65×109/L),伴肌肉酸痛及恶心,患者化疗结束后复查CT(图1H、图1I),宫颈未见明显异常密度影,复查泌尿系超声双肾盂及输尿管无扩张,考虑治疗效果完全缓解(complete remission,CR)。化疗结束后患者接受帕博利珠单抗200 mg q3w静脉输液维持治疗。帕博利珠单抗维持治疗期间,肿瘤标记物均正常,复查盆腹腔CT(图1J)宫颈未见明显异常密度影,胰腺核磁(图1K)原胰尾部病灶未见显示。
讨论
转移性宫颈癌的患者几乎难以治愈,并且预后极差,五年总生存率仅为10%[2]。 对患者而言,以系统治疗为主,支持治疗为辅助,部分患者可联合局部手术或个体放化疗[3]。靶向治疗和免疫治疗等新兴治疗手段在晚期复发性宫颈癌的治疗上取得了一定的进展。
2022年NCCN宫颈癌指南将免疫治疗纳入一线治疗[1],对于转移性宫颈癌,推荐PD-L1阳性的患者首选帕博利珠单抗+铂类/紫杉醇±贝伐珠单抗作为一线联合治疗方案,帕博利珠单抗也可作为MSI-H/dMMR患者的二线用药。某些情况下,帕博利珠单抗也可以用于高肿瘤突变负荷(≥10 mut/Mb)患者。虽然KEYNOTE-826研究的结果显示,帕博利珠单抗联合化疗(无论是否加用贝伐珠单抗)能够延长持续性、复发或转移性宫颈癌患者的无进展生存期(progression free survival,PFS)和总生存期(overall survival,OS),但PFS仅延长2个月,中位生存期仅为10个月左右,2年OS率也仅增加10%[4],其临床效果令人不甚满意,仍需要积极探索更加行而有效的治疗方案。除了帕博利珠单抗,包括纳武单抗和卡瑞利珠单抗在内的其他PD-1抑制剂也展现出了一定的疗效。在一项I/II期临床试验中评估了纳武单抗对中晚期宫颈癌患者的治疗效果,其中位PFS为5.1个月,26.3%的患者在治疗12个月时无进展[5],另一项多中心II期临床试验证实卡瑞利珠单抗联合阿帕替尼在晚期宫颈癌患者中的客观缓解率(objective remission rate,ORR)为55.6%,PFS为8.8个月[6],鉴于单免疫靶点治疗晚期复发性宫颈癌的效果有限,双特异性抗体如AK-104(抗CTLA4/PD1)等药物主角成为研究热点。吴小华教授在2022年美国妇科肿瘤学会上报道了AK-104用于复发及转移性宫颈癌二线治疗的生存数据,其中位OS为17.51个月,ORR为33%,其中PD-L1阳性患者ORR达43.8%[7]。
表皮生长因子受体(epidermal growth factor receptor,EGFR)与肿瘤的增殖、转移及放化疗敏感性密切相关[8]。在宫颈癌中,EGFR蛋白的表达水平与HPV感染直接相关,并且感染高危型HPV期间产生的致癌基因可通过EGFR促进宫颈癌的发生发展[9]。EGFR的过表达与宫颈癌患者不良预后相关[10]。尼妥珠单抗是针对EGFR的人源化单抗药物,能够竞争性的结合EGFR,阻断下游信号转导通路,从而抑制肿瘤细胞的增殖,促进细胞凋亡,并且能够抑制肿瘤血管生成,增强放化疗疗效[11]。多项研究表明,在局部晚期宫颈癌中,同步放化疗联合尼妥珠单抗较单独放化疗相比,延长了患者的生存期,降低了复发率,并且不增加不良反应发生率[12-14]。EGFR酪氨酸激酶抑制剂吉非替尼具有较强的抑制肿瘤细胞生长作用,并且可能通过抑制Wnt/beta-catenin信号通路抑制肿瘤侵袭[15],有望成为治疗宫颈癌的新策略,但仍需有效的临床试验进一步证实该类药物对晚期宫颈癌的疗效。
血管内皮生长因子(vascular endothelial growth factor,VEGF)是宫颈癌预后不良的标记物,NCCN指南已将VEGF单克隆抗体贝伐珠单抗推荐为治疗转移或复发性宫颈癌的一线联合化疗用药[1]。一项回顾性研究[16]显示贝伐珠单抗联合根治性放化疗的3年OS、无局部复发生存率和无远处转移生存率分别为87.2%、98.1%和81%。但贝伐珠单抗可能增加盆腔放疗史患者发生瘘及穿孔的风险,因此临床上使用时需权衡利弊。
具有靶向神经营养受体酪氨酸激酶(NTRK)融合基因的宫颈癌较为少见,但此类肿瘤对TRK抑制剂治疗较为敏感,NCCN指南提出拉罗替尼和恩曲替尼用于NTRK融合阳性的复发及转移性宫颈癌的二线治疗[1]。聚ADP核糖聚合酶(PARP)抑制剂和抗体药物偶联物(ADC)也在宫颈癌的治疗中展现了一定的疗效,并且更进一步的临床研究正在进行[17]。
本例患者考虑宫颈非角化型鳞状细胞癌(部分神经内分泌表型)IVB期,胰腺转移,从肿瘤病理类型及分期上看,预后不良。该患者首先接受了盆腔放疗及后装治疗同步顺铂放疗,同时加用尼妥珠单抗,增加同步放化疗敏感性。同步放化疗结束后影像学即提示宫颈肿物明显缩小,并且胰腺病灶未再显示,泌尿系压迫表现也明显改善。治疗期间,患者最高出现骨髓II度抑制,有腹泻及脱发,但并未发生严重不良反应,耐受性较好。
人类白细胞抗原(HLA)-I类分子是细胞毒性T细胞反应的重要参与者,HLA基因体细胞突变率增高与HLA功能异常相关,是免疫逃逸的潜在机制,参与肿瘤形成和进展。免疫检查点抑制剂(ICI)的抗肿瘤作用依赖CD8+T细胞,即HLA-I类分子依赖的免疫反应[18]。研究表明接受ICI治疗的患者中,HLA-I类分子杂合性有较好的预后[19]。本例患者完成了基因检测,虽然PD-L1表达阴性,不存在微卫星不稳定,但肿瘤突变负荷≥10 mut/Mb,并且存在高HLA-I类分子杂合性,考虑可以从免疫检查点抑制剂中获益,患者于同步放化疗结束后继续接受白蛋白紫杉醇+顺铂静脉化疗,同时加用帕博利珠单抗,化疗结束后复查CT,原有病灶基本消退。即使经过同期放化疗后完全缓解的宫颈癌患者,仍然有部份病例出现复发及转移,影响预后,因此初始治疗后患者的维持治疗也是目前临床研究的重点难点[20]。考虑患者FIGO分期IVB期、远处转移,结合患者基因检测结果,经过与患者及家属充分讨论,化疗结束后患者继续帕博利珠单抗维持治疗。治疗过程中患者同样未发生严重的不良反应。
近年来,随着基础和临床研究的不断深入,宫颈癌的诊治逐渐进入精准治疗的时代,靶向治疗以及免疫治疗等新兴治疗手段逐渐走入公众视野。对于晚期宫颈癌患者,传统放化疗效果可能较差,如果条件允许,可以积极完善基因检测,为靶向治疗、免疫治疗提供指导,部分患者可以从中获益,甚至可以获得较好的预后,并且不会明显增加治疗的不良反应。
(图1见封底)
1 National Comprehensive Cancer Network.(NCCN) Clinical practice guidelines in oncology.Cervical Cancer,Version 1,2024.
2 Espenel S,Garcia MA,Langrand-Escure J,et al.Special focus on stage IV cervical cancer patients:A decade experience.Oncology,2019,97:125-134.
3 周晖,刘昀昀,罗铭,等.《2023 NCCN子宫颈癌临床实践指南(第1版)》解读.中国实用妇科与产科杂志,2023,39:189-196.
4 Colombo N,Dubot C,Lorusso D,et al.Pembrolizumab for persistent,recurrent,or metastatic cervical cancer.N Engl J Med,2021,385:1856-1867.
5 Naumann RW,Hollebecque A,Meyer T,et al.Safety and efficacy of nivolumab monotherapy in recurrent or metastatic cervical,vaginal,or vulvar carcinoma:Results From the phase I/II checkmate 358 trial.J Clin Oncol,2019,37:2825-2834.
6 Lan C,Shen J,Wang Y,et al.Camrelizumab plus apatinib in patients with advanced cervical cancer(CLAP):A Multicenter,open-label,single-arm,phase ii trial.J Clin Oncol,2020,38:4095-4106.
7 Wu XH,Ji JF,Lou HM,et al.Efficacy and safety of cadonilimab,an anti-PD-1/CTLA4 bi-specific antibody,in previously treated recurrent or metastatic(R/M) cervical cancer:A multicenter,open-label,single-arm,phase II trial.2022 SGO.
8 Nedergaard MK,Hedegaard CJ,Poulsen HS.Targeting the epidermal growth factor receptor in solid tumor malignancies.BioDrugs,2012,26:83-99.
9 Valle-Mendiola A,Bustos-Rodríguez R,Domínguez-Melendez V,et al.Mutations in the helix αC of the catalytic domain from the EGFR affect its activity in cervical cancer cell lines.Oncol Lett,2022,23:71.
10 Schrevel M,Osse EM,Prins FA,et al.Autocrine expression of the epidermal growth factor receptor ligand heparin-binding EGF-like growth factor in cervical cancer.Int J Oncol,2017,50:1947-1954.
11 陈静(综述),冯林春(审校).尼妥珠单抗放疗增敏作用研究进展.解放军医学院学报,2013:895-898.
12 陈杰,曹元杰,朱莉,等.尼妥珠单抗联合同步放化疗治疗局部晚期宫颈癌的临床观察.中华医学杂志,2021,101:597-601.
13 Chen YF,Tang WB,Pan XX,et al.Safety and efficacy of Nimotuzumab combined with chemoradiotherapy in Chinese patients with locally advanced cervical cancer.Onco Targets Ther,2017,10:4113-4119.
14 Qing D,Wu Y,Liu X,et al.Long-term results of concurrent chemoradiotherapy combined with anti-EGFR monoclonal antibody prior to surgery in locally advanced cervical cancer:A single-institute prospective study.Cancer Manag Res,2020,12:12309-12317.
15 Zheng J,Yu J,Yang M,et al.Gefitinib suppresses cervical cancer progression by inhibiting cell cycle progression and epithelial-mesenchymal transition.Exp Ther Med,2019,18:1823-1830.
16 Yang H,Zhang Y,Liu C,et al.The integration of bevacizumab improves tumor response and survival in patients with refractory cervical cancer treated with radical chemoradiotherapy.Ann Transl Med,2021,9:1184.
17 Watkins DE,Craig DJ,Vellani SD,et al.Advances in targeted therapy for the treatment of cervical cancer.J Clin Med,2023,12:5992.
18 Garrido F.HLA Class-I Expression and cancer immunotherapy.Adv Exp Med Biol,2019,1151:79-90.
19 Chowell D,Morris L,Grigg CM,et al.Patient HLA class I genotype influences cancer response to checkpoint blockade immunotherapy.Science,2018,359:582-587.
20 陈晨,王浩渊,梁美嫦.替吉奥联合阿帕替尼维持治疗Ⅲ期宫颈癌的临床效果.中国当代医药,2022,29:93-95,103.