血脂是细胞基础代谢的必需物质,正常脂质代谢在维持新生儿生理功能中发挥重要作用。当胎儿发育异常或新生儿疾病时,可出现血脂代谢异常。新生儿高脂血症可影响胆红素代谢、导致血小板和巨噬细胞功能障碍可增加肺血管压力,亦可降低肺功能、加重支气管肺发育不良等[1]。妊娠期母体的血脂会升高,以支持妊娠的生理适应以及孕产妇和生长中胎儿的营养和激素需求[2]。孕妇营养不良、怀孕期间的炎症或感染等均可能导致对妊娠诱发的脂质代谢变化反应不足,引起孕妇和胎儿脂质水平异常以及不良的妊娠结局[3-5]。越来越多的证据表明怀孕期间不平衡的血脂水平可能会改变胎儿的脂质代谢,从而影响胎儿的生长[6-7]。通常认为妊娠34周后胎儿发育接近成熟,不再对其采取积极干预防止早产,既往研究多关注胎龄小于34周的早期早产儿,胎龄34~36+6周出生的晚期早产儿常被视为低危人群,但与足月儿相比,晚期早产儿的患病风险和病死率更高,低体温、呼吸问题、黄疸和感染等发生率是足月儿的2~10倍,更容易出现营养相关并发症,如低血糖、喂养困难和早期营养不良等;再入院率也是足月儿的2~3倍[8]。本研究旨在探讨着重对比足月新生儿及晚期早产儿血脂水平,并探讨影响初生新生儿血脂水平的相关因素,为精确管理孕母妊娠期及新生儿生后血脂情况提供基础。
对象与方法
一、研究对象
选取2020年1月至12月在本院产检并分娩的孕母为研究对象。入选标准:孕母妊娠期于本院空腹行血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)等各项血脂检测,检测数据及临床资料完整者。排除标准:(1)分娩死胎者;(2)分娩新生儿死亡者。根据分娩时孕周分为足月分娩组(分娩时孕周≥37周)及晚期早产分娩组(34周≤分娩时孕周<37周)。另选取同期分娩后因疾病等转入本院新生儿科的新生儿为研究对象。入选标准:(1)新生儿胎龄34~42周;(2)生后12 h内完善TC、TG、HDL-C及LDL-C等各项血脂检测,检测数据及临床资料完整者。排除标准:(1)双胎或多胎;(2)伴有严重发育畸形者。根据新生儿出生胎龄分为足月新生儿组(胎龄≥37周)及晚期早产新生儿组(34周≤胎龄<37周)。
本研究经本院伦理委员会审批(伦理批号:2021PHB202-001)。
二、研究方法
1.研究设计:回顾性病例对照研究。以北京大学人民医院新生儿科收治的新生儿及本院产检并分娩的孕母为研究人群。探讨足月新生儿及晚期早产新生儿生后早期血脂水平、血脂水平与胎龄、出生体重及孕母妊娠期血脂水平的相关性。
2.资料收集:查阅病历收集以下资料用于本文分析。(1)新生儿资料包括性别、胎龄、出生体重、血脂情况等;(2)孕母资料包括分娩年龄、孕前BMI、分娩方式、是否初产、是否合并糖尿病、高血压、甲状腺疾病、宫内感染及妊娠高尿酸血症等。
3.相关定义:孕早期指妊娠13周末以前;孕中期指妊娠第14~27周末;孕晚期指第28周及其后。
三、统计学方法
应用SPSS 24.0软件进行统计分析。正态分布的计量资料以![]() 表示,组间比较采用两独立样本t检验;非正态分布的计量资料以[M(P25,P75)]表示,两组孕母各期血脂水平比采用Mann-Whitney秩和检验。计数资料以[n(%)]表示,组间比较采用χ2检验(当频数T<5时采用Fisher检验)。新生儿血脂及孕母血脂、胎龄及出生体重相关性分析采用Spearman秩相关分析。采用Logistic回归模型分析孕母血脂水平与早产的关系,计算不同血脂水平下的OR值及其95%CI。双侧P<0.05为差异有统计学意义。
表示,组间比较采用两独立样本t检验;非正态分布的计量资料以[M(P25,P75)]表示,两组孕母各期血脂水平比采用Mann-Whitney秩和检验。计数资料以[n(%)]表示,组间比较采用χ2检验(当频数T<5时采用Fisher检验)。新生儿血脂及孕母血脂、胎龄及出生体重相关性分析采用Spearman秩相关分析。采用Logistic回归模型分析孕母血脂水平与早产的关系,计算不同血脂水平下的OR值及其95%CI。双侧P<0.05为差异有统计学意义。
结 果
一、一般结果
研究期间在本院产检并分娩活产新生儿2 571例,排除分娩新生儿胎龄<34周者56例,足月分娩组2 330例,晚期早产分娩组185例。新生儿转儿科共286例,排除生后24 h内无血脂结果者60例及双胎/多胎新生儿35例,纳入足月新生儿组99例,晚期早产新生儿组92例。足月新生儿儿组转入主要诊断包括新生儿黄疸24例、新生儿窒息22例、新生儿溶血病12例、新生儿感染12例、新生儿羊水吸入12例、新生儿肺炎11例、新生儿血小板减少6例。晚期早产新生儿组有43例为34周≤胎龄<35周,32例为35周≤胎龄<36周,17例为35周≤胎龄<37周。
二、两组新生儿及孕母一般情况比较
晚期早产新生儿组孕母剖宫产比例、合并高尿酸血症及合并糖尿病比例高于足月新生儿组孕母,差异均有统计学意义。两组新生儿男婴比例、孕母分娩时年龄、孕前BMI、初产及合并高血压、宫内感染、甲状腺疾病、自身免疫性疾病比例差异无统计学意义。见表1。
表1 两组新生儿一般情况及孕母情况比较[例(%)/M(P25,P75)]
Table 1 Comparison of general characteristics of newborns and their mothers between the two groups of newborns[n(%)/M(P25,P75)]
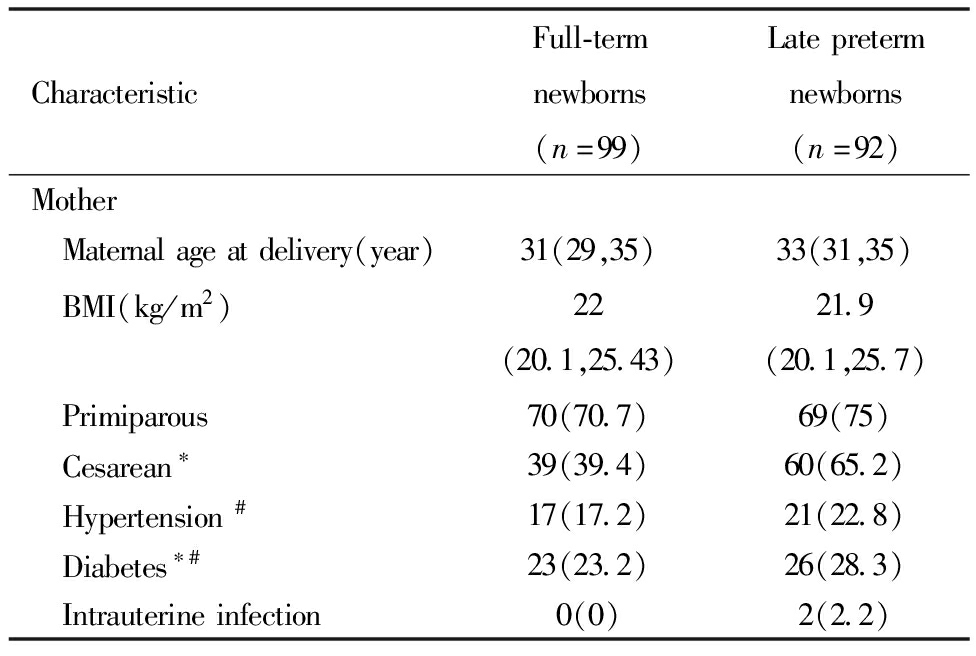
CharacteristicFull-termnewborns(n=99)Latepretermnewborns(n=92)Mother Maternalageatdelivery(year)31(29,35)33(31,35) BMI(kg/m2)22(20.1,25.43)21.9(20.1,25.7) Primiparous70(70.7)69(75) Cesarean∗39(39.4)60(65.2) Hypertension#17(17.2)21(22.8) Diabetes∗#23(23.2)26(28.3) Intrauterineinfection0(0)2(2.2)
表1(续)
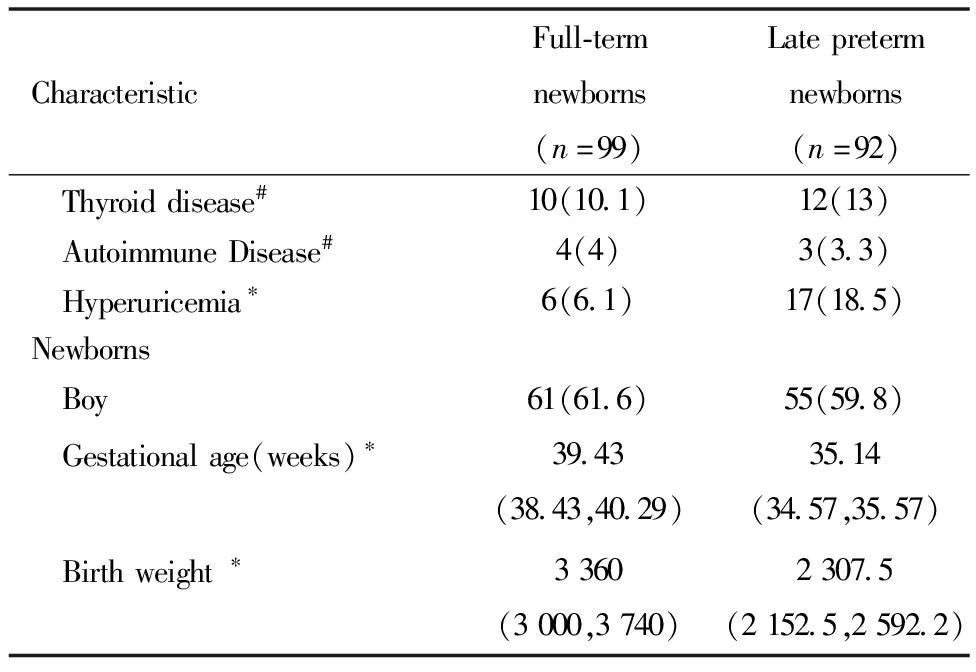
CharacteristicFull-termnewborns(n=99)Latepretermnewborns(n=92) Thyroiddisease#10(10.1)12(13) AutoimmuneDisease#4(4)3(3.3) Hyperuricemia∗6(6.1)17(18.5)Newborns Boy61(61.6)55(59.8) Gestationalage(weeks)∗39.43(38.43,40.29)35.14(34.57,35.57) Birthweight∗3360(3000,3740)2307.5(2152.5,2592.2)
Note:Comparison between the two groups,* P<0.05; #Including pre pregnancy and pregnancy period
三、两组新生儿及孕母血脂水平况比较
晚期早产新生儿组孕母孕早期TC、LDL-C及孕晚期TC、TG、HDL-C、LDL-C均低于足月新生儿组孕母,差异均有统计学意义。晚期早产新生儿TC、HDL-C及LDL-C均高于足月新生儿,TG低于足月新生儿,差异均有统计学意义。见表2。
表2 两组新生儿及孕母血脂水平比较[mmol/L,M(P25,P75)]
Table 2 Comparison of blood lipid concentrations between two groups of newborns and pregnant women[mmol/L,M(P25,P75)]
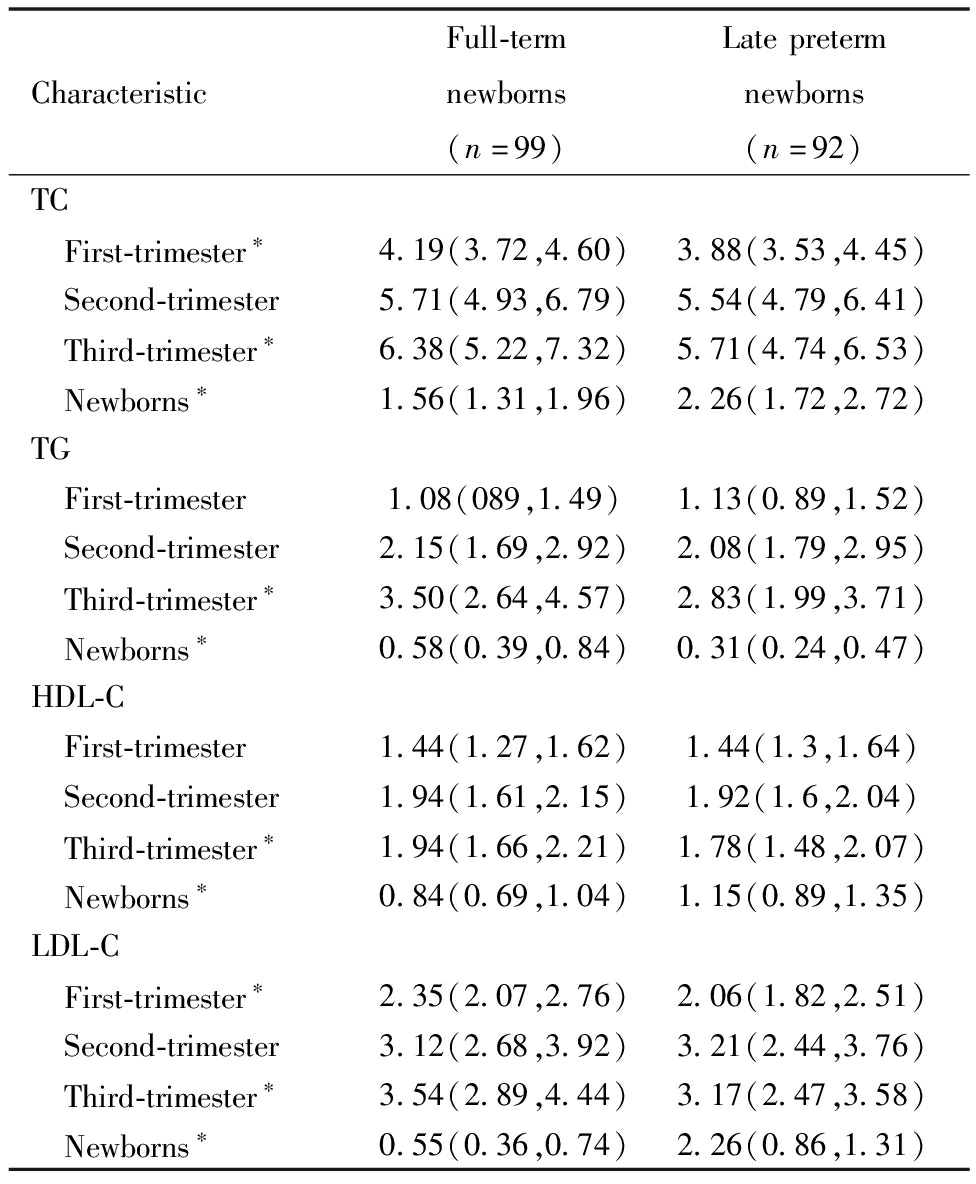
CharacteristicFull-termnewborns(n=99)Latepretermnewborns(n=92)TC First-trimester∗4.19(3.72,4.60)3.88(3.53,4.45) Second-trimester5.71(4.93,6.79)5.54(4.79,6.41) Third-trimester∗6.38(5.22,7.32)5.71(4.74,6.53) Newborns∗1.56(1.31,1.96)2.26(1.72,2.72)TG First-trimester1.08(089,1.49)1.13(0.89,1.52) Second-trimester2.15(1.69,2.92)2.08(1.79,2.95) Third-trimester∗3.50(2.64,4.57)2.83(1.99,3.71) Newborns∗0.58(0.39,0.84)0.31(0.24,0.47)HDL-C First-trimester1.44(1.27,1.62)1.44(1.3,1.64) Second-trimester1.94(1.61,2.15)1.92(1.6,2.04) Third-trimester∗1.94(1.66,2.21)1.78(1.48,2.07) Newborns∗0.84(0.69,1.04)1.15(0.89,1.35)LDL-C First-trimester∗2.35(2.07,2.76)2.06(1.82,2.51) Second-trimester3.12(2.68,3.92)3.21(2.44,3.76) Third-trimester∗3.54(2.89,4.44)3.17(2.47,3.58) Newborns∗0.55(0.36,0.74)2.26(0.86,1.31)
Note:Comparison between the twogroups,*P<0.05
四、新生儿血脂水平与孕母血脂水平、胎龄及出生体重的相关性分析
将191例新生儿血脂水平与孕母血脂水平、胎龄及出生体重进行相关性分析可见,新生儿TG与胎龄及出生体重呈正相关(P<0.05),TC、HDL-C及LDL-C与胎龄及体重呈负相关(P<0.05)。新生儿TC与孕母孕早期TC呈正相关(P<0.05),新生儿TG与孕母孕晚期TG呈正相关(P<0.05),新生儿HDL与孕母妊娠各期HDL-C均呈正相关(P均<0.05),未见新生儿LDL-C与孕母妊娠期LDL-C呈相关性(P>0.05),见表3。
表3 新生儿血脂情况的相关性分析(r)
Table 3 Correlation analysis of neonatal blood lipid status(r)
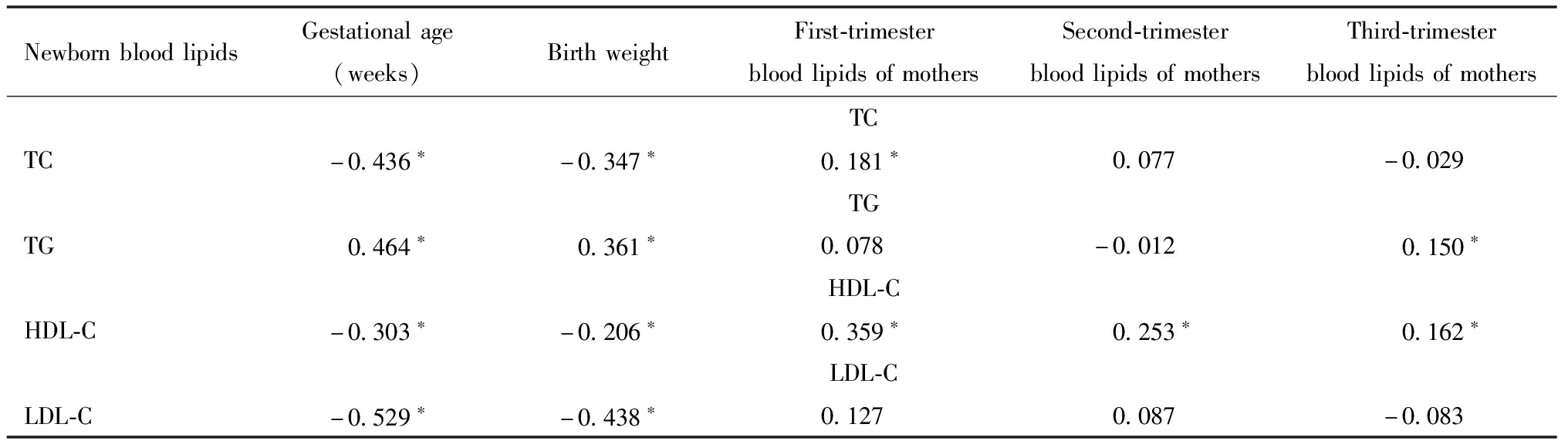
NewbornbloodlipidsGestationalage(weeks)BirthweightFirst-trimesterbloodlipidsofmothersSecond-trimesterbloodlipidsofmothersThird-trimesterbloodlipidsofmothersTCTC-0.436∗-0.347∗0.181∗0.077-0.029TGTG0.464∗0.361∗0.078-0.0120.150∗HDL-CHDL-C-0.303∗-0.206∗0.359∗0.253∗0.162∗LDL-CLDL-C-0.529∗-0.438∗0.1270.087-0.083
Note:*P<0.05
五、孕母妊娠各期血脂水平与晚期早产发生风险的分析
将本院产检并分娩的孕母按分娩时孕周分为足月分娩组(分娩时孕周>37周)及晚期早产分娩组(34周≤分娩时孕周<37周),晚期早产分娩组双胎比例、剖宫产、初产、胎膜早破及合并高尿酸血症、高血压、糖尿病比例、分娩孕周及新生儿出生体重高于足月分娩组,差异均有统计学意义。两组分娩新生儿男婴比例、分娩年龄、孕前BMI及合并宫内感染比例差异无统计学意义,见表4。
表4 两组孕母一般情况比较[例(%)/M(P25,P75)]
Table 4 Comparison of general conditions between two groups of mothers[n(%)/M(P25,P75)]
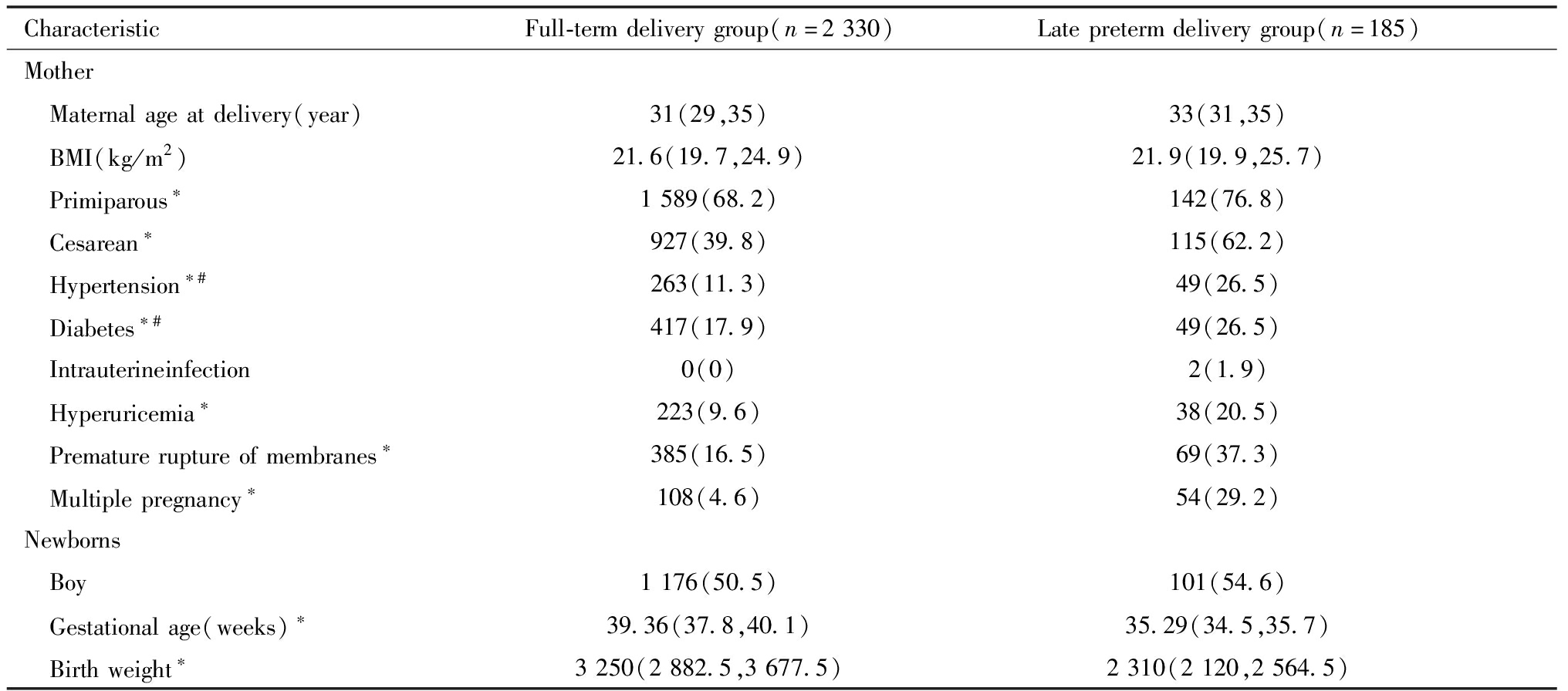
CharacteristicFull-termdeliverygroup(n=2330)Latepretermdeliverygroup(n=185)Mother Maternalageatdelivery(year)31(29,35)33(31,35) BMI(kg/m2)21.6(19.7,24.9)21.9(19.9,25.7) Primiparous∗1589(68.2)142(76.8) Cesarean∗927(39.8)115(62.2) Hypertension∗#263(11.3)49(26.5) Diabetes∗#417(17.9)49(26.5) Intrauterineinfection0(0)2(1.9) Hyperuricemia∗223(9.6)38(20.5) Prematureruptureofmembranes∗385(16.5)69(37.3) Multiplepregnancy∗108(4.6)54(29.2)Newborns Boy1176(50.5)101(54.6) Gestationalage(weeks)∗39.36(37.8,40.1)35.29(34.5,35.7) Birthweight∗3250(2882.5,3677.5)2310(2120,2564.5)
Note:Comparison between the two groups,* P<0.05; #Including pre pregnancy and pregnancy period
在调整孕母分娩时年龄、孕前BMI、初产、胎膜早破、新生儿性别、多胎妊娠即合并高血压、合并糖尿病及合并高尿酸血症后,随着妊娠中期TC、LDL-C及妊娠晚期TC、TG、HDL-C及LDL-C水平的增加,晚期早产分娩的发生风险降低,见表5。
表5 妊娠各期孕母血脂水平和晚期早产发生风险的回归分析
Table 5 Logistic regression model for maternal lipid concentration by trimester and late preterm delivery
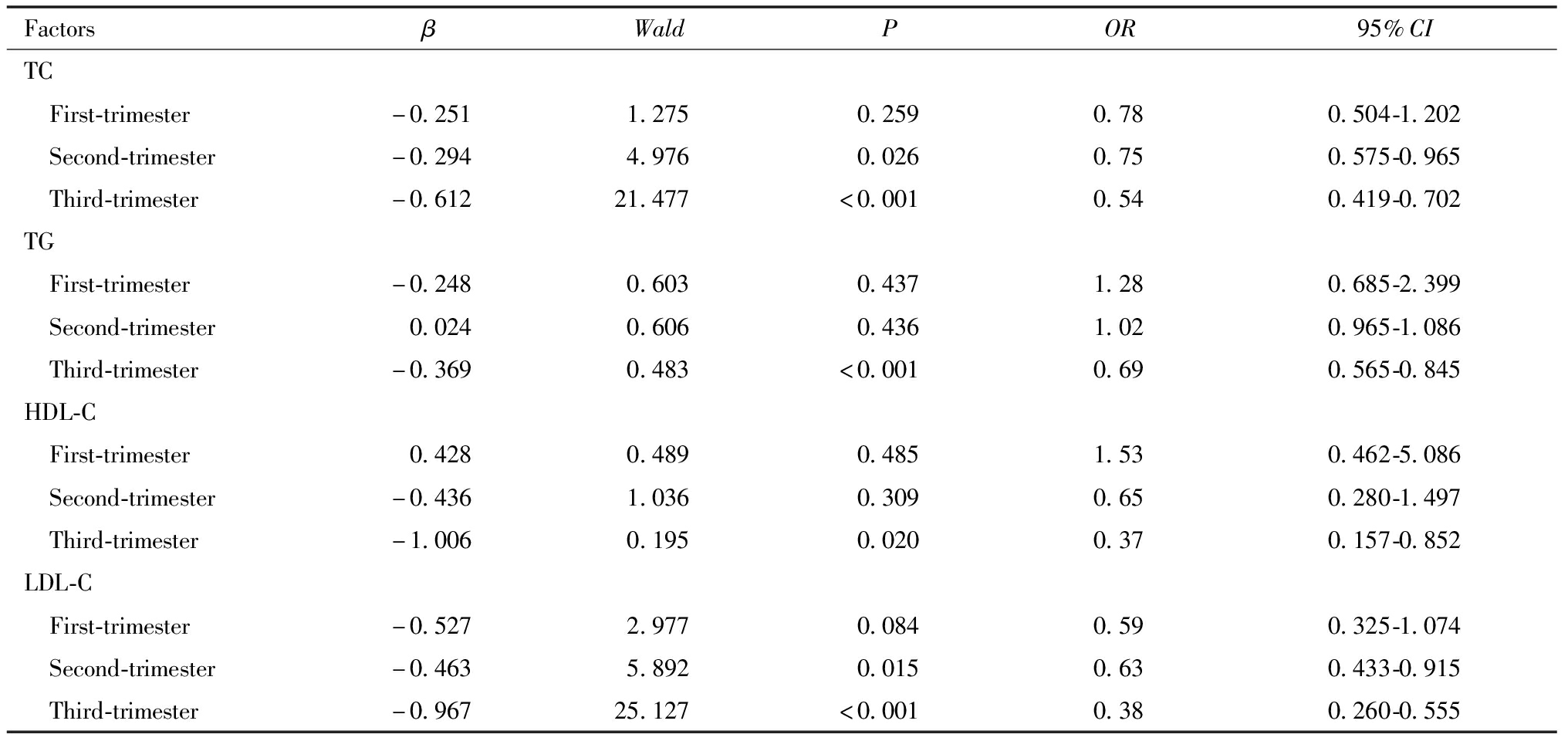
FactorsβWaldPOR95%CITC First-trimester-0.2511.2750.2590.780.504-1.202 Second-trimester-0.2944.9760.0260.750.575-0.965 Third-trimester-0.61221.477<0.0010.540.419-0.702TG First-trimester-0.2480.6030.4371.280.685-2.399 Second-trimester0.0240.6060.4361.020.965-1.086 Third-trimester-0.3690.483<0.0010.690.565-0.845HDL-C First-trimester0.4280.4890.4851.530.462-5.086 Second-trimester-0.4361.0360.3090.650.280-1.497 Third-trimester-1.0060.1950.0200.370.157-0.852LDL-C First-trimester-0.5272.9770.0840.590.325-1.074 Second-trimester-0.4635.8920.0150.630.433-0.915 Third-trimester-0.96725.127<0.0010.380.260-0.555
讨 论
一、孕母及新生儿血脂水平的变化及其重要性
妊娠时孕母体内雌激素和孕酮水平的上升会增强孕妇脂肪组织脂质和肝脏脂质合成,另外孕妇肠道吸收脂质能力增强及肝脏脂肪酶活力下降减弱了内源性脂质代谢,导致孕母血脂脂质水平升高,有利于胎儿从母体获取足够的脂类营养物质[9-10]。妊娠晚期母体脂肪分解代谢增强,酮体生成增多,母体循环中的脂肪酸及胆固醇可通过胎盘转运至胎儿循环,胎儿利用来自母亲的酮体和必需脂肪酸生成脂肪,另一方面胎儿自身也能合成胆固醇。本研究发现与足月新生儿组相比,晚期早产新生儿组生后TC、HDL-C及LDL-C较高,但TG较低,这与既往研究相符[11],有研究认为与在接近出生时加速胎儿发育而消耗营养物质(主要是脂肪)有关[12]。本研究中新生儿血脂与胎龄、出生体重的相关性分析中也有类似的结论。目前许多研究已证实早产及低出生体重与成年期高血压、糖尿病及慢性肾脏病风险增加有关[13-15],而新生儿血脂水平与早产及出生体重的相关性提示血脂异常在其发病机制中可能有重要的作用,需要更深入的研究进行探讨,若在生命早期减少血脂异常的发生有望减少成年后慢性疾病的发病率。
二、足月新生儿与晚期早产新生儿血脂水平的差异及相关影响因素
两组新生儿孕母妊娠期TC及TG随着孕期的增加均有升高趋势,晚期早产新生儿组孕母孕早期TC、LDL-C及孕晚期TC、TG、HDL-C、LDL-C均低于足月新生儿组孕母。新生儿与孕母相关性分析中可见新生儿TC、TG及HDL-C与孕母妊娠期血脂水平呈正相关,未见新生儿LDL-C与孕母妊娠期LDL-C的相关性。已有许多研究涉及新生儿血脂水平与孕母血脂水平关系的研究,但研究结论存在争议。Ghiasi等[16]人发现孕母和新生儿血清TC水平呈正相关,母体LDL-C水平与新生儿TC、HDL-C水平呈正相关。Rodie等[17]发现母体TC和LDL-C水平与新生儿HDL-C水平呈正相关。Ortega等[18]发现母体TC水平与新生儿TC、HDL-C及LDL-C之间呈正相关;母体血清LDL-C水平与新生儿LDL-C和TC水平呈正相关。另一方面,新生儿血脂水平亦会受妊娠期母体疾病的影响,宫内不良环境会引起胎儿内分泌代谢及脂代谢发生改变。例如妊娠期高血压孕妇所分娩新生儿的脐血TC、TG及LDL-CL水平均高于正常对照组,且随母亲高血压程度的加重呈进行性升高[19]。母亲血糖异常同样对新生儿脂代谢产生影响,Scholler等[20]的研究发现,糖尿病患者在高血糖症和(或)高胰岛素血症的影响下,胎盘磷脂转运蛋白(phospholipid transfer protein,PLTP)的表达增加,从而增加母体与胎儿间的胆固醇转化,影响胎儿脂质代谢水平。因此,孕母及新生儿的血脂存在关联性,这些血脂的变化与妊娠合并症、新生儿疾病的关系值得进一步探讨。
三、孕母妊娠各期血脂水平与晚期早产的发生风险
血脂异常一直被认为是一些不良健康结果的风险因素,特别是心血管疾病和2型糖尿病。以往的综述显示妊娠期血脂异常与妊娠期糖尿病(gestational diabetes mellitus,GDM),子痫前期(preeclampsia,PE)和早产(preterm birth,PTB)的风险增加有关[3,21],可能的机制涉及血液黏度增高、血管内皮损伤、胎盘床急性动脉粥样硬化等[22]。Mudd[23]等研究发现,孕母妊娠中期TC、HDL-C及LDL-C水平降低与具有医学指征的早产风险增高相关,而TC、TG和LDL-C水平升高则增加自发性早产的风险。本研究中调整混杂因素后将孕母血脂作为连续型变量进行回归分析,发现妊娠中期TC、LDL-C及妊娠晚期TC、TG、HDL-C及LDL-C水平的增加可减少晚期早产分娩的发生风险。孕母血脂异常是不良妊娠结局的重要影响因素,并且与新生儿代谢有关,通过使用生活方式干预和ω-3脂肪酸补充剂等药物对孕前及孕期的血脂调节可能会改善孕母及子代的预后[24],为孕期血脂异常的管理方面提供了重要临床参考。
四、本研究的优势及局限性
新生儿作为胎儿的延续和个体独立生存的初始阶段,其血脂及脂蛋白代谢状况不仅能帮助评估新生儿的营养状况和疾病状态,而且对于预防成人心血管疾病和代谢性疾病具有指导意义。本研究探讨了足月新生儿和晚期早产新生儿血脂水平的不同,并对新生儿血脂水平的相关影响因素进行探讨,发现与胎龄及出生体重相关,也受到孕母血脂水平的影响。孕母血脂水平方面,收集并分析在整个妊娠期的三个阶段孕母TC、TG、HDL-C水平,可以更好地理解母体脂质影响胎儿生长的适应过程。使用母体血脂水平作为连续变量进行潜在关联评估,对妊娠期血脂水平和晚期早产分娩结果之间的关联进行深入的分析。局限性方面,缺乏对新生儿远期血脂情况及心血管疾病发生的随访,远期随访数据尚待完善;单中心的样本对于自然研究人群的代表性可能存在偏倚;缺乏孕母饮食习惯、受教育程度、经济条件、身高等因素的分析。本研究通过探讨新生儿出生时血脂水平与胎龄、孕母血脂水平的相关性,为评估新生儿的营养状况和疾病状态,且对于预防远期心血管疾病和代谢性疾病提供基础资料。
1 Salama GS,Kaabneh MA,Almasaeed MN,et al.Intravenous lipids for preterm infants:a review.Clin Med Insights Pediatr,2015,9:25-36.
2 Wild R,Feingold KR.Effect of pregnancy on lipid metabolism and lipoprotein levels.Endotext[Internet].South Dartmouth(MA):MDText.com,Inc,2023.
3 Jiang S,Jiang J,Xu H,et al.Maternal dyslipidemia during pregnancy may increase the risk of preterm birth:A meta-analysis.Taiwan J Obstet Gynecol,2017,56:9-15.
4 Zhu SM,Zhang HQ,Li C,et al.Maternal lipid profile during early pregnancy and birth weight:A retrospective study.Front Endocrinol(Lausanne),2022,13:951871.
5 Zhu XZ,Deng ZM,Dai FF,et al.The impact of early pregnancy metabolic disorders on pregnancy outcome and the specific mechanism.Eur J Med Res,2023,28:197.
6 Jin WY,Lin SL,Hou RL,et al.Associations between maternal lipid profile and pregnancy complications and perinatal outcomes:a population-based study from China.BMC Pregnancy Childbirth,2016,16:60.
7 Mudd LM,Holzman CB,Evans RW.Maternal mid-pregnancy lipids and birthweight.Acta Obstet Gynecol Scand,2015,94:852-860.
8 李正红,王丹华,童笑梅,等.晚期早产儿营养管理专家共识.中国循证儿科杂志,2022.
9 Delhaes F,Giza SA,Koreman T,et al.Altered maternal and placental lipid metabolism and fetal fat development in obesity:Current knowledge and advances in non-invasive assessment.Placenta,2018,69:118-124.
10 Liberis A,Petousis S,Tsikouras P.Lipid disorders in pregnancy.Curr Pharm Des,2021,27:3804-3807.
11 Donegá S,Oba J,Maranhão RC.[Concentration of serum lipids and apolipoprotein B in newborns].Arq Bras Cardiol,2006,86:419-424.
12 Herrera E,Amusquivar E.Lipid metabolism in the fetus and the newborn.Diabetes Metab Res Rev,2000,16:202-210.
13 Crump C,Howell EA,Stroustrup A,et al.Association of preterm birth with risk of ischemic heart disease in adulthood.JAMA Pediatr,2019,173:736-743.
14 Chehade H,Simeoni U,Guignard JP,et al.Preterm birth:long term cardiovascular and renal consequences.Curr Pediatr Rev,2018,14:219-226.
15 Andraweera PH,Condon B,Collett G,et al.Cardiovascular risk factors in those born preterm-systematic review and meta-analysis.J Dev Orig Health Dis,2021,12:539-554.
16 Ghiasi A,Ziaei S,Faghihzadeh S.The relationship between levels of lipids and lipoprotein B-100 in maternal serum and umbilical cord serum and assessing their effects on newborn infants anthropometric indices.J Midwifery Reprod Health,2014,2:227-232.
17 Rodie VA,Caslake MJ,Stewart F,et al.Fetal cord plasma lipoprotein status in uncomplicated human pregnancies and in pregnancies complicated by pre-eclampsia and intrauterine growth restriction.Atherosclerosis,2004,176:181-187.
18 Ortega RM,Gaspar MJ,Cantero M.Influence of maternal serum lipids and maternal diet during the third trimester of pregnancy on umbilical cord blood lipids in two populations of Spanish newborns.Int J Vitam Nutr Res,1996,66:250-257.
19 Howlader MZ,Parveen S,Tamanna S,et al.Oxidative stress and antioxidant status in neonates born to pre-eclamptic mother.J Trop Pediatr,2009,55:363-367.
20 Scholler M,Wadsack C,Lang I,et al.Phospholipid transfer protein in the placental endothelium is affected by gestational diabetes mellitus.J Clin Endocrinol Metab,2012,97:437-445.
21 Moayeri M,Heida KY,Franx A,et al.Maternal lipid profile and the relation with spontaneous preterm delivery:a systematic review.Arch Gynecol Obstet,2017,295:313-323.
22 Herrera E,Ortega-Senovilla H.Disturbances in lipid metabolism in diabetic pregnancy-Are these the cause of the problem.Best Pract Res Clin Endocrinol Metab,2010,24:515-525.
23 Mudd LM,Holzman CB,Catov JM,et al.Maternal lipids at mid-pregnancy and the risk of preterm delivery.Acta Obstet Gynecol Scand,2012,91:726-735.
24 Firouzabadi FD,Shab-Bidar S,Jayedi A.The effects of omega-3 polyunsaturated fatty acids supplementation in pregnancy,lactation,and infancy:An umbrella review of meta-analyses of randomized trials.Pharmacol Res,2022,177:106100.