妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠期间发生或首次发现的不同程度的糖耐量异常,是妊娠期最常见的代谢性紊乱疾病之一[1]。2021年,全球有2 106万孕产妇(16.7%)在妊娠期间有某种形式的高血糖[2]。国内报道的GDM患病率在5.3%~40.2%,平均患病率为14.8%,并呈现逐年升高的趋势[3-5]。
健康与疾病的发育起源学说(developmental origins of health and disease,DOHaD)指出,在生命早期经历不良因素暴露,会增加远期慢性疾病的发生风险[6]。GDM作为一种常见的生命早期不良暴露因素,已证实与后代超重、肥胖、2型糖尿病等代谢性疾病风险增加有关,其机制可能与GDM母体炎症水平增加及免疫系统的激活有关[7-8]。除了代谢器官,生命早期神经系统发育也会受到GDM的影响,可能在不同程度增加神经行为发育障碍的风险。有研究显示,GDM后代的认知能力下降、注意缺陷与多动障碍(attention deficit and hyperactivity disorder,ADHD)、孤独症谱系障碍(autism spectrum disorders,ASD)等不良事件的发生率较正常人群有增加[9-12]。但尚未见GDM对子代社交行为影响的报道。本研究拟通过GDM大鼠模型探究GDM对子代社交行为的影响,并初步分析炎症反应在该过程中的作用。
材料与方法
一、材料
1.实验动物:4周龄SPF级健康雌性SD大鼠20只,13周龄SPF级健康雄性SD大鼠20只,由北京大学医学部实验动物科学部提供[SCXK(京)2021-0013]。动物饲养在屏障环境,温度(22.0 ± 2.0)℃,相对湿度50.0%~60.0%,昼夜照明时间为12 h∶12 h。实验动物可自由饮水及进食。实验已得到北京大学伦理委员会批准(LA2021107)。
2.材料与试剂:高脂饲料(配方为猪油10.0%,蔗糖15.0%,蛋黄粉15.0%,酪蛋白5.0%,胆固醇1.2%,胆酸钠0.2%,碳酸氢钙0.6%,石粉0.4%,大鼠基础饲料52.6%),购自北京科澳协力饲料有限公司;链脲佐菌素(streptozotocin,STZ),纯度≥ 98.0%,购自美国Sigma公司。
3.仪器与设备:SPN3001F 电子天平,美国OHAUS公司;稳豪倍易血糖仪,美国Johnson &Johnson公司;GC2030-QP2020 NX气相色谱质谱联用仪,日本岛津公司。
二、方法
1.GDM动物模型建立:采用高脂膳食(high fat diet,HFD)辅以小剂量STZ注射的方法建立GDM大鼠模型[13]。4周龄雌性SD大鼠适应性喂养1周后,根据体重随机分为对照(CON)组和模型(GDM)组。CON组给予基础饲料喂养8周,GDM组给予高脂饲料喂养8周。各组大鼠过夜禁食不禁水12 h后,采集尾静脉血,用快速血糖检测仪测定空腹血糖(fasting plasma glucose,FPG)。将FPG>6.7 mmol/L的动物剔除,选用其他血糖正常的动物进行后续实验。
将CON组和GDM组雌性SD大鼠分别与13周龄健康雄性SD大鼠1∶1合笼交配,于次日清晨行阴道涂片,显微镜下发现精子者认为成功受孕,当天记为孕0天(gestation day 0,GD 0),确定受孕的雌鼠单笼饲养,未受孕的雌鼠重复上述合笼操作。CON组孕鼠整个孕期进食普通饲料,GDM组孕鼠整个孕期继续进食高脂饲料。各组孕鼠过夜禁食不禁水后,于GD5清晨给予GDM组孕鼠腹腔注射1.0% STZ(0.1 mol/L柠檬酸-柠檬酸钠缓冲液配制,pH=4.0~4.2,0.45 μm滤膜过滤后使用)30 mg/kg·bw,注射后72 h测定FPG在6.7 mmol/L以上,即认为GDM模型建立成功。CON组孕鼠在同一时间给予同等剂量的0.1 mol/L柠檬酸-柠檬酸钠缓冲液进行腹腔注射。
所有孕鼠均自然分娩,CON组和GDM组各10窝,每窝于分娩后第3天(post-natal day 3,PND 3)调整至每窝8只仔鼠,雌雄各半。哺乳期内各组母鼠均以母乳正常喂养仔鼠,于PND 21断乳,断乳后各组子代均进食基础饲料,自由饮水。
2.行为学实验:在PND 21(断乳)、PND 56(性成熟期)、PND 98(成年期)三个时期开展一系列行为学实验,每个时间点每窝随机抽取雌雄子代各1只进行实验,即每个时间点每组10只雌鼠,10只雄鼠。旷场实验(open field test,OFT)和高架十字迷宫实验(elevated plus maze test,EPM)以评估大鼠的焦虑状态;新物体识别实验(novel object recognition,NOR)和三箱社交实验(3-chambered social test,3-CST)来评估大鼠的社交行为。见图1。
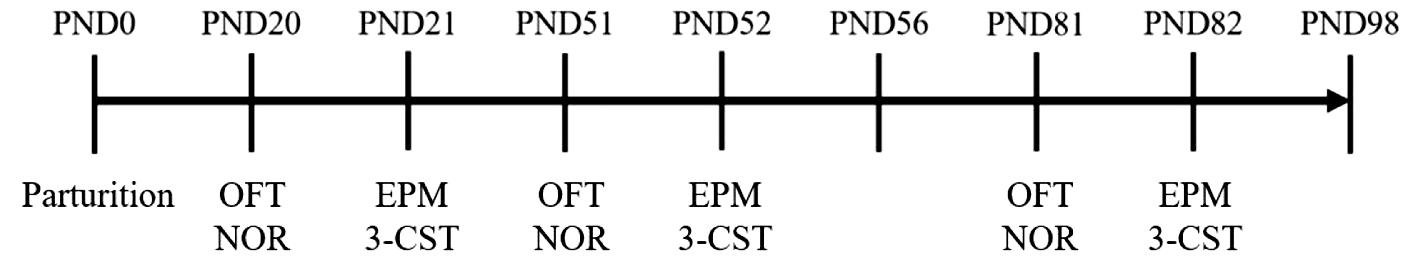
图1 行为学实验时间安排
Figure 1 Timeline of behavioral experiments
(1)旷场实验。于PND 20、PND 51、PND 81进行。旷场实验的敞箱由不透明的黑色有机塑料构成内空立方体(100 cm × 100 cm × 50 cm),底面划线分割为25个等大的方格(20 cm × 20 cm),敞箱中央的方形区设为中央区(60 cm × 60 cm),实验在安静的暗室内进行,每只大鼠单独进行实验,将大鼠放在中央格子后自由探索3 min,每次测试结束后,使用75%酒精擦拭箱体消毒,并清除异物异味。记录3 min内大鼠穿越方格数(三只爪子跨过格子)、直立次数(两只前爪离开地面)、中央区域停留时间(四只爪子全部进入中央区域),以穿越方格数和直立次数之和作为自主活动得分。
(2)高架十字迷宫实验。于PND 21、PND 52、PND 82进行。大鼠高架十字迷宫包括2个相对开放臂(50 cm×10 cm)和2个相对封闭臂(50 cm × 10 cm × 40 cm),闭臂上部是敞开的。迷宫中央有一10 cm × 10 cm的开阔部,迷宫离地面为50 cm。实验在安静的暗室内进行,将大鼠单独放入十字迷宫装置的中央平台处,使其头部正对其中一个开放臂,释放后即开始记录5 min内进入开放臂次数、进入封闭臂的次数以及开放臂停留时间,并计算开放臂进入次数百分比以及开放臂停留时间百分比。
(3)新物体识别实验。于PND 20、PND 51、PND 81进行。实验装置60 cm × 40 cm × 30 cm,两室大小为40 cm × 30 cm × 30 cm,中间有一8 cm × 10 cm小门连接。新物体是红色塑料圆柱体,熟悉物体为蓝色塑料立方体。实验中,两个物体各置一室,呈对角线放置。测试分为三个阶段:适应阶段、熟悉物体阶段和新物体识别阶段。在适应阶段,仔鼠在未放物体的装置内自由活动5 min。在熟悉物体阶段,将仔鼠单独放入确定的起始位置,与两个物体等距,允许仔鼠探索两个相同物体共5 min。1 h后,进行新物体识别实验。将仔鼠单独放置入装置,与两个物体等距,允许仔鼠探索熟悉物体和新物体共5 min。通过视频跟踪系统记录仔鼠运动轨迹。用仔鼠在距离物体5 cm范围的用时t来评估物体识别水平。偏好指数 =(t新物体-t熟悉物体)/(t新物体+ t熟悉物体)。
(4)三箱社交实验。于PND 21、PND 52、PND 82进行。实验由社交倾向和社交新奇偏爱两个测试组成。测试箱为黑色、不透明塑料材质,大小为120 cm × 40 cm × 30 cm。由两块透明隔板将测试箱分为3个区,隔板底部有一个8 cm × 10 cm的小门,可供仔鼠自由穿行。仔鼠在行为测试室适应1 h后开始实验。先将仔鼠单独放入中间室适应5 min,随后开始社交倾向测试,将陌生同种大鼠1随机放入左室或右室的束缚笼,另一只束缚笼放一物体,去掉挡板,允许仔鼠在三个房间中自由活动5 min,接着进行社交新奇偏爱测试,将物体换成新的陌生同种大鼠2,允许仔鼠继续活动5 min,记录仔鼠与物体、鼠1(熟悉鼠)和鼠2(新鼠)的互动时间t。社交倾向指数 =(t熟悉鼠 -t物体)/(t熟悉鼠 + t物体)。社交新奇偏好指数 =(t新鼠-t熟悉鼠)/(t新鼠 + t熟悉鼠)[14]。
3.样本采集:分别于PND 21、PND 56和PND 98,将上述完成行为学实验的每窝雌雄子代各1只(合计每组雌雄子代各10只)隔夜禁食不禁水,次日晨起处死,分离大脑,置于滤纸上充分擦去血迹,用电子天平称量大脑重量;称重后,于冰上快速分离大鼠海马组织,用DEPC水配制的生理盐水冲洗至无血迹后,将海马置于2 mL冻存管中,投入液氮速冻,于-80 ℃冰箱中保存。
4.海马组织蛋白相对表达检测:采用蛋白质免疫印迹法(western blot,WB)检测海马中的细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、环磷酸腺苷反应元件结合蛋白(cyclic AMP response element binding protein,CREB)、酪氨酸激酶受体B(receptor tyrosine kinase receptors B,TrkB)的磷酸化水平,以及脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的相对表达水平。将海马组织解冻,依次进行总蛋白提取、蛋白浓度测定,随后进行电泳、转膜、封闭、抗体孵育、显色检测,并对蛋白相对水平进行量化。
5.海马组织细胞因子水平测定:采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测海马中的白细胞介素-1β(interleukin-1β,IL-1β)、IL-4、IL-6、IL-10等细胞因子水平。海马组织按重量体积比1 g∶9 mL比例加入9倍体积的PBS缓冲液(pH=7.4),匀浆充分后于4 ℃,5 000 g离心10 min,收集上清用于ELISA测定。
6.统计学处理:使用统计软件SPSS 25.0进行统计分析。结果为连续变量,以均值±标准差![]() 采用独立样本t检验比较组间差异。以P<0.05作为差异具有统计学意义的判断标准。
采用独立样本t检验比较组间差异。以P<0.05作为差异具有统计学意义的判断标准。
结 果
一、母鼠孕期血糖水平
因受孕前FPG>6.7 mmol/L的雌鼠已被剔除,所以CON组和GDM组母鼠孕前血糖处于正常范围。GD 9时,GDM组母鼠FPG(14.26±6.24)mmol/L显著高于CON组(6.02±0.63)mmol/L,P<0.05,提示GDM模型建立成功。
二、行为学实验结果
1.旷场实验:与CON组相比,GDM组雌性子代在PND 98自主活动得分显著降低(P<0.05),在其余时期的自主活动得分无显著差异(P>0.05);GDM组雄性子代在各个时期的自主活动得分无显著差异(P>0.05);GDM组雌雄子代在各个时期的中央区域停留时间无显著差异(P>0.05)。见图2。
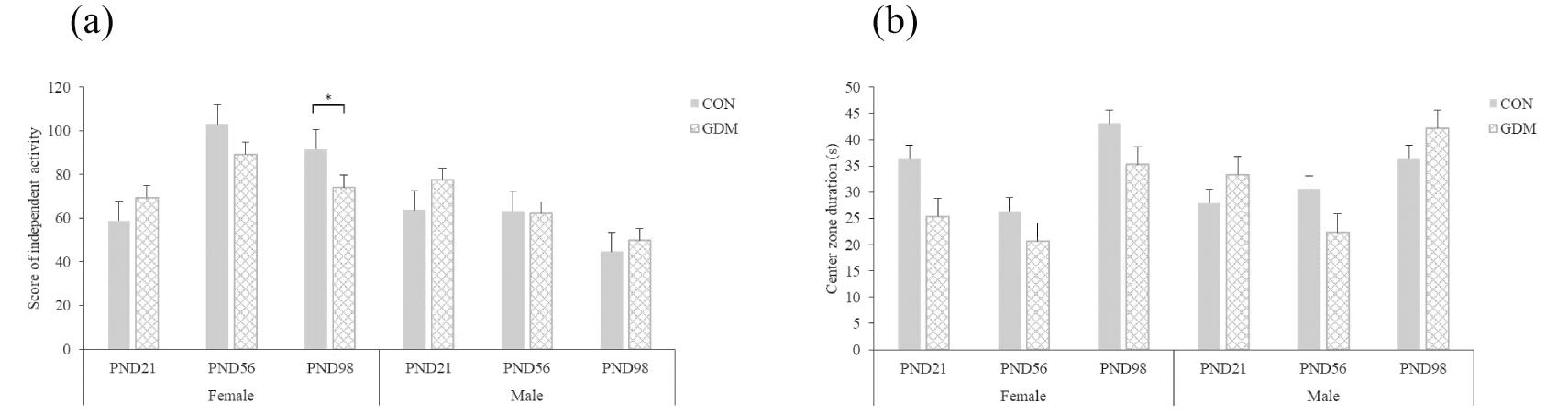
(a) Score of independent activity;(b) Center zone duration.Compared with CON,*P<0.05
图2 旷场实验结果(n=10)
Figure 2 Results of open field tese(OFT)(n=10)
2.高架十字迷宫实验:与CON组相比,GDM组雄性子代在PND 98的开放臂停留时间百分比显著降低(P<0.05),在其余时期的开放臂停留时间百分比无显著差异(P>0.05);GDM组雌性子代在各个时期的开放臂停留时间百分比无显著差异(P>0.05);GDM组雌雄子代在各个时期的开放臂进入次数百分比无显著差异(P>0.05)。见图3。
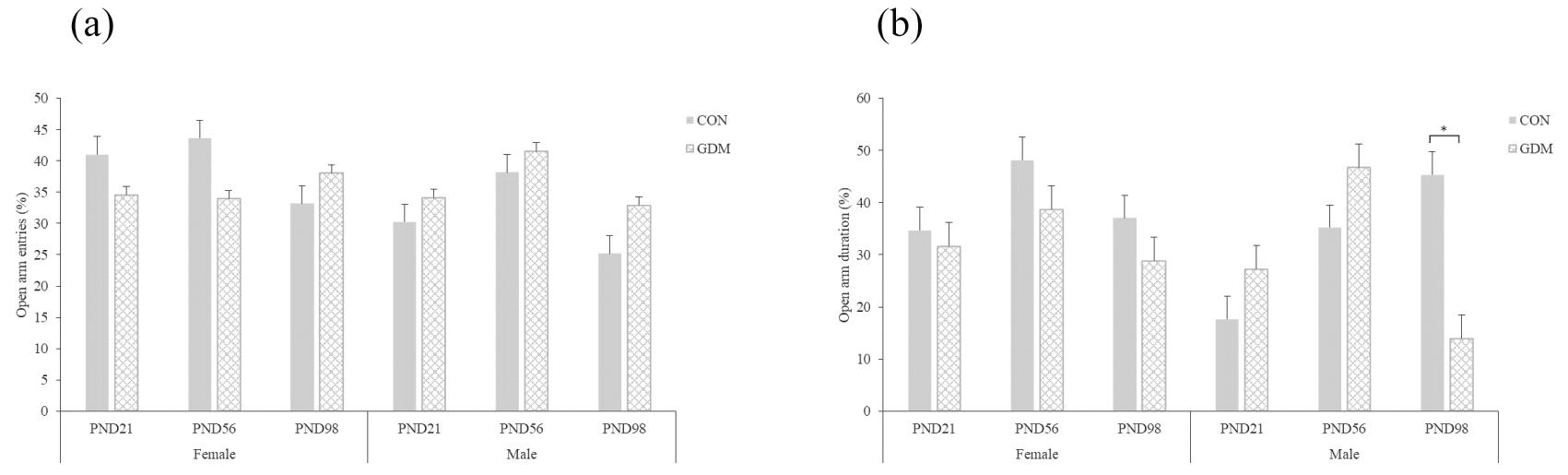
(a) Open arm entries percent;(b) Open arm duration percent.Compared with CON,*P<0.05
图3 高架十字迷宫实验结果(n=10)
Figure 3 Results of elevated plusmaze test(EPM)(n=10)
3.新物体识别实验:与CON组相比,GDM组雌性子代在PND 21的新物体偏爱指数显著降低(P<0.05),在其余时期的新物体偏爱指数无显著差异(P>0.05);GDM组雄性子代在各个时期的新物体偏爱指数无显著差异(P>0.05)。见图4。
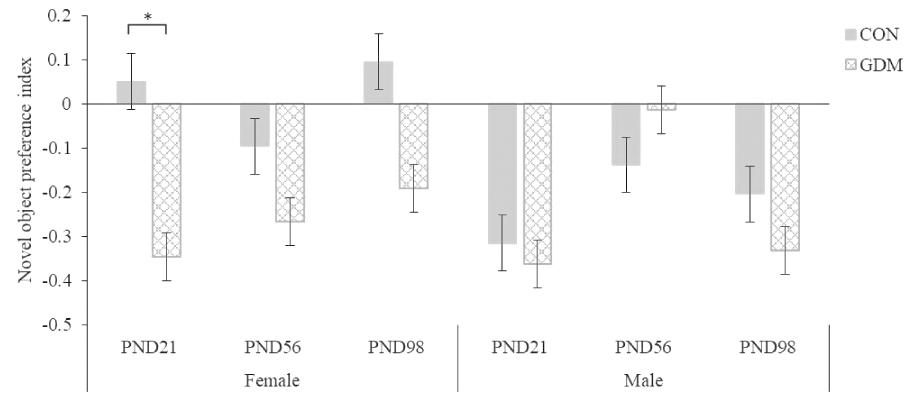
图4 新物体识别实验结果(n=10)
Figure 4 Results of novel object recognition(NOR)(n=10)
4.三箱社交实验:与CON组相比,GDM组雌性子代在PND 21的社交倾向指数显著降低(P<0.05),在其余时期的社交倾向指数无显著差异(P>0.05);GDM组雄性子代在PND 98的社交倾向指数显著降低(P<0.05),在其余时期的社交倾向指数无显著差异(P>0.05);GDM组雌雄子代在PND 98的社交新奇偏好指数也显著降低(P<0.05),在其余各时期的社交新奇偏好指数无显著差异(P>0.05)。见图5。
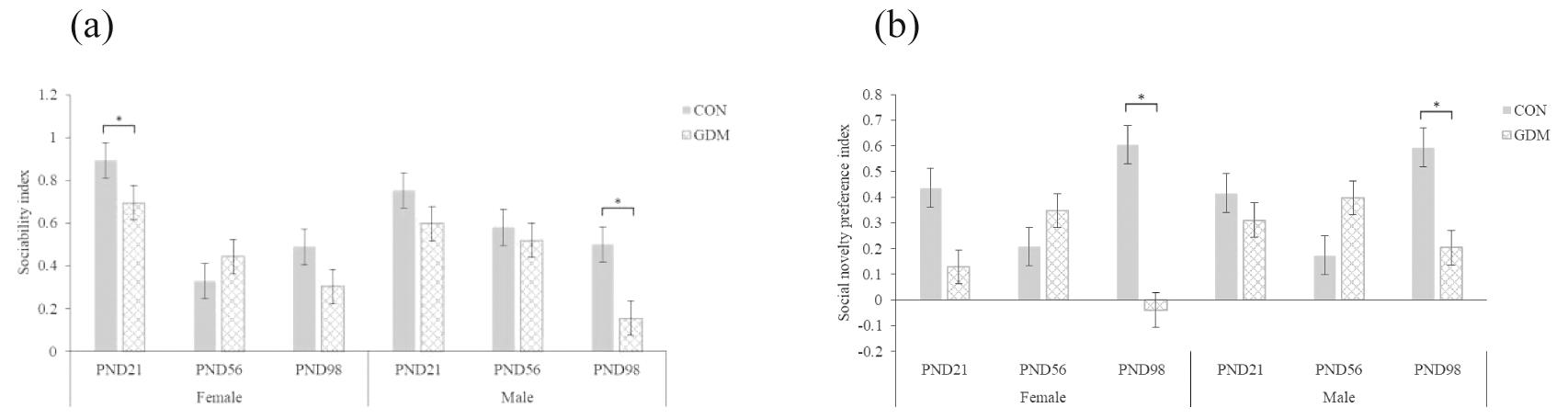
(a) Sociability index;(b) Social novelty preference index.Compared with CON,*P<0.05
图5 三箱社交实验结果(n=10)
Figure 5 Results of 3 chambered social test(3-CST)(n=10)
三、海马组织行为相关蛋白相对浓度
在PND21,与CON组相比:GDM组雌性子代p-ERK、p-CREB蛋白相对表达显著上调(P<0.05),BDNF表达显著下调(P<0.05),p-TrkB表达略有下调,但差异不显著(P>0.05);GDM组雄性子代p-ERK表达显著上调(P<0.05),p-CREB表达显著下调(P<0.05),p-TrkB表达略有下调,但差异不显著(P>0.05),BDNF表达无显著差异(P>0.05)。见图6(a)。
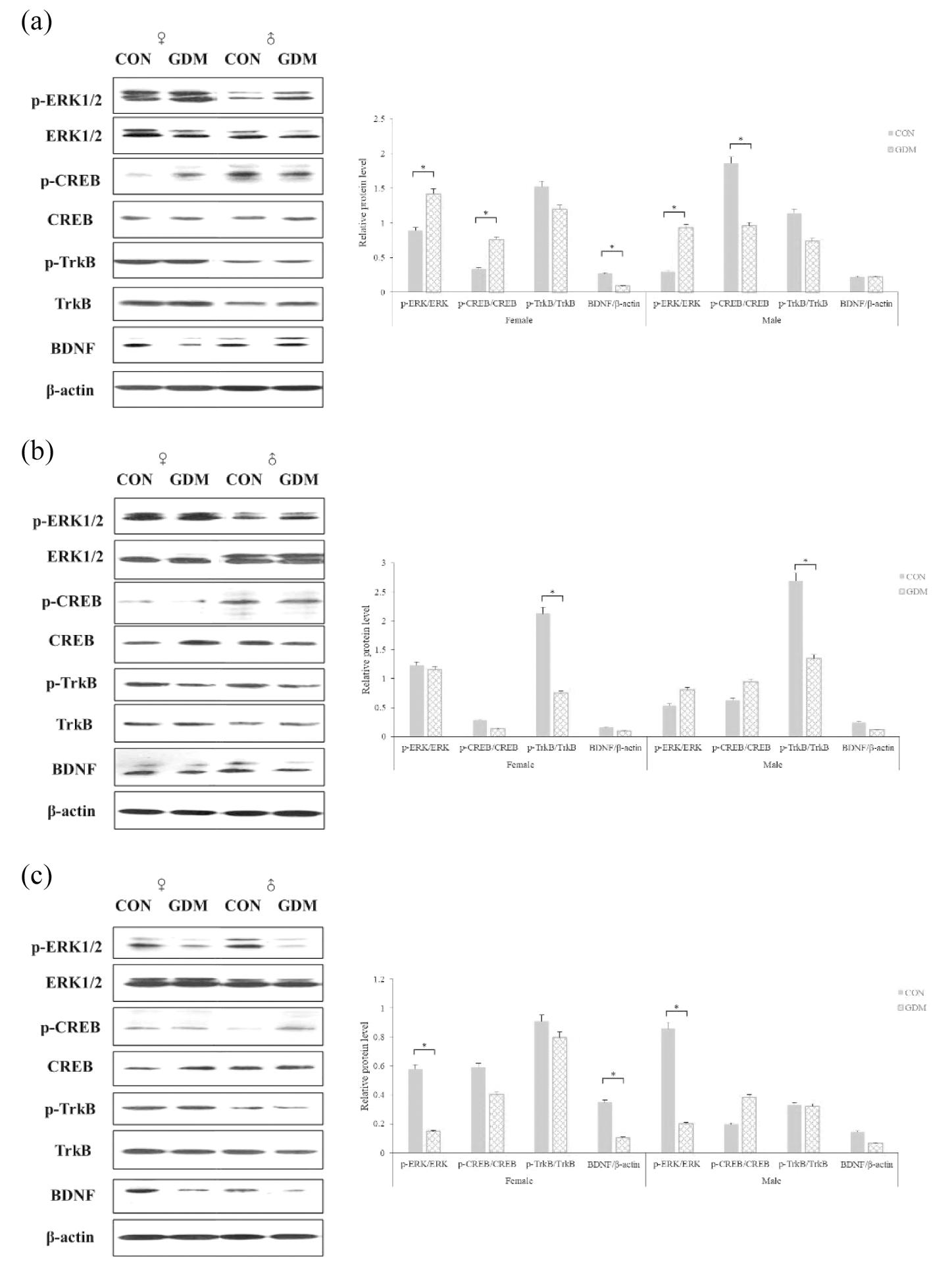
(a)PND 21;(b) PND 56;(c) PND 98.Compared with CON,*P<0.05
图6 海马组织中行为相关蛋白表达情况(n=10)
Figure 6 Expression of behavior-related proteins in hippocampal tissue(n=10)
在PND56,与CON组相比:GDM组雌雄子代p-TrkB表达均显著下调(P<0.05),p-ERK和p-CREB表达无显著差异(P>0.05),BDNF表达绝对值在雌雄两性别后代均呈现GDM组较CON组降低,但无统计学差异(P>0.05)。见图6(b)。
在PND98,与CON中相比:GDM中雌性子代p-ERK、BDNF表达显著下调(P<0.05),p-CREB、p-TrkB表达无显著差异(P>0.05);GDM组雄性子代p-ERK表达显著下调(P<0.05),p-CREB、p-TrkB、BDNF表达无显著差异(P>0.05)。见图6(c)。
四、海马组织细胞因子水平
在PND21,与CON组相比:GDM组雌性子代海马IL-1β、IL-4、IL-6浓度显著下降(P<0.05),IL-10浓度无显著差异(P>0.05);GDM组雄性子代海马IL-4、IL-6、IL-10浓度显著下降(P<0.05),IL-1β浓度无显著差异(P>0.05)。
在PND 56,与CON组相比:GDM组雌性子代海马IL-6浓度显著升高(P<0.05),IL-1β、IL-4、IL-10浓度无显著差异(P>0.05);GDM组雄性子代海马IL-1β、IL-10浓度显著升高(P<0.05),IL-4、IL-6浓度无显著差异(P>0.05)。
在PND98,与CON组相比:GDM组雌性子代海马IL-4浓度显著降低(P<0.05),IL-10浓度显著升高(P<0.05),IL-1β、IL-6浓度无显著差异(P>0.05);GDM组雄性子代海马IL-4浓度显著降低(P<0.05),IL-6浓度显著升高(P<0.05),IL-1β、IL-10浓度无显著差异(P>0.05)。见图7。
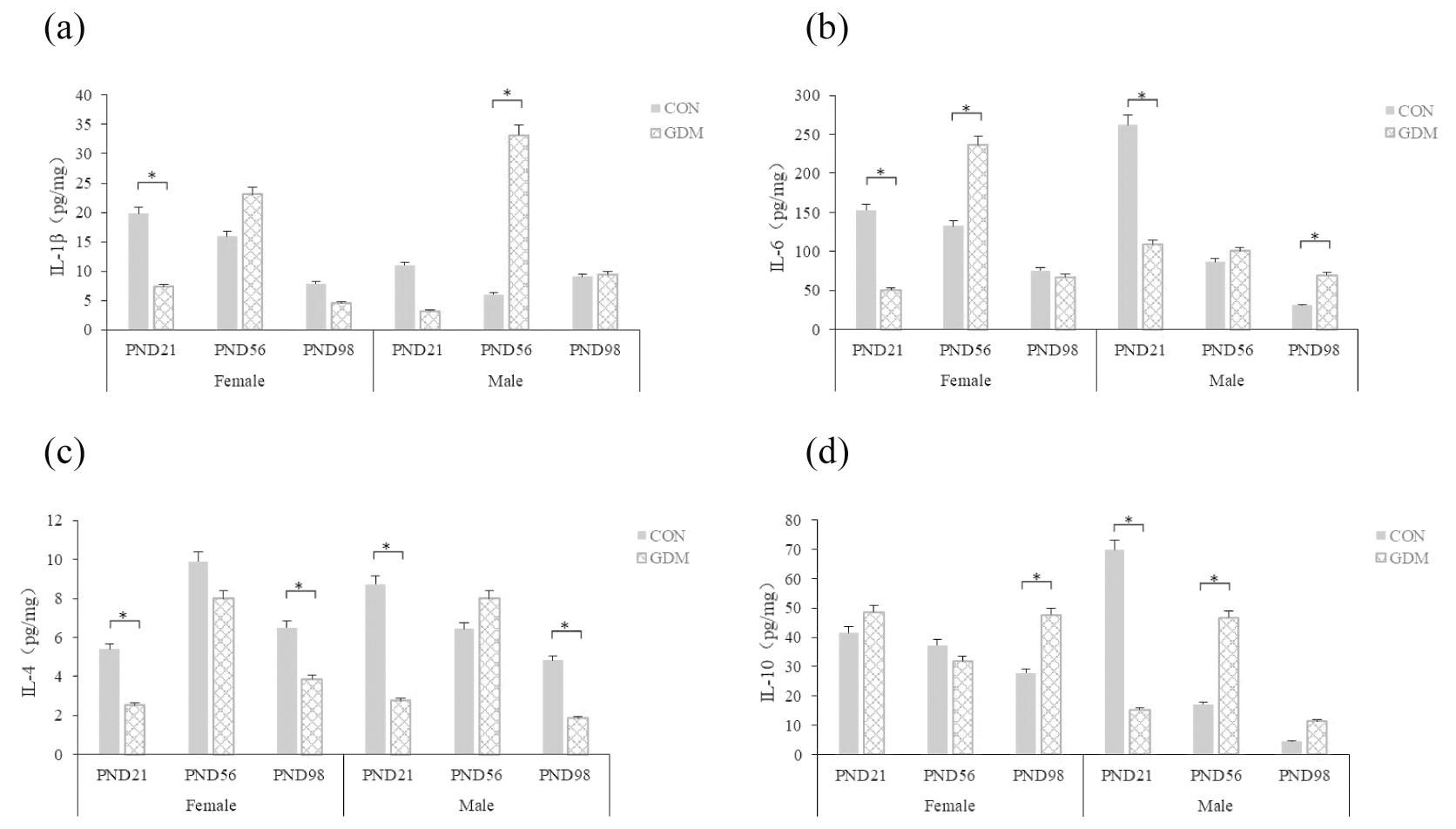
(a) IL-1β;(b) IL-6;(c) IL-4;(d) IL-10.Compared with CON,*P<0.05
图7 海马组织炎症因子水平(n=10)
Figure 7 Levels of inflammatory factors in hippocampal tissue(n=10)
讨 论
在本研究中,通过建立大鼠GDM模型,探究母体罹患GDM对其子代近期及远期社交行为影响及可能机制。结果显示,GDM大鼠子代在部分时期的自主活动得分、中央区域停留时间、开放臂停留时间百分比、新物体偏爱指数、社交倾向指数和社交新奇偏爱指数有不同程度的下降,且上述社交行为改变大多出现在PND 98,较少出现在PND 21(断乳)和PND 56(性成熟期),且雌雄均有发生。这一结果说明,GDM对子代社交行为产生长远影响,在幼年时期可能表现不明显,至成年期才表现出明显的障碍,且雌雄两性别均可出现,没有性别差异,提示GDM对于后代社交行为的影响早期具有隐匿性、不易发现,容易被忽视。
研究表明,自闭症谱系障碍等社交障碍与ERK/CREB信号通路和BDNF/TrkB信号通路密切相关,BDNF参与调节ERK、CREB、TrkB等蛋白的活化(磷酸化)过程,进而在社交和认知功能损伤过程中发挥一定作用[15-17]。本研究对海马组织中行为相关蛋白相对浓度检测后发现,GDM子代在PND 21的ERK、CREB、TrkB的磷酸化水平较正常母体后代上调,而在PND 56(性成熟期)、PND 98的ERK、CREB、TrkB、BDNF水平较正常母体子代均有不同程度下调,这与前述GDM子代社交行为障碍在幼年时期表现不明显,至成年期才明显的现象相吻合,进一步说明GDM对子代社交行为具有深远的影响。
进一步检测海马组织中各类细胞因子水平发现,GDM子代在PND 21海马的促炎细胞因子和抗炎细胞因子大多维持在比正常母体子代低的水平,这可能是由于GDM子代经历宫内高血糖暴露后,免疫系统尚未发育成熟,使得细胞因子水平普遍降低;而在PND 56(性成熟期)和PND 98时(成年后),GDM子代较正常母体子代的海马促炎因子水平增加,抗炎因子水平减低,表现出较高的炎症水平,这与前述BDNF等关键蛋白表达的趋势一致,推断海马细胞因子的变化是上述蛋白活化后的下游产物,也提示GDM母体子代的脑部炎症状态在生命早期可能出现适应性保护改变,但随着时间进展,适应性保护机制逐渐减弱,累积的炎症损伤效应更加明显,可能是GDM子代社交行为出现不同程度障碍的重要原因之一。
本研究通过建立GDM大鼠模型,发现GDM母体后代成年后出现社交行为障碍的风险较正常母体后代明显增加,且雌雄两性别后代均可出现。其机制可能与GDM子代海马组织炎症水平增加,BDNF等行为相关蛋白的表达水平变化有关,详细的分子机制仍需进一步的探索与验证。但本研究提示,GDM后代的社交障碍风险应该引起重视,更加积极有效的预防和干预措施有重要意义。
1 谢幸,孔北华,段涛.妇产科学.北京:人民卫生出版社,2018:105.
2 International Diabetes Federation.IDF Diabetes Atlas,10th edition.Brussels,Belgium:International Diabetes Federation,2021.
3 Gao CH,Sun X,Lu L,et al.Prevalence of gestational diabetes mellitus in mainland China:A systematic review and meta-analysis.J Diabetes Investig.2019,10:154-162.
4 王笑笑,刘情,张英奎,等.2016年河北省妊娠期糖尿病患病率和流行病学特点分析.中国全科医学,2018,21:2592-2596.
5 韩晓华,向治纬,李爱玲.1378例不同年龄孕妇的糖耐量试验特点.农垦医学,2015,37:139-142.
6 Bianco-Miotto T,Craig JM,Gasser YP,et al.Epigenetics and DOHaD:from basics to birth and beyond.J Dev Orig Health Dis,2017,8:513-519.
7 Berbudi A,Rahmadika N,Tjahjadi AI,et al.Type 2 diabetes and its impact on the immune system.Curr Diabetes Rev,2020,16:442-449.
8 Rohm TV,Meier DT,Olefsky JM,et al.Inflammation in obesity,diabetes,and related disorders.Immunity,2022,55:31-55.
9 Nomura Y,Marks DJ,Grossman B,et al.Exposure to gestational diabetes mellitus and low socioeconomic status:effects on neurocognitive development and risk of attention-deficit/hyperactivity disorder in offspring.Arch Pediatr Adolesc Med,2012,166:337-343.
10 Kong L,Norstedt G,Schalling M,et al.The risk of offspring psychiatric disorders in the setting of maternal obesity and diabetes.Pediatrics,2018,142:e20180776.
11 Farahvar S,Walfisch A,Sheiner E.Gestational diabetes risk factors and long-term consequences for both mother and offspring:a literature review.Expert Rev Endocrinol Metab,2019,14:63-74.
12 Ornoy A,Becker M,Weinstein-Fudim L,et al.Diabetes during pregnancy:a maternal disease complicating the course of pregnancy with long-term deleterious effects on the offspring.A Clinical Review.Int J Mol Sci,2021,22:2965.
13 Zhou Y,Zhao R,Lyu Y,et al.Serum and amniotic fluid metabolic profile changes in response to gestational diabetes mellitus and the association with maternal-fetal outcomes.Nutrients,2021,13:3644.
14 韦凤美.早期饲养环境影响成年小鼠社交行为的作用及机制研究.兰州:兰州大学,2021.
15 Yamaguchi H,Hara Y,Ago Y,et al.Environmental enrichment attenuates behavioral abnormalities in valproic acid-exposed autism model mice.Behav Brain Res,2017,333:67-73.
16 Li YJ,Li YJ,Yang LD,et al.Silibinin exerts antidepressant effects by improving neurogenesis through BDNF/TrkB pathway.Behav Brain Res,2018,348:184-191.
17 Ravichandran VA,Kim M,Han SK,et al.Stachys sieboldii extract supplementation attenuates memory deficits by modulating BDNF-CREB and its downstream molecules,in animal models of memory impairment.Nutrients,2018,10:917.