妊娠期糖尿病(gestational diabetes mellitus,GDM)是一种常见的妊娠期代谢性疾病,与子痫前期、妊娠期胆汁淤积症、胎膜早破、早产、巨大儿等密切相关[1],严重危害母婴健康。目前,怀孕24~28周口服葡萄糖耐量试验(oral glucose tolerance tests,OGTT)为大多数医院监测血糖的手段,同期行胰岛素释放试验可用于判定胰岛β细胞分泌功能,协助判断是否存在胰岛素抵抗的情况,临床工作中发现较多孕妇存在胰岛素抵抗,其胰岛素释放试验异常但部分人群OGTT试验并无异常,关于这类孕妇妊娠结局相关研究较少且个体化管理未得到重视。因此,本研究旨在比较胰岛素释放异常组及GDM组孕妇的妊娠结局,并探究妊娠期糖尿病的危险因素,以进一步提高临床对GDM及单纯胰岛素释放异常孕妇个体化管理的重视,为今后临床工作中孕妇健康管理提供相应的指导。
对象与方法
1.研究对象:选取2022年8月—2023年1月山西医科大学第一医院定期产检且住院分娩的 612例孕妇作为研究对象。纳入标准为:(1)年龄18~45岁;(2)单胎妊娠;(3)孕24~28周行OGTT试验及胰岛素释放试验。排除标准为:(1)资料信息不完整;(2)妊娠前有心血管疾病、糖尿病、高血压、血液系统、感染性疾病、恶性肿瘤、多囊卵巢综合征、严重心肺功能不全等疾病;(3)辅助生殖受孕。根据GDM诊断标准,将OGTT试验异常的孕妇纳入GDM组(271例);将仅胰岛素释放试验异常的孕妇纳入胰岛素释放异常组(263例);将OGTT试验以及胰岛素释放试验均正常的孕妇纳入对照组(78例)。本研究回顾性分析患者一般情况及临床结局,不干扰患者的治疗,不涉及个人敏感信息的隐私权,已获得医院科研豁免知情同意。
2.研究方法:在妊娠24~28周,所有孕妇接受75 g口服葡萄糖耐量试验和胰岛素释放试验。OGTT试验正常值:口服葡萄糖前<5.1mmol/L、口服葡萄糖后1 h<10.0 mmol/L、口服葡萄糖后2 h<8.5 mmol/L,任一时间点异常则诊断为GDM。同时,分别于口服葡萄糖前、口服葡萄糖后1 h及口服葡萄糖后2 h抽取静脉血测胰岛素,胰岛素释放试验正常值:(1)空腹胰岛素为5.0~20.0 mU/L;(2)2 h胰岛素水平低于1 h胰岛素水平;(3)血清胰岛素<200 mU/L,(上述三项需同时满足)。收集研究对象年龄、身高、孕前BMI、孕期增重、糖尿病家族史、人工流产史、产次、分娩孕周及生产方式。不良妊娠结局分为母体和新生儿两方面,母体结局包括前置胎盘、胎盘早剥、胎膜早破、子痫前期、甲状腺功能减退、高脂血症、高尿酸血症、产后出血、妊娠期肝内胆汁淤积症、脐带缠绕、羊水过多、羊水过少、胎儿生长受限、早产;新生儿结局包括胎儿窘迫、巨大儿、新生儿窒息、新生儿高胆红素血症、转儿科等。以上妊娠结局诊断标准均参考9版《妇产科学》[2]。
3.统计学方法:使用SPSS 26.0统计软件对收集的进行处理。正态分布的计量资料以均数±标准差![]() 表示,多组间比较采用单因素方差分析,组间两两比较行采用LSD-t检验;计数资料以例(%)表示,采用χ2检验。以P<0.05为差异有统计学意义。
表示,多组间比较采用单因素方差分析,组间两两比较行采用LSD-t检验;计数资料以例(%)表示,采用χ2检验。以P<0.05为差异有统计学意义。
结果
1.各组一般资料比较:与对照组比较,胰岛素释放异常组及GDM组孕前BMI依次升高(P<0.05),GDM组年龄以及人工流产史、糖尿病家族史、经产妇发生率升高(P<0.05),GDM组身高、孕期增重以及分娩孕周降低(P<0.05)。与胰岛素释放异常组比较,GDM组年龄、孕前BMI升高(P<0.05),GDM组孕期增重、分娩孕周降低(P<0.05)。见表1。
表1 各组一般资料比较![]() 例(%)]
例(%)]
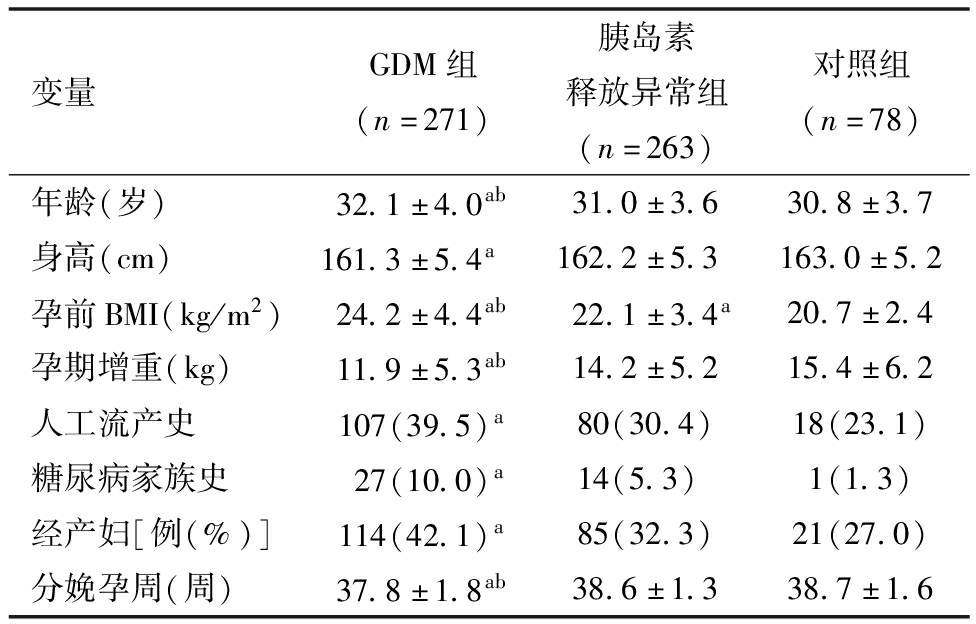
变量GDM组(n=271)胰岛素释放异常组(n=263)对照组(n=78)年龄(岁)32.1±4.0ab31.0±3.630.8±3.7身高(cm)161.3±5.4a162.2±5.3163.0±5.2孕前BMI(kg/m2)24.2±4.4ab22.1±3.4a20.7±2.4孕期增重(kg)11.9±5.3ab14.2±5.215.4±6.2人工流产史107(39.5)a80(30.4)18(23.1)糖尿病家族史27(10.0)a14(5.3) 1(1.3)经产妇[例(%)]114(42.1)a85(32.3)21(27.0)分娩孕周(周)37.8±1.8ab38.6±1.338.7±1.6
注:与对照组比较,aP<0.05;与胰岛素释放异常组比较,bP<0.01。
2.各组妊娠结局比较:与对照组比较,GDM组、胰岛素释放异常组胎膜早破、甲状腺功能减退、高脂血症发生率升高(P<0.05),GDM组剖宫产、子痫前期、高尿酸血症、早产、新生儿高胆红素血症以及转儿科发生率升高(P<0.05)。与胰岛素释放异常组比较,GDM组剖宫产、子痫前期、高脂血症、早产发生率升高(P<0.05)。见表2。
表2 各组妊娠结局比较[例(%)]
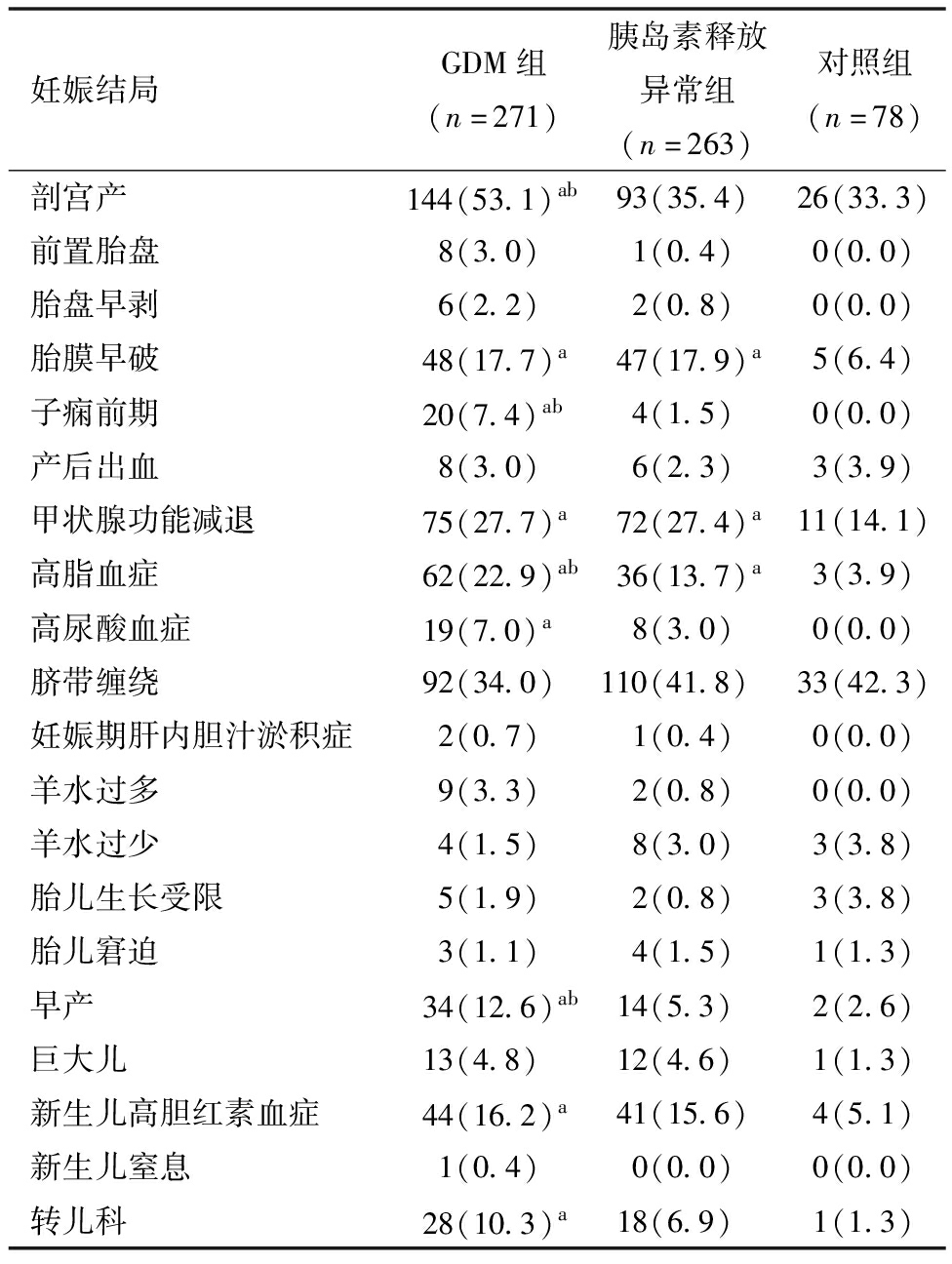
妊娠结局GDM组(n=271)胰岛素释放异常组(n=263)对照组(n=78)剖宫产144(53.1)ab93(35.4)26(33.3)前置胎盘 8(3.0) 1(0.4)0(0.0)胎盘早剥 6(2.2) 2(0.8)0(0.0)胎膜早破48(17.7)a47(17.9)a5(6.4)子痫前期20(7.4)ab 4(1.5)0(0.0)产后出血 8(3.0) 6(2.3)3(3.9)甲状腺功能减退75(27.7)a72(27.4)a11(14.1)高脂血症62(22.9)ab36(13.7)a3(3.9)高尿酸血症19(7.0)a 8(3.0)0(0.0)脐带缠绕92(34.0)110(41.8)33(42.3)妊娠期肝内胆汁淤积症 2(0.7) 1(0.4)0(0.0)羊水过多 9(3.3) 2(0.8)0(0.0)羊水过少 4(1.5) 8(3.0)3(3.8)胎儿生长受限 5(1.9) 2(0.8)3(3.8)胎儿窘迫 3(1.1) 4(1.5)1(1.3)早产34(12.6)ab14(5.3)2(2.6)巨大儿13(4.8)12(4.6)1(1.3)新生儿高胆红素血症44(16.2)a41(15.6)4(5.1)新生儿窒息 1(0.4) 0(0.0)0(0.0)转儿科28(10.3)a18(6.9)1(1.3)
注:与对照组比较,aP<0.05;与胰岛素释放异常组比较,bP<0.01。
3.Logistic回归分析GDM的影响因素:以GDM妊娠结局为因变量,以年龄、经产妇、身高、孕前BMI、孕期增重、人工流产史、糖尿病家族史为自变量,采用Logistic回归分析,结果显示,孕前BMI(OR=1.16,95%CI为1.10~1.22),糖尿病家族史(OR=2.62,95%CI为1.29~5.32)均是GDM发生的独立危险因素(P<0.05)。见表3。
表3 多因素Logistic回归分析
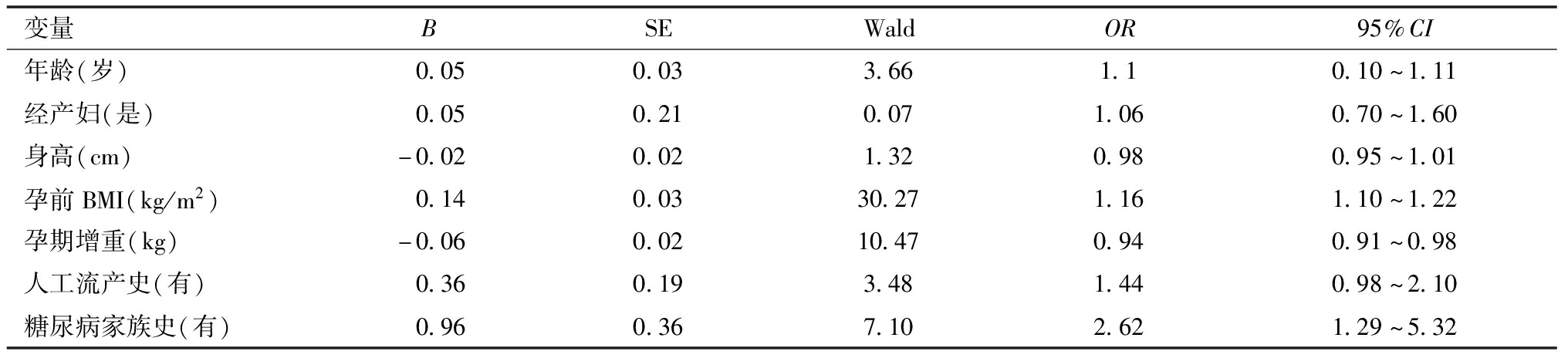
变量BSEWaldOR95%CI年龄(岁) 0.050.033.661.10.10~1.11经产妇(是) 0.050.210.071.060.70~1.60身高(cm)-0.020.021.320.980.95~1.01孕前BMI(kg/m2) 0.140.0330.271.161.10~1.22孕期增重(kg)-0.060.0210.470.940.91~0.98人工流产史(有) 0.360.193.481.440.98~2.10糖尿病家族史(有) 0.960.367.102.621.29~5.32
讨论
正常妊娠期间胰岛素敏感性下降,导致胰岛素分泌相对不足,为保证胎儿的能量供应,葡萄糖生成增加;而GDM孕妇存在胰岛β细胞功能障碍,胰岛素抵抗进一步增加,最终发生葡萄糖代谢紊乱。既往研究表明,GDM孕妇不良妊娠结局发生率显著增加[3],从而影响母婴健康。在高血糖环境下,内皮细胞血管保护、抗炎和抗血栓作用消失,血小板分泌的血栓素A2增加,血管舒张因子降低[4],增加子痫前期的发生率。本研究中,GDM组子痫前期发生率明显高于胰岛素释放异常组及对照组。本研究发现,GDM组剖宫产率、早产发生率明显高于胰岛素释放异常组及对照组。子痫前期可以影响母体多脏器功能,易引起胎儿生长受限、胎儿窘迫、新生儿窒息等,通常需要提前行剖宫产术终止妊娠,间接导致了早产及剖宫产发生率的增高。
本研究表明,GDM组及胰岛素释放异常组胎膜早破发生率均高于对照组。长期胰岛素抵抗增加及葡萄糖代谢紊乱,机体清除自由基的能力受损,多种炎症介质作用下,间叶细胞释放的蛋白溶解酶增加,羊膜组织遭到破坏,胎膜早破发生率升高[5]。同时,机体的高血糖环境可导致羊水量增多,胎膜的张力变大,易发生胎膜早破[6]。目前研究表明,甲状腺功能减退与胰岛素抵抗密切相关,由于甲状腺激素参与机体葡萄糖的吸收及利用,其功能减退可引起机体的糖脂代谢紊乱,加重胰岛素抵抗。研究发现,甲状腺功能减退症和GDM相互影响,一种疾病可促进另一种疾病的发生发展[7-8]。本研究中,GDM组及胰岛素释放异常组甲状腺功能减退症发生率均高于对照组,与上述研究一致。研究证明,在胰岛素抵抗和糖尿病患者中可出现高脂血症、脂质沉积加重及体重增加[9-10],胰岛素抵抗可增加脂肪生成酶的基因或蛋白表达,将体内多余的营养物质转化为肝脏中的脂质储存,诱导高脂血症[11-12]。脂质的持续过度沉积会进一步加重胰岛素抵抗,出现血糖升高[13]。本研究中,GDM组、胰岛素释放异常组及对照组高脂血症发生率依次降低。本研究发现,与对照组相比,GDM组高尿酸血症发生率升高。国内外研究中GDM孕妇在妊娠24~28周时的血清尿酸较高,且妊娠早期高尿酸血症可增加GDM的风险[14-15],尿酸水平增高一方面可引起内皮功能障碍,NO的生成减少,由于胰岛素对骨骼肌和脂肪组织细胞中葡萄糖的摄取依赖于NO,因此葡萄糖摄取减少和胰岛素抵抗加重;另一方面还可引起脂肪细胞的炎症和氧化应激,从而导致代谢紊乱,出现肥胖和血脂异常。非妊娠女性血清尿酸水平升高与胰岛素抵抗和2型糖尿病风险增加有关[16]。
GDM与多种新生儿不良结局有关[17],可增加早产、胎儿窘迫、新生儿窒息及新生儿高胆红素血症等的风险,从而新生儿进一步转儿科率增加[18-19]。本研究中,GDM组新生儿高胆红素血症及转儿科发生率高于对照组,与既往研究结果相符。妊娠期进展性胰岛素抵抗和代偿性高胰岛素血症使胎儿能量代谢增加,机体处于相对慢性缺氧的环境,为满足正常的代谢,胎儿体内红细胞数量增多,然而分娩后在短时间内过多的红细胞遭到破坏,导致新生儿高胆红素血症[20]。GDM女性的新生儿高胆红素血症的发生率高于正常妊娠女性,且GDM女性新生儿的胆红素水平在出生后48小时内显著增加[21],而重度高胆红素血症导致急性脑病和核黄疸的潜在风险有待进一步研究。
Logistic回归分析显示,孕前BMI、糖尿病家族史是GDM发生的独立危险因素。孕前BMI过高,可导致脂肪过度堆积,促进了 GDM 的发生[22-23]。因此,孕期需对孕妇的BMI进行监测,尽早临床干预,控制孕期体重增长[24-25]。然而,有研究表明,孕期体重增长过多可增加GDM的风险[26],在本研究中,GDM组孕期增重低于胰岛素释放异常组及对照组,结合本研究GDM组孕前BMI高于胰岛素释放异常组及对照组,考虑出现该现象与妊娠期间管理有关。GDM一经确诊,临床医师会对孕妇进行饮食指导及相应的体重管理,使得GDM孕妇合理增重。遗传因素在GDM发病机制中起显著作用,研究表明,GDM 的发生与多种遗传易感因素有关,但具体的机制有待进一步研究。因此,对于有糖尿病家族史的女性,可在孕前或者孕早期开展饮食体重管理,早期干预可减少GDM的发生。
综上所述,GDM和单纯胰岛素释放异常孕妇不良妊娠结局发生率均高,因此,在妊娠24~28周行OGTT试验时,建议同期行胰岛素释放试验,密切关注孕妇的血糖及胰岛素指标,加强对GDM孕妇及单纯胰岛素释放异常孕妇的孕期管理,给予相应的饮食运动指导,对于改善母婴结局非常重要。
1 Law KP,Zhang H.The pathogenesis and pathophysiology of gestational diabetes mellitus:Deductions from a three-part longitudinal metabolomics study in China.Clin Chim Acta,2017,468:60-70.
2 谢幸,孔北华,段涛,主编.妇产科学,第9版.北京:人民卫生出版.
3 Reinders P,Zoellner Y,Schneider U.Real-world evaluation of adverse pregnancy outcomes in women with gestational diabetes mellitus in the German health care system.Prim Care Diabetes,2020,14:633-638.
4 Joshi NP,Madiwale SD,Sundrani DP,et al.Fatty acids,inflammation and angiogenesis in women with gestational diabetes mellitus.Biochimie,2023,212:31-40.
5 Wen L,Chen Y,Liu T,et al.Different subtypes of gestational diabetes mellitus are associated with distinct perinatal outcomes in twin pregnancies.Diabetes Res Clin Pract,2023,204:110920.
6 黄兆明,卢锦娥.血糖水平控制正常妊娠期糖尿病孕妇的围产结局分析.中华妇产科杂志,2018,53:625-629.
7 Stoica RA,Drăgana N,Ancuceanu R,et al.Interleukin-8,CXCL10,CXCL11 and their role in insulin resistance in adult females with subclinical hypothyroidism and prediabetes.J Clin Transl Endocrinol,2022,28:100299.
8 Kocatürk E,Kar E,Küskü Kiraz Z,et al.Insulin resistance and pancreatic β cell dysfunction are associated with thyroid hormone functions:A cross-sectional hospital-based study in Turkey.Diabetes Metab Syndr,2020,14:2147-2151.
9 Hanamura I,Nonaka F,Kawasaki H,et al.Analysis of factors associated with insulin resistance in young women:A cross-sectional study.Clinical Nutrition Open Science,2023,51:52-61.
10 Li J,Leng J,Li W,et al.Roles of insulin resistance and beta cell dysfunction in macrosomia among Chinese women with gestational diabetes mellitus.Prim Care Diabetes,2018,12:565-573.
11 Yin B,Ding L,Chen Z,et al.Combining HbA1c and insulin resistance to assess the risk of gestational diabetes mellitus:A prospective cohort study.Diabetes Res Clin Pract,2023,199:110673.
12 Han X,Yang F,Zhang Z,et al.4EBP2-regulated protein translation has a critical role in high-fat diet-induced insulin resistance in hepatocytes.J Biol Chem,2023,299:105315.
13 韩肖燕,杨惠霞,杨桦.妊娠期糖尿病孕妇晚孕期血脂浓度检测的临床意义.中华妇幼临床医学杂志(电子版),2019,15:14-18.
14 Zhao Y,Zhao Y,Fan K,et al.Serum uric acid in early pregnancy and risk of gestational diabetes mellitus:A cohort study of 85,609 pregnant women.Diabetes Metab,2022,48:101293.
15 朱筱丹,王春茶,郑东方,等.尿酸联合糖化血红蛋白测定对妊娠期糖尿病患者妊娠结局的预测价值.中国妇幼保健,2023,38:2333-2336.
16 黄冉冉,徐英英,陈矢.比较中性粒细胞/淋巴细胞、血小板/淋巴细胞和平均血小板体积对早期糖尿病肾病的预测价值.中华内分泌外科杂志,2019,13:76-80.
17 Li G,Xing Y,Wang G,et al.Does recurrent gestational diabetes mellitus increase the risk of preterm birth? A population-based cohort study.Diabetes Res Clin Pract,2023,199:110628.
18 Shareef M,Saleh L,van den Meiracker AH,et al.The impact of implementing the WHO-2013 criteria for gestational diabetes mellitus on its prevalence and pregnancy outcomes:A comparison of the WHO-1999 and WHO-2013 diagnostic thresholds.Eur J Obstet Gynecol Reprod Biol,2020,246:14-18.
19 朱敏,朱雪萍.妊娠期糖尿病母亲所生新生儿近期结局及其产前高危因素相关性分析.中华危重症医学杂志(电子版),2019,12:174-178.
20 Karasneh RA,Migdady FH,Alzoubi KH,et al.Trends in maternal characteristics,and maternal and neonatal outcomes of women with gestational diabetes:A study from Jordan.Ann Med Surg(Lond),2021,67:102469.
21 Zanardo V,Suppiej A,Tortora D,et al.Trajectory of serum bilirubin in offspring of women with gestational diabetes mellitus.Diabetes Res Clin Pract,2023,200:110643.
22 Luo J,Geng X,Zhou J,et al.Characteristics of the oral glucose tolerance test in women with different pre-pregnancy body mass index and the effect of gestational diabetes mellitus on twin pregnancy outcomes.Clinics(Sao Paulo),2023,78:100272.
23 Ramos-Leví AM,Fernández-Pombo A,García-Fontao C,et al.Gestational weight gain influences neonatal outcomes in women with obesity and gestational diabetes.Endocrinol Diabetes Nutr(Engl Ed),2022,69:852-858.
24 Sperling MM,Leonard SA,Blumenfeld YJ,et al.Prepregnancy body mass index and gestational diabetes mellitus across Asian and Pacific Islander subgroups in California.AJOG Glob Rep,2023,3:100148.
25 孟耀涵,曲翌敏,湛永乐,等.妊娠糖尿病的影响因素及围产期结局.中华疾病控制杂志,2022,26:1011-1016.
26 Teshome AA,Li Q,Garoma W,et al.Gestational diabetes mellitus,pre-pregnancy body mass index and gestational weight gain predicts fetal growth and neonatal outcomes.Clin Nutr ESPEN,2021,42:307-312.