近年来,不孕症发病率呈逐年上升趋势,其病因中,输卵管因素约占25%[1]。输卵管性不孕严重威胁女性的生育健康,加重社会经济负担,一直以来都是研究的热点。现代医学认为沙眼衣原体等病原体入侵生殖道粘膜导致输卵管炎性渗出、水肿、增生、变形,与周围组织致密粘连甚至阻塞[2-3]是输卵管性不孕主要病因。治疗多以抗生素干预、腹腔镜手术介入为主,但具有价格昂贵、复发率高等弊端[4]。实际上,输卵管炎性状态同样影响纤毛活动,阻碍精子和卵细胞运输[5],导致不孕症的发生。
CYLD与圆柱瘤病相关,通过负调控炎症信号通路,减弱炎症因子的传导,抑制细胞增殖[6]。目前尚未有CYLD与输卵管炎性不孕的相关报道,介于CYLD基因及蛋白在女性输卵管组织中高表达(人类蛋白质图谱门户www.proteinatlas.org),推测CYLD对输卵管性不孕有一定调控作用。有研究指出[7],CYLD缺陷细胞中可观察到PCP蛋白DVL的超泛素化以及增强的Wnt/β-catenin信号通路传导。且DVL多在顶端多纤毛细胞基部富集,与初级纤毛形成密切相关[8]。故CYLD可能通过介导蛋白调控相关信号通路,影响输卵管炎性上皮细胞纤毛运动,从而对输卵管性不孕起作用。因此,本研究拟从纤毛运动角度出发,为CYLD介导相关信号通路调控输卵管纤毛运动,进而防治输卵管性不孕提供有力证据。
研究对象与方法
1.研究动物:SPF级性成熟未交配SD大鼠,雌性8~10周龄,由中国医学科学院实验动物研究所提供。动物使用许可证号:SCXK(湘)2019-0004。试验在湖南中医药大学分子病理实验室(国家中医药管理局三级科研实验室,TCM-2009-272)进行。本研究经湖南斯莱克景达实验动物有限公司批准(批准号:SJA2004156),并严格按照国家卫生研究院的实验动物护理和使用指南进行。
2.材料与仪器:(1)试剂。DMEM/F12培养基(货号:AW-MC005)、Cytokeratin 18(货号:10830-1-AP)、Vimentin(货号:10366-1-AP)、CYLD(货号:11110-1-AP,110 KDa分子量,转膜130min)、β-catenin(货号:51067-2-AP,92KDa分子量,转膜110 min)、DVL1(货号:27384-1-AP型73,75KDa分子量,转膜100 min)、β-actin(货号:66009-1-Ig,42KDa分子量,转膜60 min)(美国Proteintech);Wnt3a(货号:ab32249,37KDa分子量,转膜60 min,英国abcam);Trizol(货号:15596026,美国Thermo);PBST 缓冲液(货号:AWI0130)、电泳液缓冲液(货号:AWB0083)、转膜缓冲液(货号:AWC0114)、Western、IP细胞裂解液(货号:AWB0144)(中国abiowell);mRNA逆转录试剂盒(货号:CW2569)、miRNA逆转录试剂盒(货号:CW2141)(中国北京康为世纪)。
(2)仪器。YT-CJ-2NB型超净工作台(北京亚泰隆)、DH-160I型直热式二氧化碳培养箱(上海三藤仪器);DSZ2000X型倒置生物显微镜(北京中显恒业仪器);SL02型低速离心机(知信仪器);TS-92型摇床(中国江苏其林贝尔);DYY-6C型恒温箱、DYY-6C型电泳仪、DYCZ-40D型转膜仪、DYCP-31DN型水平琼脂糖电泳槽(中国北京六一);DW-HW438型-80 ℃冰箱(中国美菱);E-201-C型精密PH计、JB-13型磁力搅拌器(中国雷磁);BA410T型光学显微镜(Motic);H1650R型台式冷冻离心机(中国湖南湘仪);ChemiScope6100型化学发光成像系统(中国勤翔);PIKOREAL96型荧光定量RCP仪、SPL0960型荧光PCR板(美国Thermo)。
3.研究方法:
(1)提取大鼠输卵管上皮细胞。吸入过量麻醉(2%的戊巴比妥钠0.5 mL)处死健康大鼠,取输卵管组织放入5 mL HBSS的diss中,去除脂肪和卵巢后剪碎成糜状。放入0.25% Trypsin的培养瓶中,37 ℃酶解30 min。把混合液置离心管中,100 r/min离心5 min;弃上清,转移至1 mg/mL HBSS的培养瓶中,37 ℃水浴酶解30 min。再移至离心管中,1 000 r/min离心5 min;弃上清,加入1 mL DMEM/F-12培养基,轻轻吹打制成细胞悬液,37 ℃、5%CO2培养箱中培养约4 h,将上层细胞悬液吸出致离心管中,1000 r/min离心5 min;弃上清,加入1 mL DMEM/F-12培养基,轻轻吹打后接种至一次性培养皿,37 ℃、5%CO2培养箱中培养,每48 h换液一次。待输卵管上皮细胞长至80%或铺满皿底时,进行传代培养。通过免疫荧光技术(IF)鉴定,测定细胞角蛋白18(Cytokeratin18)为阳性率则提示细胞为输卵管上皮细胞。
(2)细胞鉴定。IF检测Cytokeratin18的阳性率:将切片取出,用磷酸盐缓冲液(PBS)洗涤2至3次,4%的多聚甲醛溶液中固定30分钟,PBS冲洗3次(每次5 min)。接着,放置在0.3%的曲拉通溶液中37 ℃封闭30 min,洗净,使用5%的牛血清白蛋白(BSA)37 ℃封闭60 min,随后PBS洗3次(每次3 min)。与针对Cytokeratin18和Vimentin的一抗在4 ℃下过夜孵育;PBS冲洗,滴加50到100微升标记有荧光的二抗(Alexa Fluor 488 Goat Anti-Rabbit IgG(H+L) Secondary Antibody(AWS0005b)),37 ℃浸泡90 min孵育二抗,再PBS冲洗三次(每次5 min)。用DAPI工作液在37 ℃下染核10 min,PBS冲洗3次(每次5 min)。最后,甘油封片,将制片避光保存或置于荧光显微镜下观察。
(3)大鼠输卵管炎症上皮细胞模型构建。为避免直接采用输卵管炎性不孕大鼠输卵管样本培养可能导致炎症程度降低,影响炎症细胞分析的准确性,故选用健康大鼠输卵管上皮细胞进行原代及传代培养。课题组前期研究[9]发现,LPS的最优剂量和效应时间分别为200 ng/L和24 h,利用LPS最优剂量和效应时间诱导细胞炎症模型。
(4)细胞培养和分组。大鼠输卵管上皮细胞培养于含10%FBS+1%双抗的DMEM/F12培养基中,37 ℃,5%CO2,饱和湿度培养箱中培养。首先设置IP(si-NC组,si-CYLD组)、input(si-NC组,si-CYLD组),再分别设置:oe-NC组(细胞转染oe-NC)、oe-CYLD组(细胞转染oe-CYLD)、oe-CYLD+oe-NC组(细胞转染oe-CYLD和oe-NC)与oe-CYLD+oe-DVL组(细胞转染oe-CYLD和oe-DVL)六组,每组5个样本。以LPS最优添加量和效应时间干预转染后的各组细胞。
(5)RT-qPCR检测CYLD和DVL的mRNA表达。将各组细胞中加入1 mL Trizol于匀浆器中充分研磨匀浆,通过Trizol法提取细胞总RNA,测量RNA浓度(A260nm/280nm)及纯度。逆转录为cDNA,配制为RT-PCR反应体系。反应条件如下:95 ℃变性10min,95 ℃退火15 s,40个循环,60 ℃延长30 s,通过2-ΔΔCt法进行数据分析。β-actin作为内部参考基因,引物设计见表1。
表1 引物序列信息

引物 序列(5′-3′)长度/bpactin上游:ACATCCGTAAAGACCTCTATGCC下游:TACTCCTGCTTGCTGATCCAC223CYLD上游:CATCATCCCAGATAGCGTGACA下游:TGCAGGGTCTTCTGCAACTTCA244DVL上游:TACCACATGGACGAGGAGGA下游:CAGGGCAACTTGGCATTGTC194
表2 不同组别CYLD、DVLmRNA表达水平

分组CYLDmRNA/β-actinDVLmRNA/β-actinoe-NC组0.220.24oe-CYLD组0.50∗∗∗∗0.14∗∗∗∗oe-CYLD+oe-NC组0.46ns0.13nsoe-CYLD+oe-DVL组0.46ns0.34∗∗∗∗
注:与oe-NC组相比,****P<0.0001;与oe-CYLD组相比,nsP提示无明显统计学意义,****P<0.0001
(6)Co-IP检测CYLD与DVL1在细胞中相互作用情况。为更好检测CYLD与DVL的关系,以IP(si-NC组,si-CYLD组)、input(si-NC组,si-CYLD组)进行实验研究。将300 uL IP裂解液加入细胞中,裂解,离心,取蛋白上清4 ℃过夜孵育抗体。裂解液中加琼脂糖珠,混匀离心4次,收集最后的沉淀。沉淀中加入30 uL IP裂解液,电泳、转膜,CYLD(1:1 000)、DVL1(1:2 000)4℃过夜孵育一抗,PBST清洗后室温孵育二抗90 min,再次PBST清洗,ECL显色曝光,化学发光成像系统成像。使用ImageJ软件分析各带灰度值。
(7)蛋白质印记测定(Western blot,WB)检测输卵管上皮中CYLD、DVL、Wnt3a、β-catenin表达量。向之后设立的六组细胞中分别加入蛋白裂解液,收集总蛋白裂解液,使用BCA测定蛋白浓度。取200 uL蛋白上清进行电泳、转膜,β-actin(1:5 000)、CYLD(1:1 000)、DVL1(1:2 000)、Wnt3a(1 ug/mL)、β-catenin(1:20 000)4 ℃过夜,次日室温放置30 min。PBST漂洗后于室温孵育二抗90 min。PBST漂洗后ECL显色曝光,凝胶成像系统成像。以GAPDH为内参,比较目标蛋白与内部参照蛋白的灰度值比率来定量分析蛋白质的相对表达水平。
(8)输卵管上皮细胞纤毛运动频率的检测。纤毛跳动频率(CBF)在37℃倒置亮场显微镜下显示,配备40物镜。移动纤毛的图像是由一个12位的高速摄像机采集的,该摄像机以30帧记录一个区域,持续10秒。为控制单个试管间CBF的内在差异,每个试管的样本都用前面描述的药物处理。由于CBF读数不一致,因此没有对单个纤毛细胞和小组纤毛细胞进行分析。每个处理的样本随机成像5个区域,测量5个片段,然后通过人工复查数字图像确定CBF。
4.统计学分析:使用 Graphpad Prism 8.0 进行统计分析,计算测量数据的平均值±标准偏差。两组或多组之间的比较采用t检验或单向方差分析(ANOVA)。统计显著性定义为P<0.05。
结果
1.提取输卵管上皮细胞:免疫荧光(IF)检测如图1所示,信号merge图中显示有细胞角蛋白18(cytokeratin 18)的存在,提示已成功分离出输卵管上皮细胞,为后续实验奠基。
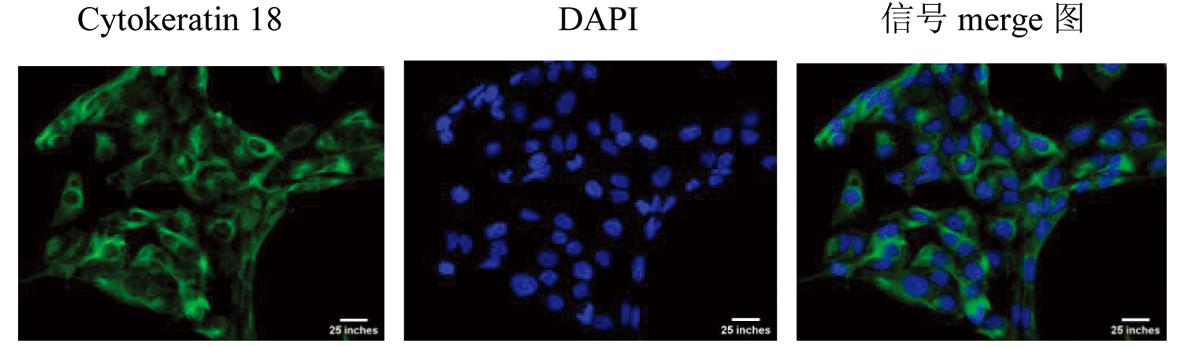
图1 输卵管上皮细胞验证模型的建立
2.大鼠输卵管上皮细胞炎症模型CYLD与DVLmRNA表达:过表达CYLD后,CYLD蛋白及mRNA表达量较oe-NC组升高(图2A所示),DVL蛋白及mRNA表达量则降低(图2B所示)(P<0.0001);过表达CYLD和DVL,与oe-CYLD+oe-NC组相比,CYLD蛋白及mRNA表达量不变,DVL蛋白及mRNA表达量升高(P<0.0001)。研究提示:CYLD蛋白与DVL蛋白呈负相关,且由此推断,DVL是CYLD的下游因子,改变其表达不影响上游蛋白CYLD水平。
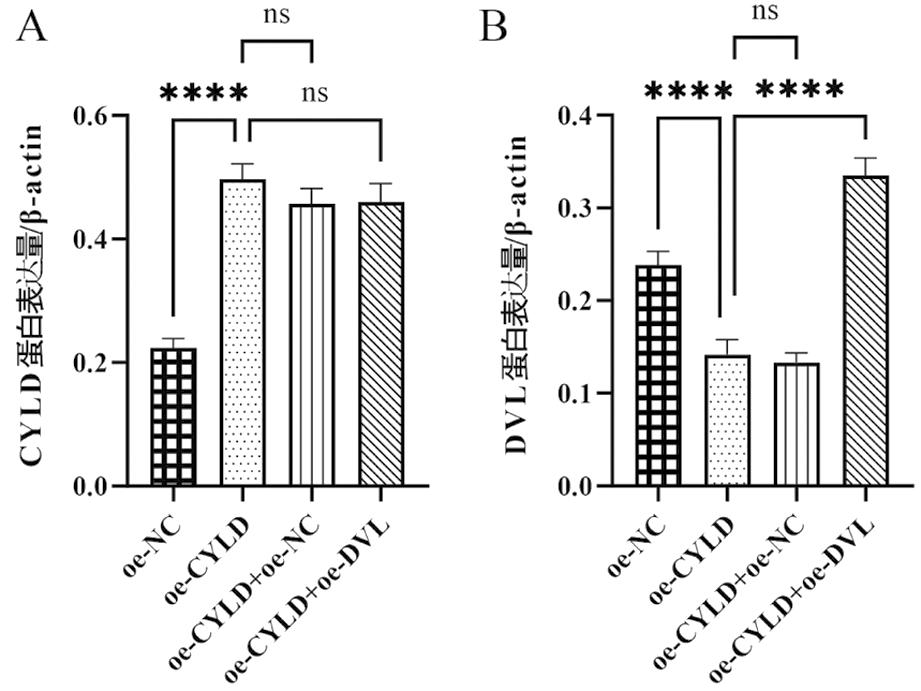
图2 输卵管上皮细胞CYLD与DVL表达量比较
3.大鼠输卵管上皮组织中的CYLD和DVL蛋白表达及相互作用:为更好验证CYLD与DVL的关系,从左至右依次予:样品全蛋白、CYLD相同来源(rabbit)的normal lgG免疫全蛋白后的沉淀物、以CYLD抗体去免疫共沉淀。通过WB检测灰度分析得:CYLD与DVL存在相互作用。在图3B中,设立IP(si-NC组,si-CYLD组)、input(si-NC组,si-CYLD组)。从左到右依次予:样品全蛋白、以UB抗体免疫样品全蛋白后的沉淀物。UB即氨基酸泛素肽,通过与底物蛋白的偶联发生泛素化。观察各组灰度,si-CYLD组>si-NC组,结合UB的灰度情况,表明CYLD通过去泛素化抑制DVL的降解。
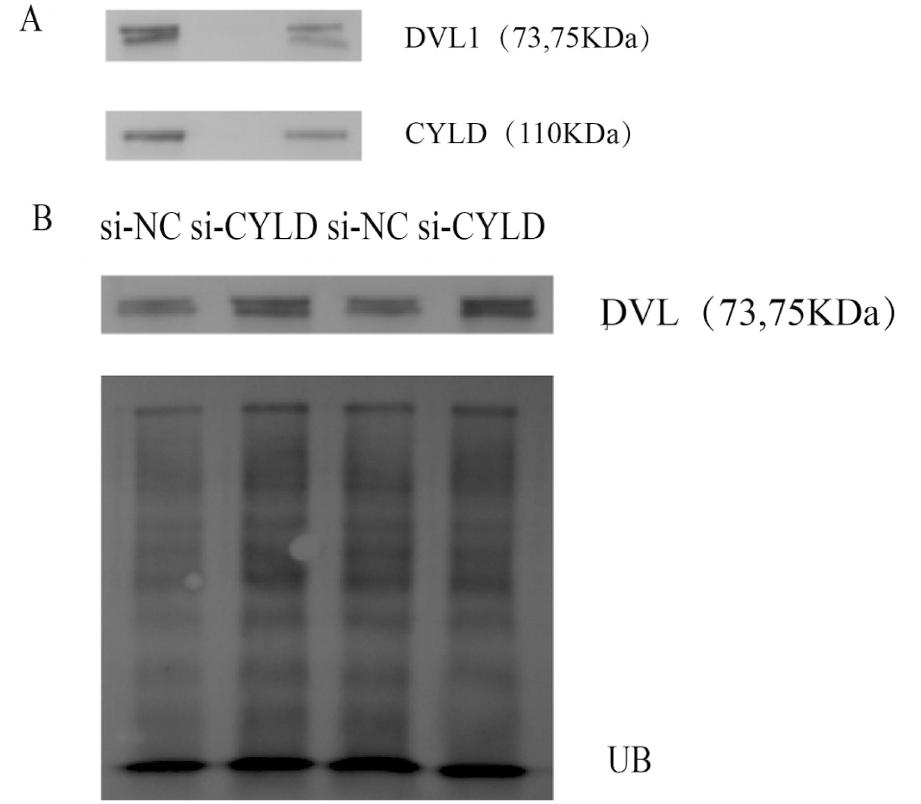
图3 输卵管上皮细胞CYLD、DVL1表达及相互作用
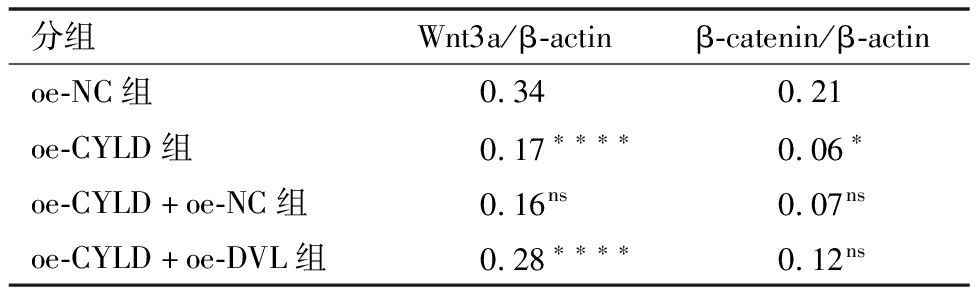
4.各组大鼠输卵管上皮组织中CYLD、DVL、Wnt3a、β-catenin蛋白量表达量:如图4A所示,对比各组DVL、Wnt3a、β-catenin灰度及蛋白表达柱状图,si-CYLD组>si-NC组。如图4B、表3:过表达CYLD使Wnt3a、β-catenin表达量下降(P<0.0001);以过表达CYLD和DVL干预,与对照组(oe-CYLD组)相比,Wnt3a、β-catenin表达量均上升。结果提示:CYLD与Wnt3a、β-catenin蛋白量成负相关;DVL与Wnt3a、β-catenin蛋白量成正相关。
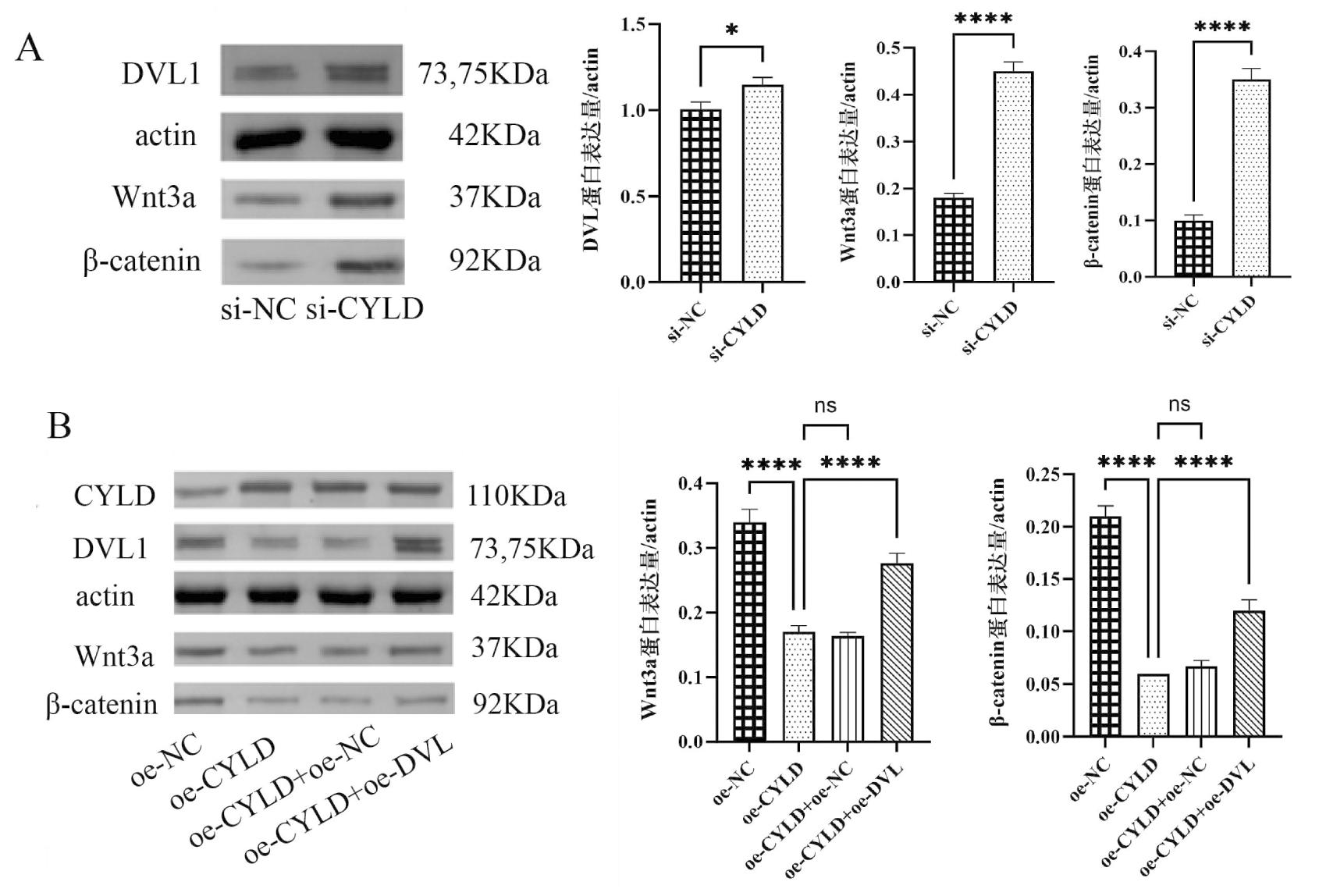
图4 Wnt3a、β-catenin蛋白表达量
表3 不同组别Wnt3a、β-catenin表达水平
分组Wnt3a/β-actinβ-catenin/β-actinoe-NC组0.340.21oe-CYLD组0.17∗∗∗∗0.06∗oe-CYLD+oe-NC组0.16ns0.07nsoe-CYLD+oe-DVL组0.28∗∗∗∗0.12ns
注:与oe-NC组相比,*P<0.1,****P<0.0001;与oe-CYLD组相比,nsP提示无明显统计学意义,****P<0.0001
5.大鼠输卵管上皮细胞中纤毛运动频率的检测:为明确CYLD及DVL对纤毛运动频率的作用,检测不同干预对输卵管炎性状态下纤毛运动频次的影响。结果表明:过表达CYLD后纤毛运动频次明显升高(P<0.001)。与对照组(oe-CYLD组)相比,oe-CYLD+oe-DVL组降低了纤毛的运动频次(P<0.1)。介于oe-CYLD组与oe-CYLD+oe-NC组间差异无统计学意义,oe-CYLD+oe-DVL组较oe-CYLD+oe-NC明显降低纤毛运动频次(P<0.01)。综上所述,输卵管上皮细胞纤毛运动频次与CYLD蛋白含量呈正相关,而与DVL水平呈负相关,组间比较差异有统计学意义。见表4、图5。
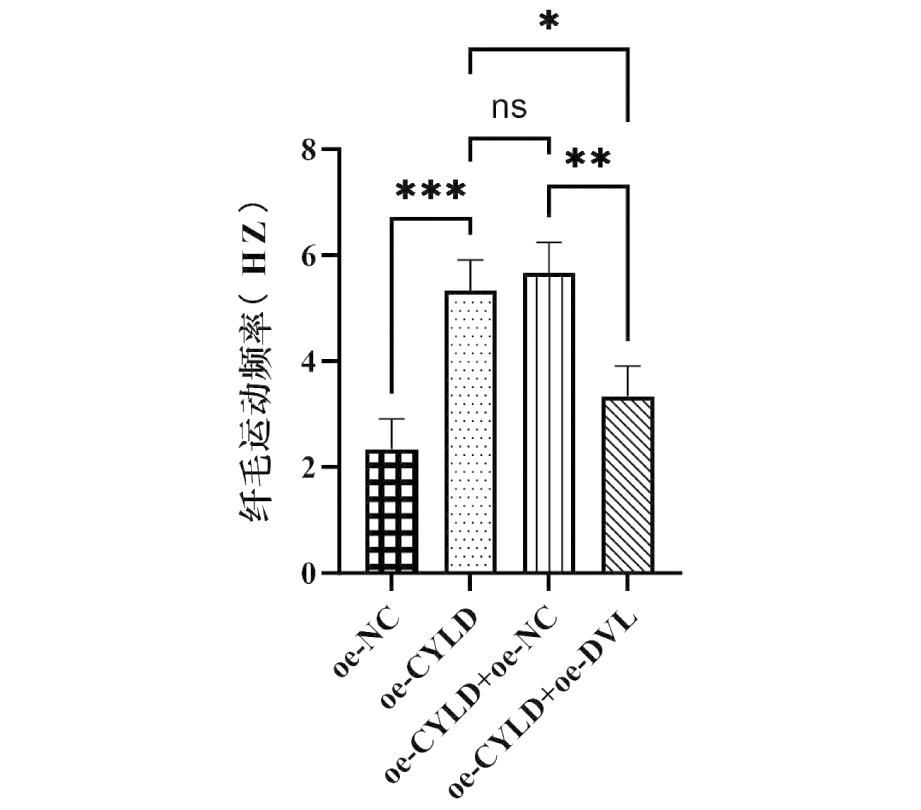
图5 输卵管上皮细胞纤毛运动频次
表4 不同组别Wnt3a、β-catenin表达水平

分组纤毛运动频次(Hz)oe-NC组2.33oe-CYLD组5.33∗∗∗oe-CYLD+oe-NC组5.67nsoe-CYLD+oe-DVL组3.33∗
注:与oe-NC组相比,***P<0.001,与oe-CYLD组相比,nsP提示无明显统计学意义,*P<0.1
讨论
输卵管炎是输卵管性不孕的主要病因[10],以沙眼衣原体为主的内、外源性微生物入侵最为常见[11]。沙眼衣原体D-K血清型对泌尿生殖道上皮细胞有高亲和性,可从子宫颈迁移至输卵管引起炎症;同时,其外膜脂多糖作为炎症激活剂,提高热休克蛋白表达,激活相关炎症因子及Toll样受体信号通路,引起输卵管纤维化,造成不孕症[12]。实际上,输卵管炎症状态还可能导致输卵管上皮细胞纤毛运动障碍,输卵管壁粘膜层柱状细胞的纤毛自外端向子宫方向摆动,同样是卵子和受精卵运行的有效助力。Wu等人[13]以缺乏miR-34b/c 和miR-449 簇的(具有无纤毛输卵管)小鼠为研究对象,在卵巢功能正常,并且排卵可正常发生时,排卵的卵母细胞仍不能到达输卵管的壶腹区域。可见,输卵管纤毛运动正常是卵丘-卵母细胞复合物拾取的绝对必要条件[4]。
最新研究发现CYLD与纤毛的主要组成——微管相互作用,调节微管动力学。CYLD具有多个功能域,其中两个CAP-Gly结构域介导与微管蛋白和/或微管的结合,严格调节微管稳定性[14];C末端去泛素化酶结构域则与末端结合蛋白 1(EB1)结合形成复合物,两者协同微调微管动力学以促进细胞迁移,影响纤毛运动[15]。作为泛素特异性蛋白酶(USP)家族成员,去泛素化酶CYLD通过选择性从底物中修剪泛素、多泛素链或泛素样蛋白,逆转泛素化过程,直接调节多个关键信号级联反应[16]。泛素化是一种重要且丰富的翻译后修饰,通过76个氨基酸泛素(Ub)肽与底物蛋白的偶联发生。而CYLD可能正是通过去泛素化下游蛋白因子调控相应信号通路介导级联反应。Dishevelled(DVL)(包含三个家族成员:DVL1、DVL2 和DVL3)对正常纤毛生成、运动也至关重要[17]。通过表达PCP特异性显性负DVL破坏DVL功能,导致每个多纤毛细胞内旋转平面极性的随机化,而基底的平面极性是极化跳动和纤毛上皮产生定向流体流动的基础。所以,DVL是纤毛运动关键调控因子。有研究报道,DVL通过其蛋白质复合物与膜受体结合的泛素化过程调控Wnt通路激活[18],而Wnt通路激活后通过对细胞周期的影响负调节纤毛运动[19]。目前尚未有研究报道CYLD介导DVL调控Wnt/β-catenin信号通路的机制及其对输卵管纤毛运动的影响。故研究通过探讨此机制与输卵管纤毛运动的关联,揭示输卵管性不孕中的一种病理过程,从新的角度指导输卵管性不孕的治疗。
首先通过IF明确所提取细胞为输卵管上皮细胞;利用LPS建立输卵管上皮细胞炎症模型;在验证CYLD与DVLmRNA表达水平呈负相关,且DVL为CYLD下游因子后,借用UB灰度分析进一步明确CYLD可使DVL去泛素化;进而利用WB技术检测各组输卵管上皮细胞中Wnt3a、β-catenin蛋白表达,结果提示CYLD负调控Wnt3a、β-catenin蛋白量表达,DVL则起正调控作用。至此,我们明确了CYLD调控信号通路的机制。为进一步探讨此调控机制与纤毛运动的关系,我们利用高速摄像机捕捉不同干预方式下纤毛运动频率情况,发现CYLD过表达可升高纤毛运动频次,DVL升高则纤毛运动频次反而下降。
综上所述,本研究探索了CYLD介导DVL去泛素化负调控Wnt/β-catenin通路的具体机制,明确了此通路激活对纤毛运动频次的负调节作用,为输卵管性不孕的防治提供新思路。研究首次从炎症状态下输卵管上皮细胞纤毛运动角度剖析其具体分子学机制,有一定的创新性,对于改善输卵管炎性不孕预后有重要的临床意义。
1 Gonzalez-Martin R,de Castro P,Fernandez C,et al.Proteomic profiling identifies candidate diagnostic biomarkers of hydrosalpinx in endometrial fluid:a pilot study.Int J Mol Sci,2024,25:968.
2 Belay T,Sahu R,Martin E,et al.Active hexose-correlated compound restores gene expression and protein secretion of protective cytokines of immune cells in a murine stress model during chlamydia muridarum genital infection.Infect Immun,2021,89:e00786-00720.
3 刘梅,谢星,匡继林.通管方对输卵管炎性不孕模型大鼠NLRP3/Caspase-1细胞焦亡通路的影响.中医药导报,2023,29:8-13.
4 Yuan S,Wang Z,Peng H,et al.Oviductal motile cilia are essential for oocyte pickup but dispensable for sperm and embryo transport.Proc Natl Acad Sci U S A,2021,118:e2102940118.
5 Huang Y,He Z,Zhou H,et al.The treatment of tubal inflammatory infertility using Yinjia tablets through EGFR/MEK/ERK signaling pathway based on network pharmacology.Curr Pharm Biotechnol,2024,25:499-509.
6 周孟学,王中群.去泛素化酶在动脉粥样硬化中的研究进展.中国动脉硬化杂志,2022,30:161-166.
7 Tauriello DV,Haegebarth A,Kuper I,et al.Loss of the tumor suppressor CYLD enhances Wnt/beta-catenin signaling through K63-linked ubiquitination of Dvl.Mol Cell,2010,37:607-619.
8 Wang IY,Chung CF,Babayeva S,et al.Loss of planar cell polarity effector fuzzy causes renal hypoplasia by disrupting several signaling pathways.J Dev Biol,2021,10:1.
9 刘玲,谭雅莉,邵良等.基于炎症相关信号通路探讨活血化瘀通络汤治疗输卵管炎性不孕作用机制.时珍国医国药,2022,33):2089-2093.
10 Poch AM,Dougherty M,Roman RA,et al.Perplexing findings during laparoscopic evaluation for tubal factor infertility resulting from a gastric leak after bariatric surgery:A case report.Case Rep Womens Health.2022.36:e00460.
11 Al Saeghi S,Al-Mahrouqi T,Al-Khadhuri M,et al.Parental consanguinity and ovarian reserve:A retrospective cohort study.Int J Reprod Biomed,2023,21:1013-1020.
12 吴亚玲.输卵管功能损伤因素和分子机制研究进展.实用妇产科杂志,2022,38:839-843.
13 Wu J,Bao J,Kim M,et al.Two miRNA clusters,miR-34b/c and miR-449,are essential for normal brain development,motile ciliogenesis,and spermatogenesis.Proc Natl Acad Sci U S A,2014,111:E2851-2857.
14 Gao J,Huo L,Sun X,et al.The tumor suppressor CYLD regulates microtubule dynamics and plays a role in cell migration.J Biol Chem,2008,283:8802-8809.
15 Li D,Gao J,Yang Y,et al.CYLD coordinates with EB1 to regulate microtubule dynamics and cell migration.Cell Cycle,2014,13:974-983.
16 Cui Z,Kang H,Grandis JR,et al.CYLD Alterations in the tumorigenesis and progression of human papillomavirus-associated head and neck cancers.Mol Cancer Res,2021,19:14-24.
17 Lee M,Hwang YS,Yoon J,et al.Developmentally regulated GTP-binding protein 1 modulates ciliogenesis via an interaction with Dishevelled.J Cell Biol,2019,218:2659-2676.
18 Solic I,Racetin A,Filipovic N,et al.Expression pattern of α-tubulin,inversin and its target dishevelled-1 and morphology of primary cilia in normal human kidney development and diseases.Int J Mol Sci,2021,22.
19 Çal
 kan C,Pehlivan M,Yüce Z,Sercan O.Dishevelled proteins and CYLD reciprocally regulate each other in CML cell lines.Mol Biol Rep.2017.44:391-397.
kan C,Pehlivan M,Yüce Z,Sercan O.Dishevelled proteins and CYLD reciprocally regulate each other in CML cell lines.Mol Biol Rep.2017.44:391-397.