CHARGE综合征,也称为Hall-Hittner综合征,是一类先天性多器官畸形综合征,发病率约为1/10 000~1.17/10 000,最早由Hall于1979年报道[1]。Pagon等于1981年以该疾病主要临床表现的英文首字母缩写定义了CHARGE综合征,包括:眼畸形、心脏畸形、后鼻孔闭锁、生长发育迟滞、生殖器发育不全、耳畸形及听力障碍。本文报道1例基因诊断明确的CHARGE综合征患者,并通过文献复习介绍此病的致病基因、临床表现、诊断及治疗建议。
一、病例资料
患儿,女,15岁3月,主因无乳房发育、无月经初潮就诊。患儿至今无乳房发育,无月经初潮,伴有智力、运动、语言发育落后、听力及视力异常、嗅觉减退,无味觉异常,为进一步诊治,遂就诊于我院门诊,平素精神、饮食可,睡眠可,大小便正常。出生史:G1P1,足月,顺产,出生体重2.8 kg,出生身长50 cm,母孕期产检无异常,否认出生窒息抢救史,否认重度黄疸史。个人史:生后配方奶喂养,吃奶可,无喂养困难,6月添加辅食,辅食添加顺利,现食普食,食欲可。1岁6月体检时发现生长迟缓,具体身高增长情况家长描述不清;4~5月会抬头,8~9月会坐,独坐不稳,不会爬,12月会走,2岁时能独走,一直行走不稳,容易摔倒;12月会说话,吐字不清;4岁时曾做过智力、运动、语言发育测试较正常孩子落后;6月出牙,5岁出齐,7岁开始换牙,12岁换第三恒牙。既往曾行心脏彩超检查发现患动脉导管未闭,1岁复查时闭合。家族史:父亲身高171 cm,母亲身高160 cm,遗传靶身高159 cm。父母均为汉族,否认近亲结婚,智力和面容正常,否认家族内分泌及遗传代谢病史,否认性腺功能低下病史,母亲月经初潮年龄12岁,父亲身高突增年龄13岁。查体(图1):T 36.2 ℃,P 92次/分,R 16次/分,身高141.5 cm(低于同性别、同年龄正常身高3SD),体重25 kg(低于同性别、同年龄正常身高3SD),BMI为12.49 kg/m2(低于同性别、同年龄P3),一般情况及反应可,神志清楚,吐字不清,全身无皮疹,浅表淋巴结未触及肿大,方形面、前额宽平、眼距过宽、小眼、小角膜,佩戴眼镜(左眼弱视、斜视加散光,右眼近视加散光),双侧瞳孔等大等圆,对光反射存,杯状耳、听力障碍佩戴助听器(左耳极重度听力障碍、右耳重度听力障碍),低鼻、无唇鄂裂,颈抗(-),甲状腺无肿大,三凹征(-)、呼吸平稳、双乳Tanner分期1期,双肺呼吸音粗,未闻及干湿罗音,心律齐,心音有力,各瓣膜区未闻及病理性杂音,腹软,不胀,肝脾未触及,肠鸣音正常,脊柱及四肢骨骼无畸形,生理反射存在,病理反射未引出,阴毛Tanner分期1期。
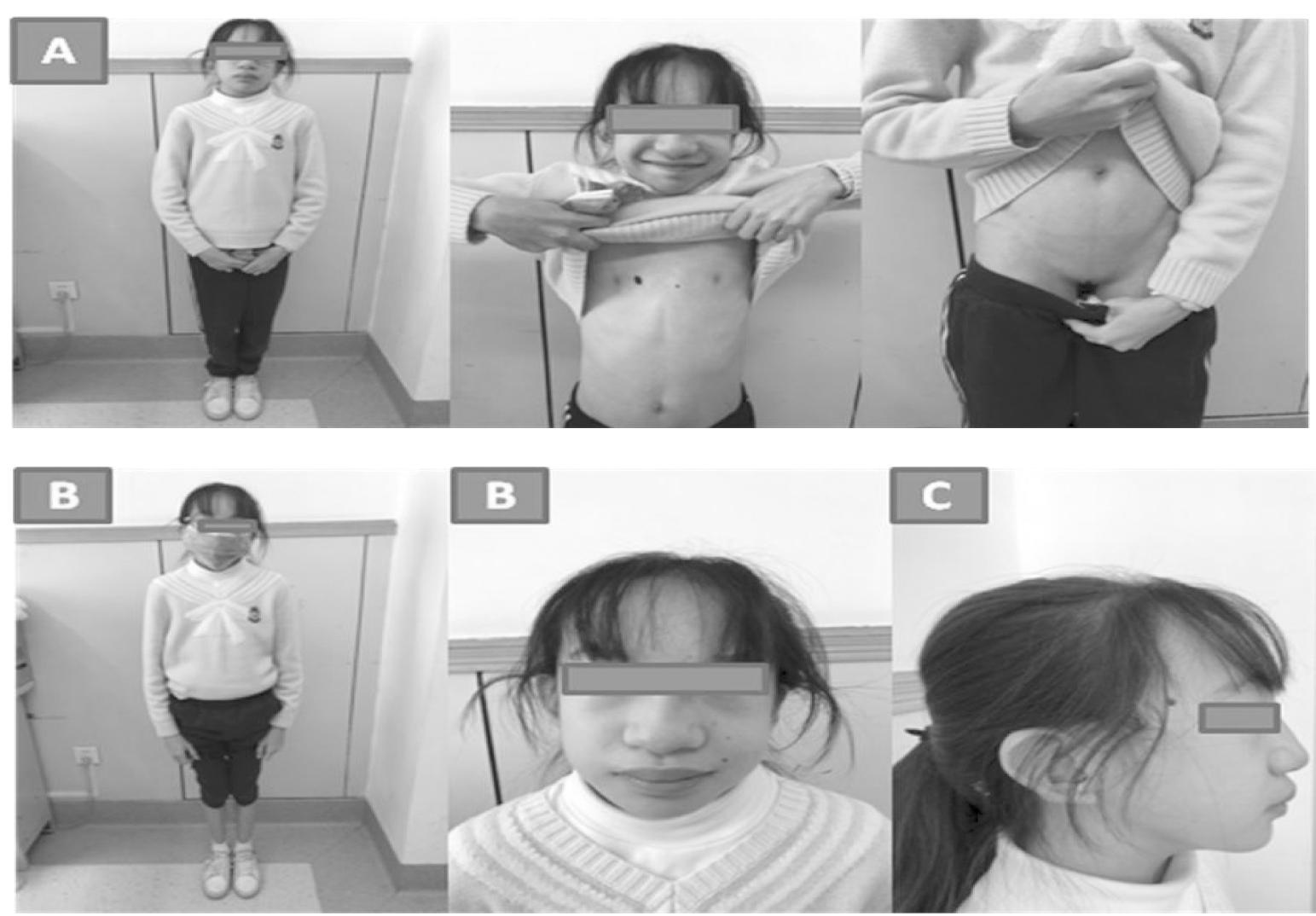
A.患儿身材矮小、性腺功能低下(无乳房及外阴发育);B.特殊面容:方形面、前额宽平、眼距过宽、小眼、小角膜、屈光不正佩戴眼镜、低鼻;C.杯状耳、听力障碍佩戴助听器
图1 患儿照片
辅助检查:三大常规、肝功能、肾功能、心肌酶、电解质及血糖检测正常,甲状腺功能正常,肾上腺功能正常,17α-羟基孕酮正常,性腺六项提示:促黄体生成素<0.1 IU/L,促卵泡生成素0.15 IU/L,垂体泌乳素109.6 mIU/L,雌二醇<18.35 pmol/L,孕酮1.4 nmol/L,总睾酮0.1 nmol/L。甲胎蛋白、癌胚抗原、绒毛膜促性腺激素正常。促性腺激素释放激素激发试验LH峰值(60 min)0.54 IU/L,FSH峰值(90 min)1.55 IU/L,LH/FSH为 0.35。外周血细胞染色体核型分析46,XX。眼底检查左眼底视网膜缺损,骨龄片(GP图谱法)评估骨龄9.5岁。乳腺B超提示双乳区未探及确切增大的乳核回声。子宫附件B超提示:子宫显示大小约3.1 cm×1.4 cm×0.7 cm,形态未见异常,表面光滑,内部回声均。左侧卵巢显示大小约1.5 cm×0.9 cm,形态未见明显异常,边界清,内部可见多个细小卵泡。右侧卵巢显示大小约1.7 cm×0.8 cm,形态未见明显异常,边界清,内部可见多个细小卵泡。垂体MRI平扫及增强扫描示:蝶鞍无扩大,形态未见异常。垂体体积约为3.5 mm×6.7 mm×11.2 mm,垂体信号均匀,神经垂体显示正常,平扫及增强未见异常信号;垂体柄居中,形态、信号未见异常;双侧海绵窦、视交叉未见异常。结合患儿15岁3月,无月经初潮,伴有智力、运动及语言发育落后、听力及视力异常、嗅觉减退、身材矮小、面容特殊,在征求家长及患儿知情同意后,留取患儿及父母新鲜外周血样本送由北京迈基诺医学检验所应用安捷伦外显子芯片捕获及高通量测序方法检测医学全外显子筛查中包括的全部基因的外显子突变情况。
患儿血样本分析到CHD7基因有一个杂合突变:c.1919delA杂合突变,导致氨基酸发生移码突变(p.K642Rfs*69)。根据ACMG指南,该变异初步判定为致病性变异(pathogenic):(1)PVS1:该变异为零效变异(移码突变),可能导致基因功能丧失;(2)PS1:文献数据库已有该位点CHARGE综合征的相关性报道,变异标签为DM(致病突变),Clin Var数据库对该位点的致病性分析为Pathogenic;CHARGE association;(3)PM2:在正常人群数据库中的频率为-,为低频变异。经家系验证分析,父亲该位点无变异,母亲血样本分析到CHD7基因有一个杂合突变:c.1919delA杂合突变,导致氨基酸发生移码突变(p.K642Rfs*69)。见图2~4。
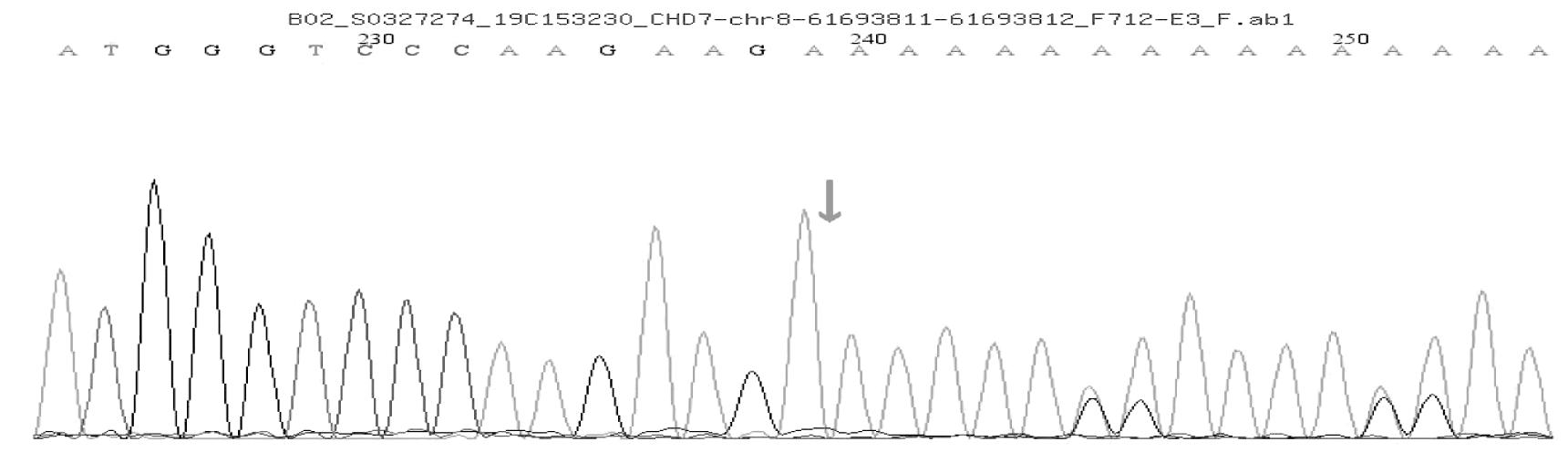
图2 患儿CHD7基因测序图(c.1919delA,p.K642Rfs*69)
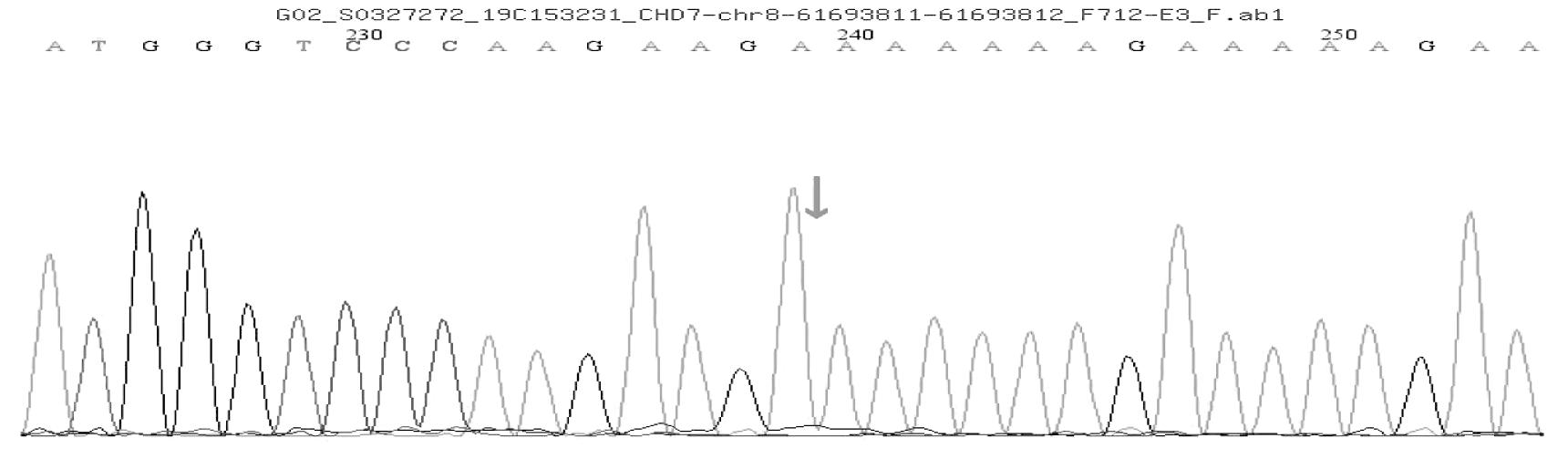
图3 父亲CHD7基因测序图(无变异)
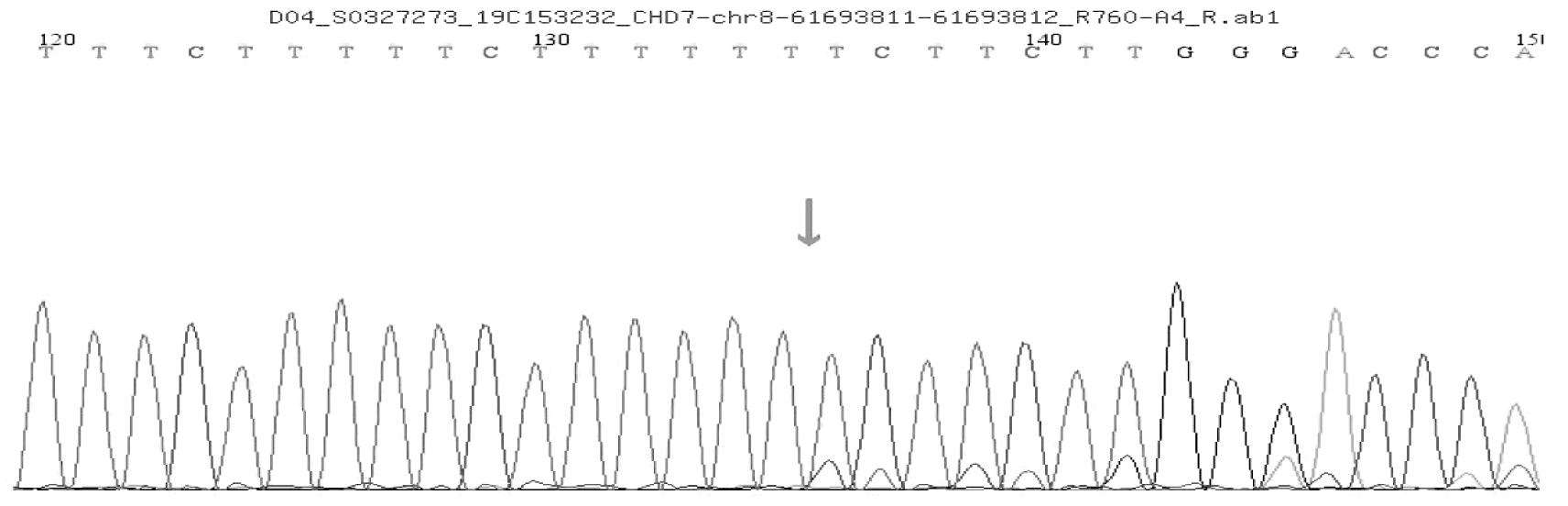
图4 母亲CHD7基因测序图(c.1919delA,p.K642Rfs*69)
二、治疗及随访
患儿年龄15岁3月,目前身高141.5 cm(低于同性别、同年龄正常身高3SD),遗传身高159 cm,骨龄(GP图谱法)评估9.5岁,无乳房发育、无月经初潮。经与家长充分有效沟通,告知家长目前患儿存在身材矮小,骨龄<12岁,可以考虑生长激素治疗改善身高,待身高接近遗传靶身高,骨龄≥12岁,可考虑性激素替代治疗诱导患儿性发育。家长表示明白并签署生长激素治疗知情同意书,于2019年8月18日开始启用基因重组人生长激素治疗,起始剂量0.16 IU/kg,期间密切监测患儿生长速率、第二性征发育情况、骨龄、垂体MRI平扫+增强、脊柱正侧位片,双乳及生殖器B超、性激素水平、甲功、肝肾功、血糖、胰岛功能、肾上腺功能、IGF-1及药物不良反应等。2022年8月5日复查,患儿年龄18岁3月,身高156.8 cm,体重33.55 kg,BMI为13.6 kg/m2,双乳Tanner分期2期,阴毛Tanner分期2期,垂体MRI提示垂体体积偏小,枕骨斜坡发育不良,颅底轻度凹陷,骨龄12岁,B超提示右侧乳核发育,子宫3.6 cm*2.0 cm*0.7 cm,左侧卵巢容积3.6 mL,右侧卵巢容积1.77 ml,肝肾功能正常,甲状腺功能正常,血糖、胰岛素、C肽及糖化血红蛋白正常,肾上腺功能正常,IGF-1:235.7(-1.4SD),性腺六项:促黄体生成素<0.1 IU/L,促卵泡生成素<0.1 IU/L,雌二醇25.03 pmol/L。目前患儿生长激素治疗3年,身高近遗传靶身高,给予停用生长激素,考虑目前患儿年龄18岁3月,骨龄12岁,经与家长充分有效沟通后启动性激素替代治疗,促进患儿性发育,加用补佳乐(戊酸雌二醇片)0.25 mg/d。具体治疗随访记录详见表1。
三、文献复习并总结
1.CHD7基因突变:胎儿胚胎发育早期,CHD7基因于神经管、未分化的神经上皮和神经嵴起源的间质中等多处组织器官中高度表达,之后只在眼、耳及嗅觉系统等处表达,这也是CHARGE综合征常见的畸形部位。CHARGE综合征的典型畸形主要发生于胚胎发育的第4~9周,为视网膜发育、口咽膜破裂、心管形成、耳蜗形成的关键时期。2004年Vissers等[2]首次报道了染色质解旋酶DNA结合蛋白7(chromodomain-helicase-DNA-binding protein 7,CHD7)在CHARGE综合征发病中的重要作用。在临床诊断为CHARGE综合征的患者中有58%~64%检测出CHD7基因的突变[3]。迄今为止报道的CHD7基因突变中,70%为无义突变或移码突变,6%~13%为错义突变,7%~15%为剪切位点突变[4],部分和全部基因缺失或重复罕见,占致病性CHD7基因突变的3%~4%。本研究报道的病例血样本也分析到CHD7基因移码突变,与既往文献报道一致。
染色质解旋酶DNA结合蛋白(CHD)是一类ATP依赖性染色质重塑酶,在调节基因转录中扮演重要角色,目前已发现的人CHD蛋白家族共有9种。所有CHD基因均有一个N端甲基化蛋白结合位点和一个位于中部的与SNF2相似的结构域,能够调节染色质重塑。CHD7基因(MIM#608892)位于第8号染色体(8q12),含有38个内含子和外显子,CHD7识别并结合核小体特定组蛋白后发挥其解旋酶作用,暴露出裸露的DNA以增加转录调控元件的可接近性,以此调控染色质重塑[5]。CHD7基因能够直接作用于SOX2基因,影响胚胎干细胞分化。目前已知CHD7基因与PBAF复合物共同调控转录因子TWIST、SOX9和SLUG的表达,以调控神经嵴迁移和分化。Okuno等[6]的研究证实,CHARGE综合征患者来源的诱导多潜能神经嵴细胞表现出明显的迁移缺陷。CHD7基因还能通过调节骨形态发生蛋白(BMP4)影响心脏发育,可正向调控Otx2基因影响耳发育,又可负向调控Otx2基因阻碍小脑发育,可以抑制p53基因导致细胞凋亡,造成颌面部骨发育不全等临床表现。杂合子CHD7基因突变小鼠[7]表现出后鼻孔闭锁、颅颌面畸形、心脏畸形等一系列典型的CHARGE综合征的临床特点。
2.临床特征:CHARGE综合征患者由于下丘脑-垂体功能异常导致激素分泌不足造成生长发育迟缓和青春期延迟,典型的面部特征包括方形面、前额宽而平、低鼻和眼距过宽等。耳部畸形可见于90%以上的患者[8],为CHARGE综合征的一大重要临床特征,约80%的CHARGE综合征患者合并不同程度的听力缺失,且大约半数患儿为双侧耳聋。典型的外耳畸形表现为耳廓缺乏软骨连接与神经支配,呈现杯状耳、猿耳畸形等,附耳、小耳畸形也有报道。内、中耳畸形可表现为卵圆窗、听骨链、半规管及耳蜗等结构发育不良[9]。眼部畸形可见于75%~90%的CHARGE综合征患者[10],包括眼睑、视网膜、脉络膜、虹膜、黄斑及视盘病变,双侧多发,其中最常见的是视网膜脉络膜病变,易导致视网膜脱落进而影响视力。早期发育异常可有小眼畸形、白内障、小角膜畸形,少数患者可有屈光不正、斜视、上睑下垂、眼球震颤。后鼻孔闭锁发生率约为1/7 000例活产儿,女性患儿多于男性,约2/3的病例为单侧发病,在CHARGE综合征患者中发病率为50%~60%[11]。双侧后鼻孔闭锁患儿常表现为上气道阻塞,呼吸困难于喂食期间加重、哭闹时改善,严重时可窒息,单侧后鼻孔闭锁常缺乏典型症状,多在成年后发现。超过85%的患者合并不同程度的中枢神经系统病变,无嗅脑畸形、嗅球发育不良在CHARGE综合征患者中较为多见,其次为前脑无裂畸形。75%~80%的患者可出现心脏畸形,畸形主要发生在主动脉弓和心室流出道,包括法洛氏四联症、主动脉离断、永存动脉干、室间隔缺损等。我们报道的病例存在身材矮小、性腺功能低下、智力及语言发育落后、听力障碍(左耳极重度听力障碍、右耳重度听力障碍)及视力异常(左眼弱视、斜视加散光,右眼近视加散光)、嗅觉减退、动脉导管未闭、特殊面容、小眼畸形、屈光不正、左眼底视网膜缺损、杯状耳等,与既往文献报道一致。
3.诊断标准:2005年Verloes诊断标准[12]如下:包括3条主要标准、5条次要标准。具备3条主要标准,或2条主要标准+2条次要标准,即为典型CHARGE综合征;具备2条主要标准 +1条次要标准,为部分型CHARGE综合征;具备2条主要标准,或1条主要标准+2条次要标准,为非典型CHARGE综合征。该患儿具备2条主要标准:(1)眼畸形:小眼、小角膜,佩戴眼镜(左眼弱视、斜视加散光,右眼近视加散光);(2)半规管发育不良:患儿会走路后一直走路不稳,容易摔倒。具备4条次要标准:(1)颅神经及脑干病变:垂体MRI提示垂体体积偏小,枕骨斜坡发育不良,颅底轻度凹陷,患儿吐字不清,嗅觉减退、近视;(2)下丘脑-垂体功能异常:患儿存在生长障碍、身材矮小,性腺功能低下;(3)耳畸形及听力障碍:杯状耳、左耳极重度听力障碍、右耳重度听力障碍;(4)智力低下:患儿智力、运动、语言发育落后,4岁时曾做过智力、运动、语言发育测试较正常孩子落后。诊断为典型CHARGE综和征。
表2 CHARGE综合征的临床评分标准

主要标准次要标准眼畸形颅神经及脑干病变后鼻孔闭锁下丘脑-垂体功能异常半规管发育不良耳畸形及听力障碍纵膈器官发育不良智力低下
4.治疗:CHARGE综合征的评估与治疗需要多学科协作展开,新生儿早期需注重呼吸及摄食功能的维护,系统评估心脏等重要脏器畸形并行手术治疗。中期干预包括听觉及言语功能维护、颅颌面畸形的手术修复;随着患者年龄的增长,动态检测激素水平并适时进行内分泌治疗、心理评估则是必要的。
(1)呼吸及摄食:有窒息危险的新生儿须早期插管,插管困难者可行喉罩通气,必要时可行气管切开。手术切除闭锁隔、重建后鼻孔为根治性措施,手术路径有经腭、鼻腔、鼻内镜等。(2)先天性心脏病:紫绀型先心病患儿应尽早行手术矫正心脏畸形,降低猝死风险;房/室间隔缺损等非紫绀型先心病严重影响患儿生长发育,须系统评估,适时干预。(3)颅颌面畸形矫正及听力、语言功能重建:听力障碍对言语功能影响较大,因此合并听力障碍的外、中耳畸形需要积极治疗,人工耳蜗植入术对重度、极重度感音神经性耳聋患者的听力重建大有裨益,但对于由于听神经病变、耳蜗破坏,特别是先天性内中耳畸形导致的极重度感音神经性耳聋患者,听觉脑干电极植入更为适宜[13]。早期解剖修复腭裂可获得较理想的语音效果,目前,公认的唇腭裂修复时机为出生后3个月左右。患者眼部畸形表现多样,对于合并白内障、屈光不正等影响视力者应早期矫正。(4)内分泌治疗:随着年龄的增长,动态检测激素水平并适时进行内分泌治疗,心理评估则是必要的。多数CHARGE综合征患者存在青春期延迟且成年后身高低于同龄人平均水平,部分案例报道患者合并生长激素缺乏。Esposito等曾报道1例长期用生长激素替代治疗的CHARGE综合征患者,该患者自3岁10月龄开始补充生长激素,至17岁停药时身高达到同龄人平均水平,提示激素替代治疗或许可能对治疗生长迟缓有效。本研究报道的病例存在矮身材,给予生长激素治疗3年,剂量从0.16 IU/kg逐渐上调至0.2 IU/kg,目前年龄19岁3月,身高158.8 cm,近遗传靶身高159 cm,用药期间监测未出现药物不良反应,提示生长激素替代治疗对改善患儿身高有效,与既往文献报道一致。
CHARGE综合征临床表现复杂多样,且与预后直接相关,进一步精确定位致病基因并完善对其筛查检测方法有望提高诊断率,对于CHARGE综合征的治疗需要多学科协作、个体化制定,并进行长期跟踪随访和逐步完善。
1 Pagon RA,Graham JM Jr,Zonana J,et al.Coloboma,congenital heart disease,and choanal atresia with multiple anomalies:CHARGE association.J Pediatr,1981,99:223-227.
2 Issekutz KA,Graham JM Jr,Prasad C,et al.An epidemiological analysis of CHARGE syndrome:preliminary results from a Canadian study.Am J Med Genet A,2005,133A:309-317.
3 Lalani SR,Safiullah AM,Fernbach SD,et al.Spectrum of CHD7 mutations in 110 individuals with CHARGE syndrome and genotype-phenotype correlation.Am J Hum Genet,2006,78:303-314.
4 Wincent J,Holmberg E,Strömland K,et al.CHD7 mutation spectrum in 28 Swedish patients diagnosed with CHARGE syndrome.Clin Genet,2008,74:31-38.
5 Zentner GE,Hurd EA,Schnetz MP,et al.CHD7 functions in the nucleolus as a positive regulator of ribosomal RNA biogenesis.Hum Mol Genet,2010,19:3491-3501.
6 Okuno H,Renault Mihara F,Ohta S,et al.CHARGE syndrome modeling using patient-iPSCs reveals defective migration of neural crest cells harboring CHD7 mutations.Elife,2017,6:e21114[pii].
7 Hurd EA,Micucci JA,Reamer EN,et al.Delayed fusion and altered gene expression contribute to semicircular canal defects in Chd7 deficient mice.Mech Dev,2012,129:308-323.
8 Israel Chemical Society Prizes:Y.Apeloig,S.Shaik,J.M.L.Martin,D.Meyerstein,S.Ruthstein,and M.E.van der Boom/NAS Award in Chemical Sciences:J.A.Doudna/Remsen Award and Ralph N.Adams Award:C.A.Mirkin.Angew Chem Int Ed Engl,2018,57:4833-4834.
9 张丰珍,张杰,陈敏,等.CHARGE综合征与听力相关分析.中华耳科学杂志,2015,13:450-453.
10 Nishina S,Kosaki R,Yagihashi T,et al.Ophthalmic features of CHARGE syndrome with CHD7 mutations.Am J Med Genet A,2012,158A:514-518.
11 Bergman JE,Janssen N,van der Sloot AM,et al.A novel classification system to predict the pathogenic effects of CHD7 missense variants in CHARGE syndrome.Hum Mutat,2012,33:1251-1260.
12 Verloes A.Updated diagnostic criteria for CHARGE syndrome:a proposal.Am J Med Genet A,2005,133A:306-308.
13 Ricci G,Trabalzini F,Faralli M,et al.Cochlear implantation in children with "CHARGE syndrome":surgical options and outcomes.Eur Arch Otorhinolaryngol,2014,271:489-493.