脐动脉多普勒(umbilical artery Doppler,UAD)测速通过测量胎盘内胎儿血流的阻力来评估不良妊娠结局风险[1]。妊娠约第14周起胎盘血管阻力降低,脐动脉中持续的向前血流维持着胎儿血流循环[2]。然而,疾病因素可以损害胎盘血流灌注,使胎盘血管阻力增加,导致脐动脉舒张末期血流降低、消失或逆转[3],引起胎儿生长受限、胎死宫内等多种不良围产期结局。既往研究表明,脐动脉舒张末期血流消失(absent end-diastolic velocity,AEDV)可能导致更早的分娩孕周[4-7]、更低的出生体重[4-6,8-11]以及更差的围产期结局。然而,目前没有大规模的队列研究或系统回顾来评估AEDV胎儿与舒张末期血流正常(normal end-diastolic velocity,NEDV)胎儿对比的围产期结果,其结论尚未统一。此外,AEDV可以分为持续舒张末期血流消失(persistentAEDV,pAEDV),即在大多数或所有心脏周期中发生血流消失,和间断舒张末期血流消失(intermittentAEDV,iAEDV),即仅在某些心脏周期中发生血流消失[12]。既往仅3例研究表明,与pAEDV胎儿相比,iAEDV胎儿分娩孕周较晚[12-13],围产期结局更好[12,14],iAEDV与pAEDV的临床结局提示意义仍不明确。
一、对象
本研究检索了1990年1月—2022年9月在数据库PubMed、Web of Science、Cochrane Library和Embase上发表的相关文献,检索策略基于AEDV关键词和MeSH词汇。AEDV部分关键词包括“umbilical artery”、“umbilical arteries”、“blood flow velocity”、“velocity waveforms”、“end-diastolic velocity”、“end-diastolic flow velocity”、“end-diastolic blood flow”,妊娠结局部分关键词包括“fetal growth restriction”、“intrauterine growth retardation”、“premature birth”、“neonatal death”、“neonatal morbidity”、“miscarriage”、“live birth”、“pre-eclampsia”、“gestational hypertension”、“small for gestational age”、“low birth weight”、“obstetric outcome”、“perinatal outcome”、“postnatal outcome”、“pregnancy outcome”、“maternal outcome”、“neonatal outcome”。本研究方案已在PROSPERO(CRD42022358537)注册。
二、方法
1.研究选择:所有文献由两位不同的研究者使用相同的标准独立筛选。本研究排除了综述文章、荟萃分析和会议摘要,不符合本研究分组标准(可分为NEDV组和AEDV组,或iAEDV组和pAEDV组)、无全文以及重复发表的文献也被排除(图1)。最终纳入25篇文献。
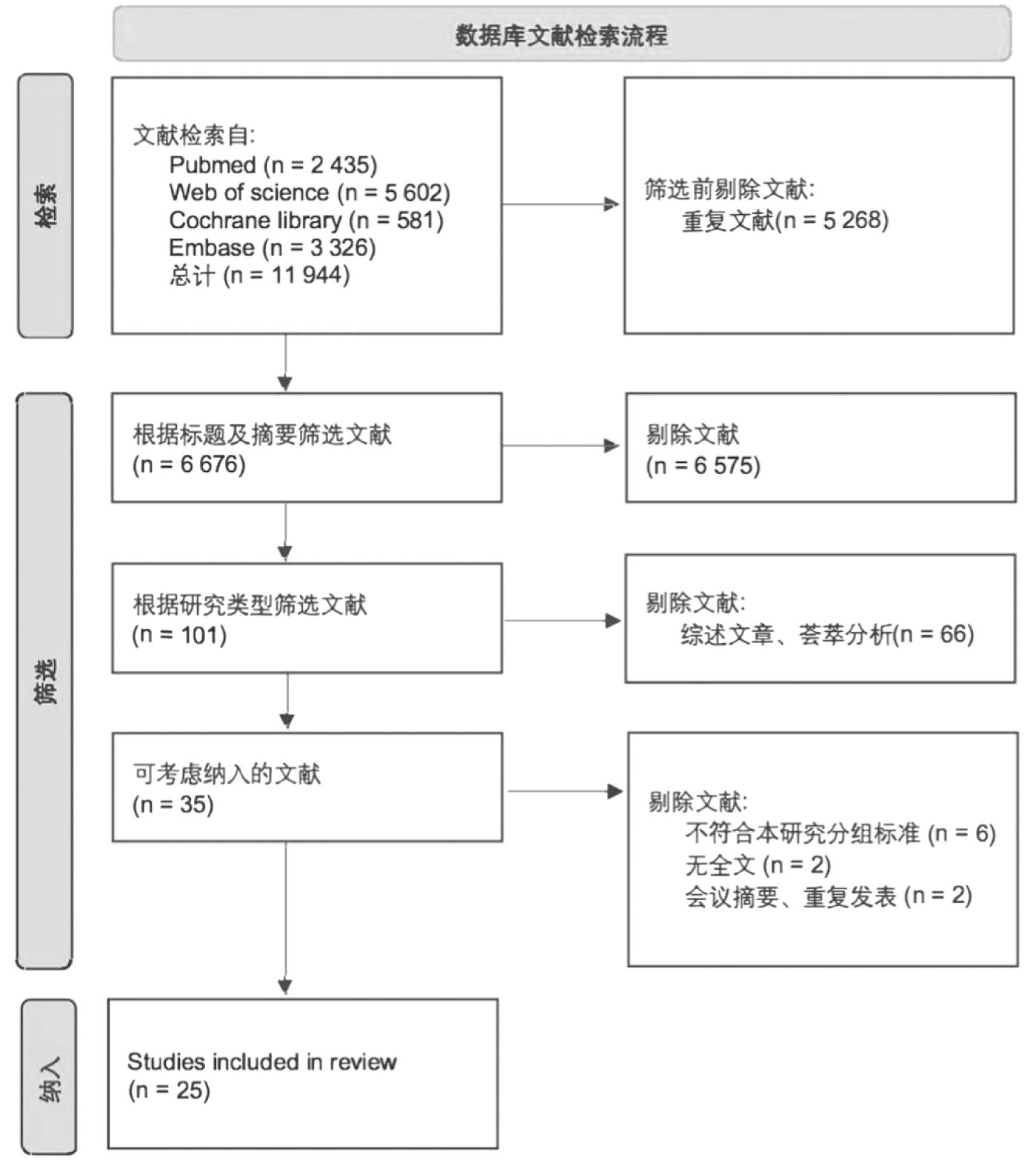
图1 文献检索流程图
2.数据提取:数据提取由两名研究者独立进行。本研究提取以下两类信息:(1)基本信息。第一作者姓名、数据收集和发表时间、样本量大小、母亲年龄、母亲种族、母亲产次、分娩方式。(2)围产期结果。①连续变量:分娩孕周、出生体重、脐动脉pH、1分钟和5分钟的Apgar评分、新生儿重症监护室入院时长、心理发展指数(mental development index,MDI)、血红蛋白(hemoglobin,Hb)、红细胞压积(hematocrit,HCT)、血小板(platelet,PLT)和白细胞(leukocyte,LEU);②分类变量:新生儿死亡(定义为出生后28 d内死亡)、胎死宫内(定义为孕周20周后死亡)或死产(定义为孕周28周后分娩期间死亡)、围产期死亡(定义为孕周28周后出生后7 d内死亡)、低出生体重儿、早产儿、胎儿生长受限(fetal growth restriction,FGR)(定义为超声估计的胎儿体重在相同孕周胎儿中低于第10百分位数或2SD)、小于胎龄儿(small for gestational age,SGA)(定义为出生体重低于相同孕周新生儿的第10百分位数或2SD)、新生儿重症监护室入院、动脉导管未闭(patent ductus arteriosus,PDA)、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、脑室间出血(Intraventricular hemorrhage,IVH)、早产儿视网膜病变(retinopathy of prematurity,ROP)、呼吸窘迫综合症(respiratory distress syndrome,RDS)、支气管肺发育不良(bronchopulmonary dysplasia,BPD)、胎儿窘迫、机械通气、败血症、新生儿高胆红素血症(neonatal hyperbilirubinemia,NHB)或黄疸、全静脉营养(total parenteral nutrition,TPN)、神经运动障碍(包括脑性麻痹、异常的肌张力和/或反射、异常运动表现)、脑室周围白质软化症(periventricular leukomalacia,PVL)。
3.风险偏倚评估:方法学质量评估由两名研究者独立进行。本研究根据Newcastle-Ottawa量表(NOS)的三个潜在偏倚来源(选择、可比性和结果)评估了每个纳入的队列研究的方法学质量[15]。AEDV被视为所有围产期结果的暴露因素。研究在选择类别中可以获得0~6颗星,可比性类别0~2颗星,暴露类别0~4颗星。三个类别相加,星级越多病例系列质量越高。
4.统计分析:本研究使用Freeman-Tukey双反正弦变换来稳定原始比率的方差,使用τ2和I2统计量来评估统计异质性[16],使用DerSimonian-Laird随机效应模型[17]来计算汇总率,使用Clopper-Pearson方法计算了汇总率的置信区间(CIs),使用Egger回归[18]和漏斗图以评估发表偏倚,使用Meta回归和多因素线性回归[19-20]来进行混杂因素的调整。本研究遵循PRISMA和MOOSE的指南[21-22]。所有统计检验均采用双尾检验,P<0.05具有统计学意义。数据分析使用R软件3.5.2版本(从https://www.r-project.org/获得),meta包版本4.9-4,以及SPSS 软件26.0版本。
三、结果
1.研究选择和特征:本研究通过上述在线电子数据库检索到了11 944篇原始文章。在筛选标题、摘要和全文后,本研究共纳入了25篇文章,包括3 413名被试者。纳入研究的基本特征见表1。
表1 纳入研究基本特征
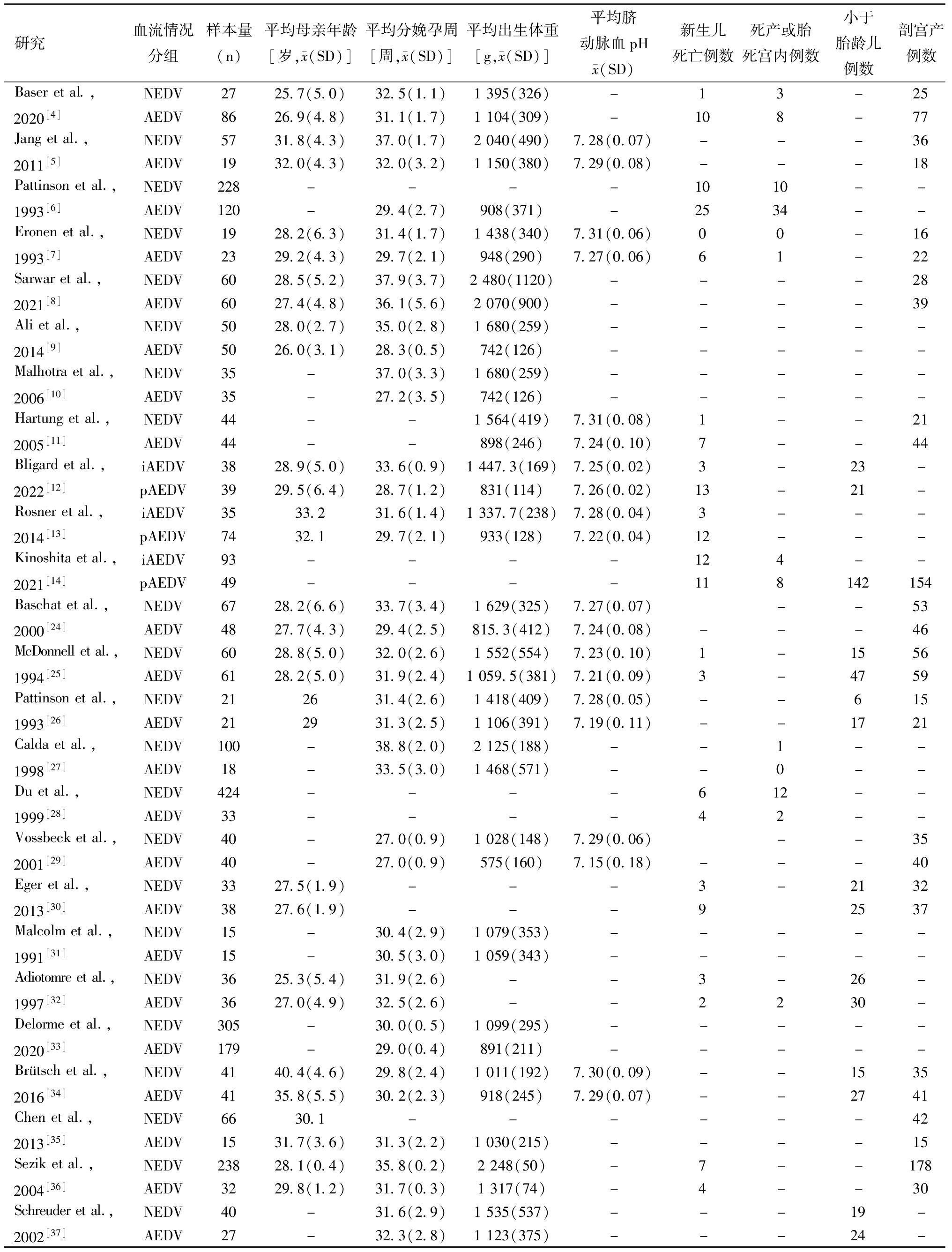
研究血流情况分组样本量(n)平均母亲年龄[岁, x(SD)]平均分娩孕周[周, x(SD)]平均出生体重[g, x(SD)]平均脐动脉血pH x(SD)新生儿死亡例数死产或胎死宫内例数小于胎龄儿例数剖宫产例数Baseretal.,2020[4]NEDV2725.7(5.0)32.5(1.1)1395(326)-13-25AEDV8626.9(4.8)31.1(1.7)1104(309)-108-77Jangetal.,2011[5]NEDV5731.8(4.3)37.0(1.7)2040(490)7.28(0.07)---36AEDV1932.0(4.3)32.0(3.2)1150(380)7.29(0.08)---18Pattinsonetal.,1993[6]NEDV228----1010--AEDV120-29.4(2.7)908(371)-2534--Eronenetal.,1993[7]NEDV1928.2(6.3)31.4(1.7)1438(340)7.31(0.06)00-16AEDV2329.2(4.3)29.7(2.1)948(290)7.27(0.06)61-22Sarwaretal.,2021[8]NEDV6028.5(5.2)37.9(3.7)2480(1120)----28AEDV6027.4(4.8)36.1(5.6)2070(900)----39Alietal.,2014[9]NEDV5028.0(2.7)35.0(2.8)1680(259)-----AEDV5026.0(3.1)28.3(0.5)742(126)-----Malhotraetal.,2006[10]NEDV35-37.0(3.3)1680(259)-----AEDV35-27.2(3.5)742(126)-----Hartungetal.,2005[11]NEDV44--1564(419)7.31(0.08)1--21AEDV44--898(246)7.24(0.10)7--44Bligardetal.,2022[12]iAEDV3828.9(5.0)33.6(0.9)1447.3(169)7.25(0.02)3-23-pAEDV3929.5(6.4)28.7(1.2)831(114)7.26(0.02)13-21-Rosneretal.,2014[13]iAEDV3533.231.6(1.4)1337.7(238)7.28(0.04)3---pAEDV7432.129.7(2.1)933(128)7.22(0.04)12---Kinoshitaetal.,2021[14]iAEDV93----124--pAEDV49----118142154Baschatetal.,2000[24]NEDV6728.2(6.6)33.7(3.4)1629(325)7.27(0.07)--53AEDV4827.7(4.3)29.4(2.5)815.3(412)7.24(0.08)---46McDonnelletal.,1994[25]NEDV6028.8(5.0)32.0(2.6)1552(554)7.23(0.10)1-1556AEDV6128.2(5.0)31.9(2.4)1059.5(381)7.21(0.09)3-4759Pattinsonetal.,1993[26]NEDV212631.4(2.6)1418(409)7.28(0.05)--615AEDV212931.3(2.5)1106(391)7.19(0.11)--1721Caldaetal.,1998[27]NEDV100-38.8(2.0)2125(188)--1--AEDV18-33.5(3.0)1468(571)--0--Duetal.,1999[28]NEDV424----612--AEDV33----42--Vossbecketal.,2001[29]NEDV40-27.0(0.9)1028(148)7.29(0.06)--35AEDV40-27.0(0.9)575(160)7.15(0.18)---40Egeretal.,2013[30]NEDV3327.5(1.9)---3-2132AEDV3827.6(1.9)---92537Malcolmetal.,1991[31]NEDV15-30.4(2.9)1079(353)-----AEDV15-30.5(3.0)1059(343)-----Adiotomreetal.,1997[32]NEDV3625.3(5.4)31.9(2.6)--3-26-AEDV3627.0(4.9)32.5(2.6)--2230-Delormeetal.,2020[33]NEDV305-30.0(0.5)1099(295)-----AEDV179-29.0(0.4)891(211)-----Brütschetal.,2016[34]NEDV4140.4(4.6)29.8(2.4)1011(192)7.30(0.09)--1535AEDV4135.8(5.5)30.2(2.3)918(245)7.29(0.07)--2741Chenetal.,2013[35]NEDV6630.1------42AEDV1531.7(3.6)31.3(2.2)1030(215)----15Seziketal.,2004[36]NEDV23828.1(0.4)35.8(0.2)2248(50)-7--178AEDV3229.8(1.2)31.7(0.3)1317(74)-4--30Schreuderetal.,2002[37]NEDV40-31.6(2.9)1535(537)---19-AEDV27-32.3(2.8)1123(375)---24-
2.纳入研究的偏倚风险:根据NOS量表进行了纳入研究的质量评估。在25篇纳入的研究中,有8篇获得了9颗星,11篇获得了8颗星,6篇获得了7颗星。76%的纳入研究获得了8颗星或更高的评分,它们报告了荟萃分析的主要结果。
3.AEDV与NEDV的围产期结局荟萃分析:本研究得出了AEDV和NEDV围产期结局的荟萃分析结果,见表2和表3。NEDV组的新生儿死亡率为2.5%(95%CI:1.1%~4.3%),明显低于AEDV组的13.8%(95%CI:10.4%~17.6%)。NEDV组的死产或胎死宫内率为2.4%(95%CI:1.2%~4.1%),明显低于AEDV组的8.7%(95%CI:3.3%~5.8%),差异有统计学意义(P=0.02)。NEDV组的胎儿窘迫率(26.3%,95%CI:15.8%~38.3%)明显低于AEDV组(51.7%,95%CI:40.7%~62.5%)。NEDV组的FGR率(31.5%,95%CI:7.2%~63.2%)明显低于AEDV组(68.4%,95%CI:49.5%~84.7%)。两组之间的早产率没有显著差异(P=0.155)。NEDV组的分娩时孕周为(33.1 ± 3.3)周,出生体重为(1 588.3 ± 431.6)g,而AEDV组的分娩孕周较早,为(30.6 ± 2.2)周,出生体重较小,为(1 038.8 ± 314.4)g,两组之间有统计学差异(P<0.01)。表2和3显示了NEDV与AEDV之间的其他比较结果。相应的漏斗图(篇幅所限未列出)和Egger回归结果表明新生儿死亡(P=0.019)和室间脑出血(P =0.002)这两组结果存在显著发表偏倚,但剪切修补法[23](修正率分别为0.04、0.06)显示这对合并结果没有显著影响。没有发现其他显著的发表偏倚。
表2 NEDV与AEDV组的围产期结局比较
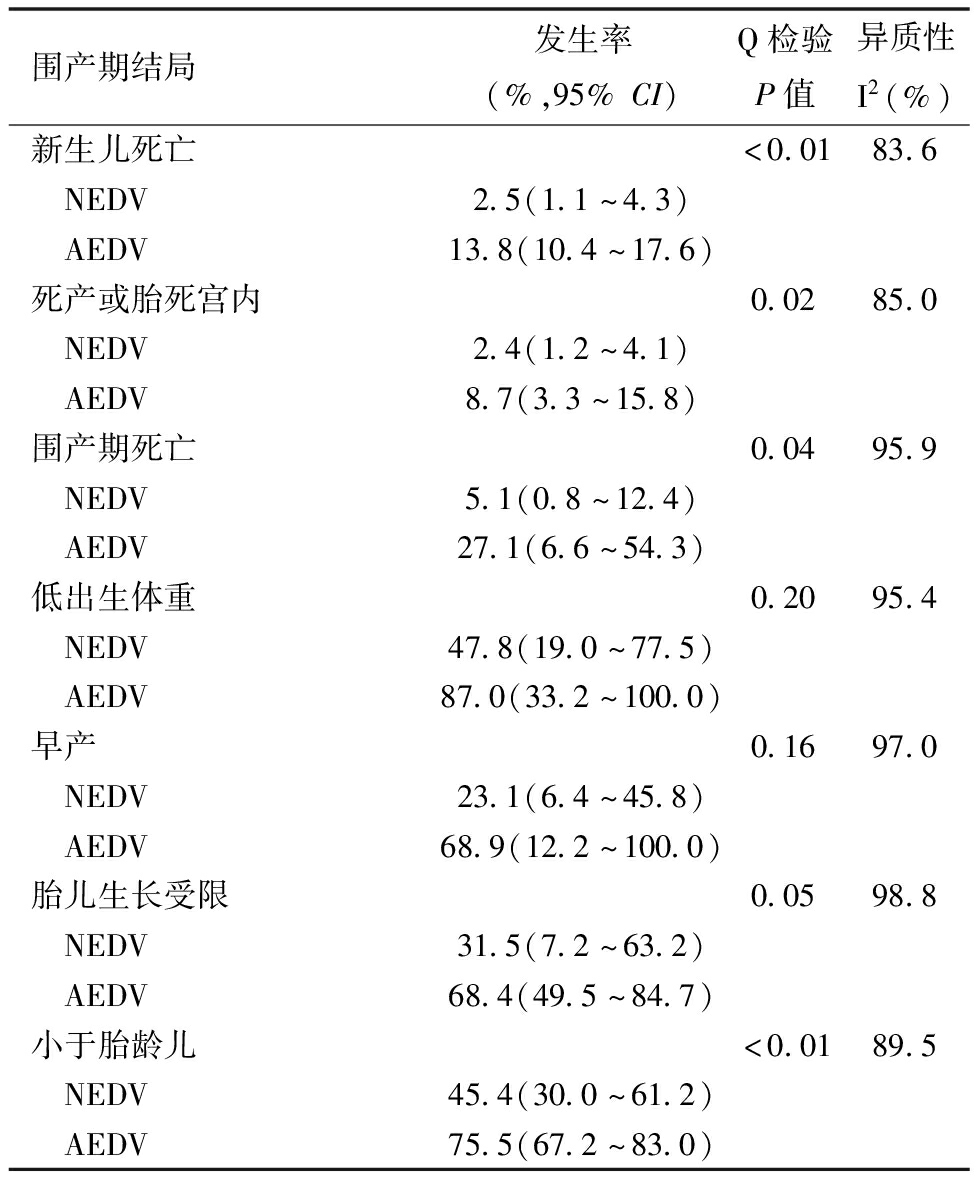
围产期结局发生率(%,95%CI)Q检验P值异质性I2(%)新生儿死亡<0.0183.6 NEDV2.5(1.1~4.3) AEDV13.8(10.4~17.6)死产或胎死宫内0.0285.0 NEDV2.4(1.2~4.1) AEDV8.7(3.3~15.8)围产期死亡0.0495.9 NEDV5.1(0.8~12.4) AEDV27.1(6.6~54.3)低出生体重0.2095.4 NEDV47.8(19.0~77.5) AEDV87.0(33.2~100.0)早产0.1697.0 NEDV23.1(6.4~45.8) AEDV68.9(12.2~100.0)胎儿生长受限0.0598.8 NEDV31.5(7.2~63.2) AEDV68.4(49.5~84.7)小于胎龄儿<0.0189.5 NEDV45.4(30.0~61.2) AEDV75.5(67.2~83.0)
表2(续)
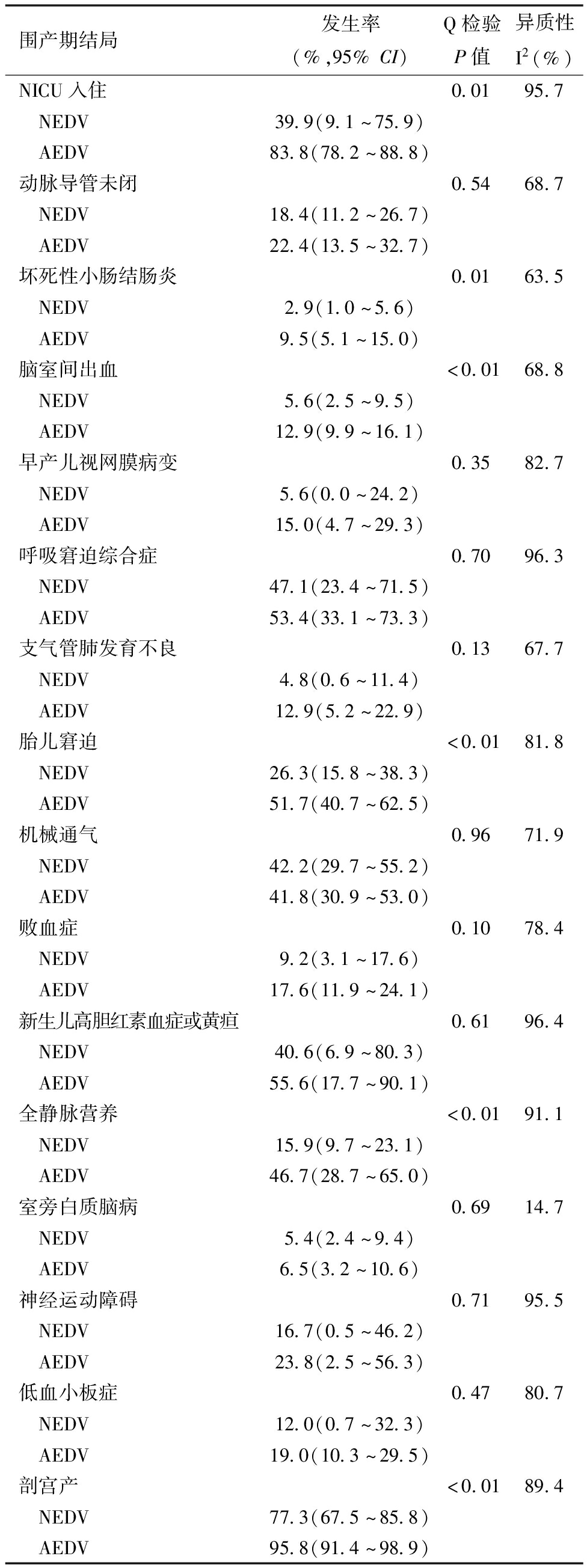
围产期结局发生率(%,95%CI)Q检验P值异质性I2(%)NICU入住0.0195.7 NEDV39.9(9.1~75.9) AEDV83.8(78.2~88.8)动脉导管未闭0.5468.7 NEDV18.4(11.2~26.7) AEDV22.4(13.5~32.7)坏死性小肠结肠炎0.0163.5 NEDV2.9(1.0~5.6) AEDV9.5(5.1~15.0)脑室间出血<0.0168.8 NEDV5.6(2.5~9.5) AEDV12.9(9.9~16.1)早产儿视网膜病变0.3582.7 NEDV5.6(0.0~24.2) AEDV15.0(4.7~29.3)呼吸窘迫综合症0.7096.3 NEDV47.1(23.4~71.5) AEDV53.4(33.1~73.3)支气管肺发育不良0.1367.7 NEDV4.8(0.6~11.4) AEDV12.9(5.2~22.9)胎儿窘迫<0.0181.8 NEDV26.3(15.8~38.3) AEDV51.7(40.7~62.5)机械通气0.9671.9 NEDV42.2(29.7~55.2) AEDV41.8(30.9~53.0)败血症0.1078.4 NEDV9.2(3.1~17.6) AEDV17.6(11.9~24.1)新生儿高胆红素血症或黄疸0.6196.4 NEDV40.6(6.9~80.3) AEDV55.6(17.7~90.1)全静脉营养<0.0191.1 NEDV15.9(9.7~23.1) AEDV46.7(28.7~65.0)室旁白质脑病0.6914.7 NEDV5.4(2.4~9.4) AEDV6.5(3.2~10.6)神经运动障碍0.7195.5 NEDV16.7(0.5~46.2) AEDV23.8(2.5~56.3)低血小板症0.4780.7 NEDV12.0(0.7~32.3) AEDV19.0(10.3~29.5)剖宫产<0.0189.4 NEDV77.3(67.5~85.8) AEDV95.8(91.4~98.9)
表3 NEDV与AEDV组的围产期结局比较(均值差)
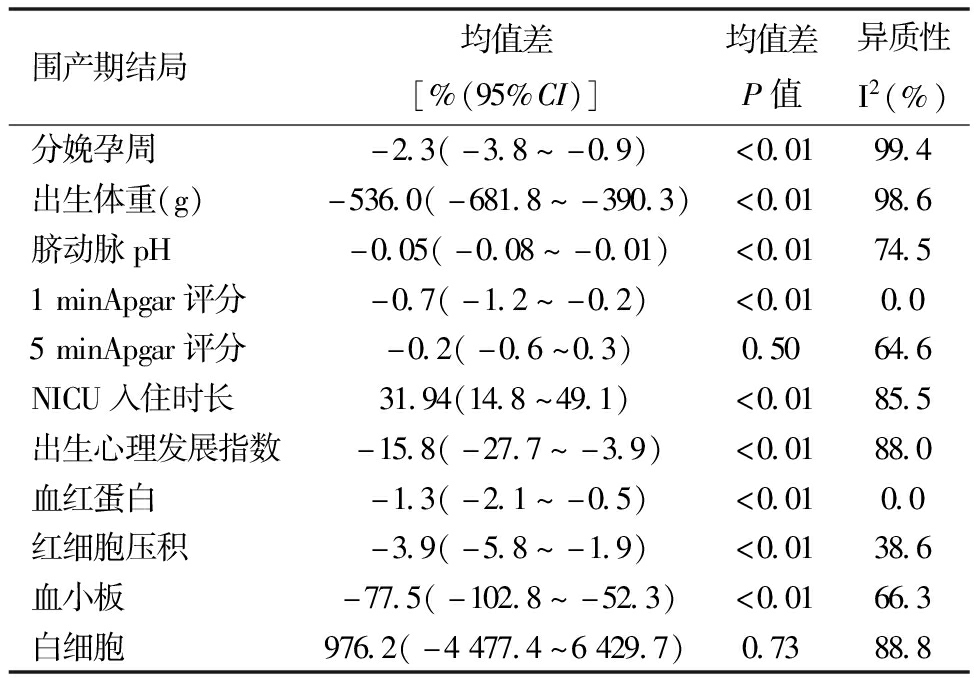
围产期结局均值差[%(95%CI)]均值差P值异质性I2(%)分娩孕周-2.3(-3.8~-0.9)<0.0199.4出生体重(g)-536.0(-681.8~-390.3)<0.0198.6脐动脉pH-0.05(-0.08~-0.01)<0.0174.51minApgar评分-0.7(-1.2~-0.2)<0.010.05minApgar评分-0.2(-0.6~0.3)0.5064.6NICU入住时长31.94(14.8~49.1)<0.0185.5出生心理发展指数-15.8(-27.7~-3.9)<0.0188.0血红蛋白-1.3(-2.1~-0.5)<0.010.0红细胞压积-3.9(-5.8~-1.9)<0.0138.6血小板-77.5(-102.8~-52.3)<0.0166.3白细胞976.2(-4477.4~6429.7)0.7388.8
由于文献数量较少,部分妊娠结局数据缺失,本研究仅对“分娩孕周”及“出生体重”这两个结局进行了分层分析,将具有诊断孕周数据的6篇文献根据诊断孕周小于28周和大于等于28周分为两层,得出分娩孕周及出生体重在两层中均与AEDV显著相关(见表4)。
表4 NEDV与AEDV组的围产期结局的分层分析
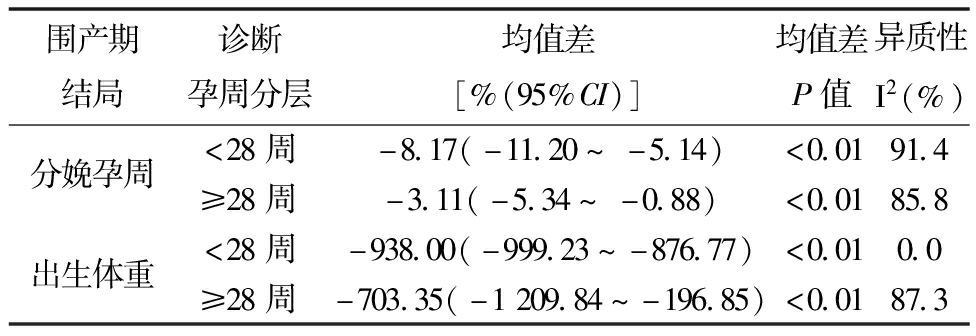
围产期结局诊断孕周分层均值差[%(95%CI)]均值差P值异质性I2(%)分娩孕周<28周-8.17(-11.20~-5.14)<0.0191.4≥28周-3.11(-5.34~-0.88)<0.0185.8出生体重<28周-938.00(-999.23~-876.77)<0.010.0≥28周-703.35(-1209.84~-196.85)<0.0187.3
总之,与NEDV组相比,AEDV胎儿有更多的不良围产期结局,如新生儿死亡、死产或胎死宫内、围产期死亡、新生儿重症监护室入院、FGR、SGA、NEC、IVH、胎儿窘迫、TPN。此外,AEDV胎儿的分娩孕周较早,出生体重较低,新生儿重症监护室停留时间较长,脐动脉pH较低,1分钟Apgar评分较低,MDI较低,Hb较低,HCT较低,PLT较低。
4.iAEDV与pAEDV的围产期结果合并分析:本研究也得出了iAEDV和pAEDV围产期结局的荟萃分析结果(表5和表6)。在iAEDV组和pAEDV组之间,新生儿死亡、FGR、NEC、IVH的率没有显著差异。然而,iAEDV组的分娩孕周明显晚于pAEDV组[(31.3 ± 2.5)周与(28.6 ± 1.2)周,P= 0.022],出生体重为高于pAEDV组[(1 353.3 ± 87.2)g与(1 019.5 ± 243.5)g,P< 0.01]。相应的漏斗图(篇幅所限未列出)和Egger回归未发现任何显著的发表偏倚。总之,与iAEDV组相比,pAEDV胎儿有更多的不良围产期结局,如分娩时孕周更低,出生体重更小。
表5 iAEDV与pAEDV组的围产期结局比较(率)
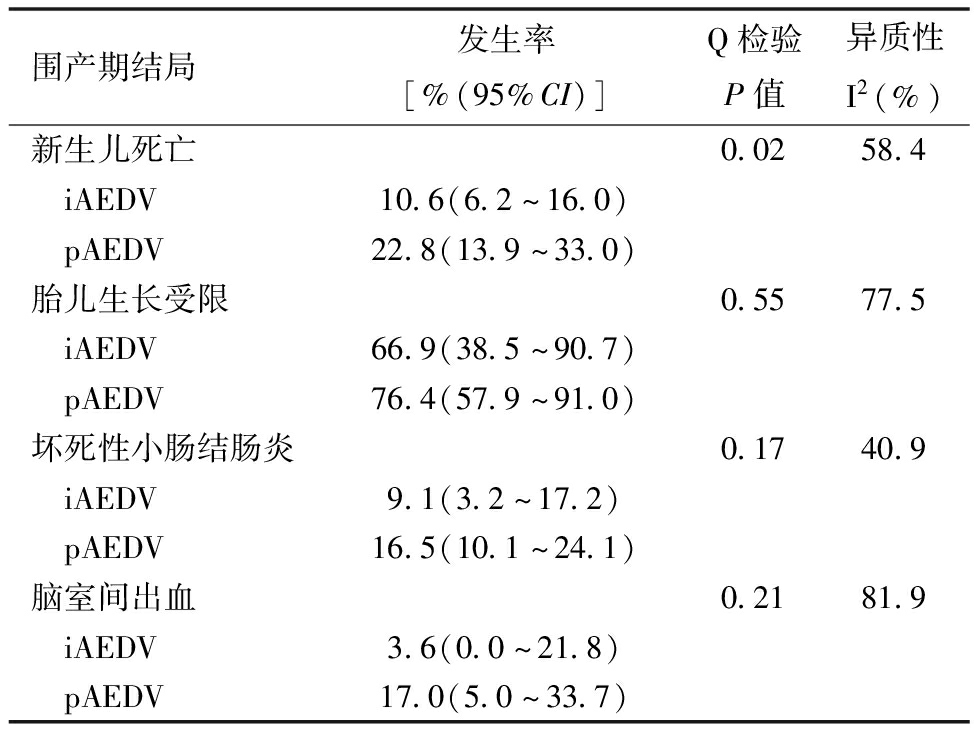
围产期结局发生率[%(95%CI)]Q检验P值异质性I2(%)新生儿死亡0.0258.4 iAEDV10.6(6.2~16.0) pAEDV22.8(13.9~33.0)胎儿生长受限0.5577.5 iAEDV66.9(38.5~90.7) pAEDV76.4(57.9~91.0)坏死性小肠结肠炎0.1740.9 iAEDV9.1(3.2~17.2) pAEDV16.5(10.1~24.1)脑室间出血0.2181.9 iAEDV3.6(0.0~21.8) pAEDV17.0(5.0~33.7)
表6 iAEDV与pAEDV组的围产期结局比较(均值差)
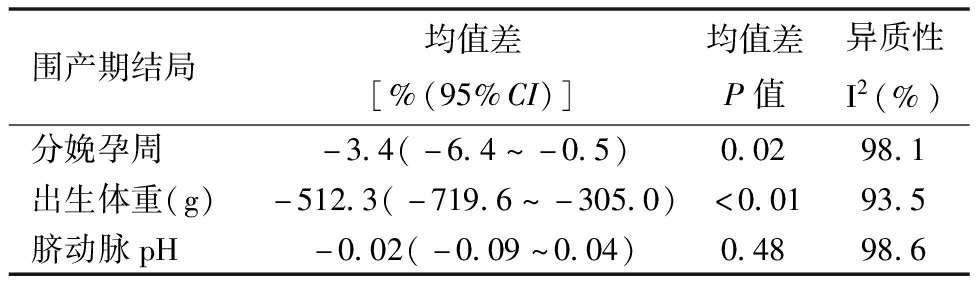
围产期结局均值差[%(95%CI)]均值差P值异质性I2(%)分娩孕周-3.4(-6.4~-0.5)0.0298.1出生体重(g)-512.3(-719.6~-305.0)<0.0193.5脐动脉pH-0.02(-0.09~0.04)0.4898.6
5.Meta回归:本研究进行了随机效应的 Meta回归分析,对显著的围产期结果进行了调整,包括出版年份、样本大小、地区和孕妇年龄等潜在混杂因素。结果表明,出版年份对FGR的汇总率有影响(P<0.01)。样本大小影响了围产期死亡(P<0.05)、FGR(P<0.001)、室间脑出血(P<0.05)、剖宫产(P<0.05)、胎儿窘迫(P<0.05)和出生体重(P<0.05)的汇总率。地区影响了FGR(P<0.05)、剖宫产(P<0.001)和出生体重(P<0.01)的汇总率。母亲年龄影响了FGR(P<0.001)和新生儿重症监护室入院(P<0.1)的汇总率。
三、讨论
在脐动脉多普勒(UAD)筛查中,AEDV是不良围产期预后的重要预测因素。先前的研究已经显示,与AEDV相关的不良妊娠结局有分娩时孕周较低[4-7]、出生体重较低[4-6,8-11]、新生儿重症监护室停留时间较长[4]、UA pH较低[11]、PLT较低[5,24-26]以及不良围产期结果的发生率较高,如新生儿重症监护室入院[8-9]、早产[9]、围产期死亡[6,9-10,27-29]、FGR[25,28]、SGA[6]、脓毒症[4]、TPN[4]、IVH[7,9,30]、BPD[7,11]、RDS[11,26]、PVL[11]、NEC[31]、胎儿窘迫[28]和机械通气[11,32]。以往的研究还进行了神经系统结果的随访,显示患有AEDV的胎儿患有更高的神经运动障碍风险[29,33]和较低的MDI[34-35]。由于总体研究的规模较小,每项研究中的人群不一致,AEDV对围产期预后的影响仍然不清楚。本研究得出了相同的结论,即与NEDV组相比,AEDV胎儿有更多的不良围产期结局,如围产期死亡、新生儿重症监护室入院、FGR、SGA、NEC、IVH、胎儿窘迫、TPN。此外,AEDV胎儿的分娩孕周较早,出生体重较低,新生儿重症监护室停留时间较长,脐动脉pH较低,MDI较低,PLT较低。此外,还发现了一些未报告的结果,如1分钟Apgar评分较低、Hb较低、HCT较低、新生儿死亡率较高、死产或胎死宫内率和剖宫产率等均具有显著差异。表明AEDV对不良围产期结果具有严重影响,需要更多的规范和干预措施。
既往研究中关于iAEDV和pAEDV的定义仍然不清楚。Bligard等人[12]基于血流缺失的比例,以50%分界点来区分iAEDV和pAEDV。然而,Rosner等人[13]定义pAEDV为所有胎儿心脏周期都具有AEDV。pAEDV往往预测不良的围产期结果风险增加。以往的研究表明,与iAEDV胎儿相比,pAEDV胎儿的新生儿死亡率更高[12,14]、分娩孕周较早[12-13],诊断到分娩时间较短[12],出生体重较低[13],UA pH较低[13]。虽然只检索到了三篇相关文献,本文也得出了类似的结论,即患有pAEDV组的胎儿较NEDV组而言分娩孕周较低,出生体重较低。这表明pAEDV意味着更严重的疾病状态,需要进行更早和更积极的干预。iAEDV和pAEDV在诊断到分娩时间上的显著差异作为临床实践中估算存活时间的初步指标,Bligard等人[12]的研究表明iADEV诊断到分娩时间平均11天,pAEDV平均3天,Kinoshita等人[14]的研究表明活产胎儿诊断到分娩时间平均148 d,死产胎儿平均14 d,但并未区分iAEDV和pAEDV,无法进行荟萃分析,还需要更多的研究来对不同类型AEDV的干预进行指导。
据文献检索所知,本研究是有关AEDV胎儿的围产期结果的第一个系统回顾和荟萃分析,本研究仍然存在一些限制。首先,由于AEDV的发病率低,目前关于AEDV的研究数量十分有限,我们仅检索到了三篇比较iAEDV和pAEDV围产期结果的文章,每篇研究纳入的妊娠结局也不一致,所以得到的证据有限。其次,有关影响围产儿不良结局(新生儿死亡、胎儿窘迫、胎儿生长受限等)的其他重要因素如母体高危因素(妊娠期糖尿病、子痫前期等)和胎儿发育异常,纳入的研究未提供具体数据,不能除外这些因素对研究结果产生的偏移。此外,漏斗图和Egger回归分析发现新生儿死亡和IVH存在显著的发表偏倚,但通过修剪填充法表明这对汇总结果没有显著影响。引文检索仅限于英文,这可能导致选择性偏倚。
总之,这项系统性回顾和荟萃分析揭示了患有AEDV的胎儿较NEDV胎儿多种不良结局更高,患有pAEDV的胎儿较iAEDV分娩孕周较低,出生体重较低。建议在AEDV诊断后的前十天内进行严格的胎儿监测,并对于pAEDV胎儿进行更积极的干预。此外,需要进行多中心的随访研究,以评估存活婴儿的长期结果,并提出更好的AEDV胎儿的规范和干预措施。
1 Bhide A,Acharya G,Baschat A,et al.ISUOG Practice Guidelines(updated):use of Doppler velocimetry in obstetrics.Ultrasound Obstet Gynecol,2021,58:331-339.
2 Fisk NM,MacLachlan N,Ellis C,et al.Absent end-diastolic flow in first trimester umbilical artery.Lancet,1988,2:1256-1257.
3 Trudinger BJ,Stevens D,Connelly A,et al.Umbilical artery flow velocity waveforms and placental resistance:the effects of embolization of the umbilical circulation.Am J Obstet Gynecol,1987,157:1443-1448.
4 Baser E,Celik IH,Bilge M,et al.Abnormal umblical artery Doppler is utilized for fetuses with intrauterine growth restriction birth at 28(0/7)-33(6/7) gestational weeks.Fetal Pediatr Pathol,2020,39:467-475.
5 Jang DG,Jo YS,Lee SJ,et al.Perinatal outcomes and maternal clinical characteristics in IUGR with absent or reversed end-diastolic flow velocity in the umbilical artery.Arch Gynecol Obstet,2011,284:73-78.
6 Pattinson RC,Odendaal HJ,Kirsten G.The relationship between absent end-diastolic velocities of the umbilical artery and perinatal mortality and morbidity.Early Hum Dev,1993,33:61-69.
7 Eronen M,Kari A,Pesonen E,et al.Value of absent or retrograde end-diastolic flow in fetal aorta and umbilical artery as a predictor of perinatal outcome in pregnancy-induced hypertension.Acta Paediatr,1993,82:919-924.
8 Sarwar A,Afridi H,Riaz B,et al.Association of adverse outcomes with abnormal umbilical artery waveform in intrauterine growth restricted pregnancies.Pak J Med Health Sci,2021,15:2340-2342.
9 Ali A,Ara I,Sultana R,et al.Comparison of perinatal outcome of growth restricted fetuses with normal and abnormal umbilical artery Doppler waveforms.J Ayub Med Coll Abbottabad,2014,26:344-348.
10 Malhotra N,Chanana C,Kumar S,et al.Comparison of perinatal outcome of growth-restricted fetuses with normal and abnormal umbilical artery Doppler waveforms.Indian J Med Sci,2006,60:311-317.
11 Hartung J,Kalache KD,Heyna C,et al.Outcome of 60 neonates who had ARED flow prenatally compared with a matched control group of appropriate-for-gestational age preterm neonates.Ultrasound Obstet Gynecol,2005,25:566-572.
12 Bligard KH,Xu X,Raghuraman N,et al.Clinical significance of umbilical artery intermittent vs persistent absent end-diastolic velocity in growth-restricted fetuses.Am J Obstet Gynecol,2022,227:519.e1-519.e9.
13 Rosner J,Rochelson B,Rosen L,et al.Intermittent absent end diastolic velocity of the umbilical artery:antenatal and neonatal characteristics and indications for delivery.J Matern Fetal Neonatal Med,2014,27:94-97.
14 Kinoshita M,Thuring A,Morsing E,et al.Extent of absent end-diastolic flow in umbilical artery and outcome of pregnancy.Ultrasound Obstet Gynecol,2021,58:369-376.
15 Zeng X,Zhang Y,Kwong JS,et al.The methodological quality assessment tools for preclinical and clinical studies,systematic review and meta-analysis,and clinical practice guideline:a systematic review.J Evid Based Med,2015,8:2-10.
16 Higgins JP,Thompson SG,Deeks JJ,et al.Measuring inconsistency in meta-analyses.BMJ,2003,327:557-560.
17 DerSimonian R,Laird N.Meta-analysis in clinical trials.Control Clin Trials,1986,7:177-188.
18 Egger M,Davey Smith G,Schneider M,et al.Bias in meta-analysis detected by a simple,graphical test.BMJ,1997,315:629-634.
19 Huizenga HM,Visser I,Dolan CV.Testing overall and moderator effects in random effects meta-regression.Br J Math Stat Psychol,2011,64:1-19.
20 Morton SC,Adams JL,Suttorp MJ,et al.Meta‐regression approaches:what,why,when,and how?.AHRQ technical reviews.Agency for Healthcare Research and Quality(US),2004.http://www.ncbi.nlm.nih.gov/books/NBK43894/?report=printable
21 Stroup DF,Berlin JA,Morton SC,et al.Meta-analysis of observational studies in epidemiology:a proposal for reporting.Meta-analysis Of Observational Studies in Epidemiology(MOOSE) group.JAMA,2000,283:2008-2012.
22 Moher D,Liberati A,Tetzlaff J,et al.Preferred reporting items for systematic reviews and meta‐analyses:the PRISMA statement.BMJ(Clin Res Ed),2009,339:b2535.
23 Duval S,Tweedie R.Trim and fill:A simple funnel-plot-based method of testing and adjusting for publication bias in meta-analysis.Biometrics,2000,56:455-463.
24 Baschat AA,Gembruch U,Reiss I,et al.Absent umbilical artery end-diastolic velocity in growth-restricted fetuses:a risk factor for neonatal thrombocytopenia.Obstet Gynecol,2000,96:162-166.
25 McDonnell M,Serra-Serra V,Gaffney G,et al.Neonatal outcome after pregnancy complicated by abnormal velocity waveforms in the umbilical artery.Arch Dis Child Fetal Neonatal Ed,1994,70:F84-89.
26 Pattinson RC,Hope P,Imhoff R,et al.Obstetric and neonatal outcome in fetuses with absent end-diastolic velocities of the umbilical artery:a case-controlled study.Am J Perinatol,1993,10:135-138.
27 Calda P,Zizka Z,et al.Perinatal outcome in growth retarded fetuses with absent or reversed end-diastolic flow in the umbilical artery.Med Sci Monitor,1998,4:209-214.
28 Du J,Gao S,et al.Clinical analysis of the absent and/or reverse end diastolic velocity of fetal umbilical artery.Chin J Obstet Gynecol,1999,34:594-596.
29 Vossbeck S,de Camargo OK,Grab D,et al.Neonatal and neurodevelopmental outcome in infants born before 30 weeks of gestation with absent or reversed end-diastolic flow velocities in the umbilical artery.Eur J Pediatr,2001,160:128-134.
30 Eger SH,Sommerfelt K,Kiserud T,et al.Foetal umbilical artery Doppler in small preterms:(IQ) neurocognitive outcome at 5 years of age.Acta Paediatr,2013,102:403-409.
31 Malcolm G,Ellwood D,Devonald K,et al.Absent or reversed end diastolic flow velocity in the umbilical artery and necrotising enterocolitis.Arch Dis Child,1991,66:805-807.
32 Adiotomre PN,Johnstone FD,Laing IA.Effect of absent end diastolic flow velocity in the fetal umbilical artery on subsequent outcome.Arch Dis Child Fetal Neonatal Ed,1997,76:F35-38.
33 Delorme P,Kayem G,Lorthe E,et al.Neurodevelopment at 2 years and umbilical artery Doppler in cases of very preterm birth after prenatal hypertensive disorder or suspected fetal growth restriction:EPIPAGE-2 prospective population-based cohort study.Ultrasound Obstet Gynecol,2020,56:557-565.
34 Brütsch S,Burkhardt T,Kurmanavicius J,et al.Neurodevelopmental outcome in very low birthweight infants with pathological umbilical artery flow.Arch Dis Child Fetal Neonatal Ed,2016,101:F212-216.
35 Chen CY,Wang KG,Wang SM,et al.Two-year neurological outcome of very-low-birth-weight children with prenatal absent or reversed end-diastolic flow velocity in the umbilical artery.Taiwan J Obstet Gynecol,2013,52:323-328.
36 Sezik M,Tuncay G,Yapar EG.Prediction of adverse neonatal outcomes in preeclampsia by absent or reversed end-diastolic flow velocity in the umbilical artery.Gynecol Obstet Invest,2004,57:109-113.
37 Schreuder AM,McDonnell M,Gaffney G,et al.Outcome at school age following antenatal detection of absent or reversed end diastolic flow velocity in the umbilical artery.Arch Dis Child Fetal Neonatal Ed,2002,86:F108-114.