早发性卵巢功能不全(premature ovarian insufficiency,POI)是指女性提前出现卵巢衰老,即在40岁以前出现卵巢功能减退,以月经异常(月经稀发或频发、闭经等)、低雌激素和高促性腺激素等变化为主要临床特征的一种疾病[1]。流行病学统计数据显示,在不同的人群中,POI病例的患病率在0.9%~4%之间[2],发病率有逐年升高且低龄化的趋势,该类患者的自然妊娠率仅为5%~10%,是女性不孕的主要原因之一[3]。POI发病机制不明,目前认为该病的发生主要与遗传、自身免疫性疾病、感染、化疗、放疗、外科手术、环境影响等几个因素有关[4]。以往认为该病不可逆,但近年发现有部分女性在接受治疗后可能怀孕[5],这意味着该病存在潜在的可逆机制,因此研究其发病机制有助于早期发现并进行干预治疗。
目前,越来越多研究证明POI发病与人体内免疫环境的紊乱有关,其中炎症蛋白的平衡失调可能是POI发病的主要因素[6-10]。但不同研究得到的结论不一致,可能是由于以往的研究多为病例-对照研究,为观察性研究,样本量有限,统计效能不足,可能存在混杂偏倚和潜在的反向因果关系。
孟德尔随机化是一种以遗传变异作为工具变量来识别危险因素与疾病之间因果关系的有效方法,消除了混杂因素和反向因果,比常规RCT研究的结果更具可靠性[11]。因此,本研究拟采用两样本孟德尔随机化的研究方法探究炎症蛋白与POI之间的因果关系,阐明POI可能的发病机制,为诊断和治疗POI提供依据。
资料与方法
一、资料来源
本研究使用的与循环炎症蛋白有关的单核苷酸多态性(single nucleotide polymorphism,SNPs)来自一项最新的研究,该研究对11个队列中14 824名参与者使用Olink Target平台测量的91种血浆蛋白进行了全基因组蛋白质数量性状位点(pQTL)鉴定[12]。POI的数据通过IEU Open GWAS项目从FinnGen生物库中提取,其中纳入了118 484名欧洲血统的个体,包括254例POI病例和118 228例对照,SNP数量为16 379 677,该数据已经对年龄、体质指数等10个主要成分、基因和遗传关系进行了校正[13]。
二、研究方法
以炎症蛋白作为暴露因素,选取与暴露因素相关性高的SNPs作为工具变量(instrumental variables,IVs),POI作为结局因素。利用两样本孟德尔随机化的方法进行因果分析。为了选取适当的IVs,本研究制定了三个假设:(1)IVs与炎症蛋白之间关联性显著;(2)IVs与POI所有混杂因素都不相关;(3)IVs不能直接影响结果,只能通过炎症蛋白对结果产生影响。
工具变量选择:(1)首先根据P<5×10-6在全基因组水平上确定与循环炎症蛋白相关性显著的SNPs。(2)通过连锁不平衡聚类获得独立的SNPs(P<5×10-6 ,r2<0.001,等位基因距离>10 000 kb)。(3)计算每个SNP的F值,排除弱工具变量偏倚(F ≤ 10),将F>10的SNP纳入分析,以确保IV与暴露因素之间的相关性强度。计算公式为F=β2/SE2。删除回文SNP,剩余的SNP即为工具变量,纳入后续分析中。(4)在PhenoScanner(http://www.phenoscanner.medschl.cam.ac.uk/)搜索所有纳入分析的SNPs,排除可能与POI相关的混杂因素。
三、统计分析
主要采用逆方差加权法(inverse variance weighted,IVW)进行分析,同时采取MR Egger法、Simple Mode法、Weighted median法和Weighted Mode法作为补充,P<0.05为差异具有统计学意义。为了确保结果的可靠性,对结果进行敏感性检验,包括异质性检验、水平多效性检验、“留一法”检验。采用Cochran′s Q检验对SNPs的异质性进行检验,如果P>0.05,则表明统计结果没有异质性。用MR Egger回归检验对水平多效性进行检验,Egger intercept截断值用于估计遗传变异是否通过暴露以外的混杂因素影响结局,若P>0.05则表明研究结果没有水平多效性。采用“留一法”进一步评估每种IV的独立性,检测是否有单个SNP对结果有显著影响。此外,使用MR PRESSO对离群值进行检测,若存在离群SNP则将其剔除并重新进行分析。当IVW法分析的结果P<0.05,没有水平多效性和异质性,且其他方法的OR值与IVW法OR值在同一方向上(即结果均大于1或均小于1)时,认为该结果为阳性结果。所有分析均在R 4.2.3和版本0.5.4的“Two Sample MR”软件包中进行,α=0.05。
结 果
一、与POI相关的炎症蛋白结果
根据IVW的结果,共筛选出4种与POI存在统计学相关性的炎症蛋白(P<0.05),分别是胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF),白介素-10(interleukin-10,IL-10),白介素-4(interleukin-4,IL-4),白血病抑制因子(leukemia inhibitory factor,LIF)。具体数值见图1, GDNF(OR=1.558,95%CI:1.078~2.252)、IL-4 (OR=1.629,95%CI:1.038~2.557)、LIF(OR=1. 578,95%CI:1.027~2.429)与POI的风险正相关,IL-10(OR=0.653,95%CI:0.462~0.922)与POI的风险成负相关(见图2散点图所示)。但是值得注意的是,IVW法显示IL-4与POI之间存在相关性,但MR Egger法分析结果为(OR=0.946,95%CI:0.314~2.845),与IVW法结果的OR值方向性不一致,MR Egger回归截距值证明不存在水平多效性(P=0.302),MR PRESSO未检测到异常离群值(P=0.908),IL-4可能与POI无直接关联。
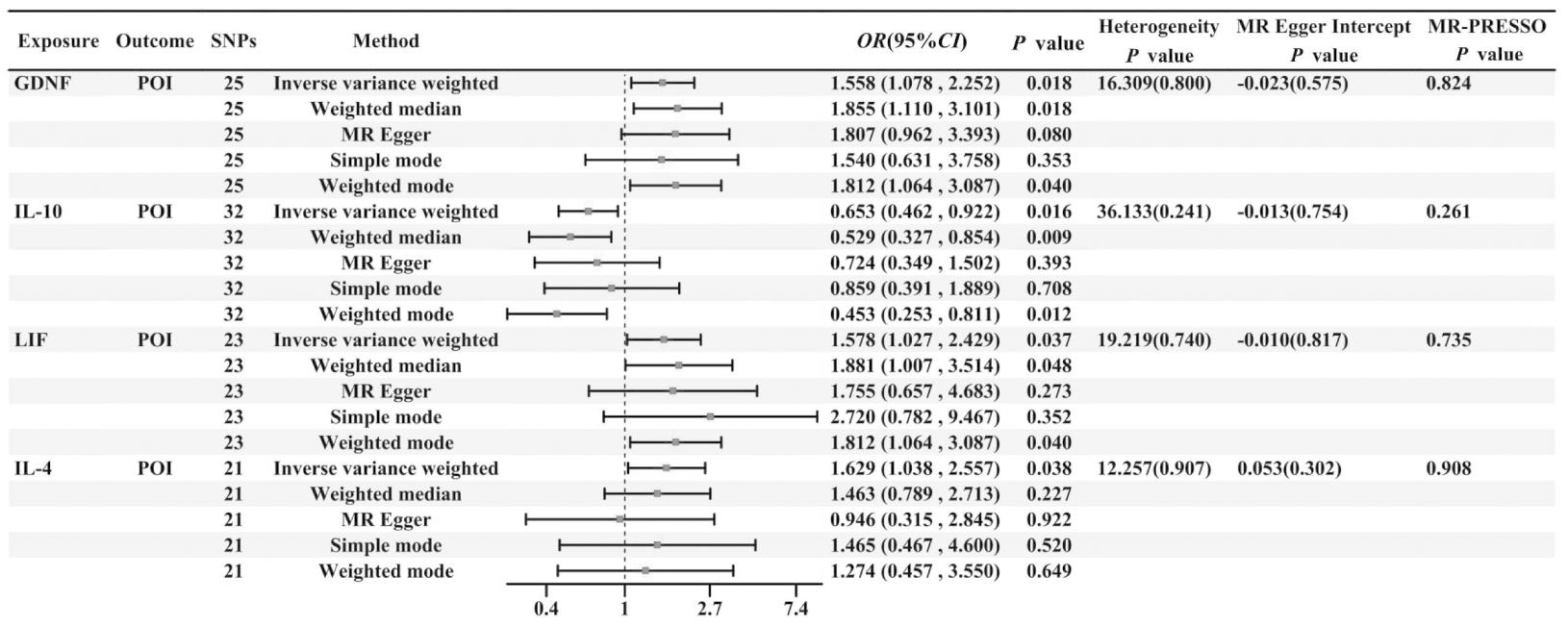
图1 MR分析的主要结果森林图
Figure 1 Main results of MR analysis
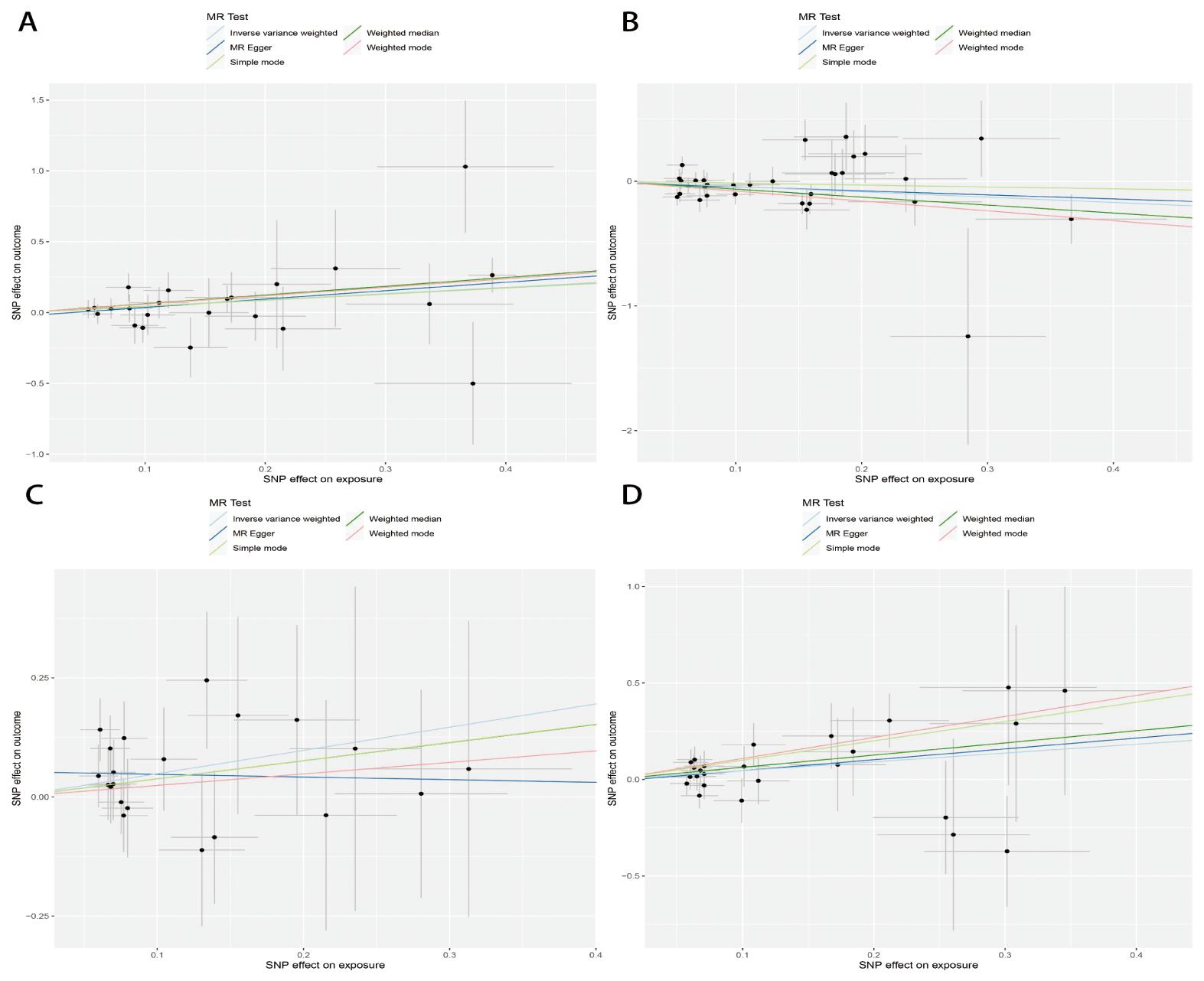
A,B, C, D分别代表GDNF, IL-10, IL-4, LIF
图2 炎症蛋白与POI的MR分析散点图
Figure 2 MR analysis scatter plot of inflammatory proteins and POI
二、敏感性检验
通过Cochran′s Q检验检测是否存在异质性,结果GDNF、IL-10、IL-4、LIF的IVW法Cochran′s Q检验P>0.05(见图1),SNPs漏斗图呈大致对称形状(见图3),表明各项结果均不存在异质性。MR egger回归截距(egger_intercept)和MR PRESSO检测的P值均>0.05(见图1),表明结果不存在明显的水平多效性。“留一法”结果表明,不存在对结果有显著影响的单个SNP(见图4)。
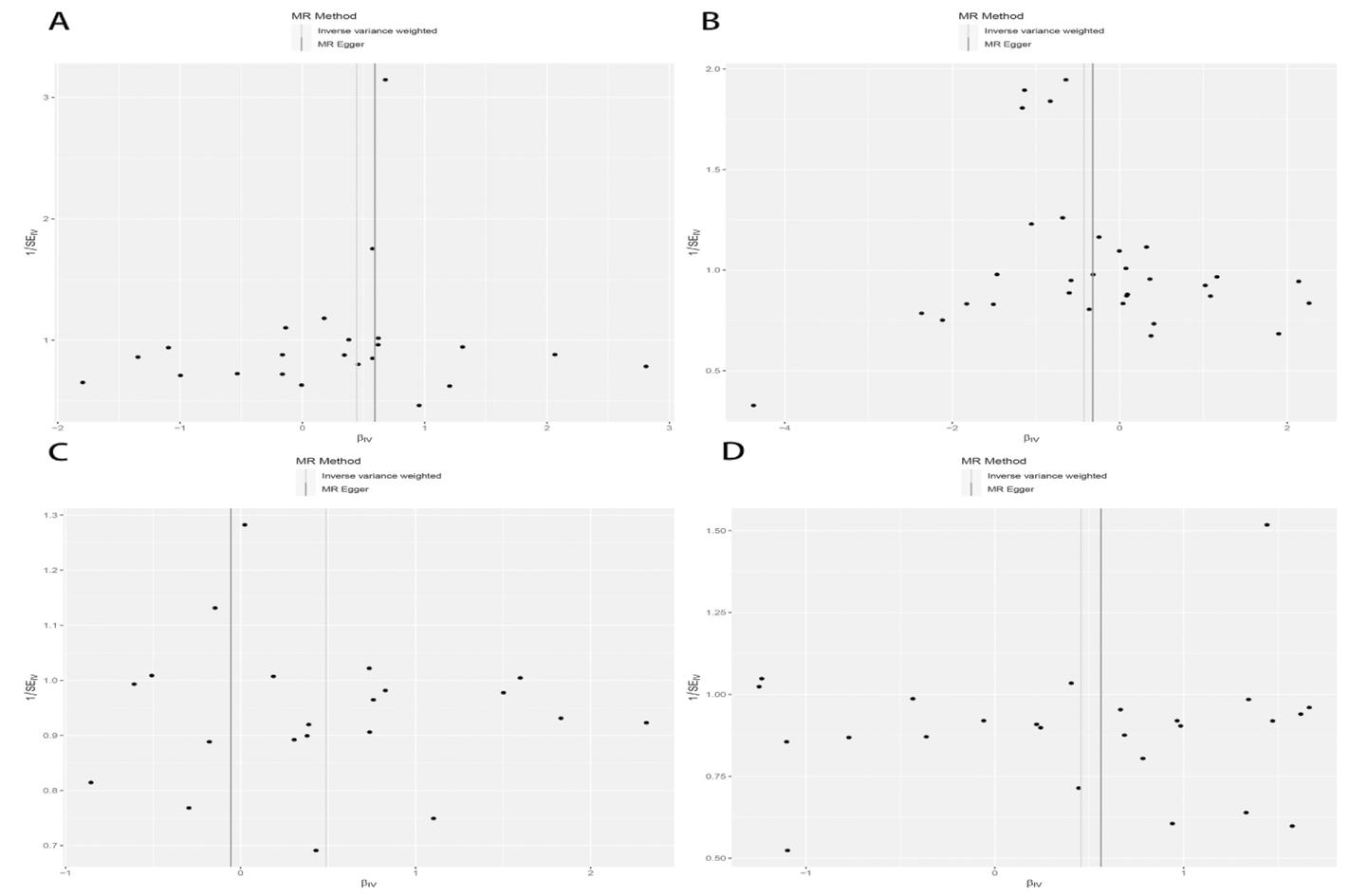
A,B, C, D分别代表GDNF, IL-10, IL-4, LIF
图3 炎症蛋白与POI的MR分析漏斗图
Figure 3 Funnel plot of MR analysis of inflammatory proteins and POI

A、B、C、D分别代表GDNF、IL-10、IL-4、LIF
图4 炎症蛋白与POI的MR分析的留一法结果
Figure 4 Sensitivity analysis about the leave-one-out results between inflammatory proteins and POI
讨 论
本研究运用孟德尔随机化分析方法,从基因层面研究了炎症蛋白与POI发病的关联,发现炎症蛋白与POI的发生具有相关性,根据IVW法分析的结果发现GDNF、IL-4、LIF与POI的发生正相关,IL-10与POI的发生负相关。但是IL-4的IVW法分析结果与MR Egger法分析结果的OR值方向性不一致,可能是因为与IL-4相关的SNP并非都独立影响POI,还可能与难以区分的多重暴露因素有关,因此本研究认为IL-4与POI之间不存在直接的因果关系。
IL-10是一种公认的免疫抑制因子,可以通过抑制巨噬细胞的抗原呈递功能和抑制巨噬细胞、树突状细胞活化进而减少Th1细胞分泌IFN-γ,从而产生炎症抑制作用,还可以抑制促炎细胞因子、趋化因子、MHCII、共刺激和黏附分子的转录从而产生免疫抑制[14]。此前的一些研究显示早发性卵巢功能不全小鼠中IL-10量较低,提高IL-10含量可以缓解卵巢功能损伤[15],IL-10可能对POI患者卵巢的慢性炎症有抑制作用,与本研究结果一致。另一项研究还表明IL-10可能通过减轻卵巢纤维化进而改善卵巢功能[16]。但也有研究表明IL-10可能破坏VEGF诱导的血管生成进而导致卵泡生成紊乱,最终抑制了生殖功能[17],这与本研究结果不一致,未来需要更多研究来明确IL-10与POI的关联。
胶质细胞源性神经营养因子(GDNF)是一种由134个氨基酸组成的蛋白质,最初在大鼠神经胶质细胞中分离出来,是神经营养因子(neurotrophic factors)家族的一员,对神经元分化和存活有着关键的促进作用[18]。除中枢神经系统以外,GDNF也在生殖系统中高度表达,尤其是在人类卵巢的主要功能细胞(颗粒细胞和卵母细胞)中高水平表达[19]。既往研究发现,GDNF在哺乳动物卵母细胞成熟和胚胎发育中起关键作用[20],GDNF可以通过神经系统刺激和细胞间的相互作用对卵巢及卵泡的发育起调节作用[21],一项研究表明在绵羊体内GDNF提高了卵巢中原始卵泡的激活率[22]。另外一项研究表明GDNF可诱导卵巢卵丘细胞持续性激活和促进卵母细胞成熟[23]。本研究为GDNF与POI的关联提供一定依据,GNDF与POI的正相关可能与其过度促进原始卵泡激活进而导致卵巢储备下降有关,但目前GDNF与POI之间的研究有限,具体作用机制还需要进一步探索。
白血病抑制因子LIF是IL-6细胞因子的成员,LIF与IL-6的作用有一定的相似之处,如可以促进炎症的发生,增加中性粒细胞对内皮细胞的粘附和浸润[24]。后来的研究还发现LIF还具有抑制小鼠胚胎干细胞分化、刺激人肝细胞分泌、引起肾间质纤维化等作用[25]。在不同的组织和细胞环境中,LIF表现出不同的下游效应。在胎儿和成人的卵巢中均可以检测到LIF,LIF对生育功能的影响主要是体现在影响子宫容受性[26],一些研究表明LIF对卵巢也有影响。一项动物研究显示,LIF可以调节绵羊体外窦前卵泡至窦卵泡发育过程中颗粒细胞的分化,提高卵母细胞的减数分裂能力,促进卵母细胞的成熟[27]。表明LIF可能有与GDNF相似的作用,通过引起卵泡过度活化导致卵巢储备功能降低。此外,LIF还与多种细胞因子共同作用,通过免疫-肾上腺-内分泌轴调控卵巢类固醇的生成[28]。一项研究表明LIF可能通过诱导cFOS增加使得促性腺激素释放激素GnRH分泌紊乱最终引起不孕[29]。
本研究的优势是所采用的数据来自最新的研究结果,涵盖的炎症蛋白范围广泛,采用MR的方法确定了炎症蛋白与POI的因果关系,最大限度避免了以往病例对照研究存在的混杂和偏倚的影响,并对结果的敏感性进行检验,确保了结论的可靠性。本研究不足之处在于GWAS数据均来自于欧洲人群,由于不同种群之间存在遗传差异,本研究的结果是否适用于其他种群还需要进一步验证。且本研究调查的炎症蛋白参与者包括了男性和女性,尽管纳入的遗传变异排除了性染色体上的变异,但为了结果的可靠性,还应对性别进行区分然后再分析。
综上所述,本研究发现三种炎症蛋白与POI相关,但仍需要更多的研究验证其相关性,为将其作为POI诊断标志物和干预靶点提供基础,深入研究具体的分子机制有助于对POI的理解,有助于临床早期识别该病并尽早干预,确保最佳的治疗及预后。
1 Chon SJ,Umair Z,Yoon MS.Premature ovarian insufficiency:past,present,and future.Front Cell Dev Biol,2021,9:672890.
2 Stevenson JC,Collins P,Hamoda H,et al.Cardiometabolic health in premature ovarian insufficiency.Climacteric,2021,24:474-480.
3 Michala L,Stefanaki K,Loutradis D.Premature ovarian insufficiency in adolescence:a chance for early diagnosis.Hormones (Athens),2020,19:277-283.
4 Takahashi A,Yousif A,Hong L,et al.Premature ovarian insufficiency:pathogenesis and therapeutic potential of mesenchymal stem cell.J Mol Med (Berl),2021,99:637-650.
5 Nash Z,Davies M.Premature ovarian insufficiency.BMJ,2024,384:e077469.
6 Jacob S,Koc M.Autoimmune oophoritis:a rarely encountered ovarian lesion.Indian J Pathol Microbiol,2015,58:249-251.
7 Chen Y,Miao C,Zhao Y,et al.Inflammasomes in human reproductive diseases.Mol Hum Reprod,2023,29:gaad035.
8 Jiao X,Zhang X,Li N,et al.T(reg) deficiency-mediated T(H) 1 response causes human premature ovarian insufficiency through apoptosis and steroidogenesis dysfunction of granulosa cells.Clin Transl Med,2021,11:e448.
9 Liu J,Huang X,Cao X,et al.Serum biomarker analysis in patients with premature ovarian insufficiency.Cytokine,2020,126:154876.
10 Zhang FL,Kong L,Zhao AH,et al.Inflammatory cytokines as key players of apoptosis induced by environmental estrogens in the ovary.Environ Res,2021,198:111225.
11 Smith GD.Mendelian randomization for strengthening causal inference in observational studies:application to gene × environment interactions.Perspect Psychol Sci,2010,5:527-545.
12 Zhao JH,Stacey D,Eriksson N,et al.Genetics of circulating inflammatory proteins identifies drivers of immune-mediated disease risk and therapeutic targets.Nat Immunol,2023,24:1540-1551.
13 Kurki MI,Karjalainen J,Palta P,et al.FinnGen provides genetic insights from a well-phenotyped isolated population.Nature,2023,613:508-518.
14 Saraiva M,Vieira P,O′Garra A.Biology and therapeutic potential of interleukin-10.J Exp Med,2020,217:e20190418.
15 Yin N,Wu C,Qiu J,et al.Protective properties of heme oxygenase-1 expressed in umbilical cord mesenchymal stem cells help restore the ovarian function of premature ovarian failure mice through activating the JNK/Bcl-2 signal pathway-regulated autophagy and upregulating the circulating of CD8(+)CD28(-) T cells.Stem Cell Res Ther,2020,11:49.
16 Nazdikbin YN,Ahmadian S,Mobarak H,et al.Amniotic fluid-derived exosomes attenuated fibrotic changes in POI rats through modulation of the TGF-β/Smads signaling pathway.J Ovarian Res,2023,16:118.
17 Yang PK,Chou CH,Huang CC,et al.Obesity alters ovarian folliculogenesis through disrupted angiogenesis from increased IL-10 production.Mol Metab,2021,49:101189.
18 Kotliarova A,Sidorova YA.Glial cell line-derived neurotrophic factor family ligands,players at the interface of neuroinflammation and neuroprotection:focus onto the glia.Front Cell Neurosci,2021,15:679034.
19 Chang HM,Wu HC,Sun ZG,et al.Neurotrophins and glial cell line-derived neurotrophic factor in the ovary:physiological and pathophysiological implications.Hum Reprod Update,2019,25:224-242.
20 Wang DH,Zhou HX,Liu SJ,et al.Glial cell line-derived neurotrophic factor supplementation promotes bovine in vitro oocyte maturation and early embryo development.Theriogenology,2018,113:92-101.
21 Streiter S,Fisch B,Sabbah B,et al.The importance of neuronal growth factors in the ovary.Mol Hum Reprod,2016,22:3-17.
22 Esmaielzadeh F,Hosseini SM,Nasiri Z,et al.Kit ligand and glial-derived neurotrophic factor as alternative supplements for activation and development of ovine preantral follicles in vitro.Mol Reprod Dev,2013,80:35-47.
23 Cui L,Fang L,Mao X,et al.GDNF-induced downregulation of miR-145-5p enhances human oocyte maturation and cumulus cell viability.J Clin Endocrinol Metab,2018,103:2510-2521.
24 Wang J,Chang CY,Yang X,et al.Leukemia inhibitory factor,a double-edged sword with therapeutic implications in human diseases.Mol Ther,2023,31:331-343.
25 Pinho V,Fernandes M,da Costa A,et al.Leukemia inhibitory factor:Recent advances and implications in biotechnology.Cytokine Growth Factor Rev,2020,52:25-33.
26 Ali R,Ahmed Khan T,Gul H,et al.An interplay of progesterone,leukemia inhibitor factor and interleukin-6 in the window of implantation; Impact on fertility.Cytokine,2023,170:156332.
27 Cadoret V,Jarrier-Gaillard P,Papillier P,et al.Leukaemia inhibitory factor modulates the differentiation of granulosa cells during sheep in vitro preantral to antral follicle development and improves oocyte meiotic competence.Mol Hum Reprod,2021,27:gaab051.
28 Pe a S,Rubio M,Vargas C,et al.Participation of leukaemia inhibitory factor in follicular development and steroidogenesis in rat ovaries.J Endocrinol,2023,258:e220255.
a S,Rubio M,Vargas C,et al.Participation of leukaemia inhibitory factor in follicular development and steroidogenesis in rat ovaries.J Endocrinol,2023,258:e220255.
29 Lainez NM,Coss D.Leukemia inhibitory factor represses GnRH gene expression via cFOS during inflammation in male mice.Neuroendocrinology,2019,108:291-307.