卵巢癌(ovarian cancer,OC)是最常见的妇科恶性肿瘤之一。由于缺乏有效的筛查策略,多数就诊时病情已于进入晚期,加之受其易复发、易耐药等特点影响,包括根治性手术和化学疗法(铂类药物)在内的可用治疗方案效果并不理想[1-2]。目前,OC 女性的平均 5 年生存率低于 25%[3]。作为线粒体基因组的关键调节因子,据报道 SSBP1与线粒体DNA内的不对称簇结合并调节其复制[4]。这种独特的定位模式使 SSBP1 成为线粒体生物发生和 DNA 损伤反应中的重要参与者[5]。目前研究证实[6],黑色素瘤、肝细胞癌等恶性肿瘤患者SSBP1 的表达水平显著升高,且其与肿瘤细胞自噬及凋亡具有密切联系,但关于其作用机制,目前尚未完全阐明。有研究报道指出[7],CHOP/DCR/Caspase8信号通路与肿瘤细胞自噬及凋亡密切相关,自噬抑制剂可通过增加内质网应激过程中CHOP 表达,激活 CHOP/DCR/Caspase8 所介导的细胞凋亡途径,诱导肿瘤细胞的凋亡。据此猜测,SSBP1基因诱导的细胞凋亡可能也与CHOP/DCR/Caspase8信号途径有关,但目前,关于SSBP1基因对卵巢癌细胞自噬和凋亡的影响和作用机制国内研究报道较少,进一步研究缺乏基础。本研究分析SSBP1基因对卵巢癌细胞自噬和凋亡的影响和作用机制,以期为进一步研究提供参考。
材料与方法
一、材料
1. 样本来源:研究样本为卵巢癌耐药细胞系SKOV3细胞例,购自深圳市豪地华拓生物科技有限公司,本研究经本院医学伦理委员会批准,批准文号20230137,所有研究内容符合伦理指导原则。
2. 主要试剂:SSBP1抑制剂(SSBP1 CRISPR 抑制质粒,见图1)、SSBP1模拟物(SSBP1 CRISPR 质粒,见图2)购自中国上海GenePharma公司;膜联蛋白V-FITC / PI凋亡检测试剂盒购自北京生物海洋生物技术有限公司;CCK-8细胞活力检测试剂盒购自苏州与恒生物科技有限公司;cDNA 合成试剂盒购自和光纯药工业有限公司,日本大阪;DyNAmo HS SYBR Green qPCR试剂盒购自赛默飞世尔科技;蛋白印迹实验相关抗体购自赛诺特生物有限公司等。
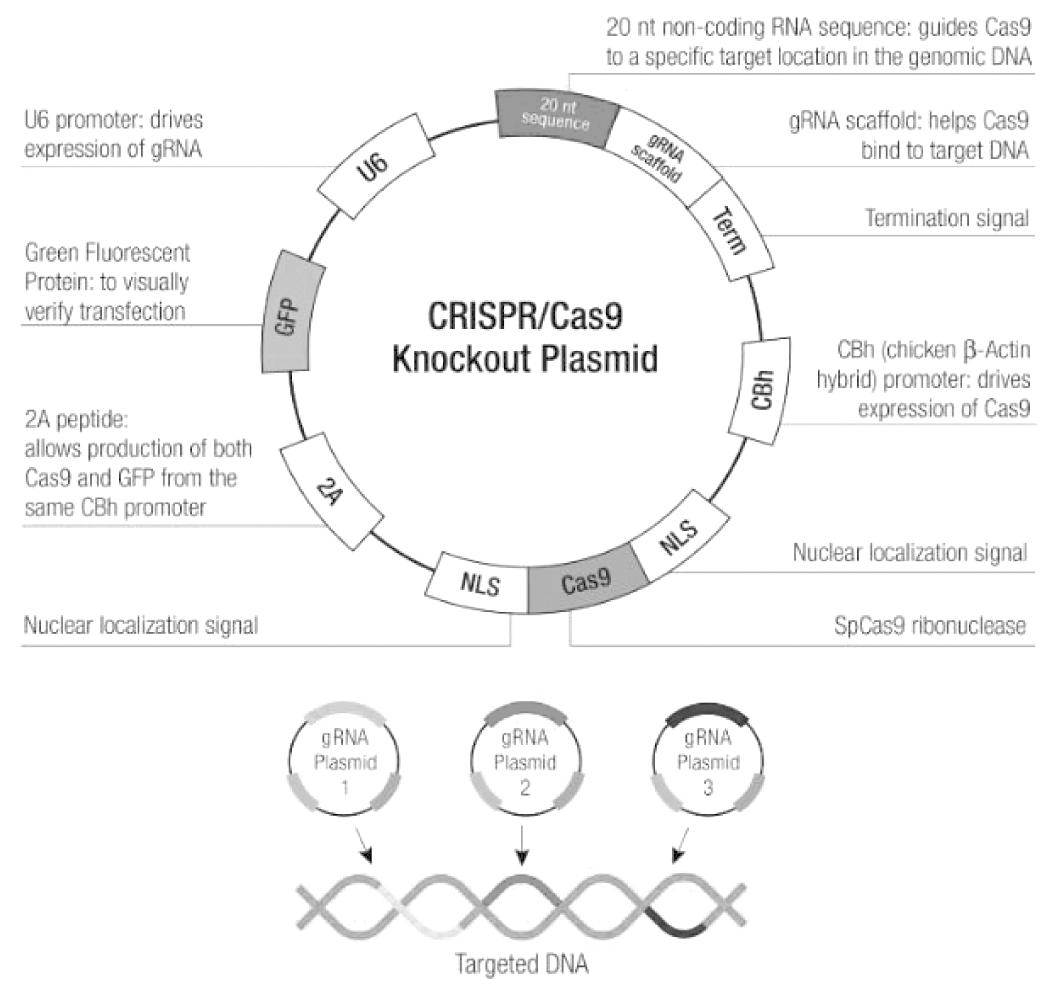
图1 SSBP1 CRISPR 抑制质粒
Figure 1 SSBP1 CRISPR inhibitory plasmid
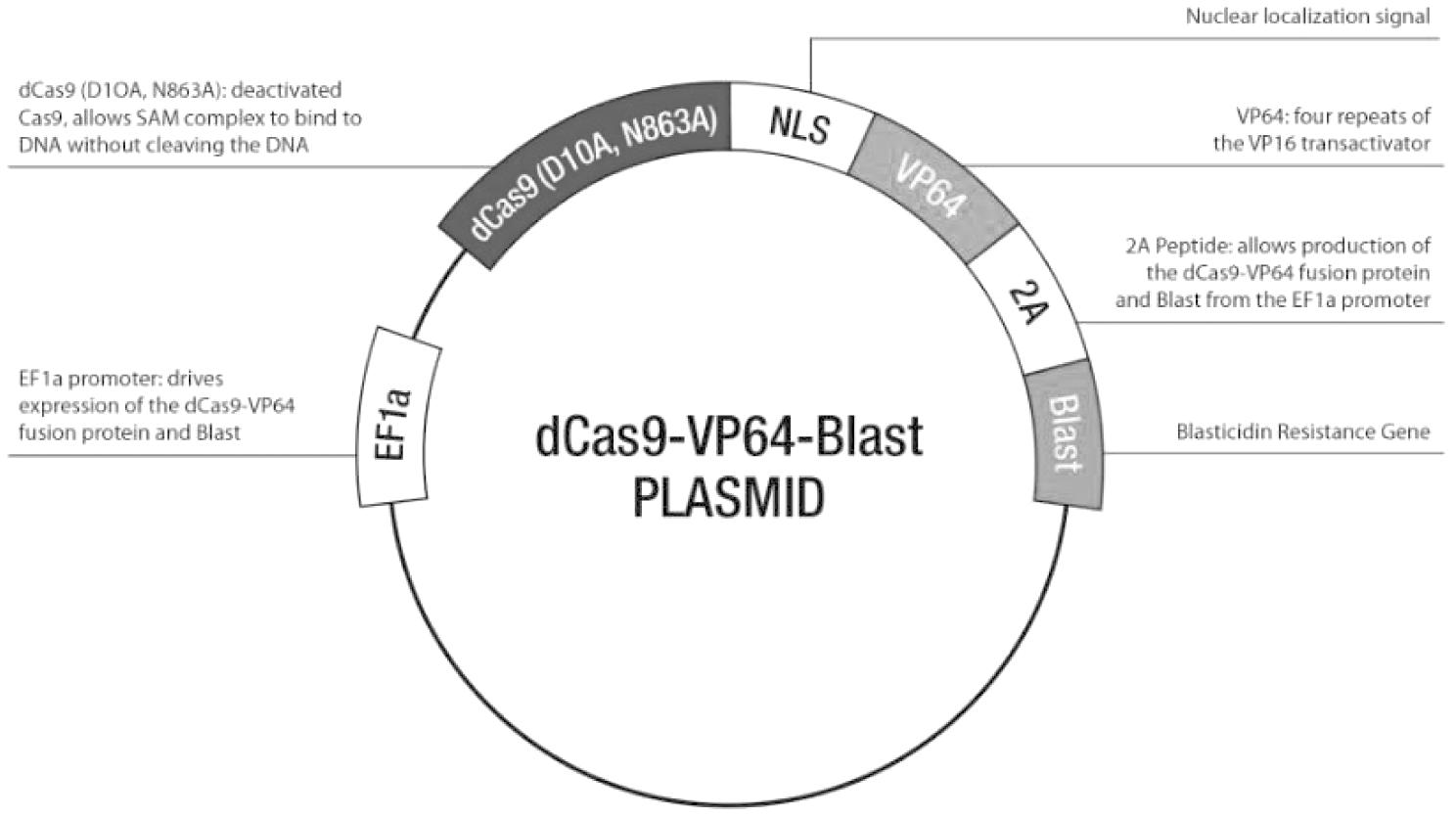
图2 SSBP1 CRISPR 激活质粒
Figure 2 SSBP1 CRISPR-activating plasmid
3. 主要仪器:细胞计数器(上海上碧实验仪器有限公司);Couvter型高速冷冻离心机(美国Beckman公司);DM 750型光学显微镜(日本Olympus公司);Spectra Max M5型多功能酶标仪(美国Molecular Devices公司)等。
二、方法
1. 实验方案:细胞样本获取后进行培养,以密度5×103接种于DMEM培养基中,培养基中含有1 % 抗生素抗真菌溶液、链霉素、两性霉素 B及10 %FBS,培养环境温度37 ℃,CO2浓度5 %。48 h后提取纯化细胞并将其以密度5×103接种于39份相同培养基继续培养。培养48 h进行随机分组,13例作为常规培养组,进行常规培养,其余26例为研究组,分为SSBP1抑制剂组和SSBP1模拟物组,分别给予SSBP1抑制剂(1ug/mL)(SSBP1 inhibitor,13例)及SSBP1模拟物(1ug/mL)(SSBP1 active,13例)。
2. 检测指标:(1)细胞活力检测试验:细胞活力采用CCK-8试剂盒,在 72 h培养期结束时,更换培养基并更换为 10 μL CCK-8 溶液和 90 μL培养基培养物,密度5×103个细胞/孔一式三份接种在96孔板,并额外培养1 h。在96孔板中以 450 nm 的光密度(OD) 读取吸光度。所有处理的细胞活力(%)计算为相对于常规培养组的百分比。
(2)细胞增殖实验:细胞增殖使用 5-溴-2′-脱氧尿苷(BrdU) 比色试剂盒,密度5×103个细胞/孔一式三份接种在96孔板,每个孔在 37 ℃下与 BrdU(10 μM) 再孵育 2 h。将 POD 工作溶液加入到每个孔中,并在室温下再孵育 90 min。在 370 nm 处测量吸光度。所有处理的细胞增殖计算为相对于常规培养组的百分比。
(3)细胞凋亡实验:细胞凋亡使用膜联蛋白V-FITC / PI凋亡检测试剂盒(北京生物海洋生物技术有限公司,批号:20221244),检测方式完全按照试剂盒说明书进行,消化离心收集细胞(按平常传代时收集细胞的离心条件即可)至离心管中;用PBS洗2遍;用双蒸水稀释5*Binding Buffer为1*Binding Buffer,每管加入500 μL 1*Binding Buffer 重悬细胞;每管加入5 μl Annexin V-FITC和10 μl PI染料,混匀;室温避光孵育5 min;过膜,流式细胞仪检测。
(4)蛋白质印迹分析:使用哺乳动物蛋白提取试剂从冷冻细胞中提取总细胞匀浆中的总蛋白。使用 Pierce BCA 蛋白质检测试剂盒测量所有样品中的蛋白质水平。加载等量的蛋白质(60 μg/孔) 并通过 SDS-PAGE(8%~12%) 分离,转移到硝酸纤维素膜上,封闭,然后与一抗室温下孵育2 h,一抗为抗p62(赛诺特生物,批号202312093,1:100)、LC3I(赛诺特生物,批号202312086,1:100)、LC3II(赛诺特生物,批号202312155,1:100)、Bax(赛诺特生物,批号202312081,1:100)、Bcl-2(赛诺特生物,批号202312111,1:100)、CHOP(赛诺特生物,批号202312101,1:100)、DCR(赛诺特生物,批号202312046,1:100)、Caspase8、β-actin(迈新生物,鼠单抗,批号121227001C,1:100)一抗,然后洗涤膜并与相应的 HRP 偶联二抗在室温下再孵育 2 h。使用 Pierce 化学发光试剂检测抗原-抗体相互作用,使用 C-DiGit Blot Scanner扫描和分析所有图像。使用内标调整印迹之间条带密度的变化。磷酸化蛋白质和总蛋白质的蛋白质水平根据参考蛋白质 β-actin进行标准化,使用2-ΔΔCt方法计算相对表达。。
3. 统计学方法:采用SPSS 21.0软件进行统计分析。所有资料进行正态分布检验,满足正态分布计量资料以![]() 表示,组间比较采用单因素ANOVA检验,两两比较使用t检验,不满足正态分布资料使用中位数+四分位数表示,使用Mann-Whitney U检验。P<0.05为差异具有统计学意义。
表示,组间比较采用单因素ANOVA检验,两两比较使用t检验,不满足正态分布资料使用中位数+四分位数表示,使用Mann-Whitney U检验。P<0.05为差异具有统计学意义。
结 果
一、各组细胞活力、增殖、凋亡比较
细胞活力、细胞增殖率SSBP1 抑制剂组低于常规培养组,SSBP1 模拟物组高于常规培养组;SSBP1抑制剂组细胞凋亡率显著高于常规培养组,SSBP1 模拟物组低于常规培养组(P<0.05),见表1。
表1 各组细胞活力、增殖、凋亡比较![]()
Table 1 Comparison of cell viability, proliferation and apoptosis by group

Note:a Compared to Routine culture group, P<0.05.
GroupCell viability Cell proliferation rate Cell apoptosis rate SSBP1 Routine culture85.72±13.2175.24±10.3825.08±7.631.04±0.11SSBP1 inhibitor60.27±11.48 a63.25±9.57a46.33±10.79a1.75±0.19aSSBP1 active95.37±14.26a84.38±11.62a16.71±5.08a0.73±0.08a
二、各组p62、LC3I、LC3II蛋白相对表达比较
p62、LC3II蛋白相对表达SSBP1抑制剂组高于常规培养组,SSBP1 模拟物组低于常规培养组,SSBP1抑制剂组 LC3I蛋白表达低于常规培养组,SSBP1 模拟物组高于常规培养组(P<0.05),见表2,蛋白印迹结果见图3。
表2 各组caspase-3活性、蛋白相对表达比较![]()
Table 2 Comparison of caspase-3 activity and protein expression by group

Note:a Compared to Routine culture group, P<0.05.
GroupLC3ILC3IIp62Routine culture1.08±0.111.24±0.130.94±0.11SSBP1 inhibitor0.84±0.08a1.59±0.16a1.29±0.14aSSBP1 active1.25±0.13a0.92±0.10a0.81±0.08a

图3 各组p62、LC3I、LC3II蛋白相对表达
Figure 3 Relative expression of p62, LC3I and LC3II proteins by group
三、各组Bax、Bcl-2蛋白相对表达比较
Bax蛋白相对表达SSBP1抑制剂组显著高于常规培养组,SSBP1模拟物组低于常规培养组;Bcl-2蛋白表达SSBP1抑制剂组低于常规培养组,SSBP1 模拟物组高于常规培养组(P<0.05),见表3,蛋白印迹结果见图4。
表3 各组Bax、Bcl-2蛋白相对表达比较![]()
Table 3 Comparison of the relative expression of Bax and Bcl-2 protein by group

Note:a Compared to Routine culture group, P<0.05.
GroupBaxBcl-2Routine culture1.37±0.151.31±0.14SSBP1 inhibitor1.55±0.17a1.09±0.10aSSBP1 active1.08±0.11a1.51±0.16a
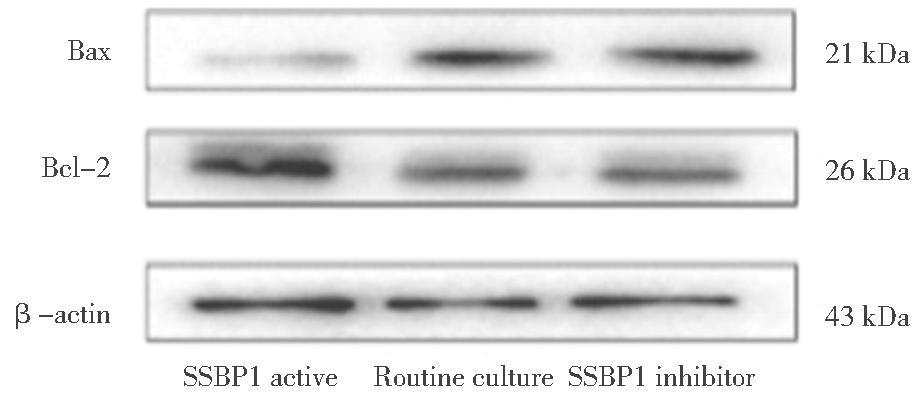
图4 各组Bax、Bcl-2蛋白相对表达
Figure 4 Relative expression of Bax and Bcl-2 proteins by group
四、各组active-Caspase8、cleaved-Caspase8蛋白相对表达比较
active-Caspase8、cleaved-Caspase8蛋白相对表达SSBP1抑制剂组高于常规培养组,SSBP1模拟物组低于常规培养组(P<0.05),见表4,蛋白印迹结果见图5。
表4 各组active-Caspase8、cleaved-Caspase8蛋白相对表达比较![]()
Table 4 Comparison of the relative expression of active-Caspase8 and cleaved-Caspase8 by group

Note:a Compared to Routine culture group, P<0.05.
Groupactive-Caspase8cleaved-Caspase8Routine culture1.02±0.140.73±0.09SSBP1 inhibitor1.69±0.21a1.24±0.16aSSBP1 active0.53±0.09a0.41±0.07a
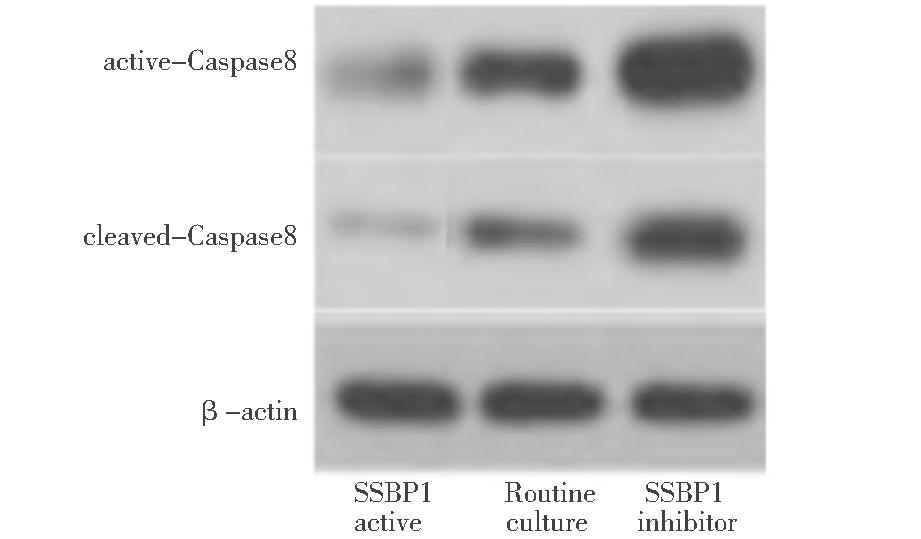
图5 各组active-Caspase8、cleaved-Caspase8蛋白相对表达
Figure 5 Relative expression of active-Caspase8 and cleaved-Caspase8 by group
五、各组CHOP、DCR、Caspase8蛋白相对表达比较
CHOP、DCR、Caspase8蛋白相对表达SSBP1抑制剂组高于常规培养组,SSBP1 模拟物组低于常规培养组(P<0.05),见表5,蛋白印迹结果见图6。
表5 各组CHOP、DCR、Caspase8蛋白相对表达比较![]()
Table 5 Comparison of CHOP, DCR and Caspase8 protein expression by group

Note:a Compared to Routine culture group, P<0.05.
GroupCHOPDCRCaspase8Routine culture1.04±0.101.21±0.151.15±0.13SSBP1 inhibitor1.23±0.14a1.39±0.17a1.26±0.14aSSBP1 active0.87±0.09a1.06±0.12a1.02±0.11a

图6 各组CHOP、DCR、Caspase8蛋白相对表达
Figure 6 Relative expression of CHOP, DCR and Caspase8 by group
讨 论
卵巢癌是威胁女性生命健康的常见恶性肿瘤之一,具有发病隐匿、病情进展迅速、预后差等特点[8]。近年来随着基础医学、药学等发展,靶向药物的研究及各种基因靶点出现为卵巢癌治疗提供了新的思路。SSBP1是一种具有促线粒体修复及DNA复制的基因,其下游蛋白SSBP1蛋白对线粒体DNA复制、转录等过程具有关键作用[9]。有研究指出,在卵巢癌患者中,患者病灶组织SSBP1表达显著低于正常卵巢组织且与患者预后具有密切联系[10]。SSBP1定位与线粒体机制和拟核,位于7号染色体,由148个氨基酸职称,主要在线粒体DNA复制、损伤后修复等过程中发挥重要作用。其结构高度保守, 包括 4 个外显子和 3 个内含子, 主要参与线粒体 DNA( mtDNA) 的复制、转录、损伤后修复过程。因此,SSBP1 表达异常将直接导致 mtDNA 拷贝数异常或基因突变, 引起恶性肿瘤的发生发展。
在人体正常组织中,细胞增殖和凋亡存在动态平衡,即细胞凋亡数量与细胞增殖数量基本持平,保证人体正常生理机能。但在肿瘤组织中,细胞凋亡与增殖动态平衡被大浦,细胞凋亡减少且增殖失控,肿瘤细胞表现出无限增殖能力,导致大量吸收并消耗人体营养物质,引起脏器衰竭,导致患者死亡。由此可见,肿瘤病情发展不仅与细胞增殖速度有关,肿瘤细胞凋亡也是关键因素,凋亡确实则是肿瘤细胞无限增殖的主要原因。本研究结果可见,SSBP1抑制剂组细胞活力、细胞增殖率α/β及细胞凋亡率升高,SSBP1模拟物组则呈现反向变化。证实SSBP1基因表达与卵巢癌细胞增殖及凋亡具有密切联系,SSBP1模拟物可增加卵巢癌细胞SSBP1基因表达,使其最终表现为SSBP1过表达状态,SSBP1抑制剂则能减少或敲除细胞SSBP1基因,使其减少SSBP1表达或不表达SSBP1基因。本研究结果证实SSBP1低表达可抑制卵巢癌细胞增殖,促进其凋亡。为进一步分析卵巢癌细胞凋亡上游影响因子,进一步对细胞Bax、Bcl-2两种常见细胞凋亡相关蛋白进行了观察,Bcl-2是著名的具有代表性的凋亡抑制因子,而Bax可拮抗Bcl-2对细胞凋亡的抑制作用并激活 caspase-3,促进 Ca2+ 释放,促进细胞凋亡。结果显示,SSBP1抑制后,Bax蛋白相对表达升高,Bcl-2蛋白相对表达减少,SSBP1模拟物干预后,这种变化被逆转,进一步证明SSBP1对卵巢癌细胞凋亡的调控作用。
此外,细胞自噬在肿瘤细胞增殖中具有重要作用,肿瘤细胞可通过自噬对自身受损的细胞器及蛋白质等进行降解并再利用,从而减少细胞内废物引起的细胞损伤,同时其降解的物质等可用于自身必须物质二次合成或代谢,维持肿瘤细胞内环境[11]。在恶性肿瘤病情发展过程中,肿瘤细胞无限增殖,充足的营养物质是患者病情发展前提,但肿瘤细胞血管及循环组织结构及功能多呈现异常,因此表现为营养损耗高于供应,营养供给无法满足其生长,在此前提下,肿瘤细胞自噬能保证肿瘤细胞内应激状态下受损细胞器和错误折叠蛋白的清除,进而维持肿瘤细胞内环境稳定,同时,自噬产物能弥补肿瘤细胞营养不足,促进其增殖[12-14]。由此可见,自噬通过清除和补给两条途径保证肿瘤细胞内环境稳定和快速增殖,而抑制自噬将导致肿瘤细胞内受损细胞器和错误折叠蛋白的堆积,进一步诱导细胞凋亡。LC3 是泛素样蛋白缀合系统,在自噬体隔离膜的延伸和扩展过程中起促进作用。LC3 存在 2 种形式,即 LC3Ⅰ和 LC3Ⅱ。细胞内新合成的 LC3 经过加工, 成为胞质可溶形式的 LC3Ⅰ,后者被进一步泛素化加工修饰, 成为膜结合形式的 LC3Ⅱ。LC3Ⅱ是自噬体的标志分子, 随自噬体膜的增多而增多。LC3Ⅱ含量或 LC3Ⅰ/LC3Ⅱ的比例与自噬体的数量呈正相关,在某种程度上反映了细胞的自噬活性[15-16]。同时,p62则是自噬关键底物之一,其水平可反应细胞自噬程度。本研究证实SSBP1基因表达对卵巢癌细胞自噬具有调控作用。国内有研究指出,CHOP/DCR/Caspase8信号通路与癌细胞自噬具有密切联系[7],为进一步分析在卵巢癌中,SSBP1基因对其自噬调控是否同样给予此型号,本研究对卵巢癌细胞CHOP、DCR、Caspase8蛋白相对表达进行了观察,结果显示,SSBP1抑制剂组CHOP、DCR、Caspase8蛋白相对表达升高,SSBP1 模拟物组则降低,证实SSBP1基因表达对卵巢癌细胞自噬调控同样与CHOP/DCR/Caspase8信号通路有关。
本研究不足在于进行了体外细胞实验,分析了SSBP1对卵巢癌细胞的影响,但其在生物体内是否具有类似效果尚不明确,进行动物实现进一步明确SSBP1在生物体内作用效果及作用机制是下一步工作的重点之一。
综上所述,SSBP1基因能调节卵巢癌细胞凋亡相关蛋白表达,其低表达促进卵巢癌细胞凋亡,抑制卵巢癌细胞自噬、细胞活力,分析其作用机制可能与CHOP/DCR/Caspase8信号通路有关,其有望成为卵巢癌治疗新的药物靶点。
1 DiSaia PJ,Creasman WT,Mannel RS,et al.Clinical gynecologic oncology e-book.Elsevier Health Sciences,2017:334-340.
2 王亚茹,邵娟,刘新美.贝伐珠单抗联合TP方案治疗卵巢癌的临床研究.中国性科学,2020,29:61-64.
3 Siegel RL,Miller KD,Fedewa SA,et al.Colorectal cancer statistics,2017.CA-Cance J Clin,2017,67:177-193.
4 Koh CWQ,Goh YT,Toh JDW,et al.Single-nucleotide-resolution sequencing of human N6-methyldeoxyadenosine reveals strand-asymmetric clusters associated with SSBP1 on the mitochondrial genome.Nucleic Acids Res.2018,46:11659-11670.
5 Morin JA,Cerron F,Jarillo J,et al.DNA synthesis determines the binding mode of the human mitochondrial single-stranded DNA-binding protein.Nucleic Acids Res,2017,45:7237-7248.
6 Cecconi D,Dalle Carbonare L,Mori A,et al.An integrated approach identifies new oncotargets in melanoma.Oncotarget,2018,9:11489.
7 贾宝兴.自噬抑制剂氯喹通过CHOP/DCR/Caspase8途径诱导胆管癌细胞凋亡的机制研究.吉林大学,2019.
8 Siegel R L,Miller K D,Fuchs H E,et al.Cancer statistics,2021.Ca Cancer J Clin,2021,71:7-33.
9 Wang Y,Hu L,Zhang X,et al.Downregulation of mitochondrial single stranded DNA binding protein(SSBP1) induces mitochondrial dysfunction and increases the radiosensitivity in non-small cell lung cancer cells.J Cancer,2017,8:1400.
10 张月阳,刘青松,邓琳,等.宫颈癌细胞自噬与Wnt/β-catenin信号通路关系的研究进展.现代肿瘤医学,2022,30:2639-2642.
11 杨晓钟,马文霞,葛鹏,等.miR-23b通过调控ATG12抑制宫颈癌细胞自噬并逆转顺铂耐药性.临床肿瘤学杂志,2021,26:877-884.
12 蒋雪梅,易瑛,陈宇,等.miR-200b-3p/NBR1轴对乳腺癌细胞自噬及生长的影响.医学研究生学报,2021,34:1259-1266.
13 赵荣演,靳文珂,姜星,等.靶向beclin-1小分子激动剂诱导三阴性乳腺癌细胞自噬性死亡和凋亡.药学学报,2021,56:1369-1383.
14 苏培渊,杨清,付兵,等.miR-30a通过靶向调控Beclin-1、ATG5影响食管癌细胞自噬及增殖过程.中国免疫学杂志,2022,38:3013-3019,3024.
15 何珂瑶,刘怡文,张哲源,等.具核梭杆菌诱导自噬调控蛋白LC3高表达在食管鳞癌中的临床意义.实用医学杂志,2022,38:2787-2794.
16 张秉丽,霍成英,李有连.重楼皂苷Ⅰ对胃癌SGC-7901细胞线粒体自噬的作用及对LC3-Ⅱ、LC3-Ⅰ、Caspase-3表达的影响.中医药导报,2021,27:31-35.