妊娠期糖尿病(gestational diabetes mellitus,GDM)指妊娠期发生的糖代谢异常,不包含妊娠前已存在的糖尿病[1]。GDM与剖宫产、巨大儿、新生儿呼吸窘迫综合征、早产及死产等多项不良妊娠结局高度相关[2],同时增加产妇分娩后患II型糖尿病的风险,增加子代远期肥胖、心血管疾病的潜在风险[3]。一项Meta分析显示,2012—2016年间中我国GDM患病率为17%,明显高于2005—2012年间的11%[4]。随着2016年中国二胎政策全面放开,高龄等高危孕妇比例显著增加,GDM发生率将进一步增加[5],因此对有GDM危险因素的孕妇早期加强管理具有重要意义,GDM的高危因素为高龄、孕前超重肥胖、糖尿病家族史、高密度脂蛋白胆固醇(high density lipoprotein chelesterol,HDL-C)<1 mmol/L、血清甘油三酯(triglyceride,TG)≥2.8 mmol/L、空腹血糖(fasting plasma glucose,FPG)≥5.1 mmol/L、GDM 史、巨大儿分娩史、妊娠期增重(gestational weight gain,GWG)过多及妊娠次数≥2次等[1]。以上大部分危险因素在孕前已存在,尽管GWG可通过饮食及运动管理控制在合理范围[6-7],但口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)前的GWG与GDM发病风险的研究结果一直存在矛盾。有研究提示OGTT前GWG过高与GDM发生风险增加相关[8],但另一研究表明GDM孕妇在筛查前GWG与对照组并无显著差异[9],而一项中国的研究发现孕早期GWG过多、孕中期GWG不足与GDM发生风险增加相关[10]。造成以上差异的原因可能是人群差异、GDM诊断标准不同及未对OGTT孕周进行校正。以孕早期增重及OGTT前孕中期每周体重增长量作为研究指标可减少筛查孕周不同对研究结果的影响。此外,高龄[11]及孕前超重肥胖[12]与血糖血脂水平及胰岛功能等相关,为避免这两个因素影响其他危险因素,本研究以年龄、孕前体质指数(pre-pregnancy body mass index,preBMI)分组为匹配因素,采用巢式病例对照研究的方法探讨GDM 发病的危险因素,以期对GDM高危孕妇早期管理提供依据。
对象与方法
1.研究对象:本研究采用前瞻性巢式病例对照研究的方法,选取2021年1月到2023年4月在本院建档并产检的孕妇。纳入标准:20~45周岁、单胎、自然受孕的孕妇。排除标准:孕前糖尿病合并妊娠、妊娠合并空腹血糖受损(FPG≥5.6 mmol/L)、妊娠期高血压或子痫前期等病。研究方案经院伦理委员会批准(XMZSYYKY2020-139),与研究对象签订知情同意书。符合以上纳排标准的孕妇共有3 426名,24~28周行OGTT的孕妇空腹及服糖后1、2 h的血糖值(mmol/L)分别≥5.1、≥10.0、≥8.5者为GDM[1],19名GDM孕妇因数据缺失未纳入研究,最终纳入529名GDM孕妇。以年龄、孕前BMI分组为匹配因素、容差为0进行 1:1 配对,用随机数字方法选择529例孕妇作为对照组。以上过程经SPSS个案匹配控制功能实现。
2.研究内容:本研究在孕妇建档时(6~8周)记录年龄、身高、孕前体重等,嘱孕妇孕12~13+6周行颈后透明膜检查及24~27+6周行OGTT,当天晨起空腹着薄衣排大小便后测量体重并记录孕周。孕中期每周体重增长为以上两个体重之差除以间隔孕周,孕中每周体重增长适宜范围参考2021年中国妇女妊娠期体重监测与评价[1],孕早期增重为孕12~13+6周体重减去孕前体重。于孕12~13+6周产检时采集空腹静脉血,测定总胆固醇(total chelesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein chelesterol,LDL-C)、HDL-C、TG及FPG水平,以上指标均在本院检验科测定。将孕早期血清TG≥1.7 mmom/L[13]、FPG≥5.1 mmom/L[1]定义为孕早期TG、FPG水平升高。本研究中糖尿病家族史为父亲和/或母亲患II型糖尿病。
3.数据处理:用EpiData 3.0录入资料,用SPSS 22.0软件统计分析。连续资料用![]() 描述、组间比较用t检验;计数资料组间比较用卡方检验。P<0.05为差异有统计学意义。将经单因素分析有显著差异的因素放入二元Logistic回归模型。
描述、组间比较用t检验;计数资料组间比较用卡方检验。P<0.05为差异有统计学意义。将经单因素分析有显著差异的因素放入二元Logistic回归模型。
结果
1.一般资料:研究对象1 058人中,妊娠期糖尿病529人、对照组529人。GDM组年龄及孕前BMI分组与对照组一致。与对照组相比,GDM组孕前BMI较高、糖尿病家族史比例较高、妊娠期糖尿病史比例较高、孕中期每周体重增长较多,以上差异均具有统计学差异,详见表1。
表1 两组孕妇一般情况的比较[n(%)]
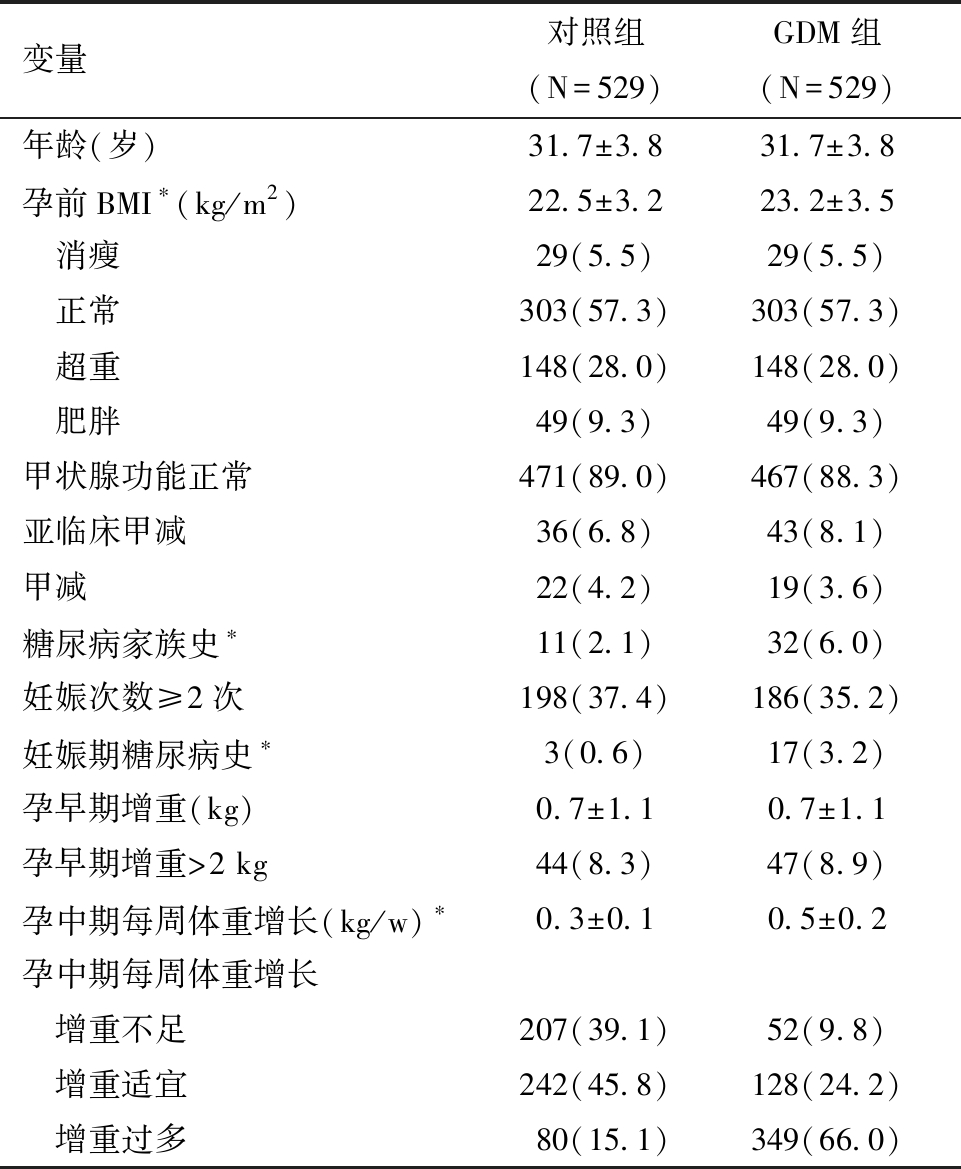
注:* GDM组和对照组相比,P<0.05.
变量对照组(N=529)GDM组(N=529)年龄(岁)31.7±3.831.7±3.8孕前BMI∗(kg/m2)22.5±3.223.2±3.5 消瘦 29(5.5)29(5.5) 正常 303(57.3)303(57.3) 超重 148(28.0)148(28.0) 肥胖 49(9.3)49(9.3)甲状腺功能正常 471(89.0)467(88.3)亚临床甲减 36(6.8)43(8.1)甲减 22(4.2)19(3.6)糖尿病家族史∗11(2.1)32(6.0)妊娠次数≥2次 198(37.4)186(35.2)妊娠期糖尿病史∗3(0.6)17(3.2)孕早期增重(kg)0.7±1.10.7±1.1孕早期增重>2 kg 44(8.3)47(8.9)孕中期每周体重增长(kg/w)∗0.3±0.10.5±0.2孕中期每周体重增长 增重不足207(39.1)52(9.8) 增重适宜 242(45.8)128(24.2) 增重过多 80(15.1)349(66.0)
2.两组孕妇孕早期血脂血糖水平比较:与对照组比较,GDM组孕早期TG、FPG水平较高,TG、FPG水平升高的人数比例较多,以上差异均具有统计学差异,详见表2。
表2 两组孕妇孕早期血清血脂、血糖水平(mmom/L)比较[n(%)]
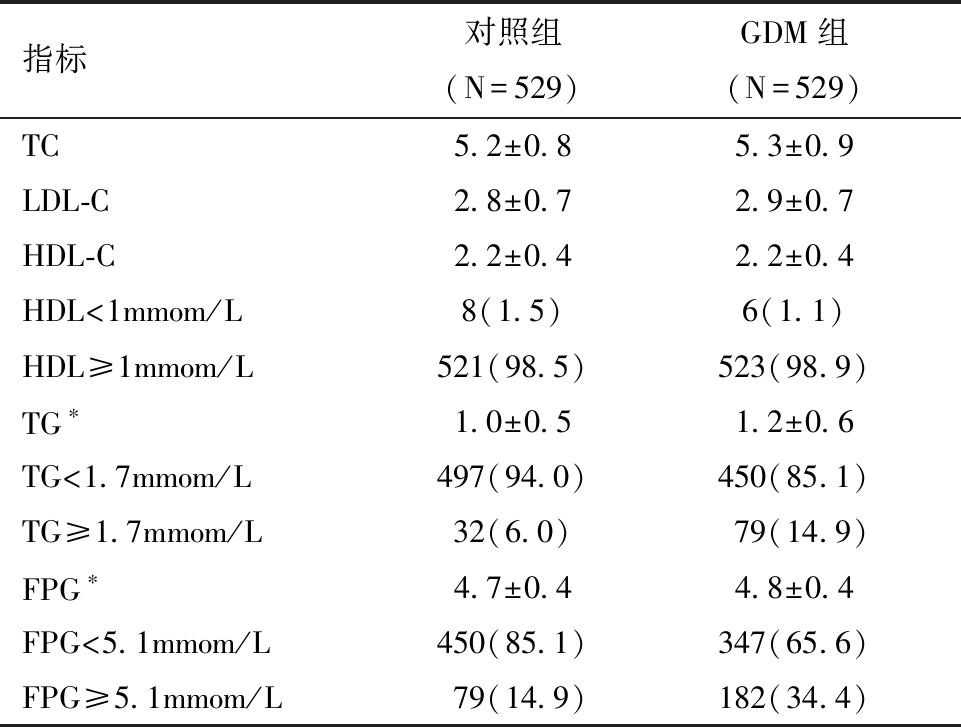
注:* GDM组和对照组相比,P<0.05;TC为总胆固醇,LDL-C为低密度脂蛋白胆固醇,HDL-C为高密度脂蛋白胆固醇,TG为甘油三酯,FPG为空腹血糖
指标对照组(N=529)GDM组(N=529)TC5.2±0.85.3±0.9LDL-C 2.8±0.72.9±0.7HDL-C2.2±0.42.2±0.4HDL<1mmom/L8(1.5)6(1.1)HDL≥1mmom/L521(98.5)523(98.9)TG∗1.0±0.51.2±0.6TG<1.7mmom/L497(94.0)450(85.1)TG≥1.7mmom/L32(6.0)79(14.9)FPG∗4.7±0.44.8±0.4FPG<5.1mmom/L450(85.1)347(65.6)FPG≥5.1mmom/L79(14.9)182(34.4)
3.GDM发病危险因素的多因素Logistic回归分析:以是否妊娠期糖尿病为因变量,以孕前BMI、家族史、GDM史、孕早期TG、FPG升高、孕中期增重每周体重增长量等有关因素为自变量,进行多因素Logistic回归分析。结果显示,糖尿病家族史(OR=3.09)、GDM史(OR=3.58)、孕早期FBG升高(OR=3.00)、孕早期TG升高(OR=2.63)、孕中期每周体重增长过多(OR=1.85)是GDM发病的危险因素,孕中期每周体重增长不足(OR=0.56)是GDM发病的保护因素,详见表3。
表3 GDM发病危险因素的Logistic回归分析结果
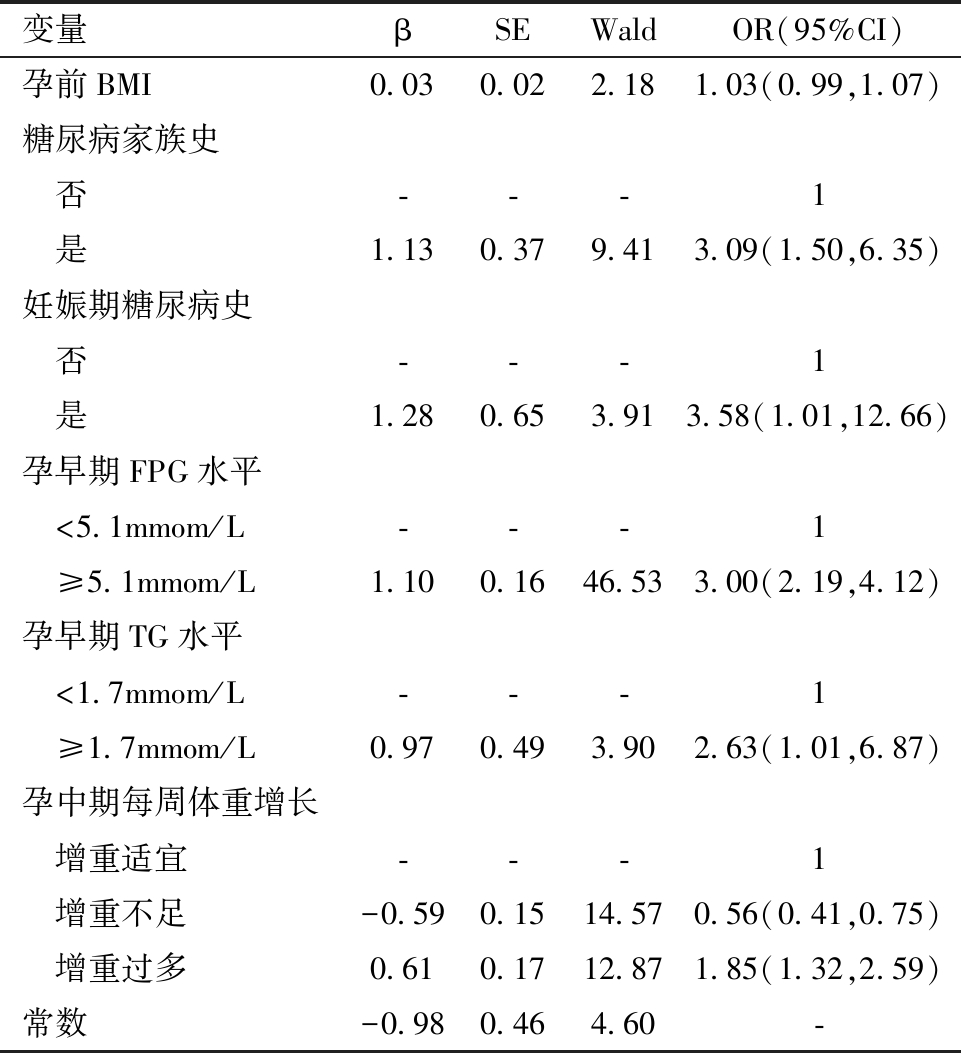
注:FPG为空腹血糖,TG为甘油三酯;自变量中,孕前BMI为连续变量。
变量βSEWaldOR(95%CI)孕前BMI0.030.022.181.03(0.99,1.07)糖尿病家族史 否---1 是1.130.379.413.09(1.50,6.35)妊娠期糖尿病史 否---1 是1.280.653.913.58(1.01,12.66)孕早期FPG水平 <5.1mmom/L ---1 ≥5.1mmom/L1.100.1646.533.00(2.19,4.12)孕早期TG水平 <1.7mmom/L---1 ≥1.7mmom/L0.970.493.902.63(1.01,6.87)孕中期每周体重增长 增重适宜---1 增重不足-0.590.1514.570.56(0.41,0.75) 增重过多0.610.1712.871.85(1.32,2.59)常数-0.980.464.60-
讨论
本研究发现家族史、GDM史、孕早期FBG升高、孕早期TG升高、孕中期每周体重增长过多是GDM发病的危险因素。GDM发病风险与II型糖尿病家族史[14-15]及其易感基因多态性有关[16]。一项Meta分析提示孕妇若有糖尿病家族史,GDM的发病风险增加1.77倍[15],本研究结果为2.58倍,略高于以上报道,可能由于本研究采集的家族史为一级亲属中的父亲及母亲。另一项研究在调整孕前BMI、孕妇年龄、GWG后,发现父母患II型糖尿病(OR=3.38)是GDM的独立危险因素[14],与本研究结果相近。GDM孕妇在产后仍存在一定程度的β细胞功能缺陷及IR[17],再次妊娠时加剧[18],且既往GDM史孕妇在孕早期已存在血糖代谢紊乱,FPG水平显著升高[19]。一项Meta分析提示,既往GDM史(OR=3.58)是GDM发生的危险因素[15],与本研究结果相近。以上结果提示在建档时,具有糖尿病家族史或既往GDM史的孕妇应受到医生的额外关注并早期管理。
在调整孕前BMI及家族史等混杂因素后,本研究发现FPG≥5.1 mmol/L的孕妇进展为GDM的风险为FPG<5.1 mmol/L的孕妇的3.00倍。一项Meta发现,在调整年龄及孕前BMI等混杂因素后,孕早期FPG每升高1 mmol/L,GDM的发生风险增加92%[20],与本研究结果相近。孕早期母亲高血糖水平会增加胎儿生长速度,长期宫内高血糖对胎儿不利,因此指南推荐对孕早期FPG≥5.1 mmol/L的孕妇尽早健康宣教及体重管理,本研究结果进一步提供了证据。
TG水平较高时,脂肪酸氧化异常可导致甘油二酯在肝脏及骨骼肌堆积,诱发IR[21],且有研究发现孕早期TG水平与IR程度呈正相关[22-23]。美国糖尿病协会建议对于超重肥胖女性合并TG≥2.8 mmol/L应在孕前行OGTT以期尽早干预[1],但孕12~13+6周TG≥2.8 mmol/L的孕妇比例在本研究的整体队列中仅为1.2%,与以往中国人群报道接近[24]。孕妇TG水平在孕12~13+6周接近孕前水平[25],故本研究参考中国血脂管理指南将TG≥1.7 mmol/L定义为TG水平升高[13],在调整混杂因素后,TG≥1.7 mmol/L的孕妇进展为GDM的风险为TG<1.7 mmol/L的孕妇的2.63倍。一些中国孕妇的研究结果与本研究相近[24,26]。另有研究提示,孕早期TG水平较高,孕中期TG升高较多均为GDM的危险因素[27-28],且孕中期TG升高幅度与体重增加呈正相关[28]。尽管目前无妊娠期TG水平的参考范围,但以上研究结果提示对孕早期TG≥1.7 mmol/L的孕妇进行体重管理,是降低GDM发生的可能措施。
孕妇在OGTT前GWG与GDM发病风险的研究结果存在差异,既往研究均未对GDM的筛查孕周进行校正[8-10]。因此本研究以孕早期增重、OGTT前的孕中期每周体重增加为观察变量,发现孕中期每周体重增长过多的孕妇发生GDM的风险是增重正常孕妇的1.85倍。一项Meta分析发现OGTT前GWG过量的孕妇GDM发生风险是非过量GWG的1.4倍,与本研究结果相似[29]。Qi等发现GDM孕妇中OGTT前GWG 过多的人数比例显著高于对照组,调整preBMI、母亲年龄、产次及GDM史后,OGTT前GWG过多则与GDM的发生风险无关,因此Qi等认为美国医学研究所(Institute of Medicine,IOM)发布的GWG最佳范围可能不适合中国孕妇[30]。本研究参考2021年发布的中国妇女妊娠期体重监测与评价,对中国孕妇更具指导意义。有学者认为运动及饮食干预避免GWG过多是预防GDM发生的最佳选择[31-32],本研究结果提示对GDM高危人群进行早期管理,使GWG在适宜范围内可能减少GDM的发病风险。尽管本研究发现孕中期每周体重增长不足(OR=0.556)是GDM的保护因素,但许多研究发现GWG过低是早产及小于胎龄儿的危险因素[33],因此并不建议GWG低于推荐范围。
本研究是基于队列研究,在OGTT前进行体重称量是比较可靠准确的。本研究的创新点在于参考2021年发布的中国妇女妊娠期体重推荐范围,且采用OGTT前孕中期每周体重增长量为观察指标,可以避免筛查孕周不同引起的偏倚。但本研究的孕前体重由孕妇自行报告,孕12~13+6周及24~27+6周体重由孕妇在家测量,无法进行统一的质量控制,存在一定的局限性。
1 中华医学会妇产科学分会产科学组,中华医学会围产医学分会,中国妇幼保健协会妊娠合并糖尿病专业委员会.妊娠期高血糖诊治指南(2022)[第一部分].中华妇产科杂志,2022,57:3-12.
2 Malaza N,Masete M,Adam S,et al.A systematic review to compare adverse pregnancy outcomes in women with pregestational diabetes and gestational diabetes.Int J Environ Res Public Health,2022,19:10846.
3 Johns EC,Denison FC,Norman JE,et al.Gestational diabetes mellitus:mechanisms,treatment,and complications.Trends Endocrinol Metab,2018,29:743-754.
4 娜仁其木格,李冬梅,米林香,等.中国妊娠期糖尿病患病率的Meta分析.中国循证医学杂志,2018,18:280-285.
5 魏玉梅,杨慧霞.妊娠期高血糖的诊断及管理.中国实用妇科与产科杂志,2020,36:117-120.
6 Wang C,Wei Y,Zhang X,et al.A randomized clinical trial of exercise during pregnancy to prevent gestational diabetes mellitus and improve pregnancy outcome in overweight and obese pregnant women.Am J Obstet Gynecol,2017,216:340-351.
7 Assaf-Balut C,García de la Torre N,Durán A,et al.A mediterranean diet with additional extra virgin olive oil and pistachios reduces the incidence of gestational diabetes mellitus(GDM):A randomized controlled trial:The St.Carlos GDM prevention study.PLoS One,2017,12:e0185873.
8 Peng Y,Han N,Su T,et al.Gestational weight gain and the risk of gestational diabetes mellitus:A latent class trajectory analysis using birth cohort data.Diabetes Res Clin Pract,2021,182:109130.
9 Chakkalakal RJ,Hackstadt AJ,Trochez R,et al.Gestational diabetes and maternal weight management during and after pregnancy.J Womens Health(Larchmt),2019,28:646-653.
10 Yin A,Tian F,Wu X,et al.Excessive gestational weight gain in early pregnancy and insufficient gestational weight gain in middle pregnancy increased risk of gestational diabetes mellitus.Chin Med J(Engl),2022,135:1057-1063.
11 Li Y,Ren X,He L,et al.Maternal age and the risk of gestational diabetes mellitus:A systematic review and meta-analysis of over 120 million participants.Diabetes Res Clin Pract,2020,162:108044.
12 Wei YM,Yang HX,Zhu WW,et al.Risk of adverse pregnancy outcomes stratified for pre-pregnancy body mass index.J Matern Fetal Neonatal Med,2016,29:2205-2209.
13 王增武,刘静,李建军,等.中国血脂管理指南(2023年).中国循环杂志,2023,38:237-271.
14 Lewandowska M.Gestational Diabetes Mellitus(GDM) Risk for declared family history of diabetes,in combination with BMI categories.Int J Environ Res Public Health,2021,18:6936.
15 Lee KW,Ching SM,Ramachandran V,et al.Prevalence and risk factors of gestational diabetes mellitus in Asia:a systematic review and meta-analysis.BMC Pregnancy Childbirth,2018,18:494.
16 Cao M,Zhang L,Chen T,et al.Genetic susceptibility to gestational diabetes mellitus in a Chinese population.Front Endocrinol(Lausanne),2020,11:247.
17 Ma Y,Wang N,Gu L,et al.Postpartum assessment of the beta cell function and insulin resistance for Chinese women with previous gestational diabetes mellitus.Gynecol Endocrinol,2019,35:174-178.
18 Barbour LA,McCurdy CE,Hernandez TL,et al.Cellular mechanisms for insulin resistance in normal pregnancy and gestational diabetes.Diabetes Care,2007,30 Suppl 2:S112-119.
19 Liang X,Zheng W,Liu C,et al.Clinical characteristics,gestational weight gain and pregnancy outcomes in women with a history of gestational diabetes mellitus.Diabetol Metab Syndr,2021,13:73.
20 Habibi N,Mousa A,Tay CT,et al.Maternal metabolic factors and the association with gestational diabetes:A systematic review and meta-analysis.Diabetes Metab Res Rev,2022,38:e3532.
21 Samuel VT,Petersen KF,Shulman GI.Lipid-induced insulin resistance:unravelling the mechanism.Lancet,2010,375:2267-2277.
22 Shen L,Wang D,Huang Y,et al.Longitudinal trends in lipid profiles during pregnancy:Association with gestational diabetes mellitus and longitudinal trends in insulin indices.Front Endocrinol(Lausanne),2022,13:1080633.
23 Lin J,Jin H,Chen L.Associations between insulin resistance and adverse pregnancy outcomes in women with gestational diabetes mellitus:a retrospective study.BMC Pregnancy Childbirth,2021,21:526.
24 Wu D,Zhang J,Xiong Y,et al.Effect of maternal glucose and triglyceride levels during early pregnancy on pregnancy outcomes:a retrospective cohort study.Nutrients,2022,14:3295.
25 Wiznitzer A,Mayer A,Novack V,et al.Association of lipid levels during gestation with preeclampsia and gestational diabetes mellitus:a population-based study.Am J Obstet Gynecol,2009,201:482.e1-8.
26 Zheng T,Ye W,Wang X,et al.A simple model to predict risk of gestational diabetes mellitus from 8 to 20 weeks of gestation in Chinese women.BMC Pregnancy Childbirth,2019,19:252.
27 Zhu H,He D,Liang N,et al.High serum triglyceride levels in the early first trimester of pregnancy are associated with gestational diabetes mellitus:A prospective cohort study.J Diabetes Investig,2020,11:1635-1642.
28 Shen H,Liu X,Chen Y,et al.Associations of lipid levels during gestation with hypertensive disorders of pregnancy and gestational diabetes mellitus:a prospective longitudinal cohort study.BMJ Open,2016,6:e013509.
29 Brunner S,Stecher L,Ziebarth S,et al.Excessive gestational weight gain prior to glucose screening and the risk of gestational diabetes:a meta-analysis.Diabetologia,2015,58:2229-2237.
30 Qi Y,Sun X,Tan J,et al.Excessive gestational weight gain in the first and second trimester is a risk factor for gestational diabetes mellitus among women pregnant with singletons:A repeated measures analysis.J Diabetes Investig,2020,11:1651-1660.
31 Wu S,Jin J,Hu KL,et al.Prevention of gestational diabetes mellitus and gestational weight gain restriction in overweight/obese pregnant women:a systematic review and network meta-analysis.Nutrients,2022,14:2383.
32 Cantor A,Jungbauer RM,McDonagh MS,et al.Counseling and behavioral interventions for healthy weight and weight gain in pregnancy:a systematic review for the U.S.Preventive Services Task Force.Rockville(MD),2021.
33 Rogozinska E,Zamora J,Marlin N,et al.Gestational weight gain outside the Institute of Medicine recommendations and adverse pregnancy outcomes:analysis using individual participant data from randomised trials.BMC Pregnancy Childbirth,2019,19:322.