子痫前期是妊娠期间新发的高血压,伴有蛋白尿或其他器官损伤,其危害主要在于可以导致孕产妇和围生儿病死率升高,在发展中国家尤为明显[1]。根据是否出现子痫前期的严重表现分为无严重表现子痫前期和伴严重表现子痫前期[2],两者在临床上终止妊娠的时机不同,妊娠结局也不同。本研究通过分析不同严重程度子痫前期患者的一般情况、妊娠并发症及妊娠结局,探讨与疾病严重程度及母儿不良结局相关的高危因素,旨在预防重度子痫前期,尽可能减少母儿不良结局的发生。
对象与方法
1.研究对象:本研究为回顾性病例对照研究,收集2007年1月1日至2021年12月31日在山西医科大学第一医院住院分娩的775例子痫前期患者及其新生儿的临床资料,分为无严重表现子痫前期组(mild preeclampsia,MPE组)228例和伴严重表现子痫前期组(severe preeclampsia,SPE组)547例。纳入标准:(1)符合子痫前期的诊断标准[2];(2)临床资料完整,有妊娠结局。排除标准:(1)既往肝、肾功能损伤;(2)患精神类疾病;(3)胎儿畸形。本研究已通过伦理委员会审查(伦理审查批件号:NO.KYLL-2023-045)。
2.方法:收集产妇年龄、入院分娩时体质指数(body mass index,BMI)、分娩孕周、胎数、产次、受孕方式、分娩方式、子痫前期病史、不良孕产史、是否规律产检、妊娠并发症、围产儿并发症等资料。以HELLP综合征、胎盘早剥、低蛋白血症、胎膜早破、心功能衰竭、心功能不全、产后出血、子宫胎盘卒中为母体不良结局。以新生儿窒息、胎儿窘迫、羊水过少、死胎为围产儿不良结局。诊断标准均参考《妇产科学》[2],分类参考美国妇产科医师学会(ACOG)2013年提出的分类标准[3]。
3.统计学方法:数据采用SPSS 27.0软件进行分析,计量资料满足正态分布及方差齐性时采用t检验;非正态分布以中位数和四分位数间距[M(P25,P75)]表示,采用Wilcoxon秩和检验比较。计数资料以率表示,采用χ2检验比较,样本量较小时用Fisher精确概率法。分析危险因素使用Logistic回归及受试者工作特征(receiver operating characteristic,ROC)曲线分析。以P<0.05为差异有统计学意义。
结果
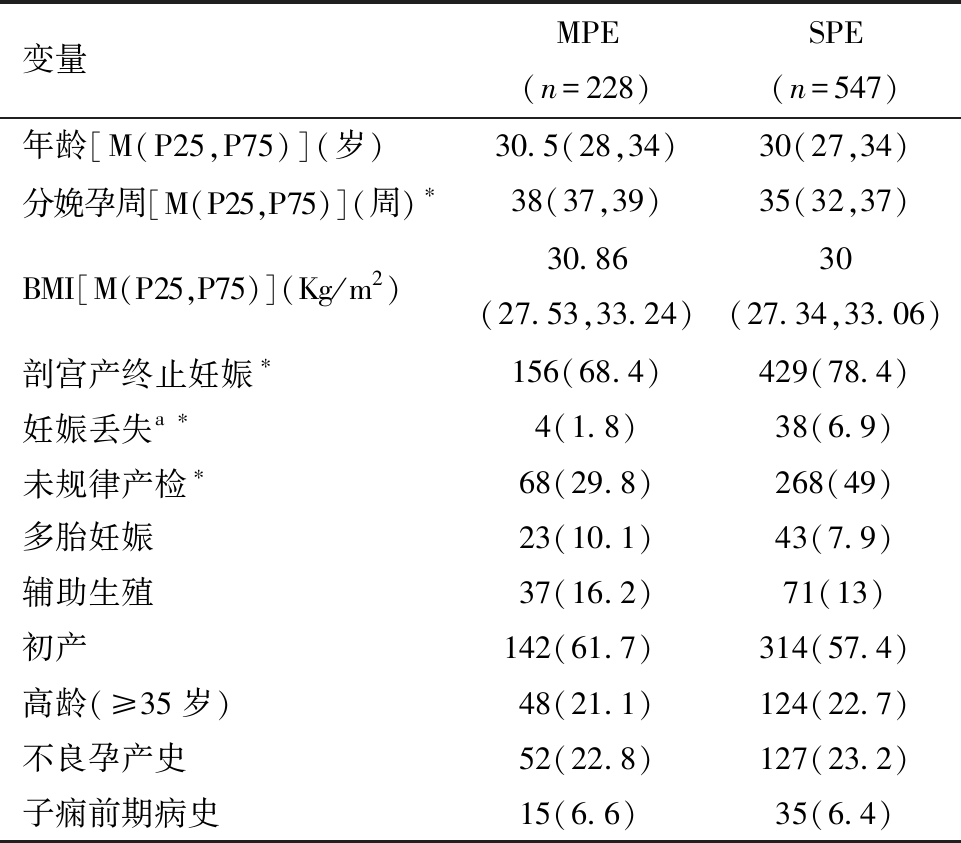
1.一般资料:2007年1月1日至2021年12月31日共14年中,患子痫前期的患者共775例,其中MPE组发生率为29.4%(228/775),SPE组为70.6%(547/775)。两组的年龄、入院分娩时BMI、多胎妊娠、辅助生殖、初产、高龄(≥35岁)、不良孕产史、子痫前期病史差异无统计学意义(P>0.05),分娩孕周、剖宫产率、妊娠丢失率、未规律产检占比有统计学意义(P<0.05),见表1。
表1 SPE组与MPE组一般情况比较[例(%)]
注:aFisher精确概率法,组间比较,*P<0.05.
变量MPE(n=228)SPE(n=547)年龄[M(P25,P75)](岁)30.5(28,34)30(27,34)分娩孕周[M(P25,P75)](周)∗38(37,39)35(32,37)BMI[M(P25,P75)](Kg/m2)30.86(27.53,33.24)30(27.34,33.06)剖宫产终止妊娠∗ 156(68.4)429(78.4)妊娠丢失a ∗4(1.8)38(6.9)未规律产检∗ 68(29.8)268(49)多胎妊娠23(10.1)43(7.9)辅助生殖37(16.2)71(13)初产142(61.7) 314(57.4)高龄(≥35岁)48(21.1)124(22.7)不良孕产史52(22.8)127(23.2)子痫前期病史15(6.6) 35(6.4)
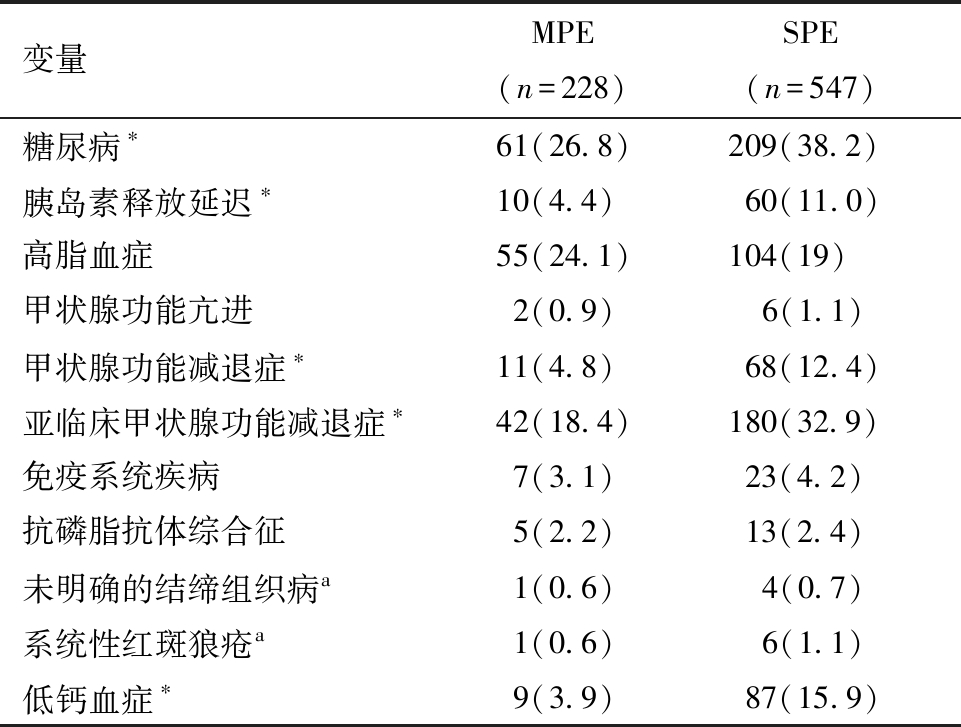
2.妊娠并发症发生情况:与MPE组比较,SPE组患者伴有糖尿病、胰岛素释放延迟、甲状腺功能减退症、亚临床甲状腺功能减退症、甲状腺功能亢进、免疫系统疾病、低钙血症的发生率更高。其中,伴有糖尿病、胰岛素释放延迟、甲状腺功能减退症、亚临床甲状腺功能减退症、低钙血症占比差异有统计学意义(P<0.05),SPE组患者合并高脂血症占比低于MPE组,差异无统计学意义(P>0.05),见表2。
表2 SPE组与MPE组妊娠并发症发生情况比较[例(%)]
注:aFisher精确概率法,组间比较,*P<0.05.
变量MPE (n=228) SPE (n=547) 糖尿病∗61(26.8)209(38.2)胰岛素释放延迟∗10(4.4)60(11.0)高脂血症55(24.1)104(19)甲状腺功能亢进2(0.9) 6(1.1)甲状腺功能减退症∗11(4.8)68(12.4)亚临床甲状腺功能减退症∗42(18.4)180(32.9)免疫系统疾病7(3.1)23(4.2)抗磷脂抗体综合征5(2.2)13(2.4)未明确的结缔组织病a1(0.6) 4(0.7)系统性红斑狼疮a1(0.6) 6(1.1)低钙血症∗9(3.9)87(15.9)
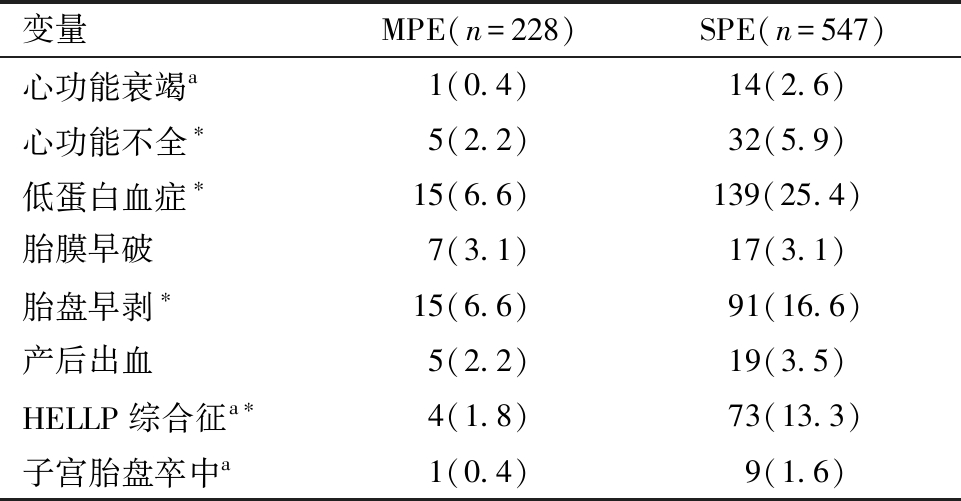
3.母体不良结局发生率比较:与MPE组相比,SPE组母体妊娠结局中心功能衰竭、胎膜早破、产后出血、子宫捆绑、子宫胎盘卒中占比差异无统计学意义(P>0.05),SPE组心功能不全、低蛋白血症、胎盘早剥、HELLP综合征占比差异有统计学意义(P<0.05),见表3。
表3 母体不良妊娠结局比较[例(%)]
注:aFisher精确概率法,组间比较,*P<0.05.
变量MPE(n=228)SPE(n=547)心功能衰竭a1(0.4)14(2.6)心功能不全∗5(2.2)32(5.9)低蛋白血症∗15(6.6)139(25.4)胎膜早破7(3.1)17(3.1)胎盘早剥∗15(6.6)91(16.6)产后出血5(2.2)19(3.5)HELLP综合征a∗4(1.8)73(13.3)子宫胎盘卒中a1(0.4) 9(1.6)
4.围产儿不良结局发生率比较:与MPE组相比,SPE组围产儿不良妊娠结局中胎儿窘迫、羊水过少占比无统计学意义(P>0.05),新生儿窒息、死胎有统计学意义(P<0.05),见表4。
表4 围产儿不良妊娠结局比较[例(%)]

注:aFisher精确概率法,组间比较,*P<0.05.
变量MPE(n=228)SPE(n=547)胎儿窘迫14(6.1)44(8.0)新生儿窒息a1(0.4)1(4.9)死胎a3(1.3)51(9.3)羊水过少10(4.4)31(5.7)
5.多因素Logistic回归分析与ROC曲线:以发生子痫前期严重表现为结局,将两组有统计学意义的指标纳入多因素Logistics回归分析,包括合并糖尿病、胰岛素释放延迟、甲状腺功能减退症、亚临床甲状腺功能减退症、低钙血症、不规律产检,结果显示以上因素均为发生子痫前期严重表现的独立危险因素(P<0.05),见表5。回归模型总体 ROC曲线下面积(AUC)为0.718,95%CI:(0.679~0.757),P<0.001,该模型有较好的诊断效能,见图1。
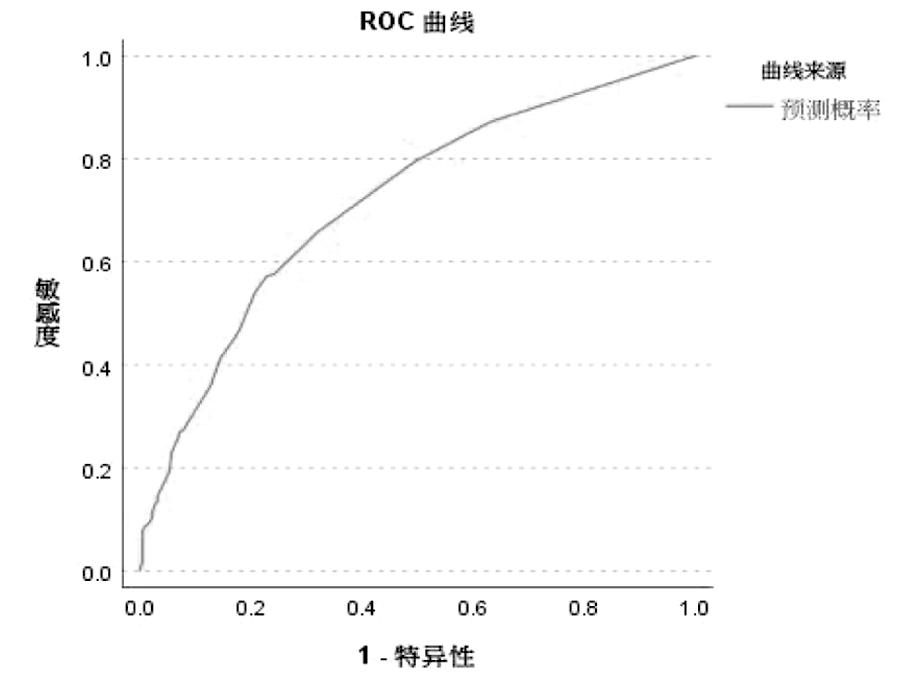
图1 伴严重表现子痫前期发病危险因素的ROC曲线
表5 重度子痫前期发病危险因素多因素Logistic回归分析
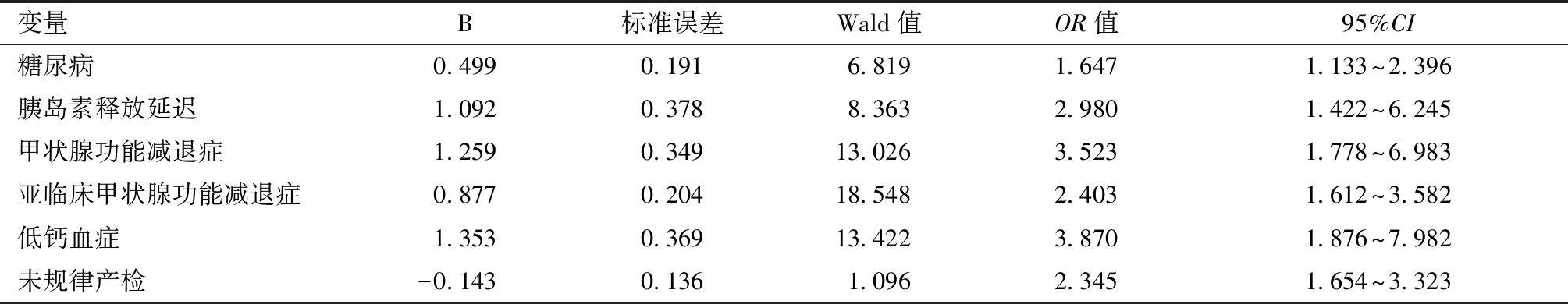
变量B标准误差Wald值OR值95%CI糖尿病0.4990.1916.8191.6471.133^2.396胰岛素释放延迟1.0920.3788.3632.9801.422^6.245甲状腺功能减退症1.2590.34913.0263.5231.778^6.983亚临床甲状腺功能减退症0.8770.20418.5482.4031.612^3.582低钙血症1.3530.36913.4223.8701.876^7.982未规律产检-0.1430.1361.0962.3451.654^3.323
讨论
子痫前期高危因素包括高龄(年龄≥35岁)、肥胖、初产、子痫前期病史、糖尿病、自身免疫系统疾病(系统性红斑狼疮、抗磷脂抗体综合征、未明确的结缔组织病)、辅助生殖受孕、未规律产前检查等[4-6]。在最新的一些临床研究中,发现胰岛素释放延迟、甲状腺功能减退症也对子痫前期的发生有影响[7-10]。在指南及相关研究中还提到,补钙可以预防子痫前期发生[11-13],因此在本研究中,将指南及最新研究的子痫前期的高危因素及低钙血症纳入,来探究这些因素对于疾病进展的影响。
本研究结果显示,合并有糖尿病、胰岛素释放延迟、甲状腺功能减退症、亚临床甲状腺功能减退症、低钙血症及妊娠期不规律产检为重度子痫前期发生的危险因素,糖尿病与胰岛素释放延迟患者体内一氧化氮合酶生成减少[14]、炎症因子如白介素-6的增加[15]、高血糖导致的血管紧张素II活性增加[16],共同作用下血管内皮细胞功能受损、血管痉挛收缩,加重病情。甲减及亚甲减患者体内血管内皮生长因子及胎盘生长因子水平下降,以及由于甲状腺激素缺乏导致的糖原代谢受损、血流动力学改变、血管内皮损伤[17-18],都与子痫前期的发生发展相关。血清钙浓度降低与细胞内钙浓度增加可导致血管收缩,参与重度子痫前期的发生[11],也有研究证明了这一点[19]。
本研究建立的回归模型P值小于0.05,曲线下面积为0.718,表示以该模型预测重度子痫前期的发生具有较好的效能。目前已经有90种预测因子及52个预测模型用来预测子痫前期的发生,而将血压、临床风险因素、生化指标和子宫动脉搏动指数等联合起来的预测价值较高[20]。本研究纳入了多种常见临床风险因素,且均为产检常规检测项目,未增加孕产妇额外经济负担,并且风险因素临床诊断标准明确,因此可以考虑作为一项临床危险因素的参考,用来预警重度子痫前期的发生。
有研究结果显示未规律产检是子痫前期及母儿不良妊娠结局发生的独立危险因素[21-22]。本研究结果中未规律产检孕妇在SPE组占比达49%,提示患者对于产检的认识仍有待提高。产科医生在临床工作中应与社区工作人员配合,加强宣传,做好妊娠期的一级管理及预防。在临床上可以通过指导患者规律产检,定期检测相关指标,及时发现这些疾病高危因素并进行干预及处理,来达到二级预防目的。
目前临床上对于无严重表现子痫前期可期待治疗至37周,而伴严重表现子痫前期则建议在妊娠≥34周即应考虑终止妊娠[2]。本研究结果显示SPE组的分娩孕周中位数为35周,MPE组则为38周,差异有统计学意义。避免重度子痫前期的发生可以有效降低早产率,从而避免因早产带来的胎儿近、远期损伤以及相应的经济支出。
该研究结果中SPE组孕产妇心功能不全、低蛋白血症、胎盘早剥、HELLP综合征占比,围产儿新生儿窒息、死胎的占比在两组比较中有统计学意义。预防子痫前期目的就在于减少不良结局的发生,提高优生优育,保障孕产妇安全。据第七次全国人口普查结果来看,虽然中国开放了二胎、三胎政策,但中国的生育率进入超低生育率水平行列,其中一部分原因就在于对生育安全及妊娠结局的不确定[23]。因此,早期识别重度子痫前期预警因子对于预防母儿不良结局具有重要的意义,或许对于生育率的提高也有一定的长期影响价值。
本研究的不足之处在于没有收集正常妊娠对照组,仅将目前国内外研究成果中确定为子痫前期发病高危因素者直接纳入研究,接下来可以增加正常对照组,研究三胎政策实行后的子痫前期相关风险因素研究,对子痫前期孕妇进行随访,观察其远期并发症,以期能够更完善更及时地预测及管理,减少母儿不良结局的发生。
1 Michele Fichera.Preeclampsia:Diagnosis,treatment and management.Nova Science Publishers,Inc.,2020:1.
2 沈铿,马丁主编.妇产科学.北京:人民卫生出版社,2015.07:133.
3 American College of Obstetricians and Gynecologists.Hypertension in pregnancy.Obstet Cynecol,2013,122:1122-1131.
4 中华医学会妇产科学分会妊娠期高血压疾病学组.妊娠期高血压疾病诊治指南(2020).中华妇产科杂志,2020,55:227‐238.
5 American College of Obstetricians and Gynecologists′ Committee.ACOG practice bulletin No.203:chronic hypertension in pregnancy.Obstet Gynecol,2019,133:e26-e50.
6 中华医学会妇产科学分会产科学组.孕前和孕期保健指南(2018).中华妇产科杂志,2018,53:7-13.
7 黄诗韵,于博,何欣,等.胰岛素抵抗指标在预测妊娠期糖尿病孕妇并发重度子痫前期中的价值.中国计划生育和妇产科,2021,13:84-87,96,后插1.
8 van Niekerk G,Christowitz C,Engelbrecht AM.Insulin-mediated immune dysfunction in the development of preeclampsia.J Mol Med(Berl),2021,99:889-897.
9 母亲甲状腺功能与妊娠期高血压和子痫前期风险的相关性:一项系统综述与个体参与者数据的meta分析.中华围产医学杂志,2022,25:338.
10 Alampoondi Venkataramanan SV,Li P,Hadley M,et al.The impact of maternal hypothyroidism on the prevalence of preeclampsia in a contemporary nationwide cohort.European Heart Journal,2021,42(Supplement1).
11 Khidri FF,Riaz H,Naz F,et al.Serum calcium levels in preeclampsia.J Pharm Res Int,2021,33:127-131.
12 Chappell LC,Cluver CA,Kingdom J,et al.Pre-eclampsia.Lancet.2021,398:341-354.
13 Hofmeyr GJ,Lawrie TA,Atallah  N,et al.Calcium supplementation during pregnancy for preventing hypertensive disorders and related problems.Cochrane Database Syst Rev,2018,10:CD001059.
N,et al.Calcium supplementation during pregnancy for preventing hypertensive disorders and related problems.Cochrane Database Syst Rev,2018,10:CD001059.
14 Sena CM,Pereira AM,Seiça R.Endothelial dysfunction - a major mediator of diabetic vascular disease.Biochim Biophys Acta,2013,1832:2216-2231.
15 Fan DM,Wang Y,Liu XL,et al.Polymorphisms in interleukin-6 and interleukin-10 may be associated with risk of preeclampsia.Genet Mol Res,2017,16.
16 Stanhewicz AE,Jandu S,Santhanam L,et al.Increased angiotensin ii sensitivity contributes to microvascular dysfunction in women who have had preeclampsia.Hypertension,2017,70:382-389.
17 Muzurovic′ E,Borozan S,Vujoševic′ S,et al.Thyroid status and vascular risk:an update.Curr Vasc Pharmacol,2022,20:460-462.
18 Zlatkina VV,Nemtsova VD,Ilchenko IA.Relationship of vasculoendothelial growth factor-A changes and lipid spectrum in patients with comorbide course of arterial hypertension,type 2 diabetes mellitus and subclinical hypothyroidism.Atherosclerosis,2021,331:e228- e 229.
19 殷珊珊.多种微量元素的检测在子痫前期发病中的临床研究.西北民族大学,2020:11.
20 Townsend R,Khalil A,Premakumar Y,et al.Prediction of pre-eclampsia:review of reviews.Ultrasound Obstet Gynecol,2019,54:16-27.
21 Koné S,Hürlimann E,Baikoro N,et al.Pregnancy-related morbidity and risk factors for fatal foetal outcomes in the Taabo health and demographic surveillance system,C te d′Ivoire.BMC Pregnancy Childbirth,2018,18:216.
te d′Ivoire.BMC Pregnancy Childbirth,2018,18:216.
22 Hui L,Marzan MB,Potenza S,et al.Increase in preterm stillbirths in association with reduction in iatrogenic preterm births during COVID-19 lockdown in Australia:a multicenter cohort study.Am J Obstet Gynecol,2022,227:491.e1-491.e17.
23 张孝栋,张雅璐,贾国平,等.中国低生育率研究进展:一个文献综述.人口与发展,2021,27:9-21.