microRNA(miRNA)是一类单链非编码小分子RNA,miRNA降解或翻译抑制,调控靶基因的表达,参与细胞增殖、代谢、时序、死亡、DNA甲基化和染色修饰、造血、神经发育、肿瘤形成等多种生物学过程[1]。在真核细胞中广泛分布,可通过与靶基因的信使 RNA 的 3′UTR端碱基相对或完全配对,导致靶基因的翻译受到抑制,或者可以促进靶基因的降解,因此可以调控转录后的基因表达[2]。miR-145基因位于染色体5q32,通过RAF、HGK、M96A;SMARCFI;ATPIA1、GOLGA2、SMS、NUDT5、PAH、DHFR等基因;参与多种途径调节[3-5],从而miR-145作为肿瘤抑癌基因在多种肿瘤组织中表达下调,如:脑肿瘤、结直肠癌、肝癌、胃癌、食管癌、肺癌、膀胱癌、前列腺癌、鼻咽癌、口腔癌、卵巢癌、宫颈癌等肿瘤组织中[6-7]。宫颈癌是一种发于子宫颈部的妇科常见恶性肿瘤,多发于40~60岁女性群体,其病死率高居妇科肿瘤第二位[8]。人乳头瘤病毒(human papillomaviru,HPV),特别是高危型病毒的感染在子宫颈鳞状细胞癌的发生过程中发挥着重要作用[9]。是否由于 HPV 的整合而导致 miRNA-145 在该肿瘤细胞中表达降低还有待于进一步研究。蒙古族及汉族宫颈癌人群中miRNA-145表达是否有差异未见报道。
本研究应用RT-PCR实验方法探讨miR-145在蒙古族和汉族患者血清及组织中的表达及分析 miRNA-145与高危型 HPV16型感染之间的关系,探讨其在子宫颈细胞恶性转变以及宫颈鳞状细胞癌(squamous-cell carcinoma,SCC) 发生中的作用以及不同民族间是否存在差异。血清中miRNA检测较组织中取材更为方便可行。在血清中检出肿瘤特异性miRNA并将其作为肿瘤生物学标志对于肿瘤早期诊断及预后判断具有重要意义。
对象与方法
1.研究对象:收集内蒙古医科大学附属医院及内蒙古自治区肿瘤医院妇科2013年6月—2021年6月蒙古族及汉族妇女子宫颈鳞状细胞癌(癌组),高级别宫颈上皮内瘤变(cervical intraepithelial neoplasia,高CIN组)、低级别上皮内流变(低CIN组),以及因子宫肌瘤切除的正常宫颈(对照组)组织及血清标本各30例,所有患者均未接受过放疗、化疗或者其他化学及物理治疗。患者年龄29~70岁,平均46.5岁。
2.方法
(1)血清与组织采集及血清与组织总RNA抽提与纯化:以抗凝管采集抗凝血,临床常规血清标本以带分离胶的真空采血管采集。以1 500 rpm离心15 min,吸取上层血清于洁净离心管中。液氮保存,组织离体后立即放于液氮中保存,按照miRcute miRNA提取分离试剂盒使用说明书从血清及组织中提取总RNA。使用Beckman DU800型紫外分光光度计测定RNA提取液A260吸光度值,计算浓度。
(2)实时荧光定量PCR:按照RT逆转录试剂盒说明书,20 μL反应体系,miRNA 3′末端进行加Poly(A),反应条件为37 ℃反应60 min Poly(A);修饰的miRNA 进行逆转录反应,反应条件为37 ℃反应60 min。然后按照qPCR试剂盒说明书配20 μL反应体系,以5S管家基因做为内参。 起始模板变性94 ℃ 2 min,PCR循环中模板变性94 ℃ 2 min,退火94 ℃ 20秒,延伸60 ℃ 34秒,40 cycles。表达量倍数的变化用公式RQ = 2-△△CT,其中△△CT=(CT miRNA- CT 5s)BC -(CT miRNA-CT 5s)MeanBN。RQ 代表相对表达量(relative quantitation),CT miRNA和 CT 5S分别代表荧光定量检测到的目标 miRNA 和内参基因 5s 的Ct值,BC 代表宫颈癌和CINⅢ级组的组织或血清,BN 代表正常对照组,MeanBN代表所有正常对照组中的平均值。
(3)试剂 miRcute miRNA提取分离试剂盒;miRcute miRNA cDNA第一链合成试剂盒;miRcute miRNA荧光定量检测试剂盒;5S及miR-145。miRNA检测引物(以上均由天根公司提供)。7300实时荧光定量PCR仪(Applied Biosystems公司),DU800型分光光度计(Beckman公司)。
3.统计学处理:采用SPSS 19.0分析miR-145的相对定量。相关分析采用Spearman秩相关检验。样本间的比较采用两独立样本和多个独立样本比较的秩和检验。计数资料比较采用 χ2检验。P<0.05为差异有统计学意义。
结果
1.HPV16在蒙古组及汉族对照组、低CIN 组、高CIN 组、癌组的表达差异:蒙古族癌组、高CIN组、低CIN组中 HPV16 阳性率分别为40.0%、36.7%、6.0%;对照组HPV16 阳性率为0 ; 汉族癌组、高CIN组 、低CIN组中 HPV16 阳性率分别为36.7%、40.0%、3.3%;对照组HPV16 阳性率为0 ; 各组蒙汉族统计无显著性差异。蒙汉两族对照组、低CIN组、与癌组比较均有差异显著(P<0.05),高CIN级与癌组无显著性差异(P>0.05),见表1。
表1 HPV16在蒙古组及汉族对照组、低CIN 组、高CIN 组、癌组的表达差异[n(%)]

注:与对照组比较,*P<0.05
民族癌组高CIN组低CIN组对照组蒙古族12(40.0)∗11(36.7)∗2(6.0)∗0(0)汉族 11(36.7)∗12(40.0)∗1(3.3)∗0(0)
2.miR-145在蒙古族及汉族宫颈癌患者血清与癌组织中表达的相关性:相对表达均为正相关性。蒙古族宫颈癌患者血清与癌组织中表达呈正相关(r=0.4,P=0.02﹚,汉族宫颈癌患者血清与癌组织中表达呈正相关(r=0.4,P=0.02)
3.蒙汉两族miRNA-145 在癌组、高CIN组、低CIN组及正常组中血清及组织的表达差异:两个民族癌组织及血清中miRNA-145 的表达较高CIN级、低CIN 组及正常宫颈组明显降低,相对定量平均秩次结果(见表2)。蒙古族:血清、组织差别有统计学意义。汉族:血清、组织差别有统计学意义。正常宫颈组、低CIN组、高CIN Ⅲ组中的 miRNA-145表达无统计学差异(P>0.05) 。蒙古族及汉族两组在癌组、高CIN组、低级别CIN组及正常组中血清及组织的表达无统计学差异(P>0.05)。
表2 蒙汉族在癌组,高CIN组、低CIN组及对照组中血清及组织miRNA-145 的表达相对定量平均秩次比较
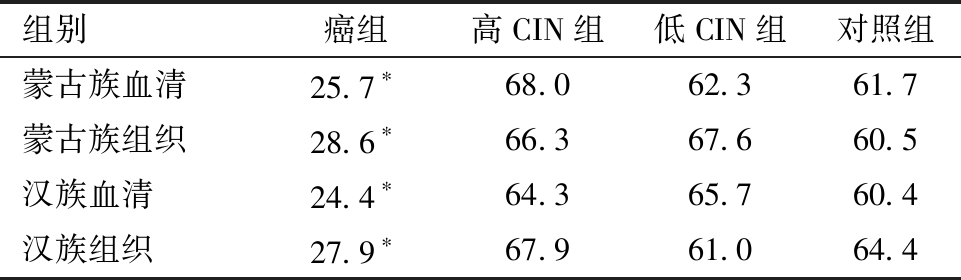
*注:与同组别高CIN组、低CIN组及对照组比较,P<0.05.
组别癌组高CIN组低CIN组对照组蒙古族血清25.7∗68.062.361.7蒙古族组织28.6∗66.367.660.5汉族血清24.4∗64.365.760.4汉族组织27.9∗67.961.064.4
4.汉族宫颈组织及血清中miRNA-145 表达的相关性分析:对蒙古族和汉族的miR-145 采用实时荧光定量PCR的方法,统计相对表达量荧光阈值循环次数(C t值 ),计算ΔC t值,进行单因素方差分析,结果显示 miR-145表达水平在蒙古族和汉族间差异无统计学意义(P>0.05)。
图1 miR-145在蒙古族及汉族宫颈癌患者血清与癌组织中表达的相关性
讨论
miRNAs在肿瘤、癌前病变与正常组织有不同的表达谱,不但可以作为肿瘤的诊断指标,还可帮助判断预后[10],扮演着原癌基因或抑癌基因的角色[11]。研究发现,人血清中稳定存在一定水平的miR,并且血清miRs表达谱的变化与多种肿瘤的发生、发展具有明确的相关性,说明血清miRs可作为肿瘤临床诊断和预后评估的分子标志物[12-13]。并且,基于血清样本采取便捷,因此很适合用于普查和预防、早期诊断及复发评估。miR-145作为肿瘤抑癌基因在肿瘤的发生发展转移过程中起着重要的作用,并且可能通过相同的靶点抑制了多种肿瘤的发生[14]。
本研究显示,癌前病变阶段及由癌前病变进展到癌过程中随着病情发展miRNA-145的表达量呈现明显的下调,提示有可能成为新的检测宫颈癌的早期指标之一。已有研究报道血清标本中的 miRNA-145 可作为宫颈癌诊断和预后标志物[15]。细胞学实验研究显示 miRNA-145表达下调可能与HPV16 阳性有关联,与民族无关。研究结果提示 miRNA-145失调及表达量的下调可能与HPV16阳性子宫颈高级别上皮内瘤变和宫颈鳞癌的发生有密切关系。
miR-145在宫颈鳞癌组织及血清内的低表达可能在子宫颈上皮由癌前病变发展到子宫颈癌的过程中持续发挥作用[16-17]。miR-145在宫颈癌患者血清中的表达与组织表达相似降低且血清检测有可能成为肿瘤检测指标之一,但不同民族宫颈癌患者血清及组织中miR-145表达目前尚未见报道。本研究发现,蒙古组及汉族血清中miR-145与组织中的表达有较高的正相关性。且宫颈鳞癌患者血清及组织与癌前期患者及良性病变有正常宫颈患者的血清及组织相比miR-145明显降低,差异具有统计学意义,表明血清中miR-145可能作为多民族宫颈鳞癌患者早期诊断的有用指标。
1 刘萍.中国大陆13年宫颈癌临床流行病学大数据评价.中国实用妇科与产科杂志,2018.
2 杜宜兰,邓娟,贾宁.宫颈癌新miRNA分子标记物发掘与功能分析.国际遗传学杂志,2019,42:411-418.
3 Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012.CA Cancer J Clin,2015,65:87-108.
4 Lu H,He Y,Lin L,et al.Long non-coding RNA MALAT1 modulates radiosensitivity of HR-HPV+ cervical cancer via sponging miR-145.Tumour Biol,2016,37:1683-1691.
5 Krishnamurthy N,Kurzrock R.Targeting the Wnt/beta-catenin pathway in cancer:Update on effectors and inhibitors.Cancer Treat Rev,2018,62:50-60.
6 Azizmohammadi S,Safari A,Azizmohammadi S,et al.Molecular identification of miR-145 and miR-9 expression level as prognostic biomarkers for early-stage cervical cancer detection.QJM,2017,110:11-15.
7 Liang Y,Sun R,Li L,et al.A functional polymorphism in the promoter of MiR-143/145 is associated with the risk of cervical squamous cell carcinoma in Chinese women:a case-control study.Medicine(Baltimore),2015,94:e1289.
8 吴小华.宫颈癌的新分期与临床意义.实用妇产科杂志,2011,27:406-407.
9 张宁,刘笑梅.宫颈人乳头瘤病毒持续性感染的临床研究进展.国际生物医学工程杂志,2018,41:348-353.
10 Lages E,Ipas H,Guttin A,et al.MicroRNAs:molecular features and role in cancer.Front Biosci(Landmark Ed),2012,17:2508-2540.
11 Zou C,Xu Q,Mao F,et al.MiR-145 inhibits tumor angiogenesis and growth by N-RAS and VEGF.Cell Cycle,2012,11:2137-2145.
12 Zhu X,Li Y,Xie C,et al.miR-145 sensitizes ovarian cancer cells to paclitaxel by targeting Sp1 and Cdk6.Int J Cancer,2014,135:1286-1296.
13 樊石磊,丁玲,任志英,等.细胞外信号调节激酶1/2表达与HPV16感染及其交互效应在子宫颈癌变中的作用.中华流行病学杂志,2017,38:96-101.
14 Baedyananda F,Chaiwongkot A,Bhattarakosol P.Elevated HPV16 E1 expression is associated with cervical cancer progression.Intervirology,2017,60:171-180.
15 Zhong R,Li S,Fang K,et al.microRNA-1225 inhibit apoptosis of pancreatic cancer cells via targeting JAK1.Cell Cycle,2019,18:990-1000.
16 Tan W,Tang H,Jiang X,et al.Metformin mediates induction of miR-708 to inhibit self-renewal and chemoresistance of breast cancer stem cells through targeting CD47.J Cell Mol Med,2019,23:5994-6004.
17 Jinhua L,Bingyu H,Zihan X,et al.PI3K/Akt/HIF-1α signaling pathway mediates HPV-16 oncoprotein-induced expression of EMT-related transcription factors in non-small cell lung cancer cells.J Cancer,2018,9:3456-3466.