胎儿脑损伤是指在胎儿期因缺氧或缺血引起的脑组织病变,是导致新生儿急性死亡和后期严重神经系统后遗症的常见病因之一,常表现为失明、失聪、癫痫及长期神经发育障碍等。早期诊断并宫内干预脑损伤,保护胎儿脑功能,对改善围生儿结局具有重要意义。
能量代谢是生命的核心,成人神经系统需要 2%~10% 的能量来维持离子梯度、神经元复极、神经递质摄取和回收利用、膜和细胞器维护和蛋白质周转[1],而考虑到胎儿与成年人相比,有相对更大的脑质量[2],能量消耗可能更高,对能量产生的任何干扰都更为敏感,与脑损伤的发生密切相关。
一、胎儿脑损伤的发病机制
围产期缺氧缺血性脑损伤的发病机理具有复杂性和综合性,先决条件是以缺氧合并缺血或单独脑缺血,继而由缺氧缺血引起继发性连锁反应[3]。缺氧影响神经元和神经胶质的代谢,使得促炎细胞因子白细胞介素1α、白细胞介素6和肿瘤坏死因子-α表达增加,自由基的形成增加。缺氧损伤后的线粒体功能障碍通过上调过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶以及通过增加谷胱甘肽过氧化物酶/肌酐比率来增强氧化应激,活性氧(reactive oxygen species,ROS)如超氧自由基(O2·-)、过氧化氢(H2O2)和羟基自由基(·OH)与缺氧介导的细胞损伤强相关,胎儿大脑高耗氧及抗氧化系统发育相对不成熟,因此极易受到ROS介导的氧化应激的影响。故而脑损伤与能量代谢障碍的关系密切。
二、肌酸的代谢与神经保护作用
肌酸是一种参与细胞能量产生的氨基酸衍生物,包括氨基酸甘氨酸、精氨酸和蛋氨酸,可以在肝脏内源性合成(见图 1),也可以通过食用鱼、肉和奶制品从外源性获得。它通过磷酸肌酸系统在缺氧或高能量需求条件下维持三磷酸腺苷(adenosine triphosphate,ATP)水平,这是一种由肌酸激酶催化的可逆反应,其中肌酸和ATP转化为磷酸肌酸和二磷酸腺苷(adenosine diphosphate,ADP),见图 2。而磷酸肌酸是一种底物,即使在缺氧条件下也可用于缓冲 ATP 水平。肌酸和磷酸肌酸充当空间能量缓冲剂和高能磷酸盐的细胞溶质来源,用于ADP(时间能量缓冲剂)的快速再磷酸化,从而在高代谢需求过程中(例如在体力消耗及组织缺氧期间)维持细胞ATP水平[4]。肌酸和磷酸肌酸的能量稳定能力可以缓冲围产期缺氧缺血(hypoxic-ischaemic,HI)后细胞ATP消耗,从而有助于保持代谢和氧化还原平衡。
胞浆存在两种肌酸激酶同工型,脑型肌酸激酶(brain-type creatine kinase,CKBB)和肌肉型肌酸激酶[5]。总体而言,肌酸激酶回路比任何其他代谢系统更快地产生 ATP,肌酸代谢的不同成分之间的相互作用对于维持细胞的生物能量需求至关重要。而除了通过将磷酸基团转移到ADP来维持ATP外,肌酸还具有许多产生神经保护作用的其他途径。
1.调节酸碱平衡:肌酸去磷酸化使用游离质子,减轻细胞内环境的酸化并帮助稳定线粒体膜电位,可能对维持肌肉收缩功能很重要。然而,在肌酸存在的情况下,缺氧期间酸碱变化的最小化不仅是由于细胞能量动力学的变化,还由于肌酸具有清除自由基的内在能力。因此,肌酸/磷酸肌酸系统能够以直接的抗氧化方式调节在严重缺氧期间可能出现的细胞内酸碱平衡变化。
2.抗氧化作用:有研究结果表明,棘鼠幼崽大脑中由产时缺氧引起的丙二醛(脂质过氧化产物)水平升高完全可以通过孕中期补充肌酸来预防[6]。此外,补充肌酸可减少8-羟基脱氧鸟苷的增加,这是脱氧核糖核酸氧化损伤的生物标志物,是自然衰老过程的一部分,故肌酸具有抗氧化作用。
3.与苯二氮卓受体的相互作用:在鸡的大脑中,肌酸与γ-氨基丁酸A(Gamma-amino butyric acid A,GABAA)受体的苯二氮卓结合位点的特异性结合[7]。且喂食肌酸补充饮食的动物在某些大脑区域(纹状体)显示GABA能活性增加,这种抗兴奋作用可能对未成熟的大脑有保护作用。
4.促进谷氨酸的摄取:谷氨酸摄取到突触小泡是一个依赖于ATP的过程,因此肌酸/磷酸肌酸可促进突触小泡吸收谷氨酸,这可能解释肌酸在神经元细胞培养中对抗谷氨酸毒性的神经保护能力。
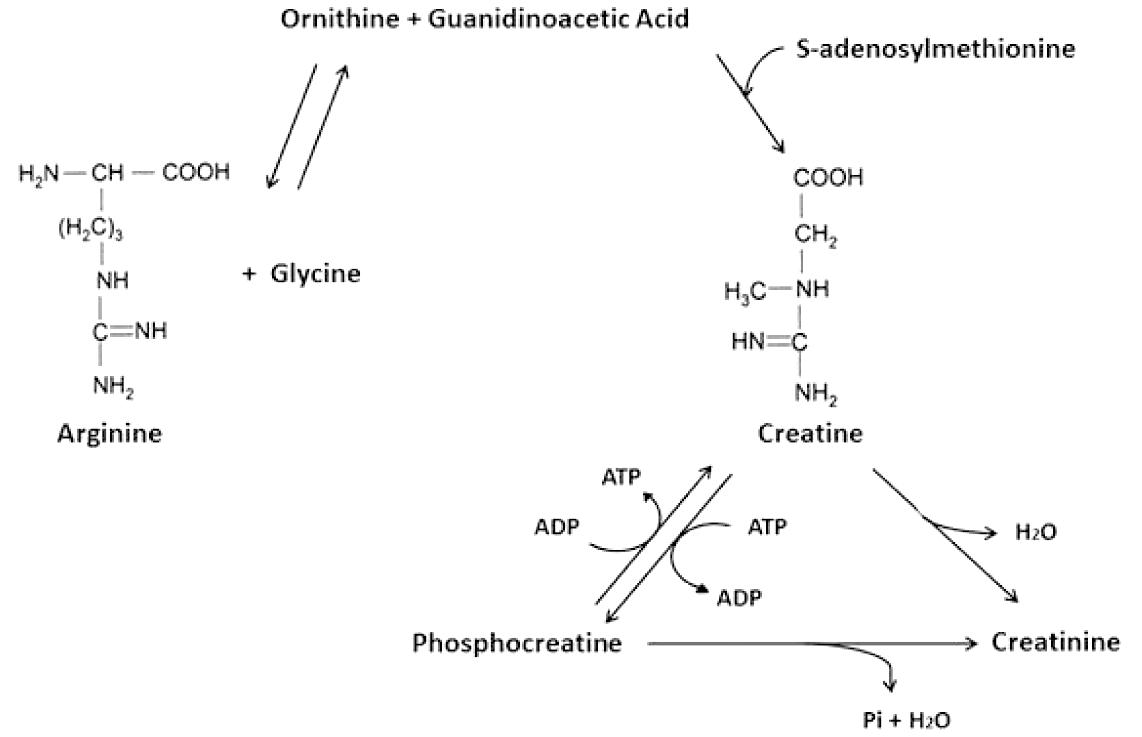
ADP:二磷酸腺苷;ATP:三磷酸腺苷
图1 肌酸代谢示意图
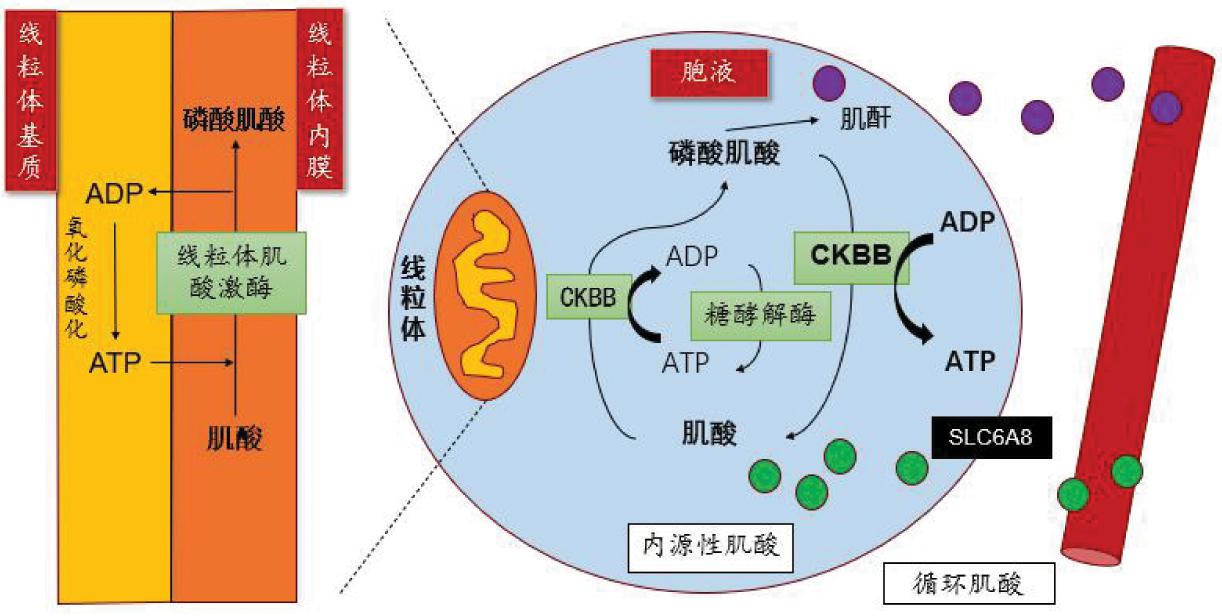
ADP:二磷酸腺苷;ATP:三磷酸腺苷;CKBB:脑型肌酸激酶
图2 肌酸激酶回路示意图
5.稳定脂质膜:磷酸肌酸与磷脂膜相互作用以稳定膜并防止膜透化[8]。事实上,以前的临床前研究已经记录了围产期缺氧事件后肌酸的神经保护作用,例如减少脑细胞死亡和脑梗塞,并改善行为功能[9]。有研究表明肌酸能显著改善海马氧-葡萄糖剥夺后 2 h蛋白质合成的恢复,带来更有利的组织学结果[10]。肌肉缺血后ROS的产生已被证明会扰乱Ca2+稳态并增加细胞内Ca2+水平,从而导致蛋白酶活性升高,增加收缩蛋白降解,肌酸可以通过帮助维持离子平衡和促进肌肉蛋白质合成来减弱这些作用。用肌酸预处理的小鼠在大脑中动脉闭塞后的再灌注期间表现出更快的脑血流恢复,提示肌酸可能改善脑血管功能。在脐带结扎(umbilical cord occlusion,UCO)之前动脉肌酸水平高的胎儿低氧血症较轻,脑丙酮酸、乳酸和 2-OH-TA水平较低[11]。急性缺氧之前进行肌酸治疗可能会改善线粒体结构完整性并可能增加有丝分裂发生和抗细胞凋亡途径的活性,但还需要在蛋白质水平评估有丝分裂关键标志物。肌酸治疗也对皮质灰质中UCO后苄氯素 1(BECN 1)信使核糖核酸(message ribonucleic acid,mRNA)表达有影响,阻止缺氧诱导的BECN 1下降。而BECN 1可清除受损的线粒体以提高细胞存活率,故肌酸介导BECN 1水平恢复可能有利于细胞存活[12]。
最近的一项研究表明补充肌酸可改善缺氧引起的胼胝体内星形胶质细胞增多症,但未发现其他明显的保护作用。不过研究者发现单独补充肌酸可诱导皮质灰质、纹状体和海马体中凋亡和炎症途径的转录变化,并有证据表明髓鞘形成增加[13]。这种肌酸效应值得进一步研究,如果向孕妇预防性给予肌酸成为一种现实的临床选择,那么了解补充肌酸对正常胎儿大脑发育的任何影响都至关重要。
三、孕期的肌酸代谢
随着妊娠期进展,肌酸稳态会发生适应性改变。怀孕棘鼠子宫内器官成熟的轨迹与人类相似,研究发现孕鼠血浆肌酸浓度从妊娠中期到晚期逐渐下降,肌酸水平显著低于非妊娠对照组。肌酸的尿排泄从妊娠中期开始逐渐减少,与对照组相比显著降低。母体心脏和骨骼肌组织观察到肌酸转运蛋白(SLC6A8)mRNA表达增加。相反,母体大脑和肝脏中的肌酸转运蛋白表达降低,以此来确保肌酸用于能量消耗可能很高的母体组织[14]。
孕妇血浆和尿肌酸的变化也有报道,怀孕期间血浆肌酸的标准范围为(35.6±15.15)μM,而非妊娠期正常范围为(54.8±21.0)μM,下降约35%[15]。与棘鼠不同,多项人体研究报告显示母体血浆肌酸水平虽然有所降低,但整个妊娠期较为稳定。总的来说,由于妊娠晚期胎儿的快速生长和代谢需求增加,母体肌酸的需求增加。
脑肌酸可通过质子或磷核磁共振波谱测定,宫内进行胎儿磁共振波谱的研究进一步支持肌酸代谢对胎儿大脑细胞生物能量学的重要性,该研究显示胎儿脑肌酸浓度在妊娠18至40周期间增加了1倍以上[16]。事实上,大脑同时拥有线粒体肌酸激酶和CKBB,并且通过肌酸激酶回路产生大量脑ATP。在海马体(颗粒细胞和锥体细胞)、小脑和脉络丛的特定细胞中发现了肌酸激酶亚型。表明这些细胞类型需要使用肌酸来维持ATP周转。此外,通过在神经元、少突胶质细胞和星形胶质细胞上表达肌酸转运蛋白,肌酸在细胞之间的转移成为可能。所以,目前肌酸激酶回路被认为在胚胎发育过程的能量稳态中发挥重要作用,尤其是中枢神经系统的发育。从神经发育的角度来看,肌酸代谢与树突和轴突的生长以及神经生长锥的迁移有关。在怀孕大鼠中完成的一项初步研究发现,在分娩前10 d向母体饮食补充1% 肌酸可使出生后的幼崽脑肌酸浓度增加约80%,同时改善后代在出生后前三周内海马角神经元的形态和电生理发育[17],并对后代成年期的突触可塑性有着永久影响[18]。
而母体循环肌酸浓度的变化是否影响其他不良围产期结局仍有待确定。在一项回顾性病例对照研究中,妊娠晚期母体血清肌酸浓度降低18%与围产期不良结局的发生率增加相关,包括小于胎龄儿、早产和进入新生儿重症监护室[19]。最近一项针对精氨酸∶甘氨酸氨基转移酶(arginine:glycine amidinotransferase,AGAT)缺乏症(无法合成肌酸)的妊娠女性的病例报告发现,妊娠中期的超声监测显示胎儿生长受限与患者血浆和尿液排泄的肌酸浓度下降相关,在将患者的膳食肌酸补充剂从2 g/d 增加到 3 g/d 后,于孕 35 周时分娩一健康婴儿,出生体重为2 450 g [正常胎龄儿第25百分位数],脑肌酸水平正常。婴儿在一岁时达到了典型的发育里程碑后停止随访[20]。
虽然孕期母体肌酸与子代结局之间已被证明存在一定的相关性,但仍需要进一步研究。由于膳食肌酸对维持循环肌酸水平和增强内源性合成能力具有重要的影响,因此女性饮食偏好和基础营养状况对于评估至关重要。
目前尚不清楚人类胎儿在妊娠的哪个阶段能够独立合成肌酸,但胎儿对肌酸的需求似乎在很大程度上取决于母体肌酸水平。有趣的是,研究表明,母体补充肌酸会影响啮齿动物后代神经元的形态和功能发育,增强整体神经元兴奋性并改善长时程增强作用[18]。然而关于影响未成熟大脑中肌酸水平升高的数据有限。研究补充肌酸可能改变胎儿大脑基础生物学过程的机制对于确定其在妊娠期和围产期使用的安全性非常重要。
四、肌酸的临床应用
人胎盘可以检测到AGAT、甘氨酸脒基转移酶(glycine amidinotransferase mitochondrial,GAMT)和SLC6A8 mRNA及蛋白,其中AGAT位于胎儿毛细血管的基质细胞和内皮细胞内。GAMT和SLC6A8染色定位于胎儿绒毛的合体滋养层。同时离体人胎盘可合成胍基乙酸和肌酸[21],证明了肌酸可在人胎盘进行生物合成及运输,即肌酸可通过胎盘转移。这是肌酸宫内干预胎儿脑损伤的优势,不需要侵入性手术,但仍需进一步评估临床可转化性。
虽然成人大脑通过血脑屏障摄取肌酸的速度相对较慢,但在发育中的大脑中,肌酸通过血脑屏障的转运能力可能较强。整个血脑屏障中肌酸转运蛋白表达存在年龄依赖性差异,因此,成人大脑中的大部分肌酸被认为是通过脑内合成获得的[22]。相比之下,胎儿期大脑在整个脉络丛和神经血管单元中表达更高水平的SLC6A8[23],似乎更依赖于外源性摄入肌酸。
此外,肌酸补充的持续时间可能决定脑肌酸负荷程度。研究表明,现有的肌酸推荐剂量可有效增加骨骼肌肌酸水平,但有效增加脑肌酸所需的推荐剂量仍然未知。或许需要更大和/或更持久的肌酸剂量来引起脑肌酸含量的增加,因此,确定增加脑肌酸含量的替代饮食策略是有意义的[24]。然而,产前长期补充肌酸是否会影响肌酸转运蛋白在胎儿血脑屏障、神经元和神经胶质上的分布和密度仍有待研究。目前仅有动物研究表明妊娠期补充肌酸的棘鼠后代具有正常的肌酸合成和运输途径[25]。
有研究表明即使脑肌酸含量没有增加,肌酸的神经保护作用依然存在。此时肌酸可能通过吸收到血管内皮和/或平滑肌细胞中来促进神经保护,从而改善HI期间和之后的脑血管功能。此外,脑血管功能、全身炎症和/或氧化应激途径的调节可能是肌酸在没有增加脑肌酸负荷的情况下促进神经保护的其他潜在机制。
肌酸补充剂的不良反应也是关注的重点,1990年代初期以来,文献中唯一报道一致的副作用是体重增加[26],并且与年龄、持续时间或给药途径无关。目前来看,在健康的成年女性中,肌酸补充剂具有良好的安全性[27]。
在HI期间或之后很快发生的细胞死亡机制与损伤数小时、数天甚至数周后发生的机制不同[28],所以肌酸的给药方案是可变的。但目前大多数获得改善了病理和/或功能结果的研究选择的是在HI之前开始干预[10,29]。围产期临床前研究的综合评估一致认为,肌酸在损伤诱导前给药具有神经保护作用,肌酸补充剂是胎儿缺氧的一种预防性治疗方法,但缺少相关的人群随机对照实验研究。因此,目前正在进行转化大型动物模型的临床前研究,以确定孕期母体膳食补充剂作为缺氧引起的胎儿脑损伤的预防策略的能力[30]。
有研究报告,成人大脑中肌酸摄取存在性别特异性差异[31]。同样的,临床前和临床研究报告了胎儿期脑病的严重程度和演变以及对治疗的反应的性别二态性[32-33]。但大部分的胎儿期研究并未关注性别差异。有限的数据表明男性胎儿HI后死亡率显著高于女性(P<0.01),并且补充肌酸对男性胎儿生存的益处更大[34]。研究表明仔鼠出生后第14天和第21天的旋转棒行为测试中,补充肌酸减轻了雄性小鼠而非雌性小鼠缺氧引起的运动限制[35]。总体而言,这些数据提出了在未来肌酸神经保护临床前研究中需要更加重视评估性别影响的必要性。
五、展望
胎儿脑损伤对胎儿及儿童期脑神经发育具有深远的影响,大多数胎儿脑损伤的确切时间很难判断,对于有危险因素的高危妊娠进行干预是减少新生儿脑损伤发生的措施之一。但中枢神经系统发育是一个漫长而复杂的过程,目前尚未确定保护胎儿大脑的最佳策略。由于营养干预可“塑造”发育中的大脑,具有良好安全性的膳食补充剂——肌酸,可能是一种有前景的神经保护剂。但仍需要进一步的随机对照实验评估肌酸对胎儿的神经保护作用,更好地了解肌酸给药的剂量、途径及怀孕期间起始干预和持续的时间,以最大限度提高保护效果。还应进行相关机制研究,了解其在中枢神经系统中的分布、生物利用度及分子靶点(目前尚不完全清楚)。期待未来能开发出胎儿早期脑损伤的有效治疗手段,减少新生儿严重并发症及新生儿死亡的发生。
1 Bordone MP,Salman MM,Titus HE,et al.The energetic brain—A review from students to students.J Neurochem,2019,151:139-165.
2 Goyal MS,Raichle ME.Glucose requirements of the developing human brain.J Pediatr Gastroenterol Nutr,2018,66 Suppl 3:S46-S49.
3 王来栓.围生期缺氧缺血性脑损伤的病理生理.河南医学研究,2000,9:190-192.
4 Muccini AM,Tran NT,de Guingand DL,et al.Creatine metabolism in female reproduction,pregnancy and newborn health.Nutrients,2021,13:490.
5 Umehara T,Kawai T,Goto M,et al.Creatine enhances the duration of sperm capacitation:a novel factor for improving in vitro fertilization with small numbers of sperm.Hum Reprod,2018,33:1117-1129.
6 Ireland Z,Castillo-Melendez M,Dickinson H,et al.A maternal diet supplemented with creatine from mid-pregnancy protects the newborn spiny mouse brain from birth hypoxia.Neuroscience,2011,194:372-379.
7 Koga Y,Takahashi H,Oikawa D,et al.Brain creatine functions to attenuate acute stress responses through GABAnergic system in chicks.Neuroscience,2005,132:65-71.
8 Tokarska-Schlattner M,Epand RF,Meiler F,et al.Phosphocreatine interacts with phospholipids,affects membrane properties and exerts membrane-protective effects.PLoS One,2012,7:e43178.
9 Tran NT,Kelly SB,Snow RJ,et al.Assessing creatine supplementation for neuroprotection against perinatal hypoxic-ischaemic encephalopathy:A systematic review of perinatal and adult pre-clinical studies.Cells,2021,10:2902.
10 Berger R,Middelanis J,Vaihinger HM,et al.Creatine protects the immature brain from hypoxic-ischemic injury.J Soc Gynecol Investig,2004,11:9-15.
11 Tran NT,Kowalski GM,Muccini AM,et al.Creatine supplementation reduces the cerebral oxidative and metabolic stress responses to acute in utero hypoxia in the late-gestation fetal sheep.J Physiol,2022,600:3193-3210.
12 Muccini AM,Tran NT,Hale N,et al.The effects of in utero fetal hypoxia and creatine treatment on mitochondrial function in the late gestation fetal sheep brain.Oxid Med Cell Longev,2022,2022:3255296.
13 Tran NT,Muccini AM,Hale N,et al.Creatine in the fetal brain:A regional investigation of acute global hypoxia and creatine supplementation in a translational fetal sheep model.Front Cell Neurosci,2023,17:1154772.
14 Ellery S.J.,LaRosa D.A.,Kett M.M.,et al.Maternal creatine homeostasis is altered during gestation in the spiny mouse:Is this a metabolic adaptation to pregnancy? BMC Pregnancy Childbirth.2015;15:92.
15 Bahado-Singh RO,Akolekar R,Chelliah A,et al.Metabolomic analysis for first-trimester trisomy 18 detection.Am J Obstet Gynecol,2013,209:65.e1-9.
16 Evangelou IE,du Plessis AJ,Vezina G,et al.Elucidating metabolic maturation in the healthy fetal brain using 1H-MR spectroscopy.AJNR Am J Neuroradiol,2016,37:360-366.
17 Sartini S,Lattanzi D,Ambrogini P,et al.Maternal creatine supplementation affects the morpho-functional development of hippocampal neurons in rat offspring.Neuroscience,2016,312:120-129.
18 Sartini S,Lattanzi D,Di Palma M,et al.Maternal creatine supplementation positively affects male rat hippocampal synaptic plasticity in adult offspring.Nutrients,2019,11:2014.
19 Heazell AE,Bernatavicius G,Warrander L,et al.A metabolomic approach identifies differences in maternal serum in third trimester pregnancies that end in poor perinatal outcome.Reprod Sci,2012,19:863-875.
20 Alessandrì MG,Strigini F,Cioni G,et al.Increased creatine demand during pregnancy in arginine:glycine amidino-transferase deficiency:a case report.BMC Pregnancy Childbirth,2020,20:506.
21 Ellery SJ,Della Gatta PA,Bruce CR,et al.Creatine biosynthesis and transport by the term human placenta.Placenta,2017,52:86-93.
22 Braissant O,Henry H,Loup M,et al.Endogenous synthesis and transport of creatine in the rat brain:An in situ hybridization study.Brain Res Mol.Brain Res,2001,86:193-201.
23 Braissant O,Henry H,Villard AM,et al.Creatine synthesis and transport during rat embryogenesis:Spatiotemporal expression of AGAT,GAMT and CT1.BMC Dev Biol,2005,5:9.
24 Dolan E,Gualano B,Rawson ES.Beyond muscle:the effects of creatine supplementation on brain creatine,cognitive processing,and traumatic brain injury.Eur J Sport Sci,2019,19:1-14.
25 Dickinson H,Ireland ZJ,Larosa DA,et al.Maternal dietary creatine supplementation does not alter the capacity for creatine synthesis in the newborn spiny mouse.Reprod Sci,2013,20:1096-1020.
26 Kreider RB,Kalman DS,Antonio J,et al.International society of sports nutrition position stand:safety and efficacy of creatine supplementation in exercise,sport,and medicine.J Int Soc Sports Nutr,2017,14:18.
27 de Guingand DL,Palmer KR,Snow RJ,et al.Risk of adverse outcomes in females taking oral creatine monohydrate:a systematic review and meta-analysis.Nutrients,2020,12:1780.
28 Pang R,Advic-Belltheus A,Meehan C,et al.Melatonin for neonatal encephalopathy:from bench to bedside.Int J Mol Sci,2021,22:5481.
29 Muccini AM,Tran NT,Hale N,et al.The Effects of in utero fetal hypoxia and creatine treatment on mitochondrial function in the late gestation fetal sheep brain.Oxid Med Cell Longev,2022,2022:3255296.
30 Steinbach RJ,Ellery SJ,Snow RJ,et al.T-082 a non-human primate model of hypoxic ischemic encephalopathy to evaluate novel translational therapeutics.Reproductive sciences,2020:27.
31 Kanekar S,Ettaro R,Hoffman MD,et al.Sex-based impact of creatine supplementation on depressive symptoms,brain serotonin and SSRI efficacy in an animal model of treatment-resistant depression.Int J Mol Sci,2021,22:8195.
32 Bennet L,Galinsky R,Draghi V,et al.Time and sex dependent effects of magnesium sulphate on post-asphyxial seizures in preterm fetal sheep.J Physiol,2018,596:6079-6092.
33 Galinsky R,Dhillon SK,Lear CA,et al.Magnesium sulfate and sex differences in cardiovascular and neural adaptations during normoxia and asphyxia in preterm fetal sheep.Am J Physiol Regul Integr Comp Physiol,2018,315:R205-R217.
34 Ireland Z,Castillo-Melendez M,Dickinson H,et al.A maternal diet supplemented with creatine from mid-pregnancy protects the newborn spiny mouse brain from birth hypoxia.Neuroscience,2011,194:372-379.
35 LaRosa DA,Ellery SJ,Snow RJ,et al.Maternal creatine supplementation during pregnancy prevents acute and long-term deficits in skeletal muscle after birth asphyxia:a study of structure and function of hind limb muscle in the spiny mouse.Pediatr Res,2016,80:852-860.