·论著·
孕期15种在用农药暴露与神经管缺陷的关联
程千慧 刘菊芬 靳蕾 李智文 任爱国 王琳琳
【摘要】 目的 探索母体胎盘组织中15种在用农药(CUPs)与胎儿神经管缺陷(NTDs)发生风险的关联。 方法 采用病例-对照研究方法,选取308例对照和150例NTDs病例母亲作为研究对象,使用液相色谱-质谱联用技术检测母体胎盘组织中的15种在用农药的浓度,同时采用多因素Logistic回归和加权分位数之和(WQS)回归探讨胎盘的在用农药水平与NTDs发生风险的关联,采用问卷调查收集孕妇孕期农药接触和饮食习惯等信息。 结果 本研究人群中15种在用农药总检出率为89.7%。多因素Logistic回归显示,高水平氟吗啉组(OR=2.58,95%CI:1.10~5.90)NTDs的发生风险显著升高,高水平吡唑醚菌酯组(OR=0.28,95%CI:0.08~0.86)和吡虫啉组(OR=0.38,95%CI:0.15~0.90)NTDs的发生风险显著降低,但经Bonferroni校正后上述关联不再具有统计学意义。WQS回归未显示胎盘中15种在用农药混合物对胎儿NTDs发生风险存在显著的联合暴露效应(OR=0.69,95%CI:0.14~3.45)。 结论 本研究人群孕期在用农药暴露十分普遍,但未发现胎盘组织中15种在用农药浓度与胎儿NTDs发生风险存在统计学关联。
【关键词】 孕妇; 胎盘; 在用农药; 神经管缺陷
【中图分类号】 R17
基金项目:国家社科基金重大项目(21&ZD187);国家重点研发计划(2022YFC2705205,2021YFC2701101)
作者单位:100191,北京大学生育健康研究所/国家卫生健康委员会生育健康重点实验室,北京大学公共卫生学院流行病与卫生统计学系
通信作者:王琳琳(linlinwang@bjmu.edu.cn)
Association between exposure to 15 current used pesticides during pregnancy and neural tube defects
CHENG Qianhui, LIU Jufen, JIN Lei, LI Zhiwen, REN Aiguo, WANG Linlin. Institute of Reproductive and Child Health/National Health Commission Key Laboratory of Reproductive Health, Department of Epidemiology and Biostatistics, School of Public Health, Peking University, Beijing 100191, China
[Abstract] Objective To explore the association between 15 current used pesticides (CUPs) in maternal placenta and the risk of fetal neural tube defects (NTDs). Methods A case-control study was conducted among mothers of 308 controls and 150 NTD cases. Concentrations of 15 CUPs in placental tissues were measured by liquid chromatography-mass spectrometry. Multivariate logistic regression and weighted quantile sum (WQS) regression were used to explore the association between placental CUPs and the risk of NTDs. Questionnaire survey was used to collect information on maternal pesticide active exposure history and dietary habits during pregnancy. Results The overall detection rate of 15 CUPs was 89.7% in this study. Multivariate logistic regression showed that high level of flumorph (OR=2.58, 95%CI[1.10-5.90]) was significantly associated with a higher risk of NTDs, and high levels of pyraclostrobin (OR=0.28, 95%CI[0.08-0.86]) and imidacloprid (OR=0.38, 95%CI[0.15-0.90]) were significantly associated with lower risk of NTDs, but the associations were no longer significant after Bonferroni correction. WQS regression did not show any significant combined exposure effect of CUP mixtures on the risk of fetal NTDs (OR=0.69, 95%CI[0.14-3.45]). Conclusion Exposure to CUPs during pregnancy was quite common in this study, but no statistical association was found between placental CUPs and the risk of fetal NTDs.
[Key words] pregnant women; placenta; current used pesticides; neural tube defects
神经管缺陷(neural tube defects,NTDs)是一种致残致死率较高的出生缺陷,是在胚胎发育早期平直神经板无法正常闭合而引起的一组先天性发育畸形,主要包括无脑畸形、脊柱裂和脑膨出[1]。据报道,NTDs全球患病率约为10/万,且在不同国家和地区的患病率有所不同[2]。中国是NTDs高发的国家之一,2014年NTDs总发生率高达31.5/万[3]。NTDs的病因复杂,尚未完全清楚,现有的研究普遍认为,NTDs的发生受遗传因素和环境因素的共同影响[4]。在环境因素方面,孕期农药暴露与NTDs的关系越来越受到人们的关注,有研究认为有机氯农药等一些传统化学农药可能导致子代发生NTDs[5]。然而,由于具有很强的生物蓄积性和毒性,以及对生态环境和人体健康的严重威胁,这些传统化学农药已陆续被各国禁用。目前中国仍在使用的农药即在用农药(current used pesticides,CUPs)作为有机氯农药的替代品[6],主要包括氨基甲酸酯类、拟除虫菊酯类、新烟碱类、甲氧基丙烯酸酯类等,被认为活性高且对环境影响相对较小,广泛用于农业生产实践。然而,由于乱用和滥用,多种在用农药在环境介质和人体中被广泛检出,并被列入新兴污染物(emerging contaminants,ECs)的范畴[7-9],可能对人体健康造成潜在危害。查阅文献,仅发现三项基于农药使用登记和地理信息系统的孕期在用农药外暴露与胎儿NTDs发生风险的研究,这些研究无法准确反映胎儿宫内在用农药暴露的真实水平[10-12]。有证据表明,农药可以穿过胎盘到达胎儿体内,并可在胎盘中蓄积,因此胎盘组织农药浓度被认为是代表环境农药宫内暴露的理想生物标志物[5]。因此,本研究在308例对照和150例NTDs母亲中开展病例对照研究,检测母体胎盘组织中15种常用的在用农药水平,探讨孕期在用农药暴露与胎儿NTDs发生风险的关联。
对象与方法
一、研究对象
本研究基于课题组前期在山西省6个县/市(太谷、平定、昔阳、寿阳、泽州和长治)开展的病例-对照研究[5,13],纳入了其中2003—2016年募集的150例NTDs病例和308例健康对照。具体纳入排除标准如下。
纳入标准:病例为产前超声诊断引产或出生时发现的NTDs患儿。对照为产前超声检查及出生时未发现畸形的胎儿或新生儿;对照母亲居住地与病例母亲相同(同省),母亲末次月经日期尽量与病例母亲相近(±4周)。排除标准:调查问卷关键信息缺失者或者无可用胎盘组织(胎盘湿重<6.0 g)者。
二、研究方法
1.样本量计算:本研究共纳入符合条件的458名研究对象,包括150例NTDs病例和308例对照。由于目前缺乏胎盘在用农药浓度的报道,本研究参考课题组前期在同一人群内进行的胎盘组织内有机氯农药与胎儿NTDs发生风险关系的研究,NTDs病例组和对照组胎盘组织内op′-DDE浓度中位数(四分位间距)分别为0.95(0.70~1.8)ng/g和0.72(0.53~1.0)ng/g[5]。假设胎盘组织内在用农药水平与op′-DDE水平相同,运用PASS 15软件Mann-Whitney-Wilcoxon Tests(Simulation)模块分析,标准差估计为0.5倍中位数,α=0.05,按照样本量为150例NTDs病例和308例对照,计算得统计功效为99.8%,满足统计学要求。
2.标本采集:NTDs病例组和对照组母亲在终止妊娠或分娩时由产科医生立即收集其胎盘组织,并将胎盘组织放置在-20℃冰箱中保存。后由项目组人员定期转运至实验室并置于-30℃冰箱中以备后续检测,运送过程全程干冰以保持低温条件。
3. 信息采集:采用结构化问卷收集研究对象一般信息,包括孕妇围孕期(怀孕前3个月~怀孕后3个月)农药接触情况,孕周,怀孕年龄等社会人口学信息。本研究已通过北京大学生物医学伦理委员会的伦理审查。所有研究对象均经知情同意并签署书面知情同意书。
4. 胎盘组织在用农药检测:参考已报道的环境农药残留情况及根据本实验室建立的方法可用性[14-15],本研究最终选择了15种在用农药为本实验的目标化合物,具体名称及类别见表1。
表1 胎盘组织15种在用农药检出率及浓度(%)
Table 1 The concentrations and detection frequencies (%) of placental CUPs
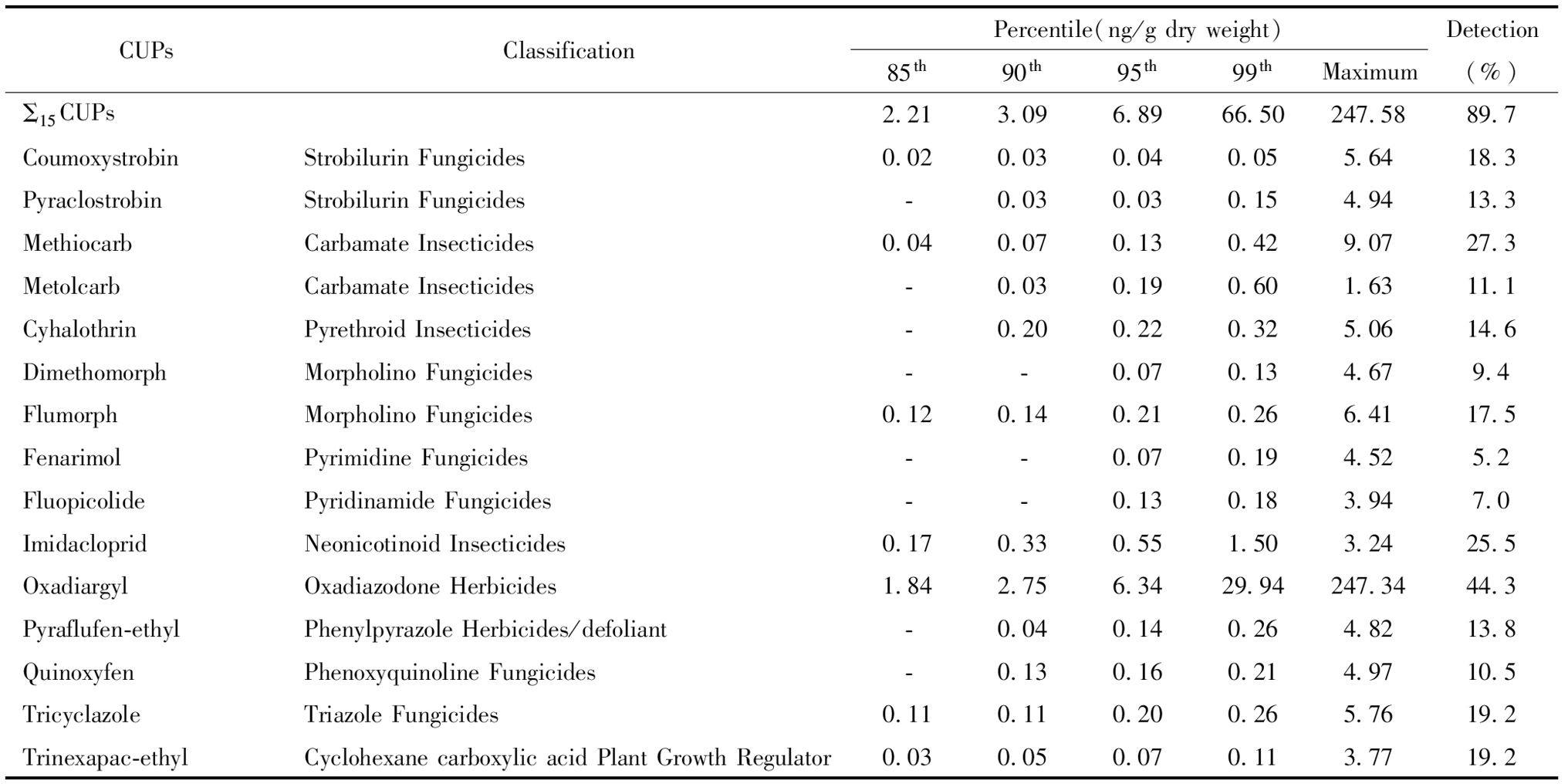
CUPsClassificationPercentile(ng/g dry weight)85th90th95th99thMaximumDetection(%)Σ15CUPs2.213.096.8966.50247.5889.7CoumoxystrobinStrobilurin Fungicides0.020.030.040.055.6418.3PyraclostrobinStrobilurin Fungicides-0.030.030.154.9413.3MethiocarbCarbamate Insecticides0.040.070.130.429.0727.3MetolcarbCarbamate Insecticides-0.030.190.601.6311.1CyhalothrinPyrethroid Insecticides-0.200.220.325.0614.6DimethomorphMorpholino Fungicides--0.070.134.679.4FlumorphMorpholino Fungicides0.120.140.210.266.4117.5FenarimolPyrimidine Fungicides--0.070.194.525.2FluopicolidePyridinamide Fungicides--0.130.183.947.0ImidaclopridNeonicotinoid Insecticides0.170.330.551.503.2425.5OxadiargylOxadiazodone Herbicides1.842.756.3429.94247.3444.3Pyraflufen-ethylPhenylpyrazole Herbicides/defoliant-0.040.140.264.8213.8QuinoxyfenPhenoxyquinoline Fungicides-0.130.160.214.9710.5TricyclazoleTriazole Fungicides0.110.110.200.265.7619.2Trinexapac-ethylCyclohexane carboxylic acid Plant Growth Regu-lator0.030.050.070.113.7719.2
“-”Values below the limits of detection(LODs), i.e., not detected.
本研究使用液相色谱-串联质谱联用仪(LC-MS,Agilent 6495 Triple Quadrupole)测定胎盘组织中15种在用农药,样本前处理步骤参考Oliveira等人的方法[16],并有所改动。在1.0 g冻干胎盘样品中加入5 mL超纯水和10 mL酸化乙腈,搅拌后加入无水硫酸镁4.0 g、乙酸钠1.0 g并超声浴,然后将样本离心后冷冻过夜。向有机层中加入1 350 mg无水硫酸镁、450 mg PSA和450 mg C18。振荡离心后,转移上清液并蒸发至接近干燥,复溶后进行LC-MS分析。
质量控制:各农药标准曲线的相关系数(R2)为0.992~0.999。检出限(LODs)的范围为0.01~0.04 ng/g,定量限(LOQs)的范围为0.03~0.12 ng/g。15种在用农药在胎盘组织中的回收率为52.6%~80.9%。使用质谱级甲醇和无目标物检出的空白胎盘样本做两个平行空白样品,在同一进样批次中,每隔20个样本插入两个平行空白样品。同时,采用中间浓度的系列标准混合溶液作为质控样品,每隔20个样本插入一个质控,观察仪器保留时间是否漂移及观察不同批次间检测误差。对于胎盘农药检测结果的异常值,查阅其离子流色谱图峰面积积分并手动带入标准曲线重新进行计算。
5. 统计学分析:采用Pearson χ2检验或Fisher精确检验比较NTDs病例组和对照组母亲的一般特征。胎盘农药浓度以ng/g胎盘干重表示,将低于检出限LODs的浓度以0替代用于计算总浓度、中位数等;低于LODs的浓度以LODs/2值替代用于分析胎盘各化合物浓度与NTDs发生的相关性。采用最大值和特定百分位数描述胎盘农药浓度分布,并采用Mann-Whitney U检验比较两组间浓度分布。目前尚无人胎盘组织中在用农药暴露水平的划分依据,考虑到胎盘农药与胎粪中在用农药类似,均可反映孕期在用农药长期暴露水平,因此本研究参考Haraux等人[17]胎粪中在用农药暴露水平的划分方法,对胎盘组织在用农药的暴露水平进行划分,即当某种农药检出率<50%时,低于LOD为“低浓度”,≥LOD为“高浓度”。当检出率在50%~70%时,低于LOD为“低浓度”,高于LOD但低于中位数为“中浓度”,高于中位数为“高浓度”。当检出率>70%时,以全部研究对象胎盘组织中浓度的三分位数为界值,将农药暴露水平划分为低浓度、中浓度和高浓度。
采用非条件Logistic回归模型,分别分析胎盘组织中各单一在用农药及15种农药浓度总和(Σ15CUPs)与胎儿发生NTDs风险的关系。由于NTDs病例组和对照组母亲在孕周、孕早期高热或感冒、被动吸烟和围孕期叶酸增补方面存在统计学差异,因此本研究将以上四个变量作为模型调整的混杂因素。考虑到人体往往同时暴露于环境中的多种污染物,因此进一步采用加权分位数之和(weighted quantile sum,WQS)[18]回归模型评估孕期在用农药混合物联合暴露对胎儿NTDs发生风险的影响。在本研究中,将log转换后的15种在用农药浓度值转化为有序四分类变量(q=4)。考虑到本研究样本量若拆分为训练集和验证集则各组样本数较少,因此模型将基于完整的数据集建立(validation=0)。此外,将β1设置为无约束正系数(b1_pos=T,b1_constr=F),进行100次bootstrap计算(b=100),方程协变量与非条件Logistic回归模型的协变量一致。
采用优势比(OR)和95%可信区间(95%CI)表示关联强度。WQS分析使用R软件(4.1.2版本,R Development Core Team)中的gWQS包(3.0.4版本)进行,使用SPSS 25.0软件进行其余分析。统计分析均采用双侧检验。由于存在15种物质的多重假设检验,因此在Mann-Whitney U检验和非条件Logistic回归中使用Bonferroni法校正显著性水平,即α=0.003(0.05/15=0.003),当P<0.003时为差异有统计学意义。其余统计分析α=0.05。
结 果
一、研究对象特征
本研究共纳入308名对照和150名NTDs病例。其中,NTDs病例包括22例活产NTDs患儿(14.7%),68例产前诊断引产的NTDs患儿(45.3%),9例死胎死产的NTDs患儿(6.0%),51例NTDs由于现场工作人员未记录等原因,缺失妊娠结局信息(34.0%)。活产、引产和死胎死产NTDs患儿的孕周中位数分别为39周、24周和31周。病例组和对照组研究对象的基本特征见表2。与对照组相比,NTDs组母亲的孕周更短,有孕早期感冒或高热史及孕早期被动吸烟的比例更高,且NTDs组母亲围孕期叶酸增补的比例更低。以上特征在两组间的差异均有统计学意义(P<0.05)。在其他社会人口学特征方面,NTDs病例组和对照组之间无统计学差异。
表2 研究对象的一般特征 [例(%)]
Table 2 Characteristics of the study participants [n(%)]

CharacteristicsTotal(n=458)n(%)Controls(n=308)n(%)NTDs(n=150)n(%)Paritya 030(6.6)19(6.2)11(7.3) 1218(47.6)141(45.8)77(51.3) ≥2199(43.4)142(46.1)57(38.0)BMI(kg/m2)a <18.533(7.2)26(8.4) 7(4.7) 18.5-23.9256(55.9)178(57.8)78(52.0) ≥24157(34.3)97(31.5)60(40.0)Gestational age at delivery/pregnancy termination(week)b* <2887(19.0) 4(1.3)83(55.3) 28-3652(11.4) 9(2.9)43(28.7) ≥37319(69.7)295(95.8)24(16.0)Maternal age(year)a <25185(40.4)123(39.9)62(41.3) 25-29137(29.9)96(31.2)41(27.3) 30-3491(19.9)63(20.5)28(18.7) ≥3540(8.7)23(7.5)17(11.3)Maternal occupationa Farmer345(75.3)229(74.4)116(77.3) Other108(23.6)76(24.7)32(21.3)Maternal educationa Primary or lower31(6.8)17(5.5)14(9.3) Junior high294(64.2)194(63.0)100(66.7) High school or above131(28.6)96(31.2)35(23.3)History of birth defectsa No445(97.2)299(97.1)146(97.3) Yes 5(1.1) 3(1.0) 2(1.3)Fever or flu during early pregnancya* No351(76.6)260(84.4)91(60.7) Yes97(21.2)42(13.6)55(36.7)Intake of folic acid supplementsa* No229(50.0)140(45.5)89(59.3) Yes216(47.2)157(51.0)59(39.3)Maternal active smokinga No451(98.5)303(98.4)148(98.7) Yes 6(1.3) 4(1.3) 2(1.3)Maternal passive smokin-ga* No244(53.3)193(62.7)51(34.0) Yes200(43.7)107(34.7)93(62.0)Maternal drinkinga No415(90.6)284(92.2)131(87.3) Yes40(8.7)22(7.1)18(12.0)Infant gendera Male202(44.1)137(44.5)65(43.3) Female233(50.9)158(51.3)75(50.0)
BMI, body mass index; a Values may not equal to the total number because of missing or unknown data; b Pearson′s chi-square test for this variable, and Fisher′s exact test for others; *P<0.05.
二、胎盘组织在用农药检出情况
本研究纳入的15种在用农药的总检出率为89.7%,单一农药的检出率为5.2%到44.3%不等。大多数农药的检出浓度最大值低于10 ng/g胎盘干重,而丙炔噁草酮的检出浓度最大值达到了247.34 ng/g胎盘干重。15种在用农药浓度总和(Σ15CUPs)的最大值为247.58 ng/g胎盘干重。胎盘组织中15种在用农药的具体百分位浓度、最大浓度(ng/g胎盘干重)和检出率(%)见表1。
三、胎盘组织在用农药浓度的组间比较及与孕周的关系
Σ15CUPs在对照组和NTDs组、NTDs主要亚型组(无脑畸形,脊柱裂)的中位浓度比较见表3。Σ15CUPs的浓度在对照组和NTDs病例组或NTDs主要亚型组间均未发现统计学差异。其他NTDs亚型如脑膨出等由于样本量过小(共15例)未参与分析。
表3 病例组和对照组胎盘组织中在用农药浓度比较,中位数(P25-P75)
Table 3 Comparison of placental CUP concentrations between NTDs and controls, Median(P25-P75)

CUPs(ng/g)Controls(n=308)Total NTDs(n=150)Anencephaly(n=53)Spina bifida(n=82)Σ15CUPs0.56(0.13-1.42)0.42(0.17-1.40)0.38(0.15-1.58)0.42(0.17-1.19)
The Mann-Whitney U test was conducted, with a significance level of α set at 0.003 following Bonferroni correction.
考虑到胎盘组织中的污染物浓度可能随孕周变化,孕周可能会对胎盘组织在用农药水平与NTDs发生风险的关系产生混杂作用。因此,本研究使用Spearman相关分析胎盘组织Σ15CUPs水平与孕周的相关性。结果显示胎盘组织Σ15CUPs水平与孕周不存在统计学相关性(Spearman′s r=-0.020,P=0.664)。
四、胎盘组织在用农药与NTDs发生风险的关联
首先采用非条件Logistic回归模型,分别分析胎盘组织中各单一在用农药及15种农药浓度总和(Σ15CUPs)与胎儿发生NTDs风险的关系,结果见表4。调整了混杂因素孕周、孕早期感冒或高热、被动吸烟和围孕期叶酸增补后,与低浓度组相比,氟吗啉高浓度组(aOR=2.58,95%CI:1.10~5.90)与更高的NTDs发生风险存在统计学关联,吡唑醚菌酯(aOR=0.28,95%CI:0.08~0.86)和吡虫啉(aOR=0.38,95%CI:0.15~0.90)高浓度组与更低的NTDs发生风险存在统计学关联。但经Bonferroni法多重校正后,上述关联不再具有统计学意义。未发现胎盘组织中Σ15CUPs及其他单一在用农药暴露与NTDs发生风险之间存在统计学关联。
表4 胎盘组织中在用农药水平与NTDs发生风险的关联
Table 4 Association between placental CUPs and NTD risk
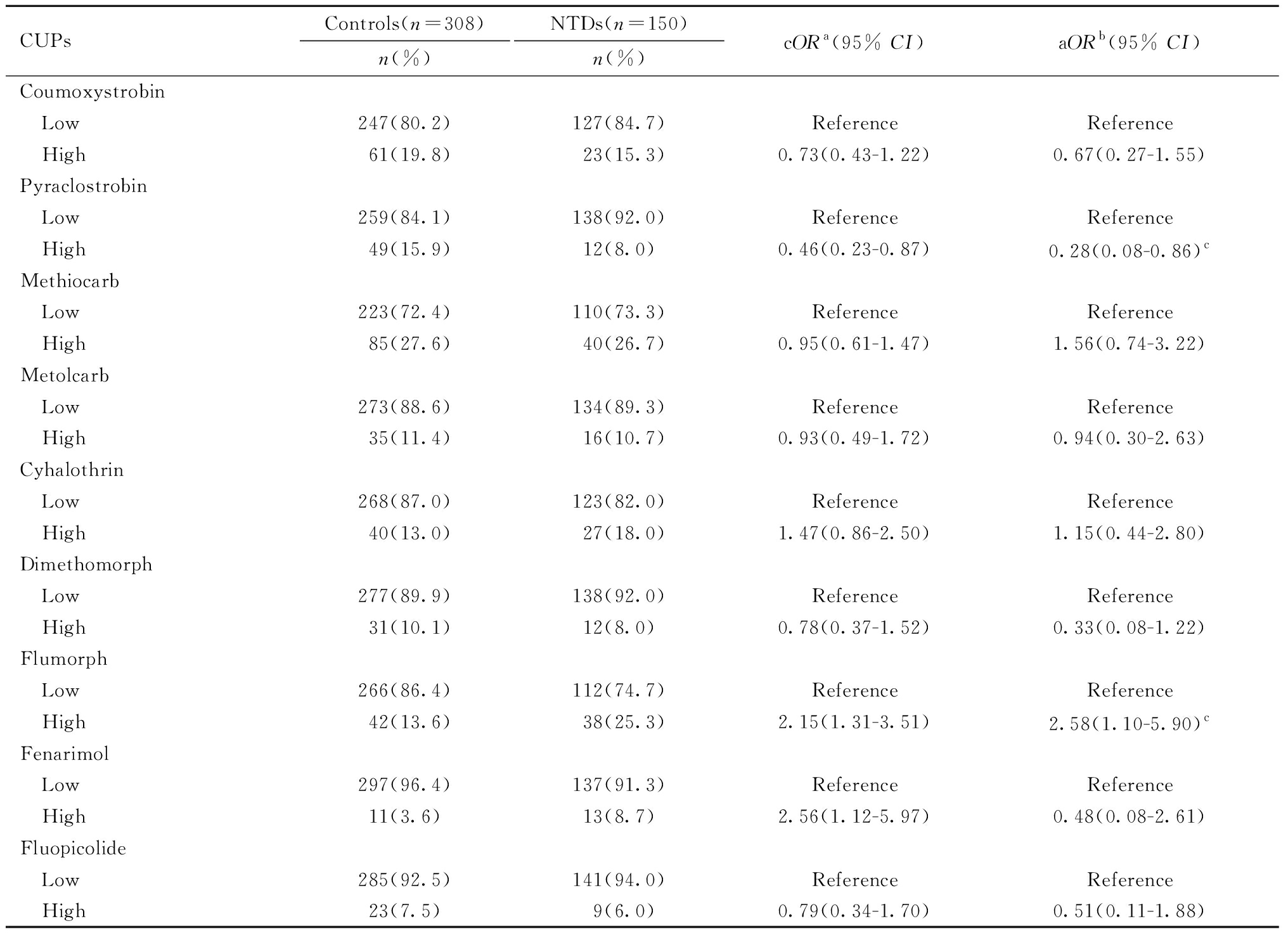
CUPsControls(n=308)n(%)NTDs(n=150)n(%)cORa(95% CI)aORb(95% CI)Coumoxystrobin Low247(80.2)127(84.7)ReferenceReference High61(19.8)23(15.3)0.73(0.43-1.22)0.67(0.27-1.55)Pyraclostrobin Low259(84.1)138(92.0)ReferenceReference High49(15.9)12(8.0)0.46(0.23-0.87)0.28(0.08-0.86)cMethiocarb Low223(72.4)110(73.3)ReferenceReference High85(27.6)40(26.7)0.95(0.61-1.47)1.56(0.74-3.22)Metolcarb Low273(88.6)134(89.3)ReferenceReference High35(11.4)16(10.7)0.93(0.49-1.72)0.94(0.30-2.63)Cyhalothrin Low268(87.0)123(82.0)ReferenceReference High40(13.0)27(18.0)1.47(0.86-2.50)1.15(0.44-2.80)Dimethomorph Low277(89.9)138(92.0)ReferenceReference High31(10.1)12(8.0)0.78(0.37-1.52)0.33(0.08-1.22)Flumorph Low266(86.4)112(74.7)ReferenceReference High42(13.6)38(25.3)2.15(1.31-3.51)2.58(1.10-5.90)cFenarimol Low297(96.4)137(91.3)ReferenceReference High11(3.6)13(8.7)2.56(1.12-5.97)0.48(0.08-2.61)Fluopicolide Low285(92.5)141(94.0)ReferenceReference High23(7.5)9(6.0)0.79(0.34-1.70)0.51(0.11-1.88)
表4(续)
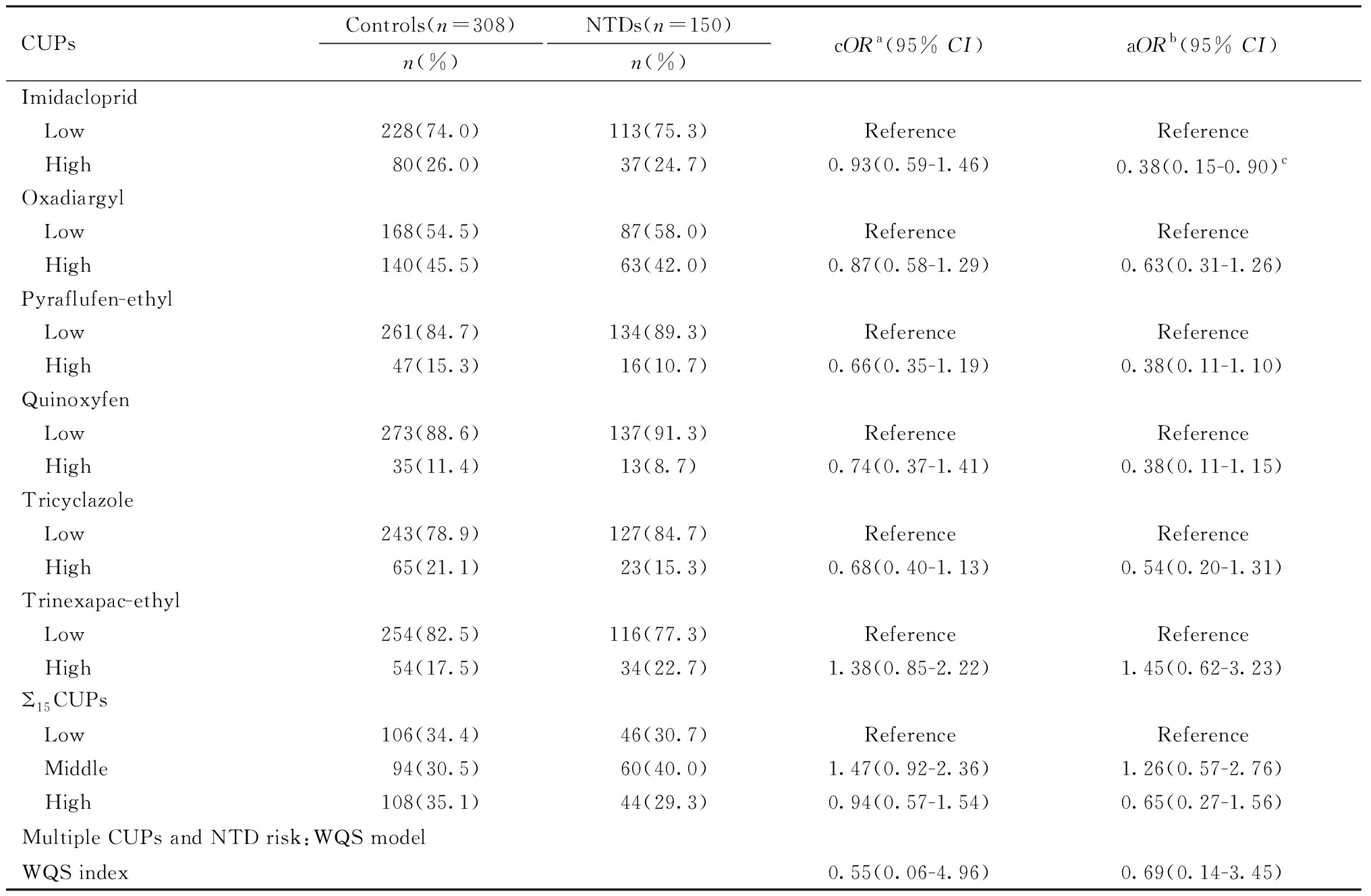
CUPsControls(n=308)n(%)NTDs(n=150)n(%)cORa(95% CI)aORb(95% CI)Imidacloprid Low228(74.0)113(75.3)ReferenceReference High80(26.0)37(24.7)0.93(0.59-1.46)0.38(0.15-0.90)cOxadiargyl Low168(54.5)87(58.0)ReferenceReference High140(45.5)63(42.0)0.87(0.58-1.29)0.63(0.31-1.26)Pyraflufen-ethyl Low261(84.7)134(89.3)ReferenceReference High47(15.3)16(10.7)0.66(0.35-1.19)0.38(0.11-1.10)Quinoxyfen Low273(88.6)137(91.3)ReferenceReference High35(11.4)13(8.7)0.74(0.37-1.41)0.38(0.11-1.15)Tricyclazole Low243(78.9)127(84.7)ReferenceReference High65(21.1)23(15.3)0.68(0.40-1.13)0.54(0.20-1.31)Trinexapac-ethyl Low254(82.5)116(77.3)ReferenceReference High54(17.5)34(22.7)1.38(0.85-2.22)1.45(0.62-3.23)Σ15CUPs Low106(34.4)46(30.7)ReferenceReference Middle94(30.5)60(40.0)1.47(0.92-2.36)1.26(0.57-2.76) High108(35.1)44(29.3)0.94(0.57-1.54)0.65(0.27-1.56)Multiple CUPs and NTD risk:WQS modelWQS index0.55(0.06-4.96)0.69(0.14-3.45)
a The OR unadjusted for confounding factors; b Adjusted for gestational age, fever or flu during early pregnancy, maternal passive smoking and intake of folic acid supplements; c Not statistically significant after adjustment for multiple comparisons using the Bonferroni correction.
本研究进一步采用WQS模型,计算出代表15种在用农药混合物负荷的加权线性指数(WQS指数)并分析其与NTDs发生风险的关联,结果见表4。WQS指数与NTDs发生风险未见统计学关联(aOR=0.69,95%CI:0.14~3.45),即未发现15种在用农药混合物同时暴露对NTDs的发生风险存在显著的联合效应。另外,本研究基于WQS模型计算出在用农药混合物中每种农药的相应权重以代表特定农药对WQS指数的贡献程度,结果见表5,其中速灭威和甲硫威在农药混合物中的权重最大,权重分别为0.48和0.30。
表5 在用农药混合物中每种农药的权重
Table 5 The weight of each pesticide in the mixture of CUPs

CUPsWeightsaMetolcarb0.48Methiocarb0.30Oxadiargyl0.05Dimethomorph0.02Fenarimol0.02Tricyclazole0.02
a The remaining nine CUPs were not listed because their weights were all less than 0.01.
五、叶酸服用情况及不同年份分层分析
由于病例组和对照组在围产期叶酸补充方面存在显著性差异,且有证据表明叶酸可能影响环境化学物质在体内的代谢转化[19],因此根据是否围孕期服用叶酸补充剂进行分层分析。此外,本研究时间跨度较长(2003—2016年),中国原农业部曾于2010年发布《关于进一步加强农药管理工作的意见》[20],加强农药滥用监管,推荐高效、低毒、低残留农药,因此在用农药种类在此期间可能有所改变,因此本研究以2010年为截断年份进行分层分析,结果见表6。是否服用叶酸、样本采集年份与Σ15CUPs暴露水平对NTDs发生风险的交互作用均无统计学意义,在叶酸服用者和非服用者中,以及不同年份采集的样本中均未发现胎盘在用农药与NTDs风险之间存在显著关联。分层后各亚组样本量较小,故未进行分层WQS回归分析。
表6 胎盘组织中在用农药水平与NTDs发生风险的关联:叶酸补充及样本采集年份分层分析
Table 6 Association between placental CUPs and NTD risk:a stratified analysis by folic acid supplementation and year of sample collection
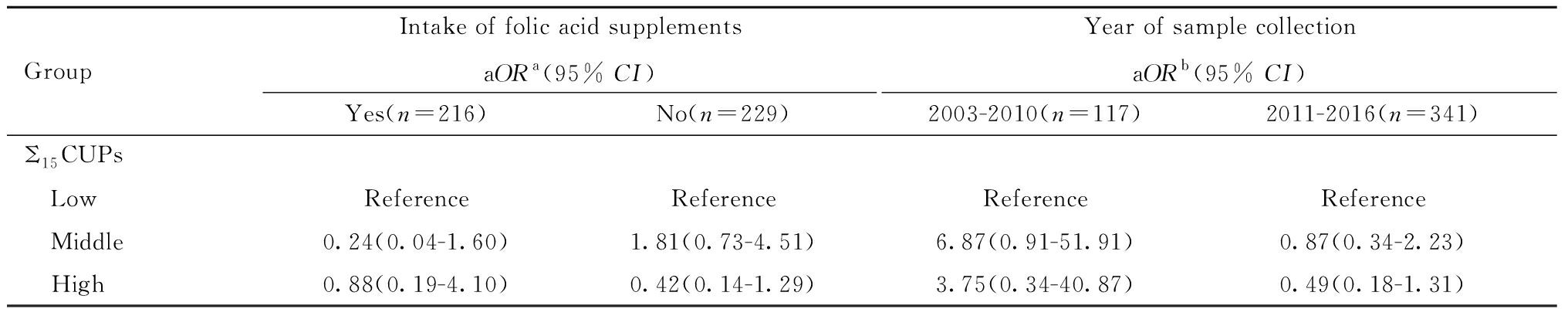
GroupIntake of folic acid supplementsaORa(95% CI)Yes(n=216)No(n=229)Year of sample collection aORb(95% CI)2003-2010(n=117)2011-2016(n=341)Σ15CUPs LowReferenceReferenceReferenceReference Middle0.24(0.04-1.60)1.81(0.73-4.51)6.87(0.91-51.91)0.87(0.34-2.23) High0.88(0.19-4.10)0.42(0.14-1.29)3.75(0.34-40.87)0.49(0.18-1.31)
a Adjusted for gestational age, fever or flu during early pregnancy and maternal passive smoking; b Adjusted for gestational age, fever or flu during early pregnancy, maternal passive smoking and intake of folic acid supplements.
六、孕期在用农药暴露来源分析
在2003年至2016年募集的对象中,共有591人报告了孕期农药接触信息,其中仅有4名母亲(0.7%)在怀孕前3个月到怀孕后3个月内接触过农药,表明孕期农药主动暴露十分罕见。鉴于在用农药在多种食物中广泛检出,饮食可能是孕期在用农药暴露的主要途径,因此,进一步研究孕期饮食习惯与胎盘在用农药浓度的相关性。结果表明,胎盘中在用农药浓度与孕期食用奶类、蔬菜、水果和豆类及豆制品的频率呈显著正相关(表7),奶类、蔬菜、水果和豆类及豆制品可能是孕期在用农药的暴露来源。
表7 胎盘组织中在用农药水平与饮食习惯的关联
Table 7 Correlations between dietary habits and placental CUPs
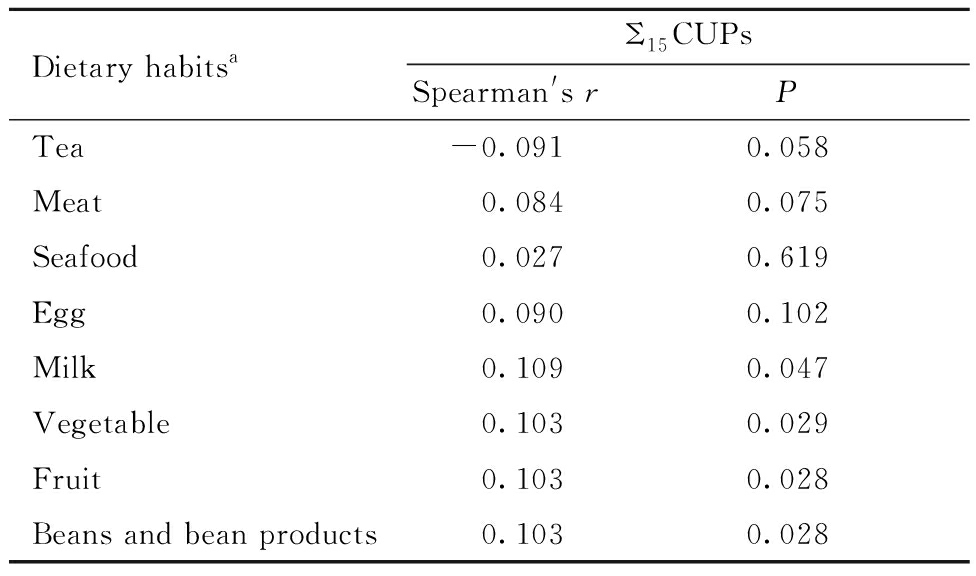
Dietary habits aΣ15CUPsSpearman's rPTea-0.0910.058Meat 0.0840.075Seafood 0.0270.619Egg 0.0900.102Milk 0.1090.047Vegetable 0.1030.029Fruit 0.1030.028Beans and bean products 0.1030.028
a Food intake frequency(<1, 1-3, 4-6, >6 times per week).
讨 论
本研究首次揭示了孕期15种常用在用农药的胎盘暴露水平并评估了孕期在用农药暴露与胎儿NTDs发生风险的关联性。本研究结果表明,虽然在非条件Logistic回归中,高水平的氟吗啉与更高的NTDs发生风险显著相关,高水平的吡唑醚菌酯和吡虫啉与更低的NTDs发生风险显著相关,但经Bonferroni校正后上述关联不再具有统计学意义。WQS回归结果未显示胎盘中15种在用农药混合物对胎儿NTDs发生风险存在显著的联合暴露效应。
既往关于孕期农药暴露对胎儿神经管发育影响的研究较为有限,且大多关注已禁用的、毒性较高的传统化学农药如有机氯农药、有机磷农药等。然而,有机氯农药和部分高毒的有机磷农药逐渐被世界各国禁用,在环境中的残留逐渐减少。作为已禁农药的替代品,在用农药的使用从上世纪90年代以来连年递增并在环境中广泛检出。环境中的CUPs可通过摄食、呼吸、皮肤等多种途径直接或间接进入孕妇体内,对胎儿生长发育的潜在危害同样不容忽视。本研究首次基于胎盘组织农药水平全面揭示了来自甲氧基丙烯酸酯类、氨基甲酸酯类、拟除虫菊酯类等15种常用在用农药的宫内暴露水平。本研究发现,尽管仅有0.7%的母亲报告有孕期农药接触史,但胎盘组织中15种在用农药的总检出率高达89.7%,总检出浓度极值达247.58 ng/g胎盘干重。因此,除了已禁用的有机氯农药等,在用农药的孕期暴露同样十分普遍,在用农药孕期暴露潜在的健康危害同样应该引起人们的关注。此外,胎盘组织中在用农药的高检出率和极端浓度值可能是长期、无意识地暴露于环境农药残留的结果,如每日摄入农药污染的食物。本研究发现,奶类、蔬菜、水果和豆类及豆制品可能是孕期在用农药的暴露来源。因此,母亲在孕期最好谨慎选择食物来源,避免食用被农药污染的食物。此外,政府监管部门应加强对农药使用的监管,减少农药的乱用和滥用,以降低环境农药残留水平。
研究表明,有些在用农药如氨基甲酸酯类和新烟碱类农药可以抑制乙酰胆碱酯酶(AChE)的活性,而AChE是大脑发育过程中的一种神经营养因子,可促进细胞分化、构建胆碱能靶位点结构,AChE或乙酰胆碱功能受损可能导致NTDs[21-22]。动物研究显示氨基甲酸酯类和新烟碱类农药可使神经细胞凋亡增加、细胞增殖紊乱,以及增加氧化和亚硝化应激,从而导致神经管发育畸形[22-23]。此外,拟除虫菊酯类农药被认为是一种环境内分泌干扰物,具有生殖内分泌毒性,且可影响神经系统ATP酶的活性,干扰神经系统发育[24]。然而目前尚无其他在用农药如甲氧基丙烯酸酯类、吗啉类、嘧啶类等人体毒性及机制的研究。本研究使用胎盘组织在用农药水平作为孕期在用农药内暴露的生物标志物,未发现孕期15种在用农药暴露与胎儿NTDs的发生风险存在统计学关联,在根据样本采集年份及围孕期叶酸补充情况的分层分析中,亦未发现两者之间存在统计学关联。可能的原因是,虽然目前尚无胎盘组织内在用农药安全剂量标准,但本研究的目标农药在该人群中的暴露剂量均较低,大多数农药检出浓度在10 ng/g以下,可能尚未达到致畸水平。其次,与高毒且具有生物蓄积性的有机氯农药相比,某些在用农药如氨基甲酸酯类、新烟碱类农药进入人体后可短时间内被代谢并排出体外[25-26],在人体内存留时间较短,因而可能对人体健康危害相对较小。然而目前多数在用农药缺乏人体内代谢及毒理学研究数据,本研究的结果还需开展相关机制研究以进一步佐证。另外,本研究在孕妇终止妊娠或分娩后采集胎盘并进行农药检测,可能无法准确反映神经管发育关键期(孕早期)的暴露水平,然而这也是所有基于胎盘污染物内暴露探索NTDs病因的研究所难以解决的问题。
据了解,本研究是首个基于胎盘组织在用农药水平探讨孕期在用农药暴露与NTDs发生风险的研究,目前仅有三项基于外暴露的在用农药孕期暴露与胎儿NTDs发生风险的人群研究。Rull等[10]针对美国加利福尼亚州1987至1991年间出生的731名NTDs患儿及940名对照开展病例对照研究,利用地理信息系统和农业登记系统将母亲孕期居住地址与农药使用报告和作物地图关联,发现母亲孕早期居住地附近使用酰胺类、苯并咪唑类、氨基甲酸甲酯和有机磷类农药可能与胎儿NTDs的发生有关,其中脊柱裂的发生可能与酰胺类、苯并咪唑类和氨基甲酸甲酯类的使用有关。Yang等[11]纳入了1997至2006年来自加利福尼亚州San Joaquin Valley的196名NTDs和785名对照,使用与前述研究相似的方法,发现母亲孕期居住地附近使用新烟碱类农药吡虫啉与新生儿无脑畸形的发生显著相关。Nordby等[12]基于一项挪威农民家庭队列研究,纳入了1973—1990年间出生的农民孩子,以从农业普查和气象测量站获得的马铃薯种植情况、农药购买情况和真菌预测数据作为氨基甲酸酯类农药代森锰锌(抗真菌剂,主要用于马铃薯种植)的暴露指标,发现NTDs的发生与马铃薯种植以及儿童父亲长时间在农场工作有关。然而,这些研究仅基于住宅附近农药使用情况或农业生产登记数据粗略地估算孕期在用农药的外暴露水平,考虑到生物屏障及个体对环境化学物质的代谢等,外暴露数据无法准确反映个体的实际内暴露剂量。
在动物研究中,DeMicco等[27]将斑马鱼胚胎暴露于6种拟除虫菊酯农药中,发现在接近半致死浓度的剂量下氯菊酯和溴氰菊酯可引起颅面异常。然而,Soni等[28]将围产期小鼠暴露于低剂量和高剂量的氟氯氰菊酯中,并未发现胎儿出现任何外部畸形。Liu等[22]将鸡胚暴露于不同浓度的吡虫啉,发现胚胎NTDs发生率随吡虫啉浓度的增加而上升。曾志豪等[29]通过对斑马鱼胚胎进行甲氧基丙烯酸类农药染毒,发现甲氧基丙烯酸类农药可引起卵黄囊畸形、心包囊肿、脊柱弯曲等畸形。然而,这些动物实验中在用农药的暴露剂量较高,不能代表人类孕期长期、低剂量的在用农药暴露模式,且由于动物和人类在生理代谢和对环境污染物敏感性方面存在差异,动物实验结果不能直接外推到人类。
本研究存在以下优势。首先,本研究共纳入了15种在用农药,数量多且种类丰富,涵盖了农业生产中常用的多种化学类别和不同用途的农药,可全面反映孕期在用农药的暴露情况。其次,本研究以胎盘组织在用农药为生物标志物,避免了回忆偏倚或报告偏倚等,可客观、准确地反映多种在用农药的宫内暴露水平。然而,本研究也存在以下不足。本研究仅针对胎盘组织中15种在用农药的原型进行检测,未检测这些农药的人体内代谢产物的浓度,因此,对于体内代谢速率较快的农药,其实际内暴露水平可能高于本研究检测得到的浓度值。
综上所述,本研究人群孕期暴露于在用农药的现象十分普遍,但未发现胎盘组织中15种在用农药暴露与胎儿NTDs的发生风险存在统计学关联。本研究对在用农药的孕期暴露及其对胎儿神经管发育的影响进行了初步探索,未来还需开展更多的研究如大型前瞻性队列研究,并在胎儿神经管发育关键期收集相关样本,以进一步探索孕期在用农药暴露对胎儿神经管发育的影响。
参考文献
1 Wallingford JB,Niswander LA,Shaw GM,et al.The continuing challenge of understanding,preventing,and treating neural tube defects.Science,2013,339:1222002.
2 Blencowe H,Kancherla V,Moorthie S,et al.Estimates of global and regional prevalence of neural tube defects for 2015:a systematic analysis.Ann N Y Acad Sci,2018,1414:31-46.
3 Liu J,Zhang L,Li Z,et al.Prevalence and trend of neural tube defects in five counties in Shanxi province of Northern China,2000 to 2014.Birth Defects Res A Clin Mol Teratol,2016,106:267-274.
4 Caiaffa CD,Fonteles C,Yunping L,et al.Gene-environment interactions underlying the etiology of neural tube defects.Curr Top Dev Biol,2023,152:193-220.
5 Ren A,Qiu X,Jin L,et al.Association of selected persistent organic pollutants in the placenta with the risk of neural tube defects.Proc Natl Acad Sci U S A,2011,108:12770-12775.
6 Sabzevari S,Hofman J.A worldwide review of currently used pesticides′ monitoring in agricultural soils.Sci Total Environ,2022,812:152344.
7 Murray KE,Thomas SM,Bodour AA.Prioritizing research for trace pollutants and emerging contaminants in the freshwater environment.Environ Pollut,2010,158:3462-3471.
8 Daughton CG,Ternes TA.Pharmaceuticals and personal care products in the environment:agents of subtle change.Environ Health Perspect,1999,107 Suppl 6:907-938.
9 许雅丽,吴颖虹,汪磊,等.在用农药的人体暴露研究进展.环境与健康杂志,2019,36:265-271.
10 Rull RP,Ritz B,Shaw GM.Neural tube defects and maternal residential proximity to agricultural pesticide applications.Am J Epidemiol,2006,163:743-753.
11 Yang W,Carmichael SL,Roberts EM,et al.Residential agricultural pesticide exposures and risk of neural tube defects and orofacial clefts among offspring in the San Joaquin Valley of California.Am J Epidemiol,2014,179:740-748.
12 Nordby KC,Andersen A,Irgens LM,et al.Indicators of mancozeb exposure in relation to thyroid cancer and neural tube defects in farmers′ families.Scand J Work Environ Health,2005,31:89-96.
13 Yin S,Wang C,Wei J,et al.Essential trace elements in placental tissue and risk for fetal neural tube defects.Environ Int,2020,139:105688.
14 郝变青,秦曙,王霞,等.山西果品主产区苹果、梨、桃和枣果实农药残留水平及评价.山西农业科学,2015,43:452-455.
15 阎会平,王丽英,何淑青.山西省蔬菜中农药残留状况分析及管理建议.农药科学与管理,2008,29:18-20,29.
16 Oliveira F,Pereira E,Gobbi JM,et al.Multiresidue method for detection of pesticides in beef meat using liquid chromatography coupled to mass spectrometry detection(LC-MS) after QuEChERS extraction.Food Addit Contam Part A Chem Anal Control Expo Risk Assess,2018,35:94-109.
17 Haraux E,Tourneux P,Kouakam C,et al.Isolated hypospadias:The impact of prenatal exposure to pesticides,as determined by meconium analysis.Environ Int,2018,119:20-25.
18 Carrico C,Gennings C,Wheeler DC,et al.Characterization of weighted quantile sum regression for highly correlated data in a risk analysis setting.J Agric Biol Environ Stat,2015,20:100-120.
19 Denk MK,Milutinovic′ NS.Reductive dehalogenation of DDT with folate models:Formation of the DDT metabolite spectrum under biomimetic conditions.Chemosphere,2018,191:408-411.
20 中华人民共和国农业农村部.农业部关于进一步加强农药管理工作的意见.http://www.moa.gov.cn/gk/tzgg_1/tz/201007/t20100726_1606326.htm.[2023-05-07].
21 Moser VC,Padilla S,Simmons JE,et al.Impact of chemical proportions on the acute neurotoxicity of a mixture of seven carbamates in preweanling and adult rats.Toxicol Sci,2012,129:126-134.
22 Liu M,Wang G,Zhang SY,et al.From the cover:Exposing imidacloprid interferes with neurogenesis through impacting on chick neural tube cell survival.Toxicol Sci,2016,153:137-148.
23 Gupta RC,Milatovic S,Dettbarn WD,et al.Neuronal oxidative injury and dendritic damage induced by carbofuran:protection by memantine.Toxicol Appl Pharmacol,2007,219:97-105.
24 Freeman KS.Testing the dose addition hypothesis:the impact of pyrethroid insecticide mixtures on neurons.Environ Health Perspect,2011,119:a399.
25 Ford KA,Casida JE.Unique and common metabolites of thiamethoxam,clothianidin,and dinotefuran in mice.Chem Res Toxicol,2006,19:1549-1556.
26 Cui J,Wang F,Gao J,et al.Bioaccumulation and metabolism of carbosulfan in zebrafish(Danio rerio) and the toxic effects of its metabolites.J Agric Food Chem,2019,67:12348-12356.
27 DeMicco A,Cooper KR,Richardson JR,et al.Developmental neurotoxicity of pyrethroid insecticides in zebrafish embryos.Toxicol Sci,2010,113:177-186.
28 Soni I,Syed F,Bhatnagar P,et al.Perinatal toxicity of cyfluthrin in mice:developmental and behavioral effects.Hum Exp Toxicol,2011,30:1096-1105.
29 曾志豪,陈昂,陈源,等.氯啶菌酯对斑马鱼胚胎发育毒性效应.农药,2016,55:359-362.
(收稿日期:2023-04-15)






