·论著·
苯并芘暴露致神经管缺陷代谢组学特征及组蛋白修饰机制的初步研究
贾晓倩 刘晓途 邱爱琴 林珊珊 李智文
【摘要】 目的 采用苯并芘(BaP)暴露致神经管缺陷(NTDs)小鼠模型研究神经管闭合异常母体外周血代谢谱的变化,以及组蛋白修饰在其中可能的机制作用。 方法 将健康ICR孕鼠分为BaP暴露组和对照组,分别在孕第7~9天腹腔注射BaP或玉米油,孕9.5 d收集孕鼠外周血血清及胎鼠。根据胎鼠NTDs表型,将BaP暴露组再分为BaP_NTDs组和BaP_nonNTDs组,通过超高效液相色谱-质谱联用技术非靶向检测血清的代谢物水平,分析组间的差异代谢物,并利用KEGG数据库分析涉及的代谢通路;基于RNA-seq技术和CUT&Tag技术分别检测胎鼠神经组织中基因表达水平及H3K27me3和H3K27ac组蛋白修饰水平,针对代谢组中发现的关键通路,进一步分析可能的致病基因及表观作用机制。 结果 相较于对照组,BaP_NTDs组共鉴定到44种差异代谢物;相较于BaP_nonNTDs组,BaP_NTDs组共鉴定到11种差异代谢物。其中,溶血磷脂酰胆碱表现为只在BaP_NTDs组特异性升高。BaP_NTDs组与对照组以及BaP_NTDs组与BaP_nonNTDs组的差异代谢物均涉及磷酸戊糖途径。胎鼠神经组织转录组测序和组蛋白测序数据显示,磷酸戊糖途径中的Aldob基因在BaP_NTDs组的表达水平是对照组的31.06倍,是BaP_nonNTDs组的9.68倍,且均伴有启动子区H3K27ac组蛋白修饰水平升高。 结论 BaP暴露致NTDs的孕鼠外周血中关键差异代谢物可能是溶血磷脂酰胆碱,磷酸戊糖途径中Aldob基因组蛋白修饰可能是致病机制之一。
【关键词】 神经管缺陷; 非靶向代谢组学; 苯并芘; 组蛋白修饰
【中图分类号】 R17;R71
基金项目:国家自然科学基金(82373582,81973056,31900608),广州市科学技术局项目(202102021251,2023A03J0872)
作者单位:100191,北京大学公共卫生学院流行病与卫生统计学系,北京大学生育健康研究所/国家卫生健康委员会生育健康重点实验室(贾晓倩,李智文);514433 广州,暨南大学环境学院,广东省环境污染与健康重点实验室(刘晓途,邱爱琴);510623,广州市妇女儿童医疗中心出生队列研究室(林珊珊)
通信作者:林珊珊(shanshan.lin@bigcs.org),李智文(lizw@bjmu.edu.cn)
Investigation on the serum metabolomics and histone modifications of neural tube defects induced by benzo[a]pyrene
JIA Xiaoqian, Liu Xiaotu, QIU Aiqin, LIN Shanshan, LI Zhiwen. School of Public Health, Peking University; Institute of Reproductive and Child Health, National Health Commission Key Laboratory of Reproductive Health, Peking University, Beijing 100191, China
[Abstract] Objective To study the change of serum metabolite profiles in pregnant mice with embryos occurring neural tube closure failure, and the possible role of histone modification in the development of neural tube defects(NTDs) induced by benzo[a]pyrene(BaP). Methods Pregnant ICR mice were classified into BaP exposure group and control group, which were treated by intraperitoneal injection of BaP or corn oil at gestational day(GD) 7-9. The serum of pregnant mice and embryos were collected at GD 9.5. Based on the phenotype of the embryos, the BaP exposure group was further classified into BaP_NTDs group and BaP_nonNTDs group. Ultra-performance liquid chromatography-mass spectrometry was used to detect serum metabolites, and the differences of metabolites between the two groups were compared. We further annotated metabolic pathways of the different serum metabolites in Kyoto Encyclopedia of Genes and Genomes(KEGG) database. RNA-seq and CUT&Tag were used to assay the genome-wide gene expression and the histone modifications of H3K27me3 and H3K27ac of embryonic neural tissues to explore the possible genes and histone modifications responsible for the NTDs based on the identified metabolic pathways. Results Compared to the control group, 44 differential metabolites were found in BaP_NTDs group. Compared to the BaP_nonNTDs group, 11 differential metabolites were found in BaP_NTDs group. The LysoPC(0:0/18:2(9Z,12Z)) was uniquely up-regulated in BaP_NTDs group. Pentose phosphate pathway was enriched both for the BaP_NTDs/control differential metabolites and BaP_nonNTDs/control differential metabolites. Further, the RNA-seq and CUT&Tag data of embryonic neural tissues revealed that the expression of Aldob in the BaP_NTDs group, one of the key genes involved in the pentose phosphate pathway, was 31.06 fold-change of that in the control group, and 9.68 fold-change of that in the BaP_nonNTDs group. They both had a higher peak of H3K27ac modification in the promoter of the gene. Conclusion LysoPC(0:0/18:2(9Z,12Z)) might be the key differential metabolite in the serum of pregnant mice with NTD embryos induced by BaP, and the histone modifications of Aldob in pentose phosphate pathway might be one of the underlying mechanisms.
[Key words] neural tube defects; untargeted metabolomics; benzo[a]pyrene; histone modification
神经管缺陷(neural tube defects,NTDs)是胚胎发育早期(受精后21至28 d),因神经管闭合不全所造成的一类严重出生缺陷,常见的亚型有无脑、脊柱裂和脑膨出,是造成围产儿死亡和儿童残疾的重要原因之一。全球范围内,NTDs的发生率约为1‰[1]。中国北方是NTDs高发地区,山西省部分农村地区NTDs出生患病率在2003年曾高达14‰,是同期美国出生患病率的数十倍[2]。NTDs属于多因素疾病,是遗传与环境因素共同作用的结果,其发病机理尚未完全清楚。近年流行病学研究发现,孕期多环芳烃(polycyclic aromatic hydrocarbons,PAHs)暴露与NTDs发生风险增加有关[3-5]。PAHs包括一系列烃类化合物及其衍生物,是常见的大气污染物,在环境中广泛存在,其中,苯并芘(benzo[a]pyrene,BaP)是强毒性的代表性PAHs类物质。在体小鼠动物模型和离体胚胎培养已证实BaP暴露可导致NTDs的发生,且氧化应激诱导的细胞凋亡在其中起着重要作用[6-7],这与既往发现氧化应激、细胞增殖/凋亡异常参与高糖、高热、全反式维甲酸等导致NTDs的病理过程相一致[8],提示各种环境因素诱发的NTDs可能存在共同的致病机理。但目前对NTDs发病机制的了解并不能完全解释所有NTDs的发生,且缺乏对更深入具体的分子通路的探索。
代谢组学可检测机体内分子量小于1 000 Da的氨基酸、小分子多肽、脂类等代谢产物或中间体,能够综合评估基因和环境对机体的影响。相较于传统毒理学方法多局限于单一或个别机制研究,高通量代谢组学技术可揭示更多的可能分子机制,已被广泛应用于多种疾病的机制研究中。目前已有一些基于代谢组学方法开展NTDs发病机制的人体和动物模型研究[9-11]。但人体研究受伦理规范限制,多为病例对照研究设计,存在检测到的代谢产物可能并不能反映NTDs疾病发生时的机制改变的问题;在动物研究中,Lrp6基因敲除小鼠模型和维甲酸致NTDs小鼠模型已初步发现叶酸代谢、线粒体β氧化等代谢通路在NTDs发生机制中的作用[10-11],但目前尚缺乏环境暴露,特别是BaP暴露致NTDs的相关研究。本研究拟基于前期已构建的孕鼠BaP暴露致胎鼠NTDs小鼠模型[6],采用超高效液相色谱-质谱联用(ultra performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)技术,对妊娠第9.5天(gestational day 9.5,GD 9.5)的孕鼠外周血血清中的代谢谱进行系统检测(一般认为小鼠神经管发育开始于胎龄8.5 d左右,于胎龄9.5 d基本完成头部神经管的闭合[12]),识别可能与神经管闭合异常有关的差异代谢物,并基于识别到的关键代谢通路,结合GD 9.5胎鼠神经组织的转录组测序(RNA-sequencing,RNA-seq)和基于CUT&Tag(cleavage under targets and tagmentation)技术的组蛋白测序数据,进一步探索组蛋白表观遗传修饰在NTDs的发病机中的可能作用。
材料与方法
一、仪器和材料
1.主要仪器:超高效液相色谱-离子轨道阱高分辨质谱联用仪(LC-Orbitrap ExplorisTM 240 Mass Spectrometer,Thermo Fisher,美国),色谱柱ACQUITY HSS T3 column(100 mm × 2.1 mm,1.8 μm,Waters,美国),NanoDrop2000(Thermo Fisher,美国),Novaseq 6000平台(Illumina,美国),低温离心机(Eppendorf,德国),体式显微镜(Olymbus,美国)等。
2.主要试剂:苯并芘(Sigma,美国),玉米油(阿拉丁,中国),Trizol(Invitrogen,美国),Illumina′s NEBNext© UltraTM RNA Library Prep Kit试剂盒(Illumina,美国),NovaNGS CUT&Tag 3.0 High-Sensitivity Kit(for Illumina)试剂盒(Illumina,美国),H3K27me3兔一抗(Sigma,美国),H3K27ac兔一抗(Abcam,美国),pG-Tn5 adapter complex(近岸蛋白,中国)等。
二、动物模型构建
健康性成熟未生育ICR小鼠(此品系小鼠来自Swiss小鼠),SPF级,8周龄,体重25~30 g,购自广州医科大学动物实验中心。每晚18:00将雌雄小鼠按2∶1合笼,次日晨检查雌鼠阴栓。查见到阴栓者认为受孕,合笼当晚22:00定为GD 0。孕鼠在恒温(22 ± 0.5)℃,恒湿(50% ± 10%)环境中饲养,给予充足饲料和饮水。将ICR孕鼠随机分为2组,其中BaP暴露组在GD 7~ GD 9每天通过腹腔注射给予BaP(250 mg/kg,即按照小鼠体重每千克给予250 mg BaP),BaP用前先溶于玉米油。对照组在同样时间段通过腹腔注射给予玉米油(10 mL/kg)。在GD 9.5将孕鼠乙醚麻醉后,采用心脏取血方式抽取血液,4 ℃ 3 000 r/min离心,分离上层血清,用于非靶向代谢物检测。取血完成后脱颈处死孕鼠,剖宫取出子宫串,用预温的生理盐水清洗后,置于培养皿中,检查受孕情况,记录吸收胎数、死胎数、活胎数等。将胎鼠逐一分离,体式显微镜下仔细逐一检查脑部及脊背等有无外观畸形,BaP暴露组根据一窝胎鼠中是否出现NTDs表型,进一步分为BaP_NTDs组(12只孕鼠)和BaP_nonNTDs组(6只孕鼠)。对照组选择胎鼠未出现NTDs表型的6只孕鼠用于后续实验检测。体式显微镜下分离胎鼠神经组织,用于转录组及组蛋白表观遗传修饰检测。其中,对于BaP_NTDs组,只将一窝中有NTDs表型的胎鼠神经组织混样后作为一个检测样本,共计12个胎鼠神经组织样本,随机各取6个样本分别用于后续的转录组检测和Cut&Tag测序检测;对于BaP_nonNTDs组,随机取将一窝中所有的胎鼠神经组织混样后,再分为两个检测样本分别用于转录组检测和Cut&Tag测序检测。同样,玉米油对照组中将没有任何异常的一窝胎鼠的神经组织混样后用于转录组检测和Cut&Tag测序检测。动物实验已获得广州医科大学实验动物伦理委员会批准(2019-520)。
三、超高效液相色谱-质谱联用非靶向检测血清代谢物
每只孕鼠取30 μL血清,加入200 ppb4-Cl-苯丙氨酸作为内标,加入120 μL甲醇,涡旋混合60 s,在-80 ℃下沉淀蛋白2 h,然后4 ℃ 16 000 r/min离心10 min,取上清液等待上机分析。另外,从每个样品中取等体积7 μL混匀制备质控(QC)样品,在实验样本进样前、中和后均上机检测以保证实验过程中的系统稳定性。
1.色谱条件:采用ACQUITY UPLC© HSS T3色谱柱(100 mm × 2.1 mm,1.8 μm),流动相在正离子模式下A相0.1%甲酸水,B相0.1%甲酸乙腈,负离子模式下A相为含有2 mM碳酸氢铵水,B相为纯乙腈。梯度程序如下0~1 min,2% B;1~3 min,2% B→50% B;3~9 min,50% B→100% B;9~12 min,100% B;12~12.1 min,100% B→2% B;12.1~15 min,2% B柱温为40 ℃;流速为0.35 mL/min;进样体积为1 μL。
2. 质谱条件:采用加热电喷雾离子源(H-ESI),在正、负离子模式下分别进行检测;H-ESI喷射电压为+3 500 /- 2 500 v;鞘气、辅助气和扫描气流量分别为40、10和1个任意单位;离子传输管温度为325 ℃;汽化器温度为350 ℃。采集模式为一级全扫描和数据依赖性二级质谱采集;一级质谱扫描范围设置为质荷比(m/z)100~1 000,扫描分辨率为120 000;二级质谱(MS/MS)扫描分辨率为15 000;高能碰撞诱导解离,碰撞能量为归一化能量30%。
四、转录组测序
转录组测序的详细实验方法可参见课题组已发表文章[13]。主要采用Trizol方法从胎鼠神经组织中提取总RNA,每个样本取1 μg用于建库,根据Illumina的NEBNext© UltraTM RNA Library Prep Kit试剂盒说明,将mRNA随机打断,以片段化的mRNA为模版,随机寡核苷酸为引物,合成双链cDNA,纯化后经过末端修复、加A尾并连接测序接头,用AMPure XP beads筛选250~300 bp左右的cDNA,进行PCR扩增后纯化产物,使用Novaseq 6000平台进行上机测序,最终获得文库。
五、CUT&Tag测序
CUT&Tag测序的详细实验方法可参见课题组已发表文章[13]。首先将细胞与磁珠混合,然后加入H3K27me3或H3K27ac组蛋白一抗孵育过夜后,加入二抗结合蛋白。再加入pAG-Tn5转座体继续孵育,随后加入Mg2+,激活Tn5酶的切割活性,将DNA随机化打断,接着提取纯化DNA,进行PCR扩增构建文库。
六、数据处理与统计分析
采用Compound discoverer软件(Thermo Fisher)对非靶代谢组学采集的原始图谱进行峰识别、校正和标准化处理。使用mzCloud数据库对鉴定到的代谢物进行注释。采用MetaboAnalyst在线软件对处理后的数据进行统计学分析,根据每个变量是否成正态分布(Shapiro-Wilk检验)分别采用t-test或Mann-Whitney U Test检验其组间差异是否具有统计学意义,并计算组间的倍数变化(fold change,FC);对各组分布进行主成分分析(principal component analysis,PCA)和偏最小二乘回归分析法(projection to latent structures-discriminant analysis,PLS-DA),以变量投影重要性(variable importance in projection,VIP)反映各变量对分组的贡献大小。最终以P<0.05,VIP>1以及FC>1.5或<1/1.5为阈值,筛选差异代谢物,并使用京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)数据库对差异代谢物进行代谢通路富集分析。RNA-seq和CUT&Tag测序数据分析具体方法见课题组已发表文章[13],主要是采用Hisat2软件对测序数据进行比对,采用R软件HTseq工具包将Reads定位到基因,并采用FPKM方法计算表达量。采用DEGseq和DESeq2进行差异基因筛选,条件为FC>2和P<0.05。在CUT&Tag测序数据分析中,使用BWA(Burrows Wheeler Aligner)软件将过滤后的测序数据比对到参考基因组上,利用PePr软件完成两组样本间差异富集峰检分析,并对差异富集峰的个数、宽度、分布等进行统计,注释得到富集峰的相关基因。
结 果
一、神经管缺陷表型
与对照组相比,BaP暴露组死胎、吸收胎的数量增加,胎鼠宫内生长发育受限明显,胎鼠头长为(1.6±0.3)mm,体长为(2.9±0.5)mm,均显著低于对照组[头长(2.0±0.2)mm,P<0.05;体长(3.5±0.4)mm,P<0.05]。NTDs发生率为13.3 %,约为对照组(2.7 %)的5倍,差异有统计学意义(P<0.001)。BaP暴露所导致的NTDs主要发生在前脑,其它还包括中脑和后脑缺陷。除NTDs外,BaP暴露还导致多种严重程度不一的其它缺陷,包括心包积水、短尾、脊柱侧弯、颜面部出血等。
二、差异性代谢物分析
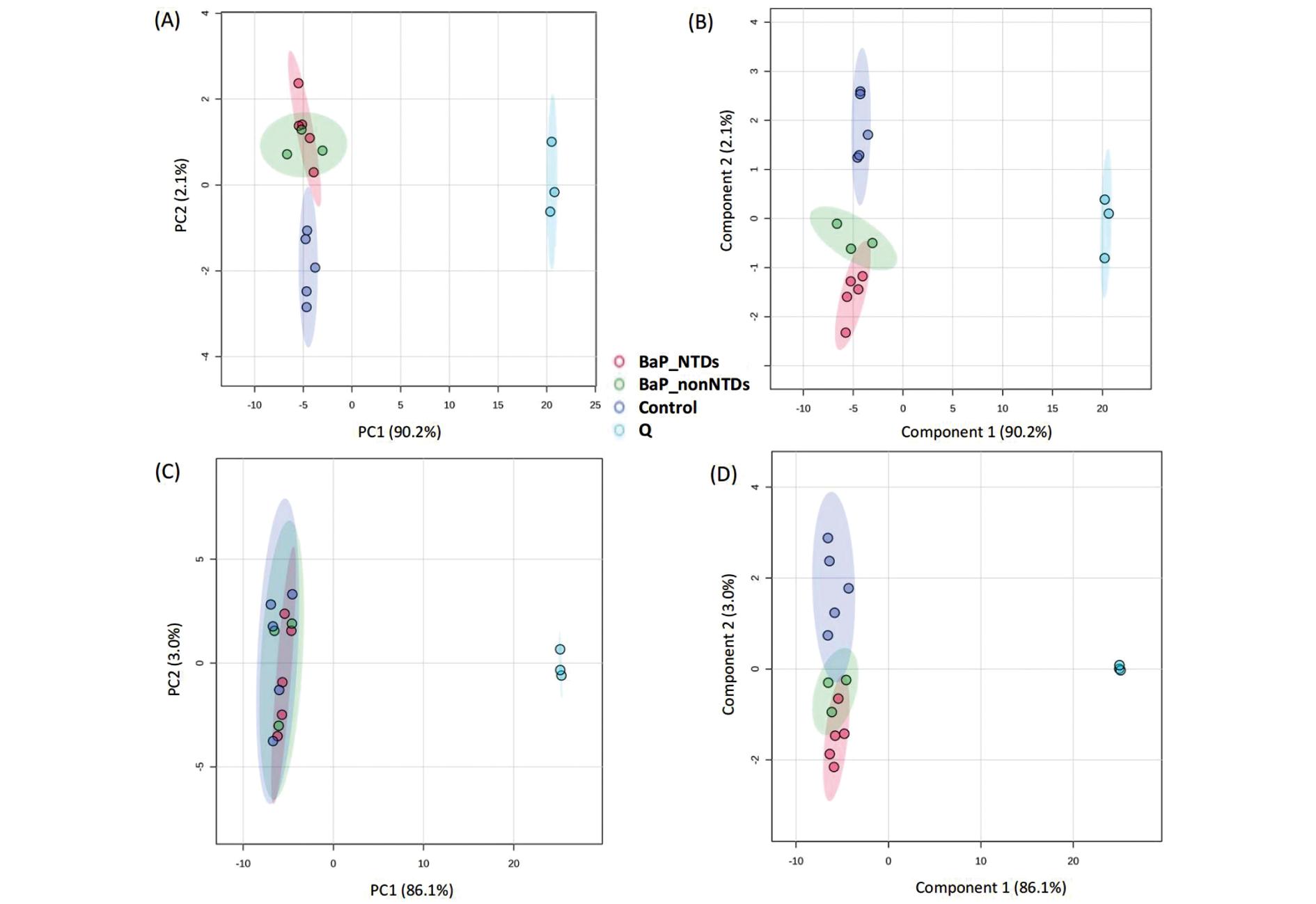
外周血血清分别在正、负极模式下进行数据采集,结果共鉴定到正离子模式代谢物168个,负离子模式代谢物128个。PCA和PLS-DA结果如图1显示,BaP_NTDs组和对照组在负离子模式下可以完全分开,提示两组孕鼠之间血清代谢物有明显差异,存在特异的代谢模式。在正离子模式下,采用有监督算法,BaP_NTDs组和对照组可以完全分开。BaP_nonNTDs组在负离子模式下可以与对照组完全分开,在正离子模式下与BaP_NTDs组和对照组均有部分重叠。
按照P值<0.05,FC>1.5或<1/1.5以及VIP值> 1标准筛选组间差异代谢物,结果发现,相比于对照组,BaP_NTDs组有23种代谢物上调,21种下调;BaP_nonNTDs组有21种代谢物上调,6种下调。相比于BaP_nonNTDs组,BaP_NTDs组有6种代谢物上调,5种代谢物下调。各组间比较,差异最显著的前5种代表性代谢产物具体信息见表1。其中,溶血磷脂酰胆碱、眼科酸、γ-L-谷氨酰-L-丙氨酸、葡萄糖酸和D-葡萄糖醛酸在BaP_NTDs组中的水平分别为对照组的10.56、3.75、2.18、2.65和2.19倍。皮诺敛酸、肌苷、溶血磷脂酰胆碱、N-甲基-L-亮氨酸和D-核酮糖-5-磷酸酯在BaP_NTDs组中的水平分别为BaP_nonNTDs组的25.55、239.38、8.51、0.58和2.16倍。
表1 BaP暴露致NTDs孕鼠孕第9.5天外周血血清的代表性差异代谢物
Table 1 Representative differential metabolites of serum in GD 9.5 BaP-induced NTD mice
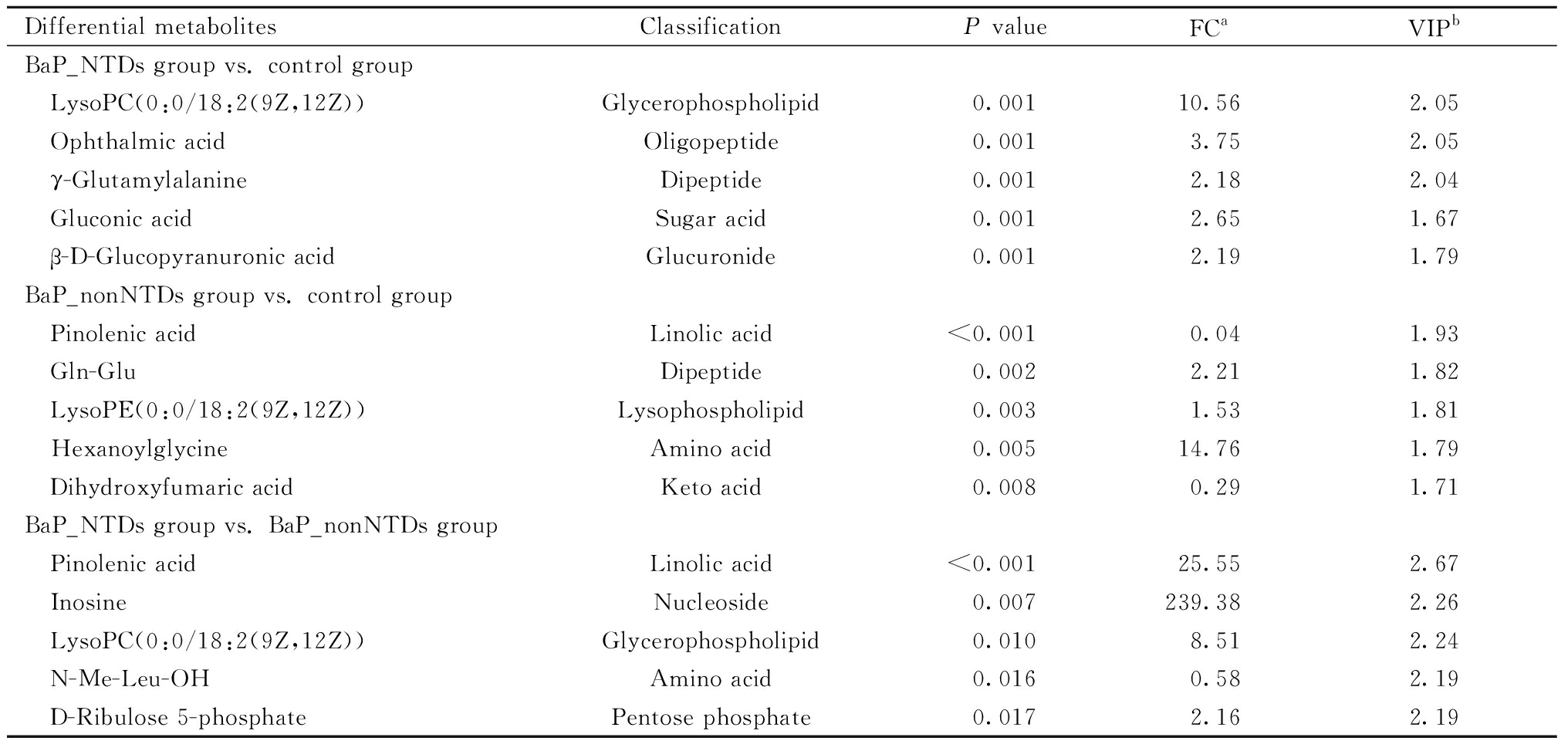
Differential metabolitesClassificationP valueFCaVIPbBaP_NTDs group vs. control group LysoPC(0:0/18:2(9Z,12Z))Glycerophospholipid0.00110.562.05 Ophthalmic acidOligopeptide0.0013.752.05 γ-GlutamylalanineDipeptide0.0012.182.04 Gluconic acidSugar acid0.001 2.651.67 β-D-Glucopyranuronic acidGlucuronide0.0012.191.79BaP_nonNTDs group vs. control group Pinolenic acidLinolic acid<0.0010.041.93 Gln-GluDipeptide0.0022.211.82 LysoPE(0:0/18:2(9Z,12Z))Lysophospholipid0.0031.53 1.81 HexanoylglycineAmino acid0.00514.761.79 Dihydroxyfumaric acidKeto acid0.0080.291.71BaP_NTDs group vs. BaP_nonNTDs group Pinolenic acidLinolic acid<0.00125.552.67 InosineNucleoside0.007239.382.26 LysoPC(0:0/18:2(9Z,12Z))Glycerophospholipid0.0108.512.24 N-Me-Leu-OHAmino acid0.0160.582.19 D-Ribulose 5-phosphatePentose phosphate0.0172.162.19
a FC, fold change; b VIP, variable important in projection
三、差异代谢物通路富集分析
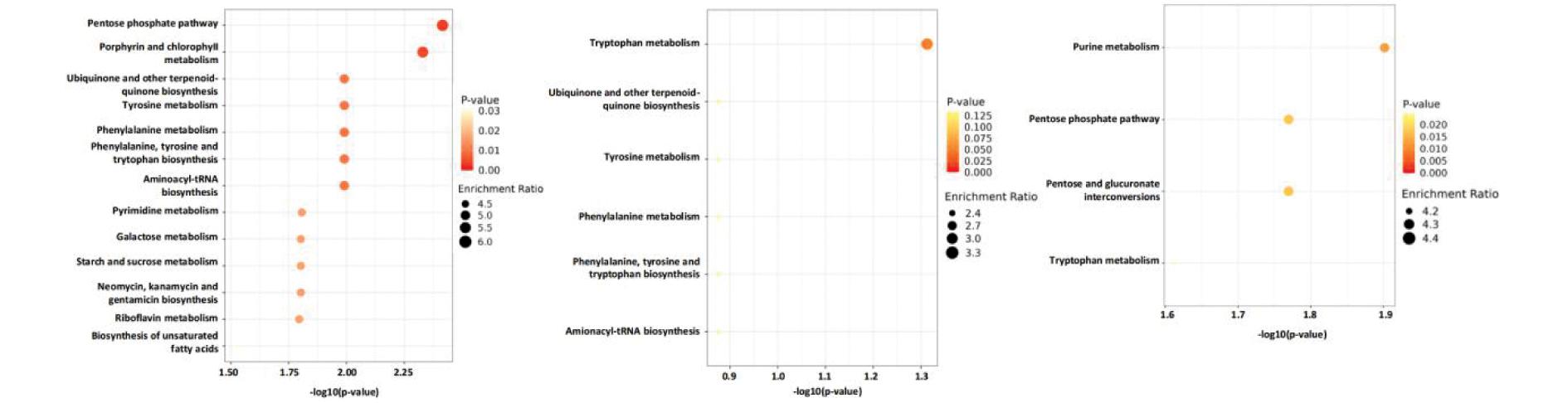
将上述发现的差异代谢物在HMDB和KEGG数据库中进行对比注释后,进行通路富集分析。结果如图2所示,BaP_NTDs组与对照组的差异代谢物富集的通路主要涉及磷酸戊糖途径、卟啉和叶绿素代谢、泛醌和其他萜类醌的生物合成、酪氨酸代谢、苯丙氨酸代谢等,BaP_nonNTDs组与对照组的差异代谢物富集的通路包括色氨酸代谢、泛醌和其他萜类醌的生物合成、酪氨酸代谢、苯丙氨酸代谢、苯丙氨酸等;BaP_NTDs组与BaP_nonNTDs组的差异代谢物富集的通路包括嘌呤代谢、磷酸戊糖途径、戊糖和葡萄糖醛酸互转、色氨酸代谢。其中,磷酸戊糖途径同时见于BaP_NTDs组与对照组的差异代谢物和BaP_NTDs组与BaP_nonNTDs组的差异代谢物富集通路,未见于BaP_nonNTDs组与对照组的比较中。
四、差异性代谢物与组蛋白修饰的关系
基于上述差异代谢物富集通路分析结果,结合课题组已发表的胎鼠神经组织组蛋白和RNA测序数据,本研究进一步在组蛋白修饰和基因表达层面分析了磷酸戊糖途径在BaP暴露致NTDs发生中的可能机制作用。通过检索KEGG数据库,小鼠磷酸戊糖途径共涉及33个相关基因,其中,包括Aldob、Pgls、Taldo1等10个基因的表达水平在BaP_NTDs组和对照组间差异存在统计学意义,Pgls、Taldo1、Rpia等7个基因在BaP_nonNTDs组和对照组间差异有统计学意义,Aldob、Fbp2及Tkt共3个基因在BaP_NTDs组和BaP_nonNTDs组间差异存在统计学意义(表2)。基因启动子区域组蛋白修饰信号值显示,BaP_NTDs组Aldob基因H3K27ac组蛋白修饰水平分别是BaP_nonNTDs和对照组的2.02倍(P=0.044)和2.85倍(P=0.009),而BaP_nonNTDs组Aldob基因组蛋白修饰水平与对照组无统计学差异(P=0.421)。
表2 BaP暴露致NTDs胎鼠神经组织中磷酸戊糖途径相关基因表达及组蛋白修饰水平
Table 2 The expression levels and the histone modifications of the genes related to pentose phosphate pathway in neural tissues of GD 9.5 BaP-induced NTD mice

GeneBaP_NTDs group vs. Control groupExpression FCaH3K27me3FCaH3K27a FCaBaP_nonNTDs group vs. Control groupExpression FCaH3K27me3FCaH3K27a FCaBaP_NTDs group vs. BaP_nonNTDs groupExpression FCaH3K27me3FCaH3K27a FCaPgls0.66*5.47*1.530.74*5.300.860.901.031.77*Taldo10.74*2.680.950.74*2.650.551.001.011.71Rpia0.61*2.53*1.410.71*1.471.070.851.711.33H6pd1.93*6.370.961.79*5.630.621.071.131.54Aldoc1.51*3.981.271.172.740.551.301.452.32Dera0.76*3.141.780.72*1.470.401.062.134.46*Pgm20.81*3.740.980.98 1.850.800.832.031.23Pgd0.32*2.271.030.912.910.900.950.781.14Pfkp2.14*3.691.441.82*4.740.471.180.783.08Aldob31.06*2.562.02*3.192.620.719.68*0.982.85*Fbp22.121.601.860.641.420.923.33*1.602.03Pfkl1.11-1.581.19*-1.130.941.931.40Tkt0.919.171.280.9336.61*0.8134.50*0.881.59
a FC, fold change; * P<0.05;- not available
讨 论
本研究采用BaP暴露致NTDs小鼠模型,通过设置染毒后无NTDs组和溶剂对照组两个参照组,分析神经管闭合失败时孕鼠外周血中代谢产物的改变,发现NTDs组孕鼠表现为溶血磷脂酰胆碱特异性异常上调,以及葡萄糖酸、D-葡萄糖醛酸、D-核酮糖-5-磷酸酯等葡萄糖代谢产物水平增加,且KEGG结果显示磷酸戊糖途径是其中富集最显著的通路。结合组蛋白和RNA测序数据提示,磷酸戊糖途径中Aldob基因可能起到调控性的作用。
在本次研究中,染毒后胎鼠发生NTDs的孕鼠血清代谢谱与对照组具有明显差异,而染毒后胎鼠未发生NTDs的孕鼠血清代谢谱与对照组和NTDs组均有部分重叠。其中,溶血磷脂酰胆碱在NTDs孕鼠血清中的水平显著高于溶剂对照组和染毒后胎鼠未发生NTDs组,提示血清中的溶血磷脂酰胆碱水平可能可以作为BaP暴露后是否发生NTDs的重要预测标志物。溶血磷脂酰胆碱主要存在于细胞膜和血浆中,是磷脂酰胆碱(卵磷脂)在磷脂酶A2催化下生成的。在心血管疾病研究中,发现溶血磷脂酰胆碱具有诱导线粒体氧化应激的作用[14],并且进一步发现溶血磷脂酰胆碱是细胞凋亡的重要信号分子[15-16],而氧化应激诱导的细胞凋亡过度是多种因素导致NTDs的共同致病机制之一[8]。细胞在凋亡的时候会释放多种“find-me”信号分子,如核苷酸ATP、UPT和溶血磷脂酰胆碱,这些因子可作为吸引信号招募吞噬细胞向凋亡细胞迁移,并调节吞噬细胞骨架,增强吞噬受体的表达和消化机制,帮助吞噬细胞清理凋亡细胞,避免炎症的发生[14]。已有研究发现在神经组织中,溶血磷脂酰胆碱也存在着类似的作用,能够激活吞噬细胞对髓鞘的吞噬作用[17]。在神经管的正常闭合过程中需要适度水平的细胞凋亡参与以保证两侧的神经褶能够融合,但同时,细胞凋亡过度也可能会导致神经管闭合失败[18]。本次研究结果提示溶血磷脂酰胆碱可能可以作为孕鼠血清中预测子代是否发生NTDs的代谢标志物,但尚需要进一步研究予以验证,并探讨在其它因素导致的NTDs中是否也能观察到溶血磷脂酰胆碱代谢的改变。
既往研究表明大鼠胚胎暴露于高氧环境中可导致NTDs的发生[19],并且多个与能量代谢相关的基因功能缺失时可导致NTDs的发生,例如在糖代谢中起重要调节作用的Cited2基因[20],提示胚胎时期能量代谢在神经管发育中的重要性。全胚胎体外培养模型发现,在神经管形成的关键时期,胚胎能量代谢的中心由糖酵解转为氧化磷酸化,其中包括起主要作用的磷酸戊糖途径[21]。在本次研究中,NTDs组孕鼠血清中包括葡萄糖酸、D-葡萄糖醛酸、D-核酮糖-5-磷酸酯等多个糖代谢通路上的产物发生异常改变,并且差异代谢物特异性的富集通路为磷酸戊糖途径,提示该途径可能在BaP暴露后导致的NTDs中起到重要的致病作用。磷酸戊糖途径是葡萄糖-6-磷酸经代谢产生NADPH和核糖-5-磷酸的途径。虽然有证据显示磷酸戊糖途径是神经元细胞代谢葡萄糖的主要途径[22],但目前较少有研究报道该途径在NTDs发生机制中的作用。在Keuls等人[23]基于miR-302敲除致NTDs小鼠模型中,RNA-seq的转录组数据和质谱检测的代谢组数据均发现NTDs胎鼠脑部组织表现为糖酵解的上游通路相关基因表达上调,大量糖酵解代谢产物增加,磷酸戊糖途径显著富集,与本研究观察到的结果一致。
为辨析在孕鼠血清中检测到的代谢物差异性改变是否与胎鼠组织在神经管闭合期的异常改变有关,本研究进一步分析了胎鼠神经组织中转录组学和表观遗传组学的改变。针对磷酸戊糖代谢途径,发现该途径上多个相关基因的表达和组蛋白修饰水平在NTDs胎鼠中表现异常,其中,Aldob基因表现为在NTDs胎鼠中特异性表达上调,以及基因启动子区H3K27ac组蛋白修饰(活化基因表达的代表性组蛋白修饰)水平特异性上调。Aldob编码的蛋白酶是重要的细胞代谢调节酶,在磷酸戊糖途径中可催化1,6-二磷酸果糖转化为磷酸二羟基丙酮和甘油醛3-磷酸,对细胞能量代谢的调节很重要。Aldob水平的增加提示存在低氧环境,导致非氧依赖性的糖酵解增加[24]。一般认为Aldob主要是在肝脏中参与糖代谢的调节,本研究的发现提示在胚胎发育期的神经组织中同样存在Aldob的表达。除了能量调节作用外,近年来研究发现在细胞微环境不同的情况下,Aldob可能发挥不同的功能,包括与神经管闭合密切相关的细胞凋亡和细胞迁移。在结肠癌细胞中发现Aldob高表达能够干扰MMR蛋白的功能,从而导致细胞DNA损伤的不可修复性,最终激活p53依赖性的细胞凋亡途径[25]。此外,Aldob酶也能够与多种细胞骨架蛋白相互作用,包括F-肌动蛋白,WASP和微管蛋白,从而影响细胞的迁移运动等[26]。但目前尚未有研究报道Aldob在胚胎发育期的神经细胞中的具体功能,尚需进一步的研究探索Aldob参与神经管闭合的调控机制。
NTDs的病理过程涉及到多种生物调控机制,其中叶酸代谢途径是目前最公认的致病机制之一。叶酸激活的一碳代谢单元可以作为主要辅助因子参与到多种生物代谢过程中,包括嘌呤的合成和代谢、丝氨酸和甘氨酸的相互转化、胸苷酸的合成以及蛋氨酸循环等[27]。在本次研究中,除了磷酸戊糖途径之外,差异代谢物在NTDs组特异性富集的通路包括嘌呤/嘧啶代谢途径以及核黄素代谢途径。其中核黄素(维生素B2)通过与甲基四氢叶酸还原酶一起作用,参与叶酸循环[28]。核苷酸代谢对于细胞DNA和RNA的合成至关重要,其代谢水平的异常很可能会抑制细胞增殖。而现有研究已证实,在神经管闭合时期,足够数量的细胞增殖对于神经管的融合至关重要。目前有两篇研究基于代谢组学的方法,同样报道了叶酸代谢途径和嘌呤/嘧啶代谢在NTDs发生中的可能作用。其中,Hansler等人[10]采用Lrp6基因敲除致NTDs小鼠模型,以野生型小鼠为对照,GD 9.5全胚胎小鼠经非靶代谢组学检测,发现主要的差异代谢物与叶酸一碳代谢通路有关,包括蛋氨酸再生、嘌呤代谢和多胺生物合成等。另一篇研究来自Akimova等人[11]采用维甲酸致NTDs的小鼠模型,同样对GD 9.5胎鼠进行全胚胎代谢组学检测,结果发现代谢通路受到最显著影响的是嘌呤和嘧啶代谢。基于上述报道,提示提示各种不同致畸因素均可能通过影响嘌呤和嘧啶的代谢而导致NTDs的发生。
结论
本研究基于非靶向代谢组学在神经管闭合期对孕鼠外周血清中内源性小分子代谢物进行检测,研究结果提示溶血磷脂酰胆碱可能是BaP暴露致NTDs的关键代谢标志物,并且联合转录组测序和组蛋白修饰检测技术发现致病机制可能涉及磷酸戊糖代谢途径中Aldob基因的组蛋白修饰。本研究结果可以为后续的人群研究提供参考,但尚需更深入的靶向研究对本项目中识别到的差异性代谢物进行验证,以明确其在疾病发生机制中的作用以及作为前期预测生物标志物的可能性。
参考文献
1 Copp AJ,Stanier P,Greene ND.Neural tube defects:recent advances,unsolved questions,and controversies.Lancet Neurol,2013,12:799-810.
2 Li Z,Ren A,Zhang L,et al.Extremely high prevalence of neural tube defects in a 4-county area in Shanxi Province,China.Birth Defects Res A Clin Mol Teratol,2006,76:237-240.
3 Lupo PJ,Symanski E,Waller DK,et al.Maternal exposure to ambient levels of benzene and neural tube defects among offspring:Texas,1999-2004.Environ Health Perspect,2011,119:397-402.
4 Li Z,Zhang L,Ye R,et al.Indoor air pollution from coal combustion and the risk of neural tube defects in a rural population in Shanxi Province,China.Am J Epidemiol,2011,174:451-458.
5 Ren A,Qiu X,Jin L,et al.Association of selected persistent organic pollutants in the placenta with the risk of neural tube defects.Proc Natl Acad Sci U S A,2011,108:12770-12775.
6 Lin S,Ren A,Wang L,et al.Oxidative stress and apoptosis in benzo[a]pyrene-induced neural tube defects.Free Radic Biol Med,2018,116:149-158.
7 Huang Y,Ren A,Wang L,et al.Casp8 hypomethylation and neural tube defects in association with polycyclic aromatic hydrocarbon exposure.Clin Epigenetics,2019,11:72.
8 Zabihi S,Loeken MR.Understanding diabetic teratogenesis:where are we now and where are we going.Birth Defects Res A Clin Mol Teratol,2010,88:779-790.
9 Zheng X,Su M,Pei L,et al.Metabolic signature of pregnant women with neural tube defects in offspring.J Proteome Res,2011,10:4845-4854.
10 Hansler A,Chen Q,Gray JD,et al.Untargeted metabolite profiling of murine embryos to reveal metabolic perturbations associated with neural tube closure defects.Birth Defects Res A Clin Mol Teratol,2014,100:623-632.
11 Akimova D,Wlodarczyk BJ,Lin Y,et al.Metabolite profiling of whole murine embryos reveals metabolic perturbations associated with maternal valproate-induced neural tube closure defects.Birth Defects Res,2017,109:106-119.
12 Greene ND,Copp AJ.Neural tube defects.Annu Rev Neurosci,2014,37:221-242.
13 Lin S,Wang C,Li Z,et al.Distinct H3K27me3 and H3K27ac modifications in neural tube defects Induced by Benzo[a]pyrene.Brain Sci,2023,13:334.
14 Li X,Fang P,Li Y,et al.Mitochondrial reactive oxygen species mediate lysophosphatidylcholine-Induced endothelial cell activation.Arterioscler Thromb Vasc Biol,2016,36:1090-1100.
15 Lauber K,Bohn E,Kröber SM,et al.Apoptotic cells induce migration of phagocytes via caspase-3-mediated release of a lipid attraction signal.Cell,2003,113:717-730.
16 Zhang W,He X,Yin H,et al.Allosteric activation of the metabolic enzyme GPD1 inhibits bladder cancer growth via the lysoPC-PAFR-TRPV2 axis.J Hematol Oncol,2022,15:93.
17 Plemel JR,Michaels NJ,Weishaupt N,et al.Mechanisms of lysophosphatidylcholine-induced demyelination:A primary lipid disrupting myelinopathy.Glia,2018,66:327-347.
18 Cecconi F,Piacentini M,Fimia GM.The involvement of cell death and survival in neural tube defects:a distinct role for apoptosis and autophagy.Cell Death Differ,2008,15:1170-1177.
19 Morriss GM,New DA.Effect of oxygen concentration on morphogenesis of cranial neural folds and neural crest in cultured rat embryos.J Embryol Exp Morphol,1979,54:17-35.
20 Li Q,Hakimi P,Liu X,et al.Cited2,a transcriptional modulator protein,regulates metabolism in murine embryonic stem cells.J Biol Chem,2014,289:251-263.
21 Yamaguchi Y,Miyazawa H,Miura M.Neural tube closure and embryonic metabolism.Congenit Anom(Kyoto),2017,57:134-137.
22 Herrero-Mendez A,Almeida A,Fernández E,et al.The bioenergetic and antioxidant status of neurons is controlled by continuous degradation of a key glycolytic enzyme by APC/C-Cdh1.Nat Cell Biol,2009,11:747-752.
23 Keuls RA,Kojima K,Lozzi B,et al.MiR-302 regulates glycolysis to control cell-cycle during neural tube closure.Int J Mol Sci,2020,21:7534.
24 Huang Q,Geng Z,Chen T,et al.Comparative proteomic analysis of plasma of children with congenital heart disease.Electrophoresis,2019,40:1848-1854.
25 Lian J,Xia L,Chen Y,et al.Aldolase B impairs DNA mismatch repair and induces apoptosis in colon adenocarcinoma.Pathol Res Pract,2019,215:152597.
26 Caspi M,Perry G,Skalka N,et al.Aldolase positively regulates of the canonical Wnt signaling pathway.Mol Cancer,2014,13:164.
27 Fox JT,Stover PJ.Folate-mediated one-carbon metabolism.Vitam Horm,2008,79:1-44.
28 Li K,Wahlqvist ML,Li D.Nutrition,one-carbon metabolism and neural tube defects:A Review.Nutrients,2016,8:741.
(收稿日期:2023-07-21)