·论著·
碳酸锂对小鼠胚胎神经发育细胞周期关键基因的影响
李莘 郭晓兰▲ 郭金 王秀伟 官臻 梁颖超 于佳璐 朱智强 杨爱云 王建华
【摘要】 目的 通过小鼠和细胞模型,探究碳酸锂(Li2CO3)在小鼠胚胎神经发育过程中对细胞周期及其关键基因的影响。 方法 利用课题组前期建立的Li2CO3诱导的神经管畸形(NTDs)小鼠模型,以350 mg/kg Li2CO3在胚胎第7.5 d干预C57BL/6J孕鼠,观察子代发育情况;利用0.5、1、1.5、2、2.5、3、5及10 mM的Li2CO3处理小鼠神经干细胞NE4Cs及小鼠胚胎成纤维细胞NIH3T3细胞系,采用噻唑兰、5-乙炔基-2-脱氧尿苷标记及流式细胞术检测细胞存活、增殖及周期;实时荧光定量聚合酶链式反应及免疫印迹技术检测细胞周期关键基因的表达。 结果 350 mg/kg Li2CO3影响胚胎发育,特别是神经系统发育,NTDs发生率32.7%(18/55);低浓度Li2CO3处理后明显提高细胞存活率,减少G1期细胞,增加S期与G2/M期,促进细胞增殖;小鼠和细胞模型中均发现Li2CO3干预后细胞周期关键基因cyclin A、cyclin D1、Cdk2及Cdk4表达显著上升(P<0.01)。 结论 Li2CO3通过上调细胞周期关键基因cyclin A、cyclin D1、Cdk2及Cdk4的表达,扰乱细胞周期引起细胞异常增殖,导致NTDs发生。
【关键词】 碳酸锂; 细胞周期; 神经管畸形
【中图分类号】 R71
基金项目:北京市自然科学基金(7222016,7244290),国家自然科学基金区域创新发展联合基金(U23A20420),首都儿科研究所创新工专项(CXYJ-2021-03),首都儿科研究所所级课题(JCYJ-2023-14),首都儿科研究所青年项目(QN-2024-27)
作者单位:100020北京,首都儿科研究所转化医学研究室;儿童发育营养组学北京市重点实验室
▲共同第一作者
通信作者:王建华(fywjh@163.com)
Effect of lithium carbonate on the key genes involved in cell-cycle regulation in mouse embryonic neural development
LI Shen, GUO Xiaolan, GUO Jin, WANG Xiuwei, GUAN Zhen, LIANG Yingchao, YU Jialu, ZHU Zhiqiang, YANG Aiyun, WANG Jianhua. Translational Medicine Laboratory, Beijing Key Laboratory of Child Development and Nutriomics, Capital Institute of Pediatrics, 100020 Beijing
[Abstract] Objective Using murine and cell models to explore the effects of Li2CO3 on the cell cycle during mouse embryonic neural development. Methods According to the Li2CO3-induced NTDs murine mode which we have established, 350mg/kg Li2CO3 was injected intraperitoneally into the C57BL/6J pregnant mice on embryonic day 7.5. The development of the offspring were observed. Li2CO3 in different concentrations(0.5,1,1.5, 2, 2.5, 3, 5 and 10mM) were used to treat the NE4Cs and NIH3T3. Cell survival, proliferation and cell cycle were detected by methylthiazolyldiphenyl tetrazolium bromide, 5-ethynyl-2-deoxyuridine labeling and flow cytometry. The quantitative real-time polymerase chain reaction and western blotting used to detect the expressions of cell cycle key genes. Results 350mg/kg Li2CO3 affected embryonic development. The incidence of NTDs was 32.7%(18/55). Treatment with the low concentration of Li2CO3 in NE4Cs and NIH3T3 cells increased cell survival, reduced the cells in G1 phase, most cells were in S and G2/M phases and promoted cell proliferation. Both in mice and cells models, the expressions of cell cycle key genes cyclin A, cyclin D1, Cdk2 and Cdk4 increased after Li2CO3 treatment(P<0.01). Conclusion Li2CO3 disturbed the cell cycle to cause abnormal cell proliferation leading to NTDs by up-regulating the expression of cell cycle key genes cyclin A, cyclin D1, Cdk 2 and Cdk 4.
[Key words] lithium carbonate; cell cycle; neural tube defects
碳酸锂(lithium carbonate,Li2CO3)作为一种一线心境稳定剂在临床上被广泛应用于躁狂症、双相情感障碍(bipolar disorder,BPD)等疾病的治疗[1-2]。其无成瘾性且无蓄积,治疗效果显著[3-4]。BPD是一种常见且严重的精神疾病[5],终生患病率约为2%[6]。女性BPD患者通常在十几岁到三十岁左右发病,虽然Li2CO3致畸已被证实,围孕期BPD患者仍需服用Li2CO3来稳定病情及防止停药后疾病的复发[7]。Li2CO3影响胚胎神经系统发育中最严重的是神经管畸形(neural tube defects,NTDs)[8]。NTDs是胚胎发育早期神经管闭合失败所致最严重的中枢神经系统先天畸形,包括脑膨出及脊柱裂等。NTDs不仅是新生儿死亡的主要原因,也是存活婴儿终身残疾的重要原因[9],为家庭和社会带来沉重的负担。神经管闭合期间神经上皮细胞处于快速增殖状态,周期短至4~6 h,同时一些神经上皮细胞逐步退出细胞周期并开始分化为神经元。神经管闭合过程中神经上皮细胞的异常增殖会导致露脑畸形[10],保持稳定的细胞周期对防止NTDs的发生非常重要。细胞周期蛋白(cyclins)和细胞周期蛋白依赖性激酶(cyclin-dependent kinases,Cdks)协作调控细胞周期[11]。一种特定的细胞周期蛋白/Cdks相互作用导致下游分子的激活或解离,决定了细胞周期进程的下一个阶段[12]。Li2CO3对胚胎神经发育中细胞周期的影响及机制尚不明确。
本课题组前期已建立Li2CO3诱导的NTDs小鼠模型,与对照组相比,NTDs组胚胎神经组织异常增殖,母体Li2CO3暴露引起胚胎神经组织异常增殖[13]。本研究利用前期建立的Li2CO3诱导的NTDs小鼠模型、小鼠神经干细胞NE4Cs及小鼠胚胎成纤维NIH3T3细胞系,采用噻唑兰法(methylthiazolyldiphenyl-tetrazolium bromide,MTT)、5-乙炔基-2-脱氧尿苷标记(5-ethynyl-2- deoxyuridine,EdU)、流式细胞术、免疫印迹(western blotting,WB)及实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,RT-qPCR)技术探究Li2CO3在小鼠胚胎神经发育过程中对细胞周期及其关键基因的影响,为深入研究母体Li2CO3暴露下调控子代神经发育的分子机制提供实验基础,为阐明NTDs的发病机制及防控提供新的思路。
材料与方法
一、动物模型建立
本研究由首都儿科研究所伦理委员会批准(批准号:DWLL2023001)。无特定病原体级(specific pathogen free,SPF)C57BL/6J雌雄小鼠(6~8周,18g~20g)从北京维通利华公司购买,常规饲养于首都儿科研究所SPF级动物房。小鼠适应性喂养2~3 d后,18:00时按雌雄1:1合笼,次日早8:00检查到阴栓者判定为胚胎第0.5 d(embryonic day 0.5,E0.5),E7.5小鼠随机分为对照组与实验组,称重后,实验组腹腔注射最佳造模剂量350 mg/kg Li2CO3[13](Sigma,554-13-2),对照组腹腔注射等体积的生理盐水。E13.5解剖,在体视显微镜下剥离出小鼠胚胎,观察其畸形情况并拍照,记录畸形情况,计算致畸率,测量顶臀径与体重。观察Li2CO3对胚胎发育的影响。取各组胚胎神经组织样本,于-80℃冰箱冻存。
二、细胞培养和检测
1.细胞培养:本研究采用小鼠神经干细胞NE4Cs与小鼠胚胎成纤维细胞NIH3T3细胞系进行研究。将NE4Cs与NIH3T3细胞分别复苏于含有10%胎牛血清(Gibco,16000044)的MEM(Thermo,11090081)与DMEM培养基(Thermo,11965092)中,NE4Cs与NIH3T3正常贴壁后培养48 h传代,将混匀的单细胞悬液分别按照1∶8与1∶5分装于新的细胞培养皿中,置37 ℃,5%CO2细胞培养箱中培养。
2. MTT实验检测细胞存活:收集对数期NE4Cs与NIH3T3细胞制成细胞悬液,以100 μL/孔加至96孔板中,空白孔只加入PBS溶液。培养24 h后,实验组加入0.5、1、1.5、2、2.5、3、5及10 mM的Li2CO3,对照组加入等体积的PBS溶液,继续培养24 h后,每孔加入10 μL 5 mg/mL的MTT(Sigma,M2003)溶液,进入培养箱继续避光孵育4 h。吸弃孔内液体,每孔加入150 μL DMSO(Sigma,M2003)终止反应,37 ℃水浴锅内孵育10 min,摇床低速振荡10 min至蓝色结晶充分溶解,酶标仪在490 nm波长处检测各孔光密度值。细胞存活率=[(OD实验组-OD空白孔)/(OD对照组-OD空白孔)]×100%
3. EdU实验检测细胞增殖:利用EdU标记试剂盒(Invitrogen,C10420)进行细胞增殖检测。EdU标记:将NE4Cs与NIH3T3细胞分别培养至对数生长期,根据MTT实验结果,选取Li2CO3处理后每种细胞存活率最高的浓度来处理细胞,向NE4Cs及NIH3T3培养皿中加入Li2CO3,使培养基中Li2CO3的终浓度分别为1.5 mM和2 mM,对照组加入等体积的PBS溶液,继续培养24 h后,将每个培养皿中的培养液更换为EdU标记液(培养基与EdU工作液按1∶1均匀混合),放入细胞孵箱中孵育4~6 h;倒掉含有EdU的培养基,将预热过的4%多聚甲醛加入到每个培养皿中,37 ℃固定20 min;倒掉液体,PBS室温清洗5 min/3次;将Triton X-100(0.1%TritonX-100溶于PBS)加入培养皿中,室温晃动孵育10~20 min;倒掉液体,PBS室温清洗5 min/3次。
检测EdU:将检测反应液加入到每个培养皿中,轻柔晃匀,室温避光孵育25~40 min;倒掉液体,PBS室温清洗5分钟/3次;将细胞核染料DAPI溶液加入到每个培养皿中,室温避光摇动孵育10 min;倒掉液体,PBS室温清洗5分钟/3次;利用激光共聚焦显微镜进行检测,EdU显示增殖细胞为绿色荧光,细胞核染料显示细胞核为蓝色荧光,拍照记录每组EdU阳性细胞数占总细胞数的比例。
4.流式细胞术检测细胞周期:利用细胞周期检测试剂盒(索莱宝,CA1510)进行检测,将NE4Cs与NIH3T3细胞分别培养至对数生长期,根据MTT实验结果,选取Li2CO3处理后每种细胞存活率最高的浓度来处理细胞,向NE4Cs及NIH3T3培养皿中加入Li2CO3,使培养基中Li2CO3的终浓度分别为1.5 mM和2 mM,对照组加入等体积的PBS溶液,继续培养24 h后,收集Li2CO3处理后的NE4Cs及NIH3T3细胞,PBS洗涤后,调整每组细胞浓度为1×106/mL,取1 mL单细胞悬液离心后加预冷的70%乙醇600 μL,置于4 ℃固定4 h;PBS室温清洗5分钟/3次;将100 μL RNase A 加入到细胞沉淀中,充分混合,37 ℃孵育30 min;加入核酸染料碘化丙啶400 μL,4 ℃避光孵育30 min;300目尼龙膜过滤后,送入流式细胞仪进行细胞周期检测。
5.RT-qPCR检测mRNA表达水平:以1.5 mM与2 mM分别处理NE4Cs和NIH3T3细胞24h,对照组加入等体积的PBS溶液,具体操作同“流式细胞术检测”部分,利用胰酶(Sigma,T4049)消化,离心后收集Li2CO3处理后的NE4Cs及NIH3T3细胞。利用RNA提取试剂盒(Qiagen,74104)提取对照组及NTDs组的胚胎神经组织,Li2CO3处理后的NE4Cs及NIH3T3细胞的RNA,测定RNA浓度后利用cDNA逆转录试剂盒(Abm,G592)逆转录为cDNA,测定各组cDNA浓度后,使用荧光染料SYBRGreen Ⅰ进行RT-qPCR扩增,反应体系为20 μL,每个基因设置4个重复孔。反应条件为:第一阶段30 s,95 ℃;第二阶段5 s,95 ℃,60 ℃退火30 s,40 s延伸,循环40次;第三阶段:溶解曲线分析,95 ℃变性1 min;降温至55 ℃反应30 s。反应完成后,根据各目的基因和管家基因GAPDH的Threshold cycle(Ct值)平均值,计算出目的基因的相对表达量,以 2- △ △ Ct 表示。引物设计见表1。
表1 RT-qPCR反应中各基因的扩增引物
Table 1 Primers for amplification of genes in RT-qPCR

GenesForward Primer Reverse Primer cyclin A5'-GGGCACCTCGAGGCATTC-3'5'-CCTATTACCCGTCGAGTCTTGAG-3'cyclin D15'-TGGAGCCCCTGAAGAAGAG-3'5'-AAGTGCGTTGTGCGGTAGC-3'Cdk25'-GTGACCCTGTGGTACCGAGCAC-CTG-3'5'-GGTTTTGCTCTTGGATGTGGGCAT-GG-3'Cdk45'-CCGTCAGCACAGTTCGTGAG-3'5'-CCATCAGCCGTACAACATTGG-3'GAPDH5'-CGTCCCGTAGACAAAATGGT-3'5'-GAATTTGCCGTGAGTGGAGT-3'
GAPDH, glyceraldehyde-3-phosphate dehydrogenase.
6. WB检测蛋白质表达水平:利用蛋白提取试剂盒(生工,C500006)提取1.5 mM Li2CO3处理24 h后NE4Cs的蛋白,BCA蛋白定量试剂盒(Thermo,23225)检测蛋白浓度,配制样品煮沸变性后进行十二烷基磺酸钠—聚丙烯酰胺凝胶电泳。电泳结束后进行半干转膜40 min,随后置于5%脱脂奶粉中封闭1~2 h后,4 ℃过夜孵育Ⅰ抗cyclin A(Thermo,PA5-36048)、cyclin D1(Abcam,ab16663)、Cdk2(Abcam,ab32147)及Cdk4(Abcam,ab137675)。次日室温孵育Ⅱ抗2h。PBS清洗后使用超灵敏化学发光成像仪扫描。
三、统计学分析
应用SPSS 25.0软件进行数据分析,数据以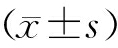 表示。多组间先进行单因素方差分析,差异有统计学意义,进一步两两比较采用Dunnett′s t检验。以P<0.05为差异具有统计学意义。
表示。多组间先进行单因素方差分析,差异有统计学意义,进一步两两比较采用Dunnett′s t检验。以P<0.05为差异具有统计学意义。
结 果
一、母体碳酸锂暴露影响胚胎神经发育
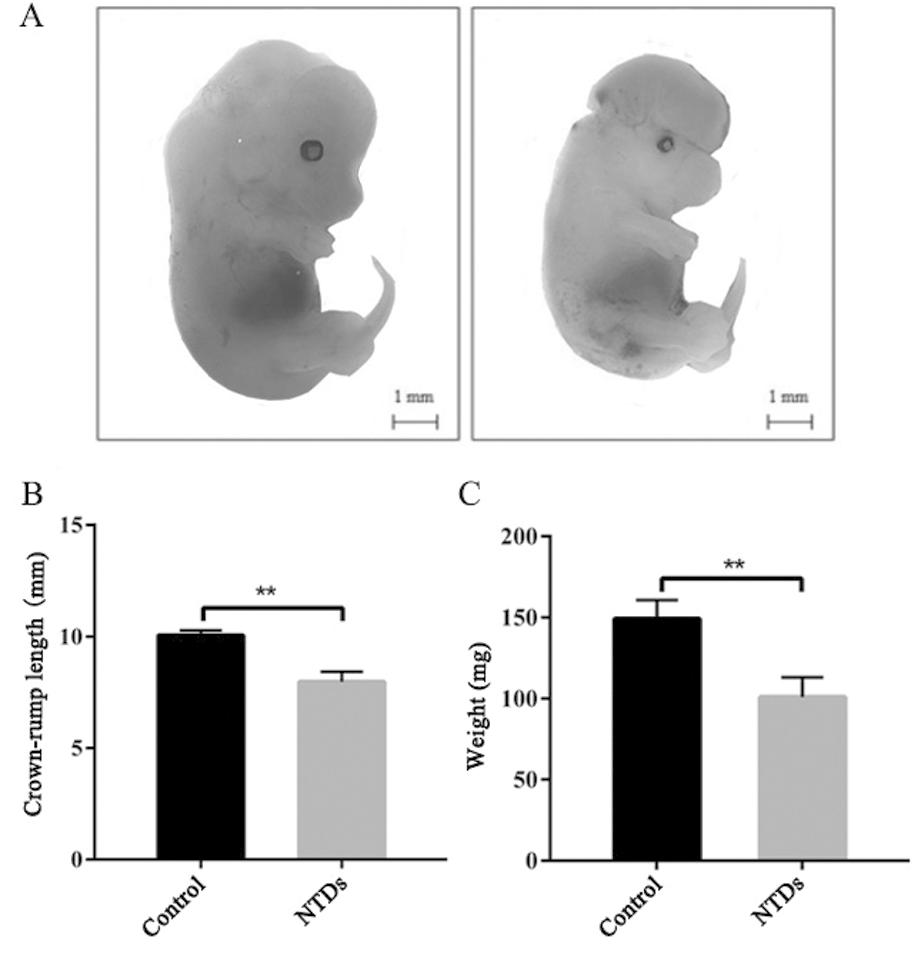
采用课题组前期建立的Li2CO3诱导NTDs小鼠模型,于E7.5利用350 mg/kg的Li2CO3腹腔注射E7.5孕鼠,E13.5观察胚胎神经发育。体式镜下观察,发现对照组胚胎的神经管光滑平整,闭合完全,Li2CO3组神经管未闭合,出现脑膨出等NTDs表型(图1A),如表2所示NTDs的发生率为32.7%(18/55)。同时测量各组胚胎顶臀径和体重,结果如图B-C所示:对照组平均顶臀径为10.1 mm,Li2CO3组为8 mm;Li2CO3组平均体重为101 mg,远小于对照组平均体重149.3 mg,Li2CO3组在胚胎顶臀径和体重方面与对照组具有差异性显著(P<0.01),母体Li2CO3暴露影响胚胎生长发育,特别是胚胎神经发育。
表2 Li2CO3对小鼠胚胎神经发育的影响
Table 2 The effects of Li2CO3 on mouse embryonic neural development

Li2CO3(mg/kg)EmbryosnNormaln(%)Resorptionn(%)NTDsn(%)Other malformationsn(%)05050(100)0(0)0(0)0(0)3505513(23.6)5(9.1)18(32.7)9*;3#;5&;2§(34.6)
*Eye malformations include microphthalmia and anophthalmia; #Facial malformation; &Craniofacial malformation; §Growth retardation.
二、碳酸锂增强胚胎神经组织中细胞周期关键基因的表达
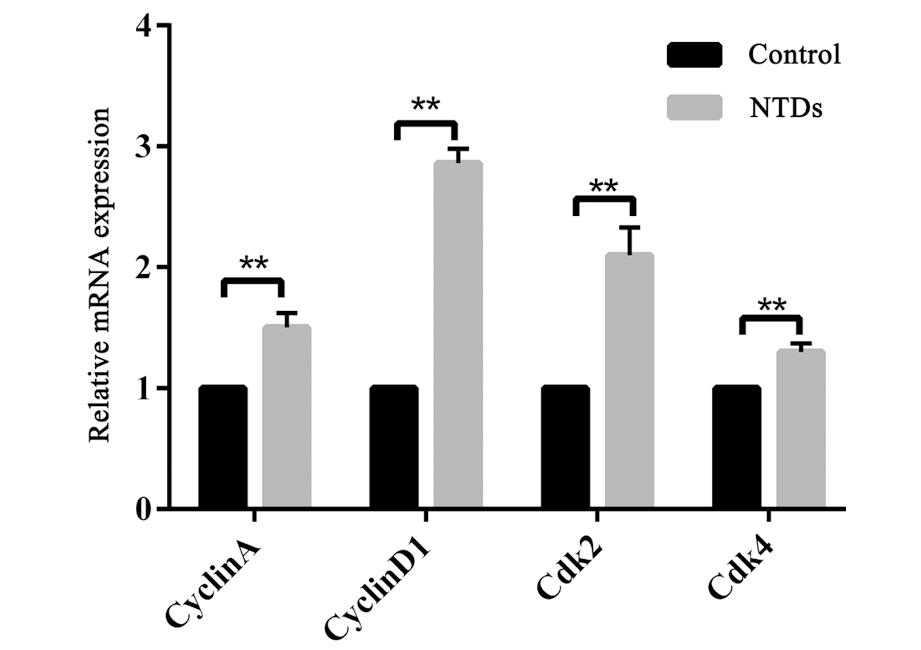
课题组前期发现Li2CO3诱导的NTDs小鼠模型中与对照组相比,NTDs组胚胎神经组织异常增殖[13],为了探究Li2CO3对小鼠胚胎发育中细胞周期的影响,选取E13.5对照组、Li2CO3诱导NTDs组的胚胎神经组织对细胞周期关键基因的表达进行了检测。RT-qPCR结果如图2所示,与对照组相比,NTDs组细胞周期关键基因 cyclin A、cyclin D1、Cdk2及Cdk4的表达上升(P<0.01),其中cyclin D1上升幅度最大。表明Li2CO3增强胚胎神经发育中细胞周期关键基因 cyclin A、cyclin D1、Cdk2及Cdk4的表达,导致胚胎神经组织异常增殖。
三、碳酸锂影响细胞周期促进细胞增殖
为了探究Li2CO3对细胞存活的影响,分别选取0、0.5、1、1.5、2、2.5、3、5及10 mM的Li2CO3处理小鼠神经干细胞NE4Cs及小鼠胚胎成纤维细胞NIH3T3细胞系,Li2CO3处理24 h后进行MTT检测,结果如图3所示,在两种细胞中低浓度Li2CO3能促进细胞存活(P<0.01),而高浓度(>5mM)抑制细胞存活(P<0.01)。从整体看,与NIH3T3相比,Li2CO3对NE4Cs促存活的作用更强。与动物实验结果一致,选取Li2CO3处理后每种细胞存活率最高的浓度来处理细胞(NE4Cs为1.5 mM,NIH3T3为2 mM),用于细胞增殖及周期的检测。
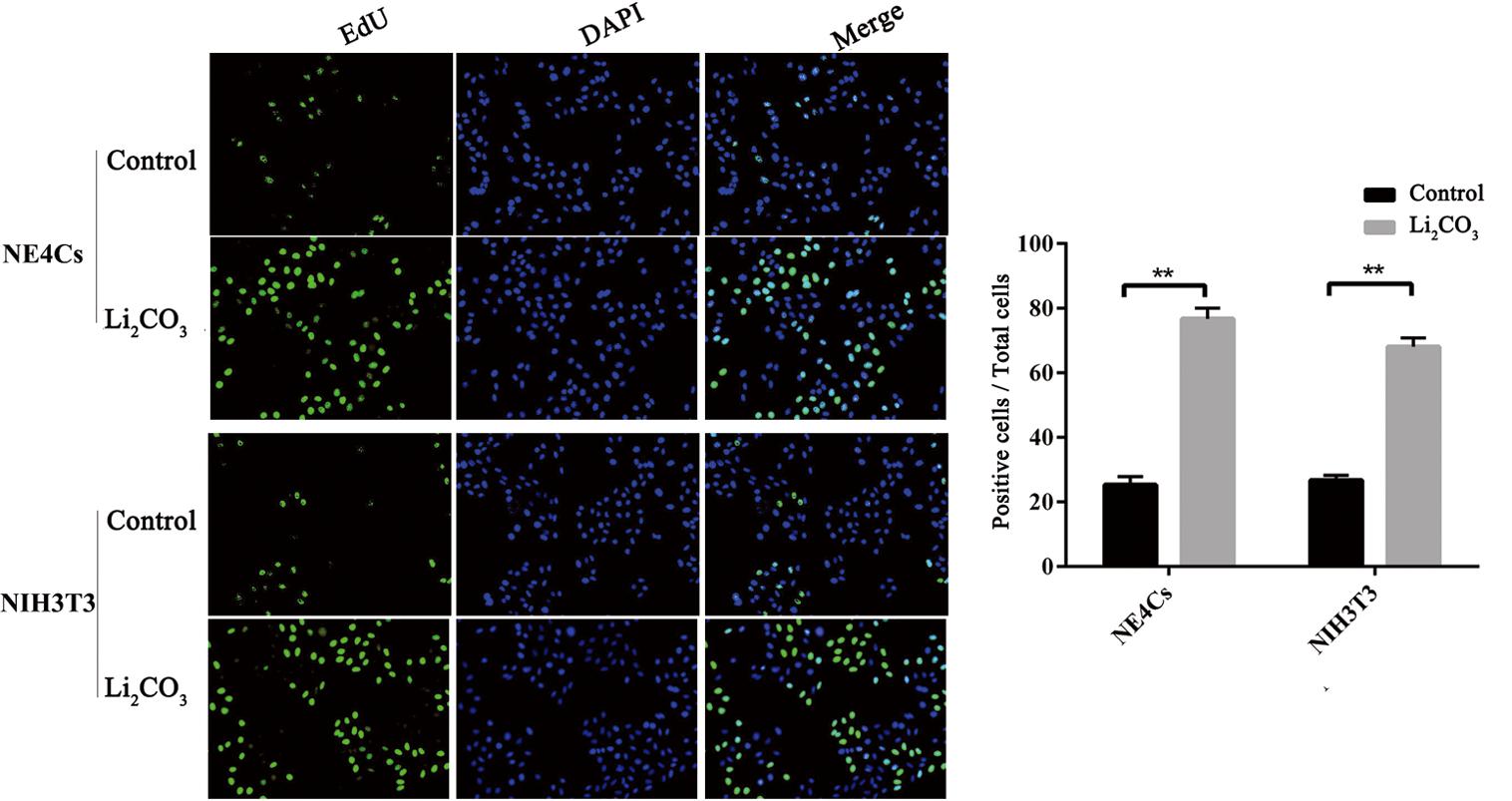
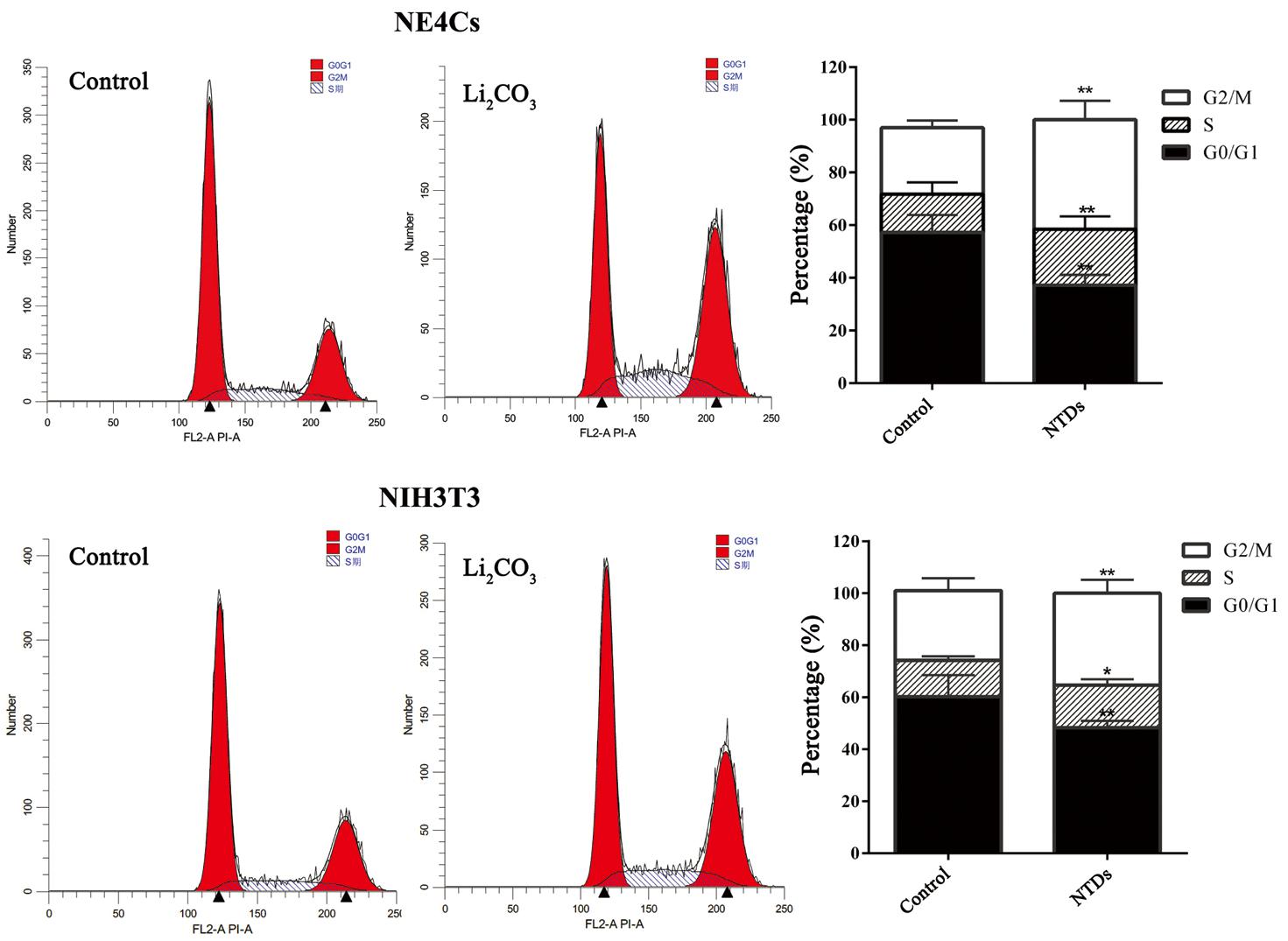
EdU结果显示与对照组(0 mM)相比,Li2CO3处理组EdU阳性细胞数显著增多(P<0.01),NE4Cs增长幅度较大(图4)。利用流式细胞术对各组细胞周期检测发现(图5),与对照组相比,每种细胞Li2CO3处理后,DNA合成前期(first gap,G1)期细胞占总细胞的百分比显著降低,DNA合成期(synthesis,S)期与DNA合成后期(second gap,G2)及分裂期(mitotic, M)期细胞比例增高(P<0.01)。低浓度Li2CO3处理后明显提高细胞存活率,使处在G1期的细胞减少,大部分细胞处于S期与G2/M期,促进细胞增殖;从变化幅度来看,与NIH3T3细胞相比,Li2CO3对NE4Cs促增殖的作用更明显。
四、碳酸锂增强细胞内调控细胞周期关键基因的表达
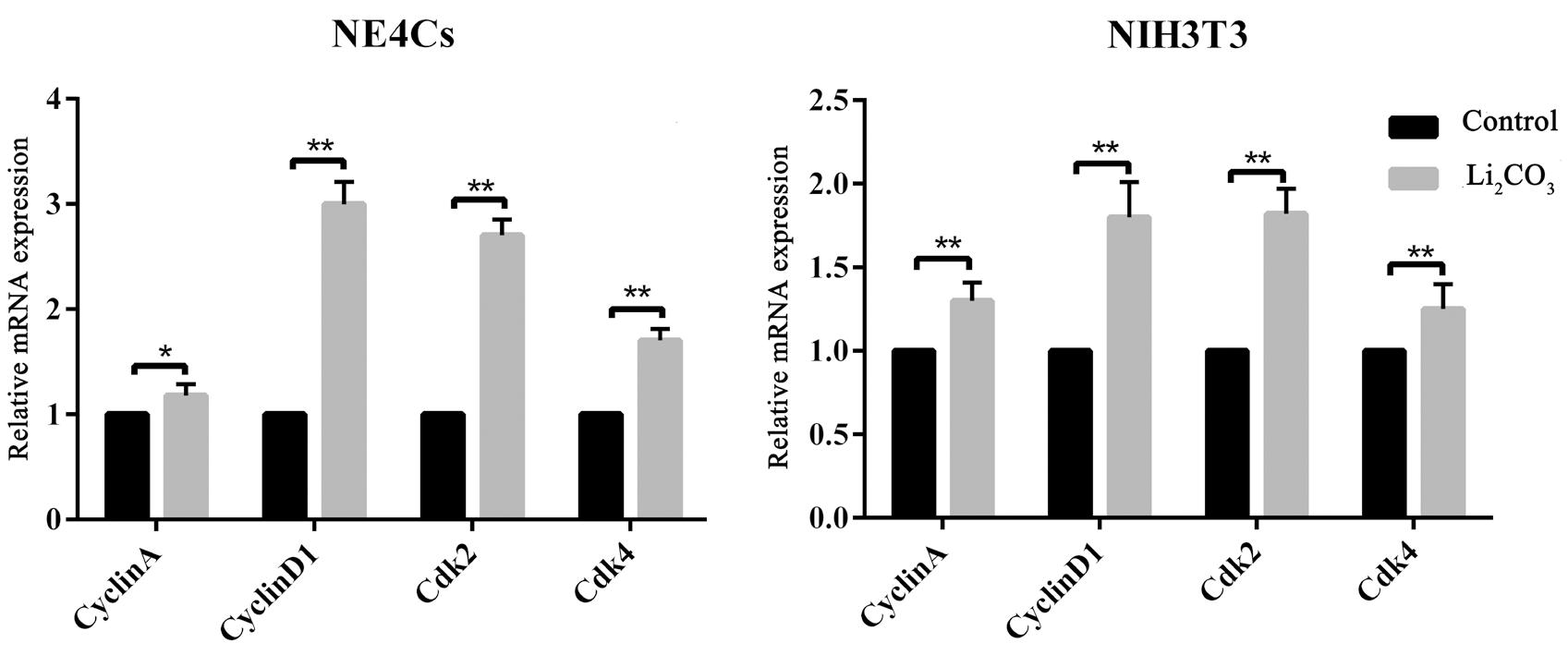
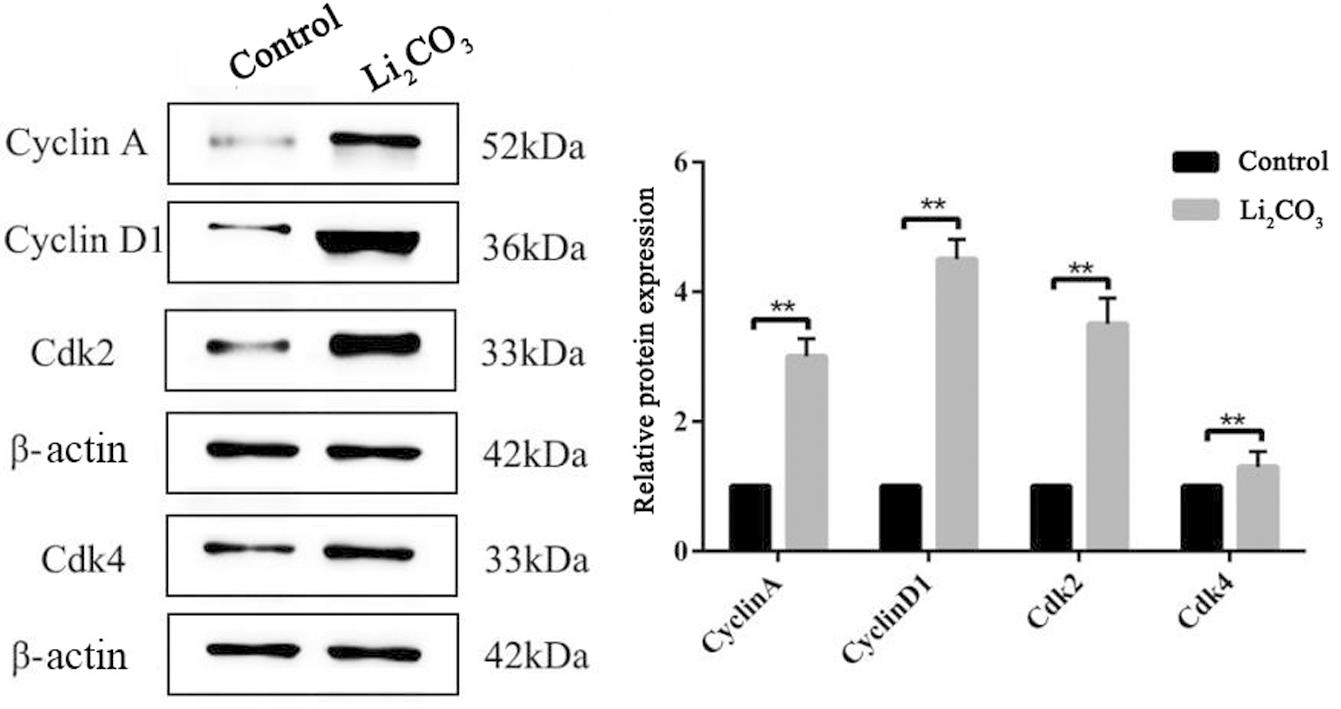
选取1.5mM与2mM Li2CO3分别处理NE4Cs及NIH3T3,24h后检测调控细胞周期关键基因的表达,在mRNA水平上如图6所示,同种细胞中,与对照组相比,Li2CO3处理后增加细胞周期关键基因cyclin A、cyclin D1、Cdk2及Cdk4的表达(P<0.01),其中cyclin D1与Cdk2上升幅度较大。对Li2CO3处理后的NE4Cs进一步检测了各基因蛋白水平的表达,与mRNA结果基本一致(图7)。这些结果与Li2CO3处理后的胚胎神经组织中一致。综上,发现 Li2CO3通过上调细胞周期关键基因cyclin A、cyclin D1、Cdk2及Cdk4的表达,使处在G1期的细胞减少,增加处在S和G2/M期的细胞,扰乱细胞周期引起细胞异常增殖,导致NTDs的发生。
讨 论
Li2CO3导致NTDs一直受到广泛关注[8],但其机制仍不明确。人群研究发现围孕期母体的锂暴露增加了胎儿NTDs的风险;在动物实验中也观察到Li2CO3致NTDs[14];体外锂处理产生的唯一畸形是露脑畸形[15]。本研究采用课题组前期建立的Li2CO3诱导的NTDs小鼠模型[13],于E7.5利用Li2CO3最佳造模剂量(350mg/kg)腹腔注射E7.5孕鼠,E13.5观察胚胎神经发育。重复实验表明该模型NTDs发生率稳定,为32.7%。同时通过测量各组胚胎顶臀径和体重发现,Li2CO3诱导的NTDs组顶臀径和体重均显著低于对照组,Li2CO3处理影响胚胎生长发育,特别是胚胎神经发育。
神经管闭合期间神经上皮细胞过度增殖与NTDs密切相关[10],在既往研究的小鼠模型中Phactr4突变引起细胞过度增殖导致NTDs的发生[16];凋亡相关基因caspase-3、Apaf1或P53敲除/突变的小鼠都会出现NTDs[17],这表明神经管闭合需要细胞增殖与凋亡的平衡。因此,准确、有序地调控细胞增殖是促进神经管正常闭合的关键因素,当稳定的细胞增殖周期被破坏时会导致NTDs的发生。课题组前期在Li2CO3诱导的NTDs小鼠模型中发现,与对照组相比,NTDs胚胎神经组织发生异常增殖。本研究利用NE4Cs与NIH3T3进一步研究Li2CO3对细胞增殖及周期的影响,结果发现低浓度Li2CO3大幅度提高细胞存活率,减少G1期细胞,增加S期与G2/M期细胞比例,扰乱细胞周期引起细胞异常增殖,其中处理NE4Cs及NIH3T3最佳浓度分别为1.5mM和2mM;而高浓度则抑制细胞存活。此外,与NIH3T3细胞相比,Li2CO3对NE4Cs促增殖的作用更显著,Li2CO3表明对小鼠胚胎神经发育起重要作用。锂离子以剂量依赖性调节细胞增殖水平在以往不同细胞的实验中已有报道:有研究报道锂离子可以促进集合管细胞、雪旺细胞和神经干细胞的细胞增殖[18-19];低剂量的锂离子能够抑制神经前体细胞的凋亡[20],促进其增殖[21];间充质干细胞的增殖与分化被锂离子促进已被证实[22-24];另有研究表明锂离子诱导肝细胞自噬并保持其增殖活性[25],以上结果与本研究一致。Li2CO3可能通过调控细胞异常增殖导致NTDs。
神经系统的发育需要严格控制细胞的增殖和分化,细胞周期这一过程中起着重要作用。神经管闭合期间,神经上皮细胞对代谢变化十分敏感,研究发现体内糖酵解产物增加会导致细胞周期缩短,细胞异常增殖导致NTDs发生[10];另有研究表明补充叶酸可通过促进细胞周期从S期向G2期过渡来补偿Pax3基因的缺失,从而预防NTDs[26]。有研究报道了E9.5和E10.5 NTDs胚胎与正常胚胎相比差异表达的基因,其中细胞周期相关基因占比例最大[27]。在细胞周期过程中,G1期向S期的过渡是调控细胞增殖的关键。cyclin D/Cdk4复合物在此过程中起关键作用,特别是cyclin D1[28]。cyclin A/Cdk2复合物则是S期向G2期过渡的指引。有研究认为Cdk4的缺失是胚胎致死的关键[29];Cdk2的表达水平在胚胎发育期到出生后变化剧烈,在E12.5时达到最高值[30],这都表明细胞周期关键基因在胚胎发育中起重要作用。本研究在Li2CO3诱导的NTDs小鼠模型中发现,与对照组相比,NTDs组胚胎神经组织中细胞周期关键基因cyclin A、cyclin D1、Cdk2及Cdk4的表达显著增加;在Li2CO3处理后的两种细胞模型中同样发现了这些细胞周期关键基因表达增高,同时细胞异常增殖。既往研究发现锂离子增加神经母细胞瘤细胞中cyclin A、cyclin D1、Cdk2及Cdk4的表达[31];研究表明急性和慢性锂治疗后上调小鼠大脑中cyclin D1的表达[32];近新研究发现Li2CO3可协同其他药物大幅度提高cyclin D1及Cdk4的表达促进神经发生[33],此外Li2CO3可逆转抗增殖促凋亡药物对cyclin D1表达的抑制作用[34,35],以上报道与本研究一致。说明Li2CO3通过增加细胞周期关键基因cyclin A、cyclin D1、Cdk2及Cdk4的表达,扰乱细胞周期引起细胞异常增殖。
综上所述,本研究利用前期建立的Li2CO3诱导NTDs小鼠模型、NE4Cs及NIH3T3探究Li2CO3在小鼠胚胎神经发育过程中对细胞周期及其关键基因的影响,结果发现Li2CO3影响胚胎发育,特别是胚胎神经系统,导致NTDs的发生,与对照组相比NTDs组胚胎神经组织中cyclin A、cyclin D1、Cdk2及Cdk4的表达显著增高,引起异常增殖;在两种细胞模型中发现Li2CO3处理后上调细胞内cyclin A、cyclin D1、Cdk2及Cdk4的的表达,细胞存活率显著提高,处在G1期的细胞减少,S和G2/M期细胞增多,细胞异常增殖。与NIH3T3细胞相比,Li2CO3对NE4Cs促增殖作用更显著。本研究发现Li2CO3通过上调细胞周期关键基因cyclin A、cyclin D1、Cdk2及Cdk4的表达扰乱细胞周期引起细胞异常增殖,导致NTDs的发生。为深入研究母体Li2CO3暴露下调控子代神经发育的分子机制提供实验基础,为阐明NTDs的发病机制及防控提供新的思路。
参考文献
1 Rybakowski JK.Lithium treatment in the era of personalized medicine.Drug Dev Res,2021,82:621-627.
2 Ochoa E.Lithium as a neuroprotective agent for bipolar disorder:An overview.Cell Mol Neurobiol,2022,42:85-97.
3 Rissardo JP,Caprara A,Durante  ,et al.Lithium-associated movement disorder:A literature review.Brain Circ,2022,8:76-86.
,et al.Lithium-associated movement disorder:A literature review.Brain Circ,2022,8:76-86.
4 Wangqiang L,Hejian T,Fengli S,et al.Preventive effects of lithium carbonate on antidepressant-induced switch during depressive episodes:Chinese data analysis.Altern Ther Health Med,2022,28:58-64.
5 Hu X,Yu C,Dong T,et al.Biomarkers and detection methods of bipolar disorder.Biosens Bioelectron,2023,220:114842.
6 Levchenko A,Plotnikova M.Genomic regulatory sequences in the pathogenesis of bipolar disorder.Front Psychiatry,2023,14:1115924.
7 Hermann A,Gorun A,Benudis A.Lithium use and non-use for pregnant and postpartum women with bipolar disorder.Curr Psychiatry Rep,2019,21:114.
8 Grover S,Gupta N.Lithium-associated anencephaly.Can J Psychiatry,2005,50:185-186.
9 Zhang L,Dong Y,Wang W,et al.Ethionine suppresses mitochondria autophagy and induces apoptosis via activation of reactive oxygen species in neural tube defects.Front Neurol,2020,11:242.
10 Keuls RA,Kojima K,Lozzi B,et al.MiR-302 regulates glycolysis to control cell-cycle during neural tube closure.Int J Mol Sci,2020,21:7534.
11 Joseph C,Mangani AS,Gupta V,et al.Cell Cycle Deficits in neurodegenerative disorders:uncovering molecular mechanisms to drive innovative therapeutic development.Aging Dis,2020,11:946-966.
12 Beukelaers P,Vandenbosch R,Caron N,et al.Cycling or not cycling:cell cycle regulatory molecules and adult neurogenesis.Cell Mol Life Sci,2012,69:1493-1503.
13 Li S,Luo D,Yue H,et al.Neural tube defects:role of lithium carbonate exposure in embryonic neural development in a murine model.Pediatr Res,2021,90:82-92.
14 Smithberg M,Dixit PK.Teratogenic effects of lithium in mice.Teratology,1982,26:239-246.
15 Hansen DK,Walker RC,Grafton TF.Effect of lithium carbonate on mouse and rat embryos in vitro.Teratology,1990,41:155-160.
16 Kim TH,Goodman J,Anderson KV,et al.Phactr4 regulates neural tube and optic fissure closure by controlling PP1-,Rb-,and E2F1-regulated cell-cycle progression.Dev Cell,2007,13:87-102.
17 Zhao J,Tian Y,Zhang H,et al.p53 Mutant p53(N236S) Induces Neural Tube Defects in Female Embryos.Int J Biol Sci,2019,15:2006-2015.
18 Lo A C,Houenou L J,Oppenheim R W.Apoptosis in the nervous system:morphological features,methods,pathology,and prevention.Arch Histol Cytol,1995,58:139-149.
19 Copp A J,Greene N D.Genetics and development of neural tube defects.J Pathol,2010,220:217-230.
20 Cabrera O,Dougherty J,Singh S,et al.Lithium protects against glucocorticoid induced neural progenitor cell apoptosis in the developing cerebellum.Brain Res,2014,1545:54-63.
21 Contestabile A,Greco B,Ghezzi D,et al.Lithium rescues synaptic plasticity and memory in Down syndrome mice.J Clin Invest,2013,123:348-361.
22 Dong BT,Tu GJ,Han YX,et al.Lithium enhanced cell proliferation and differentiation of mesenchymal stem cells to neural cells in rat spinal cord.Int J Clin Exp Pathol,2015,8:2473-2483.
23 Liu J,Ju P,Zhou Y,et al.Six2 Is a Coordinator of liCl-induced cell proliferation and apoptosis.Int J Mol Sci,2016,17:1504.
24 Li J,Wang W,Li M,et al.Repair of segmental bone defect using tissue engineered heterogeneous deproteinized bone doped with lithium.Sci Rep,2021,11:4819.
25 Dossymbekova R,Bgatova N,Tungushbayeva Z,et al.Effect of lithium carbonate on autophagy and proliferative activity of isolated hepatocytes.Biochem Biophys Res Commun,2020,528:343-346.
26 Sudiwala S,Palmer A,Massa V,et al.Cellular mechanisms underlying Pax3-related neural tube defects and their prevention by folic acid.Dis Model Mech,2019,12:dmm042234.
27 Li X,Yang Z,Zeng Y,et al.Cell cycle-related genes p57kip2,Cdk5 and Spin in the pathogenesis of neural tube defects.Neural Regen Res,2013,8:1863-1871.
28 Wang Y,Xu P,Qiu L,et al.CXCR7 Participates in CXCL12-mediated cell cycle and proliferation regulation in mouse neural progenitor cells.Curr Mol Med,2016,16:738-746.
29 Campbell GJ,Hands EL,Van de Pette M.The role of CDKs and CDKIs in murine development.Int J Mol Sci,2020,21:5343.
30 Ikeda Y,Matsunaga Y,Takiguchi M,et al.Expression of cyclin E in postmitotic neurons during development and in the adult mouse brain.Gene Expr Patterns,2011,11:64-71.
31 Pizarro JG,Folch J,Esparza JL,et al.A molecular study of pathways involved in the inhibition of cell proliferation in neuroblastoma B65 cells by the GSK-3 inhibitors lithium and SB-415286.J Cell Mol Med,2009,13:3906-3917.
32 De-Paula VJ,Dos Santos C,Luque M,et al.Acute and chronic lithium treatment increases Wnt/β-catenin transcripts in cortical and hippocampal tissue at therapeutic concentrations in mice.Metab Brain Dis,2021,36:193-197.
33 Wang Z,Cheng Y,Lu Y,et al.Baicalin Coadministration with Lithium Chloride Enhanced Neurogenesis via GSK3β Pathway in Corticosterone Induced PC-12 Cells.Biol Pharm Bull,2022,45:605-613.
34 Mu YR,Cai L,Zhou MY,et al.Acetazolamide ameliorates the severity of collagen-induced arthritis in rats:Involvement of inducing synovial apoptosis and inhibiting Wnt/β-catenin pathway.Int Immunopharmacol,2021,90:107214.
35 Cai L,Zong P,Zhou MY,et al.7-Hydroxycoumarin mitigates the severity of collagen-induced arthritis in rats by inhibiting proliferation and inducing apoptosis of fibroblast-like synoviocytes via suppression of Wnt/β-catenin signaling pathway.Phytomedicine,2022,94:153841.
(收稿日期:2023-08-11)



 ,et al.Lithium-associated movement disorder:A literature review.Brain Circ,2022,8:76-86.
,et al.Lithium-associated movement disorder:A literature review.Brain Circ,2022,8:76-86.