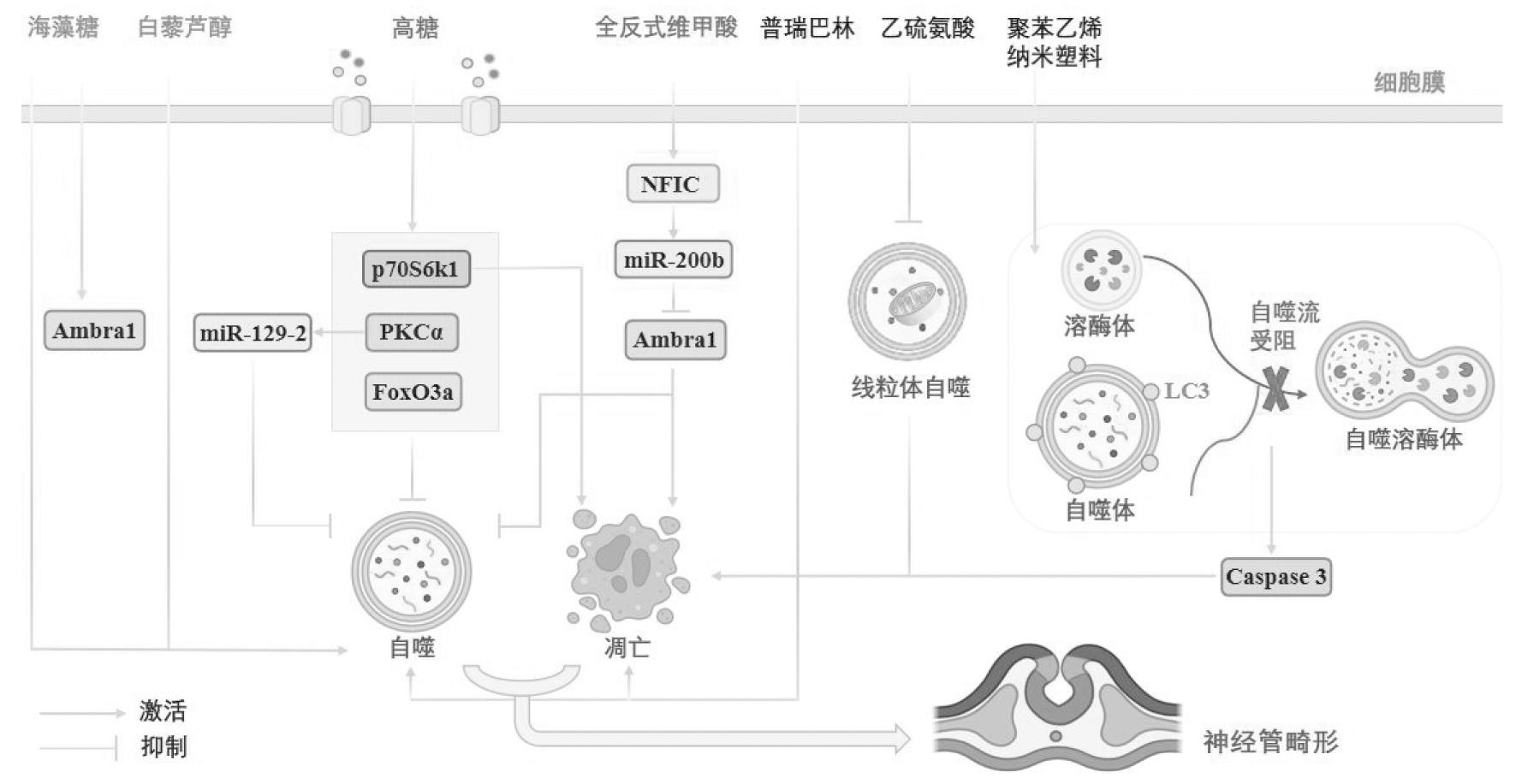
图1 细胞自噬在NTDs中的作用机制图
·综述·
先天性畸形是指由于基因突变或母体暴露于包括感染在内的环境因素,在胚胎发生和胎儿发育过程中出现的器官形态发生的单一或多个缺陷。神经管畸形(neural tube defects,NTDs)是影响中枢神经系统的主要结构性出生缺陷,是最常见的先天性畸形之一,可造成孕妇流产、围产儿和婴儿死亡或终身残疾[1]。据估计,全球NTDs的平均流行率为每1000名新生儿中有2例,每年全球约有21.4万~32.2万名孕妇受到影响[2]。脊柱裂、脑膨出和无脑畸形,是最常见的NTDs类型。颅骨裂和无脑畸形相对罕见[2]。脊柱裂通过损伤脊髓和神经导致运动、感觉和自主功能受损或丧失,而脑膨出则导致脑疝,导致各种认知障碍[3]。在高等脊椎动物中,神经管是在神经板的塑造、弯曲和融合过程产生的,由两侧的神经皱襞与背中线融合形成。NTDs起源于胚胎发生期间,是由于神经管闭合未完成导致[4]。NTDs病因复杂,其发病差异可能是由于如环境和遗传等多种风险因素协同作用导致,例如营养状况、肥胖、糖尿病、环境毒物以及遗传易感性等[3]。已知补充叶酸可以降低NTDs患病率,但仍然有相当数量的胎儿存在叶酸抵抗的情况[5]。因此,明确NTDs发病机制并做到早期预防对于提高胎儿生存率和生活质量具有十分重要的意义。已有许多研究表明,细胞自噬在NTDs发生发展中起重要作用。
细胞自噬是一种细胞降解和循环过程,在所有真核生物中都是高度保守的[6]。通过细胞质细胞器、蛋白质和大分子的降解,以及分解产物的回收,在细胞生存和维持中发挥着重要作用。在哺乳动物细胞中,自噬有三种主要类型:巨自噬(Macroautophagy)、微自噬(Microautophagy)和伴侣介导的自噬(chaperonr-mediated autophagy,CMA)。巨自噬(以下称为自噬)是这三种类型自噬中研究最多的。自噬通常由应激诱导,如缺氧、能量或氨基酸缺乏、辐射、药物等。自噬是维持细胞和生物体内稳态的核心分子途径,自噬相关过程中的突变会导致严重的人类病理过程[7]。 自噬调节失调可诱发多种疾病表现,如炎症、衰老、代谢性疾病、神经退行性疾病和癌症[8]。因此,自噬激活在应激环境中是一种细胞保护机制。然而,自噬激活不足或过度也可能导致细胞功能失调和细胞死亡[9]。
细胞自噬是一种进化保守的细胞过程,受损的细胞器和多余的蛋白质可通过自噬途径被降解,以在应急损伤期间维持正确的细胞平衡[9]。自噬过程需要一系列由自噬相关基因(autophagy-related gene,ATG)调节的蛋白质复合物的活性,是自噬体组装和成熟所必需的[10]。自噬的起始阶段首先要形成一个简单的膜结构——吞噬泡(phagophore)。随后,自噬体膜的延伸受到两种复合物调控,一种是ATG5-ATG12-ATG16L复合物,由E1样酶ATG7介导的ATG12和ATG5结合形成的类泛素共轭体系,后者在E2样酶ATG10的调控下与ATG16L寡聚化;另一种是由盘绕肌球蛋白样BCL2相互作用蛋白(coiled-coil myosin-like BCL2-interacting protein,Beclin-1)、磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)、p150和ATG14形成的复合物,简称为III型PI3K复合物。Beclin 1在某些自噬诱导物的作用下与B淋巴细胞瘤-2基因(B-cell lymphoma-2,BCL-2)分离后被招募到该复合体中[11]。随后,在E1样酶ATG7和E2样酶ATG3的催化下,微管相关蛋白1轻链3(microtubulerassociated protein 1 light chain 3,LC3)由可溶解形式(LC3-I)转变为脂溶形式(LC3-II),与自噬泡结合形成自噬体。最后,自噬体与溶酶体融合成自噬溶酶体(autolysosomes),自噬体中包裹的蛋白质、脂质、细胞器等物质由溶酶体内水解酶在酸性环境中被降解消化。这些自噬相关分子以高度协调的方式激活并直接连接,从而驱动自噬以应对细胞内多种应激反应。
自噬被发现在神经上皮的发育和神经胚形成中起着至关重要的作用。LC3蛋白表达目前被用作自噬的特异性标记。研究发现,LC3在人类胎儿和小鼠胚胎中的分布都受到时空调控,其在妊娠早期胚胎脊椎中强烈表达,在妊娠12周时表达信号消失。对小鼠胚胎中LC3a和LC3b转录物的表达分析表明,这两种同源物在小鼠大脑、不同阶段的背神经管以及迁移的神经嵴细胞及其衍生物中均有表达[12]。
1.NTDs中自噬的调节:在发育中的神经上皮中挽救被母体糖尿病抑制的自噬可抑制糖尿病妊娠中NTDs的形成。p70核糖体蛋白S6激酶1(p70 ribosomal protein S6 kinase 1,p70S6K1)是哺乳动物雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)的主要下游效应物,介导母体糖尿病对发育中的神经上皮中自噬的抑制作用。在p70S6K1缺失的情况下,母体糖尿病抑制的神经胚形成阶段的自噬活性指标LC3-I向LC3-II的转化被挽救。敲除编码p70S6K1的Rps6kb1基因可以改善母体糖尿病诱导的NTDs,并恢复受母体糖尿病抑制的神经上皮细胞中自噬体的形成[13]。蛋白激酶,如mTOR和AMP活化蛋白激酶(AMP-activated protein kinase,AMPK),是最早发现的自噬调节因子,而最近的研究报道了关于蛋白激酶C(protein kinase C,PKC)信号通路对自噬的调节作用。Wang等[14]发现PKCα负调控自噬,删除编码PKCα的Prkca基因可以逆转母体糖尿病导致的胚胎前脑和中脑神经上皮细胞中自噬损伤、细胞器应激和细胞凋亡,从而改善NTDs的发生。此外,有研究揭示转录因子叉头框O3A(forkhead box O3a,FoxO3a)与糖尿病胚胎病中自噬受损之间可能存在联系。母体糖尿病诱导神经管缺陷可刺激胚胎神经上皮中FoxO3a的活性,抑制神经上皮细胞中LC3-I向LC3-II的转化,降低自噬阳性调节因子Unc-51样自噬激活激酶1(unc-51 like autophagy activating kinase 1,ULK1)、Beclin-1、ATG5和自噬阴性调节因子p62(sequestosome 1,p62/SQSTMl)的表达。删除FOXO3a基因可以逆转由母体糖尿病诱导的胚胎自噬损伤以及NTDs的形成[15]。
2.自噬和细胞凋亡与NTDs:自噬和细胞凋亡以复杂的交叉调节关系联系在一起。自噬/苄氯素1调节因子1(activating molecule in BECN1-regulated autophagy protein 1,Ambra1)是自噬启动的关键调节因子,人类NTDs中检测到五种罕见的错义AMBRA1变体,其中四种突变(AMBRA1 p.Thr80Met、p.Leu274Phe、p.Ser743Phe和p.Met884Val)在功能上被验证可以在不同程度上影响体外自噬调节或体内斑马鱼胚胎发育[16]。小鼠胚胎中的Ambra1功能缺陷会导致前脑畸形和/或脊柱裂,这些NTDs与自噬损伤和过度凋亡引起的细胞死亡有关[17]。Huang等[18]发现,Ambra1受到自噬调节因子的核转录因子I-C(nuclear factor I-C,NFIC)和miR-200b的调节,从而影响小鼠胚胎神经管闭合。具体而言,NFIC可直接转录激活miR-200b,miR-200b通过靶向抑制自噬相关基因Ambra1的表达,进而抑制自噬并诱导细胞凋亡,最终导致NTDs的形成。这些研究表明,自噬相关基因Ambra1在调控神经上皮细胞自噬和细胞凋亡以及NTDs形成中起关键作用。
中枢神经系统的胚胎和胎儿发育过程复杂,环境因素(如化学物质暴露)对这些过程的干扰可能会导致神经发育障碍[19]。Nie等[20]发现聚苯乙烯纳米塑料暴露会导致小鼠胎盘损伤和胎鼠发育不良,还会直接干扰鸡胚原肠胚形成和神经管形成。可能与聚苯乙烯纳米塑料激活自噬,且自噬体无法被自噬溶酶体系统降解有关,随后,错误的细胞凋亡导致神经管形态发生缺陷。Zhang等[21]使用乙硫氨酸诱导建立小鼠NTDs模型以及体外细胞模型的研究表明,乙硫氨酸可以通过减少线粒体自噬来诱导线粒体凋亡。在体外研究中,细胞自噬被证明可以影响神经管发育及闭合相关神经细胞功能。神经前体细胞(neural precursor cell,NPC)和神经干细胞在神经管闭合过程中起至关重要的作用。饥饿和溶酶体功能障碍都会导致自噬体的积累,但细胞死亡受到这两种刺激的不同调节。通过在NPC和神经干细胞系C17.2中使用饥饿和溶酶体功能障碍诱导剂的研究发现,与饥饿诱导的细胞死亡不同,Atg7在溶酶体功能障碍诱导的自噬体积累和NPC死亡中发挥重要作用。当正常溶酶体功能受损时,Atg7可能会促进细胞凋亡。说明在溶酶体能力降低的细胞中诱导自噬可能会将这种正常的细胞保护反应转化为强有力的死亡刺激[22]。以上研究说明自噬受损和细胞过度凋亡破坏了细胞稳态,并最终导致NTDs的发生。然而,Sayin等[23]报道,普瑞巴林给药通过增加自噬和增强细胞凋亡,导致鸡胚NTDs及胚胎异常。说明自噬具有双面性,过度的自噬也可能是造成NTDs的原因。
3.改善自噬,缓解NTDs的策略:孕妇在怀孕前和怀孕早期叶酸(维生素B9)不足是NTDs最常见的风险因素[2]。实验研究发现,叶酸缺乏可以通过破坏AMPK/mTOR信号来减少自噬,导致子宫内膜蜕膜异常和不良妊娠结局。在小鼠在体内喂食无叶酸饮食的动物模型以及小鼠子宫内膜基质细胞在体外无叶酸培养基中培养的细胞模型中发现叶酸缺乏组子宫内膜自噬体数量和自噬蛋白表达的减少,自噬体的形成、自噬体-溶酶体融合和溶酶体降解受到抑制。使用mCherry-GFP-LC3转染的自噬流量检查显示,叶酸缺乏抑制了自噬体与溶酶体的融合。自噬诱导剂雷帕霉素(rapamycin)可以逆转叶酸缺乏对子宫内膜蜕膜化的损害[24]。然而,有研究报道,怀孕期间补充叶酸会增加小鼠模型中乳腺癌的发生率和后代中炎症性肠病的发生率[25,26]。因此,需要更多的研究来发掘更多安全有效的用以治疗NTDs的方法。
海藻糖是一种天然二糖,也是毒性相对最小的自噬激活剂,具有很高的治疗价值。通过使用荧光标记的海藻糖来追踪其在自噬体复合物中的存在确定海藻糖可直接诱导自噬,其通过将自身结合到自噬体中,直接参与功能性自噬体的产生。海藻糖在诱导GFP-LC3报告细胞和C17.2神经干细胞中的自噬体形成以及增加自噬流方面与Rapamycin和饥饿一样有效,在体外高糖条件下逆转自噬体复合物的损伤,在体内减缓母体糖尿病的发生。不仅如此,海藻糖诱导的自噬体具有功能活性,在暴露于母体糖尿病的神经上皮细胞中形成线粒体自噬和内质网自噬,清除受损的细胞器[27]。Xu等[28]研究证明海藻糖通过重新激活小鼠神经上皮细胞的自噬来纠正延迟的神经发生,从而改善母体糖尿病诱导的NTDs。研究还发现,海藻糖能够挽救由Ambra1敲低引起的斑马鱼畸形[16]。除此之外,Zhao等[29]研究发现天然化合物白藜芦醇——一种强特异性的Sirt1激活剂,可减弱自噬抑制并在一定程度上改善脊柱裂的发生,见图1。

图1 细胞自噬在NTDs中的作用机制图
NTDs是一种严重的出生缺陷,给患儿家庭及社会造成了巨大的负担。自噬对胚胎神经发育至关重要,在NTDs的形成过程中,胚胎发育受到神经上皮细胞过度凋亡和细胞自噬相关分子的复杂相互调控。目前,研究者们针对改善自噬以缓解NTDs的治疗策略方面也开始了初步探索。深度研究自噬在NTDs发生过程中的作用机制,以及探索NTDs潜在治疗靶点的工作仍任重道远。
1 Isakovic′ J, imunic′
imunic′ ![]() D,et al.Overview of neural tube defects:Gene-environment interactions,preventative approaches and future perspectives.Biomedicines,2022,10:965.
D,et al.Overview of neural tube defects:Gene-environment interactions,preventative approaches and future perspectives.Biomedicines,2022,10:965.
2 Kancherla V.Neural tube defects:a review of global prevalence,causes,and primary prevention.Childs Nerv Syst,2023,39:1703-1710.
3 Yacob A,Carr CJ,Foote J,et al.The global burden of neural tube defects and disparities in neurosurgical care.World Neurosurg,2021,149:e803-e820.
4 Avagliano L,Massa V,George TM,et al.Overview on neural tube defects:From development to physical characteristics.Birth Defects Res,2019,111:1455-1467.
5 Copp AJ,Stanier P,Greene ND.Neural tube defects:recent advances,unsolved questions,and controversies.Lancet Neurol,2013,12:799-810.
6 ![]() F,Ali DM,Berger MR.Multiple facets of autophagy and the emerging role of alkylphosphocholines as autophagy modulators.Front Pharmacol,2020,11:547.
F,Ali DM,Berger MR.Multiple facets of autophagy and the emerging role of alkylphosphocholines as autophagy modulators.Front Pharmacol,2020,11:547.
7 Klionsky DJ,Petroni G,Amaravadi RK,et al.Autophagy in major human diseases.EMBO J,2021,40:e108863.
8 Condello M,Pellegrini E,Caraglia M,et al.Targeting autophagy to overcome human diseases.Int J Mol Sci,2019,20:725.
9 Xu X,Wang J,Xia Y,et al.Autophagy,a double-edged sword for oral tissue regeneration.J Adv Res,2024,59:141-159.
10 Levine B,Kroemer G.Biological functions of autophagy genes:A disease perspective.Cell,2019,176:11-42.
11 Fu LL,Cheng Y,Liu B.Beclin-1:autophagic regulator and therapeutic target in cancer.Int J Biochem Cell Biol,2013,45:921-924.
12 Avagliano L,Doi P,Tosi D,et al.Cell death and cell proliferation in human spina bifida.Birth Defects Res A Clin Mol Teratol,2016,106:104-113.
13 Cao S,Shen WB,Reece EA,et al.Deficiency of the oxidative stress-responsive kinase p70S6K1 restores autophagy and ameliorates neural tube defects in diabetic embryopathy.Am J Obstet Gynecol,2020,223:753.e1-753.e14.
14 Wang F,Xu C,Reece EA,et al.Protein kinase C-alpha suppresses autophagy and induces neural tube defects via miR-129-2 in diabetic pregnancy.Nat Commun,2017,8:15182.
15 Xu C,Chen X,Reece EA,et al.The increased activity of a transcription factor inhibits autophagy in diabetic embryopathy.Am J Obstet Gynecol,2019,220:108.e1-108.e12.
16 Ye J,Tong Y,Lv J,et al.Rare mutations in the autophagy-regulating gene AMBRA1 contribute to human neural tube defects.Hum Mutat,2020,41:1383-1393.
17 Fimia GM,Stoykova A,Romagnoli A,et al.Ambra1 regulates autophagy and development of the nervous system.Nature,2007,447:1121-1125.
18 Huang W,Huang T,Liu Y,et al.Nuclear factor I-C disrupts cellular homeostasis between autophagy and apoptosis via miR-200b-Ambra1 in neural tube defects.Cell Death Dis,2021,13:17.
19 Hessel EVS,Staal YCM,Piersma AH.Design and validation of an ontology-driven animal-free testing strategy for developmental neurotoxicity testing.Toxicol Appl Pharmacol,2018,354:136-152.
20 Nie JH,Shen Y,Roshdy M,et al.Polystyrene nanoplastics exposure caused defective neural tube morphogenesis through caveolae-mediated endocytosis and faulty apoptosis.Nanotoxicology,2021,15:885-904.
21 Zhang L,Dong Y,Wang W,et al.Ethionine suppresses mitochondria autophagy and induces apoptosis via activation of reactive oxygen species in neural tube defects.Front Neurol,2020,11:242.
22 Walls KC,Ghosh AP,Franklin AV,et al.Lysosome dysfunction triggers Atg7-dependent neural apoptosis.J Biol Chem,2010,285:10497-10507.
23 Sayin M, im
im ek FE.Pregabalin administration induces alterations in neural tube development during early embryonic stages.Turk Neurosurg,2018,14.
ek FE.Pregabalin administration induces alterations in neural tube development during early embryonic stages.Turk Neurosurg,2018,14.
24 Zhang Y,Gao R,Zhang L,et al.AMPK/mTOR downregulated autophagy enhances aberrant endometrial decidualization in folate-deficient pregnant mice.J Cell Physiol,2021,236:7376-7389.
25 Ly A,Lee H,Chen J,et al.Effect of maternal and postweaning folic acid supplementation on mammary tumor risk in the offspring.Cancer Res,2011,71:988-997.
26 Schaible TD,Harris RA,Dowd SE,et al.Maternal methyl-donor supplementation induces prolonged murine offspring colitis susceptibility in association with mucosal epigenetic and microbiomic changes.Hum Mol Genet,2011,20:1687-1696.
27 Xu C,Chen X,Sheng WB,et al.Trehalose restores functional autophagy suppressed by high glucose.Reprod Toxicol,2019,85:51-58.
28 Xu C,Li X,Wang F,et al.Trehalose prevents neural tube defects by correcting maternal diabetes-suppressed autophagy and neurogenesis.Am J Physiol Endocrinol Metab,2013,305:E667-E678.
29 Zhao L,Liu D,Ma W,et al.Bhlhe40/Sirt1 axis-regulated mitophagy is implicated in all-trans retinoic acid-induced spina bifida aperta.Front Cell Dev Biol,2021,9:644346.