多囊卵巢综合征(polycystic ovary syndrome, PCOS)是育龄期女性常见的内分泌紊乱综合征,一项荟萃研究分析显示育龄期女性PCOS患病率高达8%至13%[1],作为一种异质性疾病,其临床表现和病理生理机制都极为复杂,在临床中常表现为高雄激素血症(hyperandrogenism,HA)、稀发排卵或无排卵(oligomenorrhea,OA)、卵巢多囊样改变(polycystic ovary,PCO)。在PCOS女性中,胰岛素抵抗(insulin resistance, IR)、心血管疾病、腹部肥胖、心理障碍、不孕不育、非酒精性脂肪性肝病的发病率也高于一般女性[2-3],最近一项研究发现,PCOS 可能促进心肌巨噬细胞积聚,加剧心血管炎症并加重缺血性心脏损伤[4]。PCOS从青春期开始可贯穿并严重影响患病女性一生的健康。2023国际PCOS评估和管理循证指南指出阻塞性睡眠呼吸暂停(obstructive sleep apnoea, OSA)是PCOS患者的重要临床特征之一[5]。OSA是一种以睡眠期间咽喉气道反复塌陷为特征的睡眠障碍,伴有反复氧饱和度下降和慢性缺氧[6],会导致患者白天嗜睡认知能力下降,严重影响患者的生活质量。OSA 是高血压、血压控制不良、中风、心肌梗塞、心力衰竭、心律失常、心源性猝死的危险因素[7]。在育龄期PCOS女性中,OSA的患病率约是其他不明原因不孕女性的4倍[8],最近的研究发现在PCOS患者的血糖异常、炎症和高雄激素状态与OSA风险独立相关[9]。本研究旨在确定中国PCOS女性中OSA的比例和临床特征,以及对OSA的生殖内分泌和代谢特征的影响。
对象与方法
一、对象
本研究纳入2019年1月至2022年8月在北京大学第三医院生殖医学中心初次就诊的PCOS患者。根据2003年鹿特丹诊断标准[10],PCOS诊断如下:(1) OA定义为月经< 8次/年或月经周期>35 d;(2)有高雄激素临床表现,包括多毛、痤疮、脂溢性皮炎、脱发等和(或)HA,总睾酮≥2.2 nmol/L,雄烯二酮≥12.2 nmol/L;(3) PCO,即卵巢一侧或两侧有12个以上直径2~9 mm的卵泡,妇科超声显示卵巢体积>10 cm3。若符合上述3项标准中的任意2项,并且除外具有这些症状的其他相关疾病,如高泌乳素血症和甲状腺疾病、先天性肾上腺皮质增生等。即可诊断为PCOS。所有入组患者均为初次就诊的患者,排除3个月内使用过口服避孕药或其他激素类药物的患者,以及使用过影响糖脂代谢的药物或降压药的患者。
二、方法
1. 数据收集:收集初次就诊于北京大学第三医院生殖医学中心患者检查指标,包括身高、体重、血清性激素水平[雌二醇(estradiol , E2)、促黄体生成素(luteinizing hormone, LH)、卵泡生成素(follicle-stimulating hormone, FSH)、游离睾酮 (free testosterone, TT)、硫酸脱氢表雄酮 (dehydroepiandrosterone sulfate, DHEAS)、雄烯二酮(androstenedione, AND)、孕酮(progesterone, P)、垂体泌乳素(prolactin, PRL)、抗缪勒管激素(anti-Mullerian hormone, AMH)、性激素结合球蛋白(sex hormone binding globulin, SHBG)]、糖化血红蛋白(glycosylated hemoglobin, HbA1c)水平、空腹血糖水平(fasting blood glucose, FPG)、空腹胰岛素水平(Fasting insulin, FINS)、口服糖耐量试验(fasting glucose tolerance test, OGTT)、胰岛素(insulin, INS)释放试验、血脂水平、炎症指标、凝血水平、肝肾功能水平、血常规、甲状腺功能指标。通过计算得出(1)游离睾酮指数 (free testosterone index, FAI)=TT(nmol/mL )/SHBG ( nmol/L)×100;(2)稳态模型评估胰岛素抵抗指数(Homeostasis model assessment of insulin resistance, HOMA-IR)=FPG(mmol/L)×FINS(μU/mL)/22.5;(3)稳态模型胰岛素分泌指数(homeostasis model assessment for beta-cell function index, HOMA-β)(%)=20×FINS(μU/mL)/[ FPG (mol/L)-3.5];(4)β细胞功能指数(modified beta-cell function index, MBCI)=(FINS×FPG)/(PG 2 h+PG 1 h-2FPG),PG 2 h为糖负荷后 2 h血糖,PG1 h为糖负荷后1 h血糖。本研究伦理经北京大学第三医院伦理委员会(IRB00006761-M2020391)批准,并获得所有纳入研究的个体参与者的知情同意。
2. 睡眠呼吸监测:本研究使用了澳大利亚ResMed Ltd.的Apnealink Plus,这是一种便携式睡眠监测仪,带有四根导联,可测量鼻气流、打鼾、动脉血氧饱和度、脉搏和呼吸力,已被证实可用于筛查OSA,呼吸暂停低通气指数(apnea and hypopnea index,AHI)以及夜间最低血氧饱和度是OSA严重程度分度的依据。AHI为平均每小时呼吸暂停次数与低通气次数的总和。相关软件根据记录的信号生成修改后的AHI值。在指导并确认患者可以正确使用便携式睡眠监测仪后,患者自行居家佩戴便携式睡眠监测器过夜,并在第二天将设备送回睡眠医学中心。对于设备监测时间少于240 min的患者,在排除仪器故障后确认患者可以正确操作设备,再次进行居家睡眠呼吸监测。专业技术人员审查原始数据,并排除导联脱落的时间点。AHI由便携式睡眠监测仪自动计算,并由睡眠技术人员手动审阅数据后编辑。采用美国睡眠医学学会OSA分级系统[11]将结果根据AHI和夜间最低血氧饱和度(minSpO2)对OSA严重程度进行分层,见表1。
表1 OSA分度标准
Table 1 Severity of obstructive sleep apnoea (OSA)

SeverityAHIminSpO2(%)Mild OSA5≤-<1585≤-≤89Moderate OSA15≤-<3080≤-<85Severe OSA≥30<80
3. 统计学处理:统计分析软件应用SPSS 26.0,正态分布连续资料采用均数±标准差![]() 表示,非正态分布连续资料用中位数M(P25,P75)表示。采用单因素方差分析(ANOVA)检验各组间方差齐性的连续变量,否则进行Kruskall-Wallis H检验。分类变量用百分数表示,不同组间比较采用卡方检验或Fisher精确检验。P<0.05为差异有统计学意义。
表示,非正态分布连续资料用中位数M(P25,P75)表示。采用单因素方差分析(ANOVA)检验各组间方差齐性的连续变量,否则进行Kruskall-Wallis H检验。分类变量用百分数表示,不同组间比较采用卡方检验或Fisher精确检验。P<0.05为差异有统计学意义。
结 果
一、PCOS患者中OSA的发病率
本研究共纳入687例PCOS患者,结果显示,OSA的患病率为47.0%(323/687),其中轻度OSA占73.1% (236/323),中度OSA占18.3%(59/323),重度OSA占8.6%(28/323),见表2。
表2 PCOS患者中OSA的发病率
Table 2 Prevalence of OSA in PCOS patients
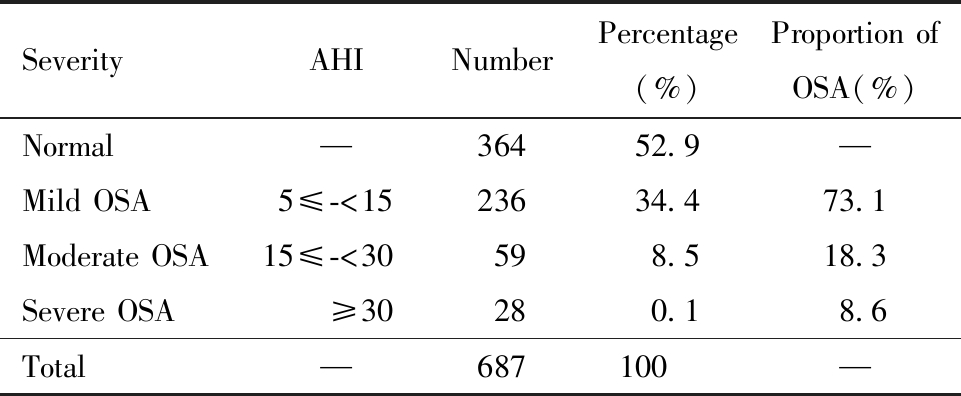
Severity AHINumberPercentage(%)Proportion of OSA(%)Normal—36452.9—Mild OSA5≤-<1523634.473.1Moderate OSA15≤-<30598.518.3Severe OSA≥30280.18.6Total—687100—
二、PCOS患者与PCOS &OSA患者临床特征比较
入组患者年龄在19至41岁之间,PCOS &OSA患者与单纯PCOS患者的年龄差异没有统计学意义。在单纯PCOS患者与PCOS &OSA患者临床特征比较中,PCOS &OSA患者的BMI均值为(28.2±4.8)kg/m2,明显高于单纯PCOS组患者均值(23.4±3.3)kg/m2,且差异具有统计学意义;PCOS &OSA患者HA人数占比高于单纯PCOS组患者(P<0.05),PCOS &OSA患者IR人数占比高达70.9%(229/323),显著高于单纯PCOS中IR人数占比[36.8%(134/364)],差异具有统计学意义。本研究中OA人数占比79.0%(543/687),PCO人数占比99.6%(543/687),而单纯PCOS患者与PCOS &OSA患者之间OA人数占比、PCO人数占比差异均没有统计学意义。见表3。
表3 PCOS 患者与PCOS &OSA 患者临床特征比较
Table 3 Comparison of clinical features between PCOS patients and PCOS &OSA patients

Compared to PCOS group, *P<0.05
GroupNAge(yrs)BMI(kg/m2)OA proportion[n(%)]HA proportion[n(%)]PCO proportion[n(%)]IR proportion[n(%)]PCOS36429.4±7.123.4±3.3293(86.4)189(55.5)361(99.2)134(36.8)PCOS & OSA32330.4±3.828.2±4.8∗250(85.9)199(64.0)∗323(100.0)229(70.9)∗
三、PCOS与PCOS &OSA患者性激素水平的比较
在性激素水平比较中,PCOS &OSA组患者的睾酮(T)、FAI值均高于单纯PCOS组患者(P<0.05), P、AMH、SHBG均低于单纯PCOS患者(P<0.05);而E2、LH、FSH、DHEAS、AND、PRL组间差异均没有统计学意义。见表4。
表4 PCOS与PCOS &OSA患者性激素水平比较
Table 4 Comparison of sex hormone levels between PCOS patients and PCOS &OSA patients

Compared to PCOS, *P<0.05
GroupNE2(pmol/L)LH(U/L )FSH(U/L)T(nmoL/mL)DHEAS(umol/mL)PCOS364167(124,232)7.87(4.55,12.60)6.26±3.170.86(0.68,1.27)6.91±2.83PCOS & OSA323176(133,256)7.87(5.04,12.48)5.89±1.951.00(0.68,1.40)∗7.33±3.25GroupNAND(nmol/L)FAIP(nmol/L)PRL(ng/mL)AMH(ng/mL)SHBG(nmol/L)PCOS36412.15±5.362.70(1.61,4.82)1.56(1.10,2.32)13.63±7.758.02(5.21,11.35)36.2(21.5,53.7)PCOS & OSA32312.60±5.735.05(3.16,8.02)∗1.26(0.98,1.70) ∗14.57±8.276.10(4.04,9.43) ∗20.40(14.13,31.53) ∗
四、PCOS与PCOS &OSA患者代谢指标的比较
在评估糖代谢的指标比较中,PCOS &OSA患者的HbA1c、Glu0、Glu30、Glu60、Glu120、INS0、INS30、INS60、INS120均高于单纯PCOS患者,差异具有统计学意义。在评估IR水平的指标中,PCOS &OSA患者的HOMA-IR、HOMA-β、MBCI均高于单纯PCOS患者,差异具有统计学意义。在评估脂代谢的指标中,PCOS &OSA患者的LDL、TG均高于单纯PCOS患者,而HDL低于单纯PCOS患者,且差异均有统计学意义,T-CHO组间差异没有统计学意义。评估甲状腺功能指标中的TSH、FT3、FT4、TT3、TT4结果,组间差异均没有统计学意义。见表5。
表5 单纯 PCOS 患者与PCOS &OSA患者代谢指标比较
Table 5 Comparison of metabolic indexes between simple PCOS and PCOS &OSA patients

GroupNHbA1c(%)GLu0(mmol/L)GLu30(mmol/L)GLu60(mmol/L)GLu120(mmol/L)PCOS3645.4±0.54.8±0.78.3±1.58.2(6.2,10.7)6.3(5.5,8.4)PCOS & OSA3235.7±0.7∗5.2±1.3∗9.1±2.1∗9.5(7.6,14.2) ∗7.7(6.3,12.9)∗
表5(续)
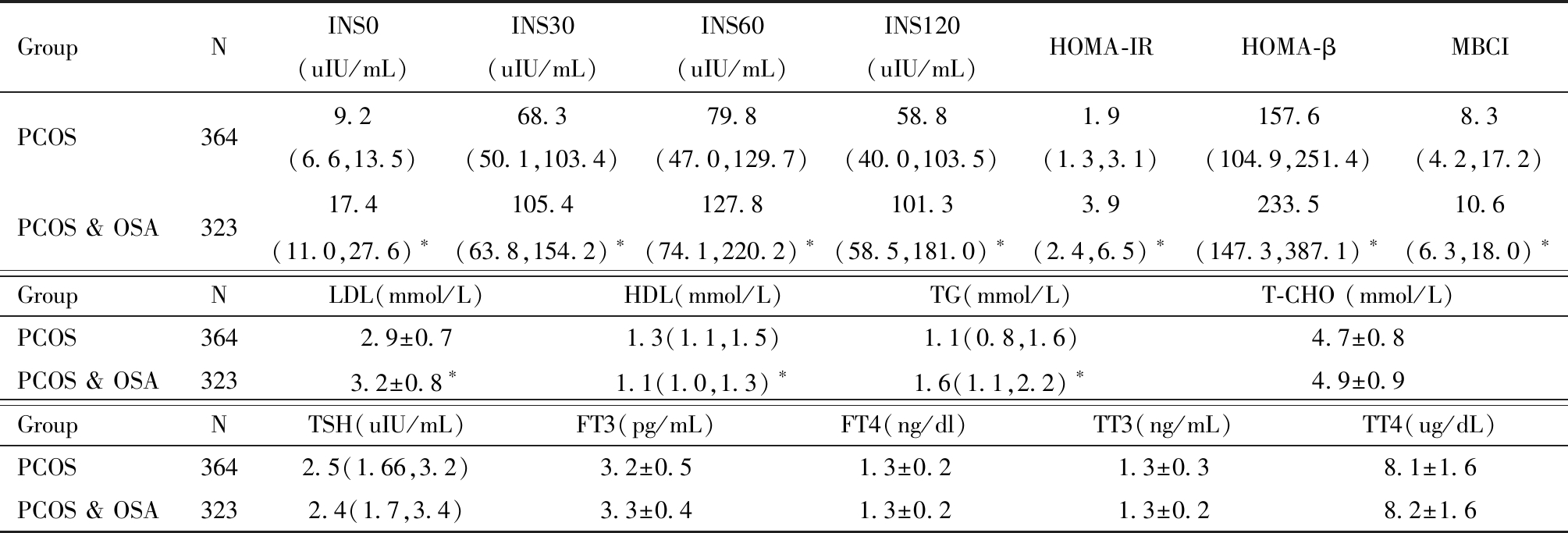
Compared to PCOS, *P<0.05
GroupNINS0(uIU/mL)INS30(uIU/mL)INS60(uIU/mL)INS120(uIU/mL)HOMA-IRHOMA-βMBCIPCOS3649.2(6.6,13.5)68.3(50.1,103.4)79.8(47.0,129.7)58.8(40.0,103.5)1.9(1.3,3.1)157.6(104.9,251.4)8.3(4.2,17.2)PCOS & OSA32317.4(11.0,27.6) ∗105.4(63.8,154.2) ∗127.8(74.1,220.2) ∗101.3(58.5,181.0) ∗3.9(2.4,6.5) ∗233.5(147.3,387.1) ∗10.6(6.3,18.0) ∗GroupNLDL(mmol/L)HDL(mmol/L)TG(mmol/L)T-CHO (mmol/L)PCOS3642.9±0.71.3(1.1,1.5)1.1(0.8,1.6)4.7±0.8PCOS & OSA3233.2±0.8∗1.1(1.0,1.3) ∗1.6(1.1,2.2) ∗4.9±0.9GroupNTSH(uIU/mL)FT3(pg/mL)FT4(ng/dl)TT3(ng/mL)TT4(ug/dL)PCOS3642.5(1.66,3.2)3.2±0.51.3±0.21.3±0.38.1±1.6PCOS & OSA3232.4(1.7,3.4)3.3±0.41.3±0.21.3±0.28.2±1.6
五、单纯PCOS与PCOS &OSA患者炎症、凝血指标的比较
PCOS &OSA患者的US-CRP中位数、 凝血酶原活动度(prothrombin time activity percentage,A)均值均高于单纯PCOS患者(P<0.05),WBC、N%、N#、QCRP、TT、PT、APTT、Fib组间差异均没有统计学意义,见表6。
表6 单纯 PCOS 患者与PCOS &OSA 患者炎症、凝血指标比较
Table 6 Comparison of inflammation and coagulation indexes between simple
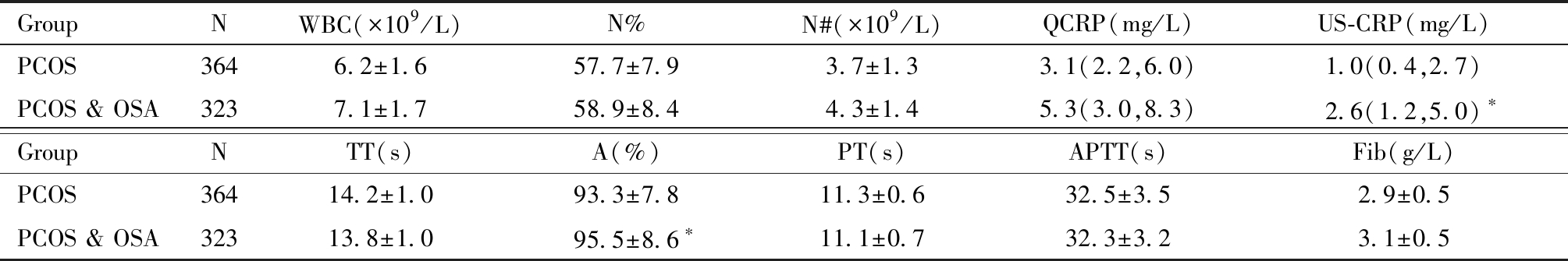
Compared to PCOS, *P<0.05
GroupNWBC(×109/L)N%N#(×109/L)QCRP(mg/L)US-CRP(mg/L)PCOS3646.2±1.657.7±7.93.7±1.33.1(2.2,6.0)1.0(0.4,2.7)PCOS & OSA3237.1±1.758.9±8.44.3±1.45.3(3.0,8.3)2.6(1.2,5.0) ∗GroupNTT(s)A(%)PT(s)APTT(s)Fib(g/L)PCOS36414.2±1.093.3±7.811.3±0.632.5±3.52.9±0.5PCOS & OSA32313.8±1.095.5±8.6∗11.1±0.732.3±3.23.1±0.5
六、单纯PCOS与PCOS &OSA患者肝肾功能指标的关系
PCOS &OSA患者ALT、AST、胱抑素C(P<0.05)均高于单纯PCOS患者(P<0.05),Cr、Ca、eGFR、Urea、UA、T-Bil、D-Bil、Alb、TP组间差异均没有统计学意义,见表7。
表7 单纯 PCOS 患者与PCOS &OSA 患者肝肾功能指标比较
Table 7 Comparison of liver and kidney function indexes between simple PCOS and PCOS &OSA patients
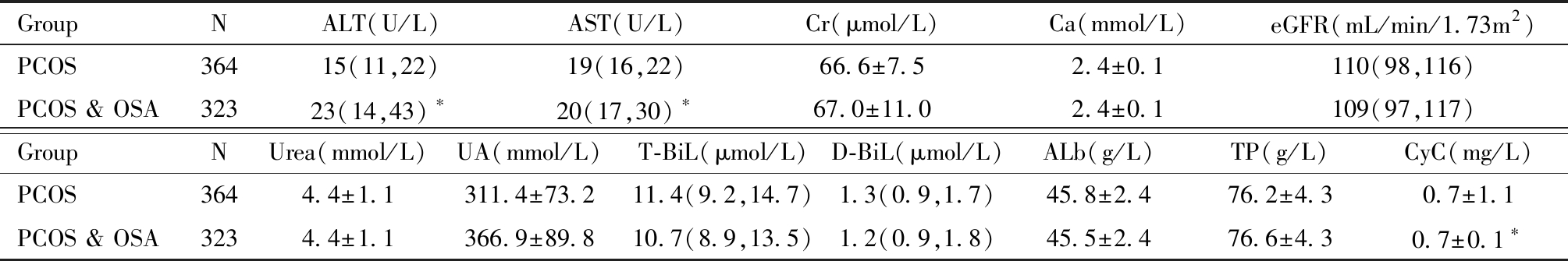
Compared to PCOS, *P<0.05
GroupNALT(U/L)AST(U/L)Cr(μmol/L)Ca(mmol/L)eGFR(mL/min/1.73m2)PCOS36415(11,22)19(16,22)66.6±7.52.4±0.1110(98,116)PCOS & OSA32323(14,43)∗20(17,30) ∗67.0±11.02.4±0.1109(97,117)GroupNUrea(mmol/L)UA(mmol/L)T-BiL(μmol/L)D-BiL(μmol/L)ALb(g/L)TP(g/L)CyC(mg/L)PCOS3644.4±1.1311.4±73.211.4(9.2,14.7)1.3(0.9,1.7)45.8±2.476.2±4.30.7±1.1PCOS & OSA3234.4±1.1366.9±89.810.7(8.9,13.5)1.2(0.9,1.8)45.5±2.476.6±4.30.7±0.1∗
七、不同严重程度PCOS &OSA患者性激素水平、代谢、炎症、凝血和生化指标比较
在临床特征方面,中重度PCOS &OSA患者的BMI均值明显高于轻度PCOS &OSA患者(P<0.05)。在性激素方面,中重度PCOS &OSA患者FAI高于轻度PCOS &OSA患者(P<0.05),AMH、SHGB均低于轻度PCOS &OSA患者(P<0.05)。在糖代谢方面,中重度OSA的PCOS患者的HbA1c、Glu0、Glu60、Glu120、INS0、INS30、INS60、INS120均高于轻度PCOS &OSA患者(P<0.05)。在IR方面,中重度PCOS &OSA患者的HOMA-IR、HOMA-β、MBCI均高于轻度PCOS &OSA患者(P<0.05)。在脂代谢方面,中重度PCOS &OSA患者的TG高于轻度PCOS &OSA患者(P<0.05)。在肝肾功能方面,中重度PCOS &OSA患者的ALT、AST均高于轻度PCOS &OSA患者(P<0.05)。中重度PCOS &OSA患者的US-CRP高于轻度PCOS &OSAS患者(P<0.05)。中重度PCOS &OSA患者与轻度PCOS &OSA患者的T、P、Glu30、LDL、CyC、A(%)比较,组间差异均没有统计学意义。见表8。
表8 不同严重程度PCOS &OSA患者性激素水平、代谢、炎症、凝血和生化指标比较
Table 8 Comparison of sex hormone levels, metabolism, inflammation, coagulation and biochemical indexes in PCOS &OSA patients of different severity
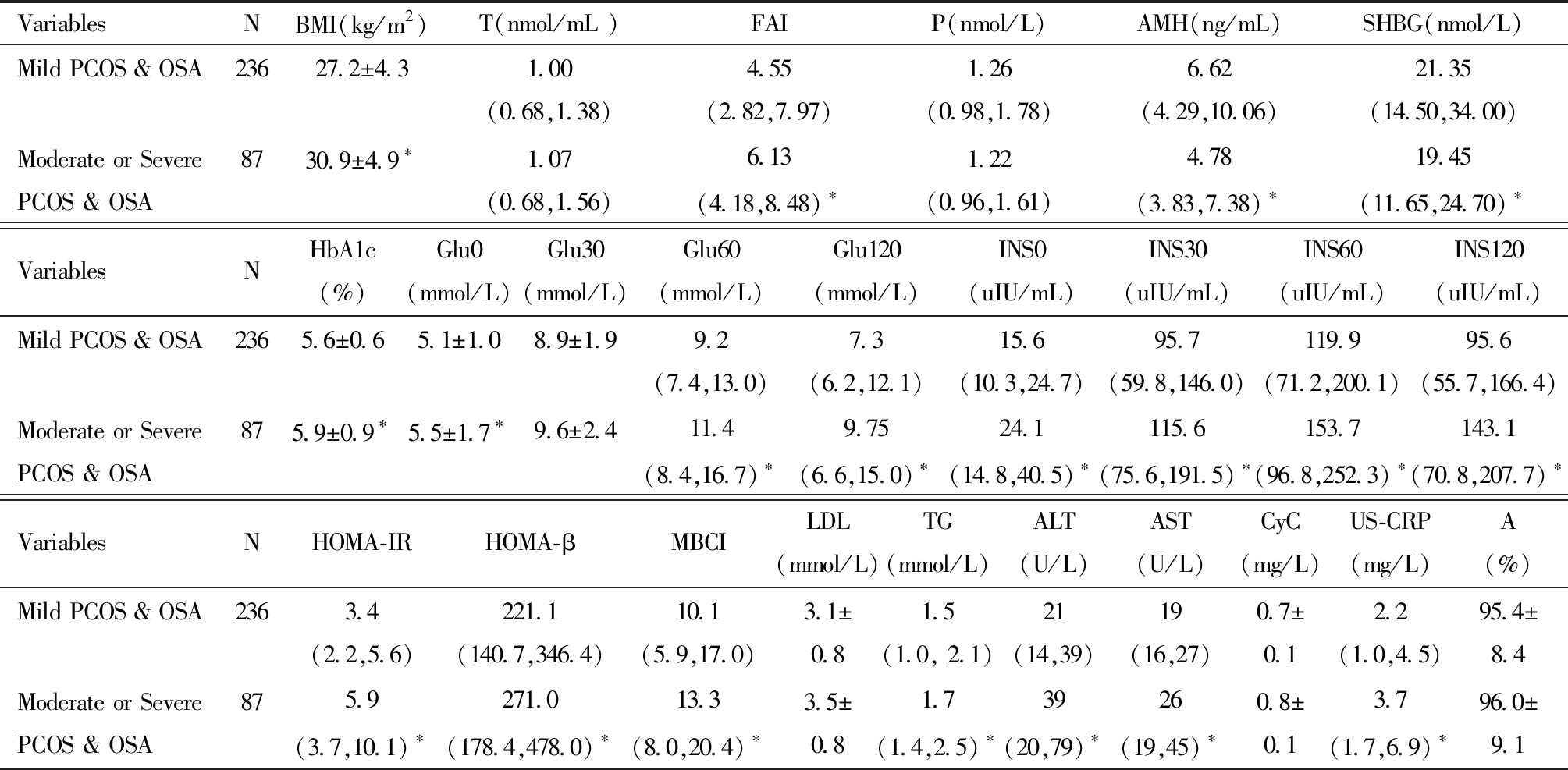
VariablesNBMI(kg/m2)T(nmol/mL )FAIP(nmol/L)AMH(ng/mL)SHBG(nmol/L)Mild PCOS & OSA23627.2±4.31.00(0.68,1.38)4.55(2.82,7.97)1.26(0.98,1.78)6.62(4.29,10.06)21.35(14.50,34.00)Moderate or Severe PCOS & OSA8730.9±4.9∗1.07(0.68,1.56)6.13(4.18,8.48)∗1.22(0.96,1.61)4.78(3.83,7.38)∗19.45(11.65,24.70)∗VariablesNHbA1c(%)Glu0(mmol/L)Glu30(mmol/L)Glu60(mmol/L)Glu120(mmol/L)INS0(uIU/mL)INS30(uIU/mL)INS60(uIU/mL)INS120(uIU/mL)Mild PCOS & OSA2365.6±0.65.1±1.08.9±1.99.2(7.4,13.0)7.3(6.2,12.1)15.6(10.3,24.7)95.7(59.8,146.0)119.9(71.2,200.1)95.6(55.7,166.4)Moderate or Severe PCOS & OSA875.9±0.9∗5.5±1.7∗9.6±2.411.4(8.4,16.7) ∗9.75(6.6,15.0) ∗24.1(14.8,40.5) ∗115.6(75.6,191.5) ∗153.7(96.8,252.3)∗143.1(70.8,207.7)∗VariablesNHOMA-IRHOMA-βMBCILDL(mmol/L)TG(mmol/L)ALT(U/L)AST(U/L)CyC(mg/L)US-CRP(mg/L)A(%)Mild PCOS & OSA2363.4(2.2,5.6)221.1(140.7,346.4)10.1(5.9,17.0)3.1±0.81.5(1.0, 2.1)21(14,39)19(16,27)0.7±0.12.2(1.0,4.5)95.4±8.4Moderate or Severe PCOS & OSA875.9(3.7,10.1) ∗271.0(178.4,478.0)∗13.3(8.0,20.4) ∗3.5±0.81.7(1.4,2.5) ∗39(20,79)∗26(19,45) ∗0.8±0.13.7(1.7,6.9) ∗96.0±9.1
八、PCOS &OSA患者OSA相关指标的Logistic回归分析
在行多元回归分析之前,进行多重共线性诊断分析,结果表明,表8列出的预测变量之间不存在多重共线性,其方差膨胀因子(VIF)小于10。Logistic回归分析显示,BMI较高[OR= 8.51,95% CI:2.86~25.36)]、糖化血红蛋白(HbA1c)升高[OR =21.76,95% CI:2.05~231.25)]与OSA的发生相关(P<0.05),见表9。
表9 PCOS &OSA患者OSA相关指标的Logistic回归分析
Table 9 Logistic regression analysis of OSA related indicators in PCOS &OSA patients
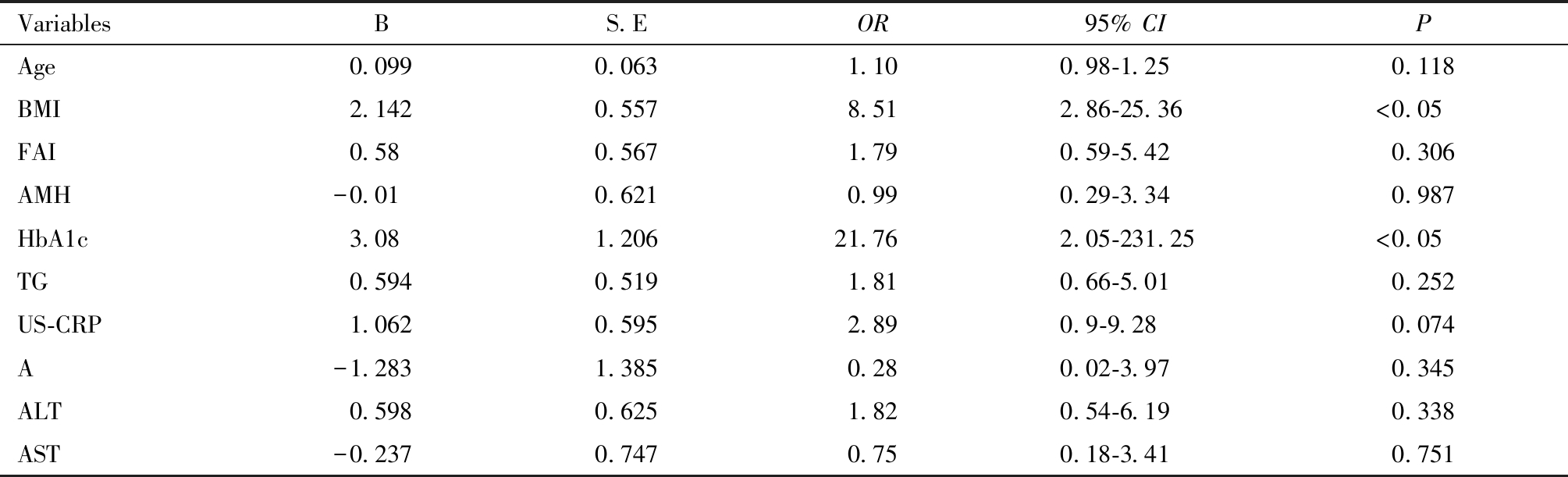
VariablesBS.EOR95% CI PAge0.0990.0631.100.98-1.250.118BMI2.1420.5578.512.86-25.36<0.05FAI0.580.5671.790.59-5.420.306AMH-0.010.6210.990.29-3.340.987HbA1c3.081.20621.762.05-231.25<0.05TG0.5940.5191.810.66-5.010.252US-CRP1.0620.5952.890.9-9.280.074A-1.2831.3850.280.02-3.970.345ALT0.5980.6251.820.54-6.190.338AST-0.2370.7470.750.18-3.410.751
讨 论
据报道,在育龄期女性中,OSA患病率为9%至28%[12],在患有PCOS的女性中OSA患病率增加到17%至75%[13],PCOS女性患OSA综合症的风险显著高于一般女性[14]。与PCOS类似,OSA也与高血压、脑血管疾病、IR和2型糖尿病、抑郁和生活质量受损以及生育不良的风险增加有关[15]。
既往有研究对PCOS女性中OSA的发生进行了阐述[9],本研究针对中国女性人群,纳入患者样本量大,相较于既往研究较多采用的问卷评估,本研究采用了便携式睡眠呼吸监测仪来对PCOS患者的睡眠进行检测,更加客观准确地做到对OSA的诊断和分度。本研究前期对PCOS患者中OSA的发病及临床特征进行了统计[16],本次研究扩大了样本量,并在此基础上又纳入了OSA对PCOS患者甲状腺功能、肝肾功能以及炎症指标的收集,更加全面地评估了OSA对PCOS女性各方面的影响。
本研究纳入687例PCOS患者,OSA的患病率高达到47%,这一发现与以往国内外的研究相一致。本研究中重度和中度OSA占到OSA发病人群的9%和18%,可见虽然OSA在PCOS女性中发病率高,但严重程度分级并不高。目前已知OSA唯一风险预测因素是BMI[17],体重增加10%预测AHI增加32%,发展为中到重度OSA的几率增加6倍[18]。女性脂肪更倾向于储存在皮下,雄激素可改变脂肪分布模式,使PCOS患者表现为内脏肥胖,脂肪组织在气道壁的异位沉积影响被动和主动的上呼吸道功能,容易在睡眠期间导致上呼吸道塌陷,从而导致睡眠呼吸暂停,因此脂肪分布方式对OSA发病有重要影响。既往研究指出合并OSA的PCOS患者体重指数更高[19],本研究结果也支持BMI升高是影响PCOS患者OSA发生及严重程度的风险因子。
以往研究显示,在调整体重因素后的多因素Logistic回归分析中,高雄激素血症与PCOS女性的OSA发病率呈正相关,PCOS女性合并OSA的风险较非PCOS女性增加8.2倍[20],说明雄激素升高可能是导致PCOS患者更易患OSA的原因之一。此外,一些研究表明,PCOS女性的OSA严重程度与雄激素水平密切相关,随着雄激素的升高,OSA的分度及临床表现也更严重[9,21]。本研究也发现在PCOS &OSA患者中HA人数占比更多,患有OSA的PCOS患者睾酮及FAI均高于单纯PCOS患者,且随OSA严重程度增加而升高。但也有研究提出睾酮水平在单纯PCOS患者与合并OSA的PCOS患者中没有差异[21],在本研究多因素Logistic回归分析中并未显示HA与OSA的相关性,这可能是与其他参数有交叉,是多因素共同起作用的结果。而且由于中国女性PCOS患者的HA大部分都为轻度,因此进行Logistic回归分析时可能会被其他的因素掩盖导致不相关。高雄激素血症可能通过改变上呼吸道解剖结构以及内脏脂肪分布增加导致OSA更高发,研究发现男性上气道长于女性,更容易导致气道塌陷,这可能与OSA在男性中发病更高有关[22]。
除了雄激素水平较高外,PCOS患者的血浆孕酮水平由于排卵稀少或无排卵而长期保持较低水平[23]。孕酮对OSA有预防作用,因为它可以刺激呼吸动力并增强上呼吸道扩张肌的活动[24]。在本研究中,79.0%的 PCOS 患者存在排卵功能障碍(如OA),并且患有OSA的PCOS患者孕酮水平低于单纯PCOS患者,持续低水平的孕酮可能与PCOS患者OSA的高发生率有关。
抗苗勒氏管激素(anti-mullerian hormone, AMH)是人类和其他动物卵泡发育过程中卵泡颗粒细胞分泌一种激素,在卵巢中AMH对原始卵泡的募集以及窦卵泡的发育有抑制作用,可以防止卵泡过早耗竭,在临床中常被用作评估卵巢储备功能和卵巢功能障碍的重要指标[25]。在患有PCOS的患者中常观察到AMH的升高,AMH升高作为PCOS的一个特征,在该病的病理生理学中发挥着重要作用[26]。AMH可能通过限制FSH促进卵泡发育的功能来参与无排卵[27]。AMH也会影响卵巢周围脂质代谢和胰岛素敏感性,高水平的AMH可能会影响胰岛素分泌和代谢,导致IR[28]。最近的研究发现AMH水平升高与超声下卵巢多囊样改变有显著相关性,PCOS女性的AMH浓度随着窦卵泡数量的增加而增加[29]。而在本研究中观察到患有OSA的PCOS患者AMH水平却低于单纯PCOS患者,而且随着OSA严重程度加重,AMH进一步降低,说明OSA可能会导致卵巢储备功能的下降,这可能由于OSA造成的慢性炎症从而导致卵巢功能损伤有关,有研究发现PCOS女性卵泡液中氧化应激标志物升高[30-31]。本研究发现,PCOS &OSA 患者的炎症指标高于单纯PCOS患者,且差异具有统计学意义;OSA会进一步加重PCOS患者的炎症损伤,且随炎症从程度增加而加重。OSA可能会导致卵母细胞质量下降,从而在PCOS &OSA患者中表现为AMH减低,但也有研究表示AMH升高为PCOS患者OSA发病的保护因素[19]。
IR是PCOS常见的临床表型,常与HA、氧化应激、肥胖相互作用,共同促进,导致PCOS表型的进一步加重,有研究发现患有OSA的患者IR发生率高,同时发生糖尿病的可能也会增加[32],既往研究也提示血糖异常与PCOS患者OSA发病率高相关[9,16,19,21]。HOMA-IR是用于评价个体的IR水平的指标,在本研究中单纯PCOS患者中合并IR的患者占比38.7%(n=134),而PCOS &OSA患者中合并IR的患者占比高达72.7%(n=229),说明患有OSA的PCOS患者合并IR的发生率显著升高。而PCOS &OSA患者的空腹血糖水平、OGTT水平、糖化血红蛋白、胰岛素释放实验结果均高于单纯PCOS患者,而且随着OSA严重程度加重,Logistic回归分析显示HbA1c升高是影响PCOS患者OSA发生及严重程度的风险因子。可见OSA会使PCOS患者的糖代谢进一步紊乱,TG水平也高于单纯PCOS患者,这可能是由肥胖、IR、糖代谢异常导致的,OSA使PCOS患者的脂代谢水平受到影响,发生心脑血管意外风险升高。
OSA 会导致氧化应激(oxidative stress,OS)。既往研究表明OSA患者白细胞中烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶表达上调,显著增加白细胞的氧化作用,导致氧化应激[33]。氧化应激产生的促炎细胞因子诱发IR和高雄激素血症,并增加心血管疾病的风险,还会损害蛋白质、脂质和DNA,从而导致组织损伤。PCOS女性卵泡液和血清中氧化应激标志物升高,氧化应激和促炎细胞因子可直接影响卵母细胞质量而导致不孕[34],还可通过改变卵泡微环境促进 PCOS 患者的炎症级联反应,慢性炎症的进一步发展会引起线粒体功能障碍,影响卵母细胞的能量供应,导致卵子质量受损、影响排卵[35]。本研究发现PCOS &OSA患者US-CRP明显高于单纯PCOS患者,且随着OSA严重程度加重US-CRP也进一步升高,与既往研究结果相一致[9],揭示OSA可能导致PCOS患者的炎症反应加重,这可能是与OSA反复慢性缺氧有关,同时氧化应激可通过加重IR和HA进一步导致炎症反应加重,从而形成恶性循环。
近期有研究显示OSA患者的ALT和AST水平较高,并且在接受持续气道正压通气治疗后降低[36],大多数OSA患者同时患有肥胖,使得脂肪肝风险增大[37],OSA患者中非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)发病率高[38],可能导致肝脏损伤从而导致转氨酶升高。此外,还有研究发现,OSA可能通过IR和全身性炎症导致肝损伤[39], OSA本身可能是独立于肥胖之外的肝损伤危险因素。OSA直接导致的肝脏缺氧和OSA诱导的IR可能在OSA相关肝病的发生中发挥作用。在本研究中,PCOS &OSA患者AST、ALT水平均高于单纯PCOS患者,且中重度PCOS &OSA患者的转氨酶水平显著高于轻度PCOS &OSA的患者,这提示OSA可能使PCOS患者的肝功能进一步受损,且随着OSA程度加重,肝脏缺氧加重以及IR、慢性炎症的中介作用,肝功能受损情况也会进一步加重。凝血酶原活动度(A)是反映肝脏凝血功能的重要指标,也可反映肝脏储备功能,本研究发现凝血酶原活动度(A)在PCOS &OSA患者中升高,说明OSA可能对肝脏功能有所损害,但导致凝血酶原活动度(A)升高的原因很多,暂不能明确与OSA发病存在因果关系。
血清胱抑素C(cystatin C,CyC)是反应肾小球滤过率的内源性生物标志物,常用于检测早期肾功能损害,同时也是心血管疾病和糖尿病的预测因子。有研究指出 PCOS 患者的血清CyC水平升高[40],还有研究发现,在校正性别、BMI、高血压等危险因素后,CyC浓度升高仍是OSA患者脑卒中发生的危险因素[41],同时,OSA严重程度与血清CyC浓度呈正相关[42]。本研究的结果表明,PCOS &OSA患者的血清CyC水平高于单纯PCOS患者,且差异具有统计学意义,阐释OSA可能会加重PCOS女性潜在肾功能障碍和心血管风险。CyC可作为早期识别PCOS女性心血管风险的重要标记物[43]。
总之,本研究揭示了PCOS患者合并OSA与生殖内分泌和代谢紊乱指标的多种改变相关,这不仅为临床医生提供了更全面的诊疗信息,也为未来深入研究PCOS与OSA关联性的机制以及相应干预措施提供了有力的基础。研究结果强调了综合治疗PCOS患者时应考虑是否合并OSA,建议将OSA筛查作为PCOS患者的常规评估,并在此基础上制定更有效的干预策略,可能对提高PCOS患者整体健康状况及助孕效果有积极意义。
本研究的局限性在于缺乏正常人群作为对照组,因此,很难确定PCOS是否是OSA诊断和严重程度的独立危险因素。此外,本研究使用家庭睡眠呼吸暂停测试(澳大利亚 ResMed Ltd. 的 Apnealink Plus 的3型便携式监测)来记录参数,与多导睡眠图 (PSG) 检查相比,这种监测方法可能会低估患者的病情和严重程度。尽管本研究提供了对PCOS患者中OSA患病情况及其影响的深入了解,但存在一些局限性,未来的研究应该采用更全面的纵向设计,以揭示PCOS与OSA之间的因果关系,并拓展样本范围以提高研究结果的普适性。
1 Bozdag G,Mumusoglu S,Zengin D,et al.The prevalence and phenotypic features of polycystic ovary syndrome:a systematic review and meta-analysis.Hum Reprod,2016,31:2841-2855.
2 Powell TA,Mysliwiec V,Brock MS,et al.OSA and cardiorespiratory fitness:a review.J Clin Sleep Med,2022,18:279-288.
3 Doycheva I,Ehrmann DA.Nonalcoholic fatty liver disease and obstructive sleep apnea in women with polycystic ovary syndrome.Fertil Steril,2022,117:897-911.
4 Gao L,Zhao Y,Wu H,et al.Polycystic Ovary Syndrome Fuels Cardiovascular Inflammation and Aggravates Ischemic Cardiac Injury.Circulation,2023,148:1958-1973.
5 Teede HJ,Tay CT,Laven J,et al.Recommendations From the 2023 International Evidence-based Guideline for the Assessment and Management of Polycystic Ovary Syndrome.J Clin Endocrinol Metab,2023,108:2447-2469.
6 Fernandez L,Lüthi A.Sleep Spindles:Mechanisms and Functions.Physiol Rev,2020,100:805-868.
7 Redline S,Azarbarzin A,Peker Y.Obstructive sleep apnoea heterogeneity and cardiovascular disease.Nat Rev Cardiol,2023,20:560-573.
8 Eisenberg E,Legro RS,Diamond MP,et al.Sleep Habits of Women With Infertility.J Clin Endocrinol Metab,2021,106:e4414-e4426.
9 Christ JP,Shinkai K,Corley J,et al.Metabolic and endocrine status associate with obstructive sleep apnea risk among patients with polycystic ovary syndrome.J Clin Sleep Med,2024,20:871-877.
10 Rotterdam ESHRE/ASRM—Sponsored PCOS consensus workshop group.Revised 2003 consensuson diagnostic criteria and long term health risks related to polycystic ovarysyndrome.Hum Reprod,2004,81:19-25.
11 Kirsch DB.Obstructive Sleep Apnea.Continuum,2020,26:908-928.
12 Sam S,Tasali E.Role of obstructive sleep apnea in metabolic risk in PCOS.Curr Opin Endocr Metab Res,2021,17:46-51.
13 Kahal H,Kyrou I,Uthman OA,et al.The prevalence of obstructive sleep apnoea in women with polycystic ovary syndrome:a systematic review and meta-analysis.Sleep Breath,2020,24:339-350.
14 Helvaci N,Karabulut E,Demir AU,et al.Polycystic ovary syndrome and the risk of obstructive sleep apnea:a meta-analysis and review of the literature.Endocr Connect,2017,6:437-445.
15 Wang X,Fan J,Guo R,et al.Association of obstructive sleep apnoea with cardiovascular events in women and men with acute coronary syndrome.Eur Respir J,2023,61:2201110.
16 Yang R,Gao C,Yan Y,et al.Analysis of the proportion and clinical characteristics of obstructive sleep apnea in women with polycystic ovary syndrome.Sleep Breath,2022,26:497-503.
17 Ibrahim S,Mehra R,Tantibhedhyangkul J,et al.Sleep and obstructive sleep apnea in women with infertility.Sleep Breath,2023,27:1733-1742.
18 Peppard PE,Young T,Palta M,et al.Longitudinal study of moderate weight change and sleep-disordered breathing.JAMA,2000,284:3015-3021.
19 宋岩,何鑫,胡克.多囊卵巢综合征合并阻塞性睡眠呼吸暂停临床特征与危险因素分析.临床肺科杂志,2022,27:822-828.
20 Tock L,Carneiro G,Togeiro SM,et al.Obstructive sleep apnea predisposes to nonalcoholic Fatty liver disease in patients with polycystic ovary syndrome.Endocr Pract,2014,20:244-251.
21 Kahal H,Kyrou I,Uthman O,et al.The association between obstructive sleep apnea and metabolic abnormalities in women with polycystic ovary syndrome:a systematic review and meta-analysis.Sleep,2018,41.
22 Hartfield PJ,Janczy J,Sharma A,et al.Anatomical determinants of upper airway collapsibility in obstructive sleep apnea:A systematic review and meta-analysis.Sleep Med Rev,2023,68:101741.
23 Nitsche K,Ehrmann DA.Obstructive sleep apnea and metabolic dysfunction in polycystic ovary syndrome.Best Pract Res Clin Endocrinol Metab,2010,24:717-730.
24 Jehan S,Auguste E,Zizi F,et al.Obstructive Sleep Apnea:Women′s Perspective.J Sleep Med Disord,2016,3:1064 [pii].
25 Visser JA,de Jong FH,Laven JS,et al.Anti-Müllerian hormone:a new marker for ovarian function.Reproduction,2006,131:1-9.
26 Siddiqui S,Mateen S,Ahmad R,et al.A brief insight into the etiology,genetics,and immunology of polycystic ovarian syndrome (PCOS).J Assist Reprod Genet,2022,39:2439-2473.
27 Tal R,Seifer DB,Khanimov M,et al.Characterization of women with elevated antimüllerian hormone levels (AMH):correlation of AMH with polycystic ovarian syndrome phenotypes and assisted reproductive technology outcomes.Am J Obstet Gynecol,2014,211:59.e1-8.
28 Bani Mohammad M,Majdi Seghinsara A.Polycystic Ovary Syndrome (PCOS),Diagnostic Criteria,and AMH.Asian Pac J Cancer Prev,2017,18:17-21.
29 Piltonen TT,Komsi E,Morin-Papunen LC,et al.AMH as part of the diagnostic PCOS workup in large epidemiological studies.Eur J Endocrinol,2023,188:547-554.
30 Dumesic DA,Meldrum DR,Katz-Jaffe MG,et al.Oocyte environment:follicular fluid and cumulus cells are critical for oocyte health.Fertil Steril,2015,103:303-316.
31 Collodel G,Gambera L,Stendardi A,et al.Follicular Fluid Components in Reduced Ovarian Reserve,Endometriosis,and Idiopathic Infertility.Int J Mol Sci,2023,24:2589.
32 Zhang Y,Elgart M,Kurniansyah N,et al.Genetic determinants of cardiometabolic and pulmonary phenotypes and obstructive sleep apnoea in HCHS/SOL.EBioMedicine,2022,84:104288.
33 Dursun P,Demirta E,Bayrak A,et al.Decreased serum paraoxonase 1 (PON1) activity:an additional risk factor for atherosclerotic heart disease in patients with PCOS.Hum Reprod,2006,21:104-108.
E,Bayrak A,et al.Decreased serum paraoxonase 1 (PON1) activity:an additional risk factor for atherosclerotic heart disease in patients with PCOS.Hum Reprod,2006,21:104-108.
34 Pasquali R,Gambineri A.New perspectives on the definition and management of polycystic ovary syndrome.J Endocrinol Invest,2018,41:1123-1135.
35 Liu Y,Liu H,Li Z,et al.The Release of Peripheral Immune Inflammatory Cytokines Promote an Inflammatory Cascade in PCOS Patients via Altering the Follicular Microenvironment.Front Immunol,2021,12:685724.
36 Fiedorczuk P,Polecka A,Walasek M,et al.Potential Diagnostic and Monitoring Biomarkers of Obstructive Sleep Apnea-Umbrella Review of Meta-Analyses.J Clin Med,2022,12:60.
37 Vgontzas AN,Papanicolaou DA,Bixler EO,et al.Sleep apnea and daytime sleepiness and fatigue:relation to visceral obesity,insulin resistance,and hypercytokinemia.J Clin Endocrinol Metab,2000,85:1151-1158.
38 Zhu C,Tang S,Xiao J,et al.Insulin Resistance,but Not Obstructive Sleep Apnea Is Associated with Hepatic Steatosis in Chinese Patients with Severe Obesity.Obes Facts,2023,16:344-355.
39 Zhang L,Zhang X,Meng H,et al.Obstructive sleep apnea and liver injury in severely obese patients with nonalcoholic fatty liver disease.Sleep Breath,2020,24:1515-1521.
40 Özdemir BÖ,Göçmen ![]() K
K rm
rm z
z D.The role of inflammation,oxidation and Cystatin-C in the pathophysiology of polycystic ovary syndrome.Turk J Obstet Gynecol,2022,19:229-235.
D.The role of inflammation,oxidation and Cystatin-C in the pathophysiology of polycystic ovary syndrome.Turk J Obstet Gynecol,2022,19:229-235.
41 Su X,Gao Y,Xu W,et al.Association Cystatin C and Risk of Stroke in Elderly Patients With Obstructive Sleep Apnea:A Prospective Cohort Study.Front Neurosci,2021,15:762552.
42 Li JH,Gao YH,Xue X,et al.Association between Serum Cystatin C levels and long-term cardiovascular outcomes and all-cause mortality in older patients with obstructive sleep apnea.Front Physiol,2022,13:934413.
43 Yildirim A,Yildizhan B,Anik Ilhan G,et al.Cystatin C,a novel cardiometabolic risk marker in women with polycystic ovary syndrome.Gynecol Endocrinol,2016,32:457-459.