早产儿是新生儿期及远期健康的双重高危人群。据世界卫生组织统计,全球每年约有1 500万例早产儿出生,约占新生儿总数的10%[1]。中国早产儿数量位居全球第二位[2]。近年来,随着围生医学和新生儿重症救治技术的进步,早产儿存活率显著提高,但出生胎龄和体重越低,其近期并发症(如呼吸窘迫综合征、坏死性小肠结肠炎等)及远期健康风险(如神经发育障碍、代谢综合征等)也相应增加,给家庭和社会带来沉重的医疗和经济负担。
体重追赶生长是评估早产儿健康发育的关键指标。生后2年内(尤其是前6个月)的体重增长模式不仅与神经系统发育密切相关,还可能影响远期代谢健康,追赶不足可能导致生长迟缓、认知功能障碍;而追赶过快则与儿童期肥胖、胰岛素抵抗及心血管疾病风险升高相关。多数适于胎龄早产儿在科学喂养和合理营养支持下,可在1~2年内追赶上足月儿生长轨迹,但实际追赶过程受多因素影响,包括出生胎龄、出生体重、宫内生长状况、喂养方式及并发症等。如何基于个体特征制定精准的干预策略,仍是临床实践中的难点。
本研究以早产儿校正24月龄内的体重追赶为核心观察指标,通过回顾分析母亲孕期情况,结合产后养育行为(喂养方式、照护策略等)的问卷调查,探讨影响体重追赶的关键因素,为促进早产儿实现更适宜的追赶生长,降低远期不良健康结局的发生提供理论基础。
对象与方法
1.对象:本研究采用回顾性病例对照研究,选取2021年5月至2022年4月在北京大学第三医院产科分娩的早产儿作为研究对象。共纳入符合研究标准的早产儿363例。纳入标准包括(1)胎龄<37周的活产早产儿;(2)母亲在本院完成规范产检分娩,且保留完整的产检资料;(3)完成全程随访且关键时间节点数据完整者;(4)主要照护者具备正常沟通能力并签署知情同意书。排除标准包括(1)新生儿合并先天性畸形或严重疾病;(2)母亲合并入组标准外的其他内外科疾病;(3)母亲失访病例。本研究已获北京大学第三医院伦理委员会批准(M2022693)。
2.诊断标准:(1)出生体重指新生儿出生后1 h内的体重。早产儿(指28≤胎龄<37周的新生儿定义参考第9版《儿科学》[3]。(2)妊娠期高血压疾病、妊娠期糖尿病、妊娠期甲状腺疾病、贫血等诊断参考第9版《妇产科学》[4]。
3.资料收集:妊娠期相关因素包括(1)一般资料。分娩年龄、孕前BMI、受孕方式(自然/辅助生殖)、单胎/多胎、分娩方式(经阴分娩/剖宫产);(2)孕期状况。妊娠期高血压疾病,包括早发型子痫前期和晚发型子痫前期;妊娠期高血糖,包括孕前糖尿病(diabetes mellitus,DM)和妊娠期糖尿病(gestational diabetes mellitus,GDM);甲状腺疾病,包括甲状腺功能亢进、甲状腺功能减退和单纯甲状腺抗体阳性;贫血,包括轻度贫血(外周血血红蛋白浓度100~109 g/L)和中度贫血(外周血血红蛋白浓度70~99 g/L)。新生儿资料包括(1)基本情况。出生胎龄、出生体重、分娩方式、新生儿窒息史;(2)随访情况。体重、喂养方式(母乳/配方奶/混合)、主要照护者(父母/祖父母/保姆)。随访情况按校正月龄阶段(0~6月、7~12月、13~18、19~24月)分别记录,以确保纵向数据的可比性。
4.分组:选择体重作为主要观察指标,体重受遗传影响小,更能准确反映营养与追赶生长情况,使用精确度±100 g的电子体重秤测量3次,取中间值或两次相同值。参照世界卫生组织 0~24月龄婴幼儿生长曲线[5]分组:低体重组(<第15百分位)、中等体重组(第15~85百分位)、高体重组(>第85百分位)。
5.统计学处理:采用SPSS 27.0软件进行数据分析。正态分布的计量资料以(均数±标准差)表示,采用独立样本t检验或方差分析;非正态分布的计量资料以中位数(四分位间距)[M(P25,P75)]表示。计数资料以构成比(%)表示;有序分类资料(等级资料)的组间比较,若为两独立样本,采用 Mann-Whitney U 检验;若为多独立样本,采用 Kruskal-Wallis H 检验。以P<0.05为差异有统计学意义。多因素分析采用有序Logistic回归分析。
结果
1.研究对象基线特征与体重变化趋势:本研究纳入363例早产儿,母亲平均年龄(34.2±4.5)岁,其中高龄产妇(≥35岁)占66.9%。孕前超重/肥胖率为32.8%,辅助生殖技术受孕占46.3%,剖宫产率84.0%,双胎妊娠率54.0%。妊娠合并症中,妊娠期高血压疾病(40.2%)、妊娠期高血糖(28.4%)和甲状腺功能减退(17.9%),单纯甲状腺抗体阳性(10.7%)及孕期贫血(17.9%)较为常见。363例早产儿性别比例男185例(51.0%),女178例(49.0%),平均胎龄(34.6±2.2)周,极早产儿44例(12.1%),中期早产儿57例(15.7%),晚期早产儿262例(72.2%)。平均出生体重(2 257.2±540.3)g,平均身长(44.3±3.7)cm。随访数据显示,早产儿体重分布呈现明显的动态变化趋势,即低体重组比例持续下降,从6月龄的9.9%显著降低至24月龄的1.4%,12月龄时降至3.9%;中体重组比例稳步上升,由6月龄的87.6%逐步增至24月龄的95.3%;高体重组比例相对稳定,始终维持在2.5%~3.6%的较低水平,虽在12~18月龄略有波动,但24月龄时稳定在3.3%。见表1、表2。
表1 孕产妇及早产儿基线特征
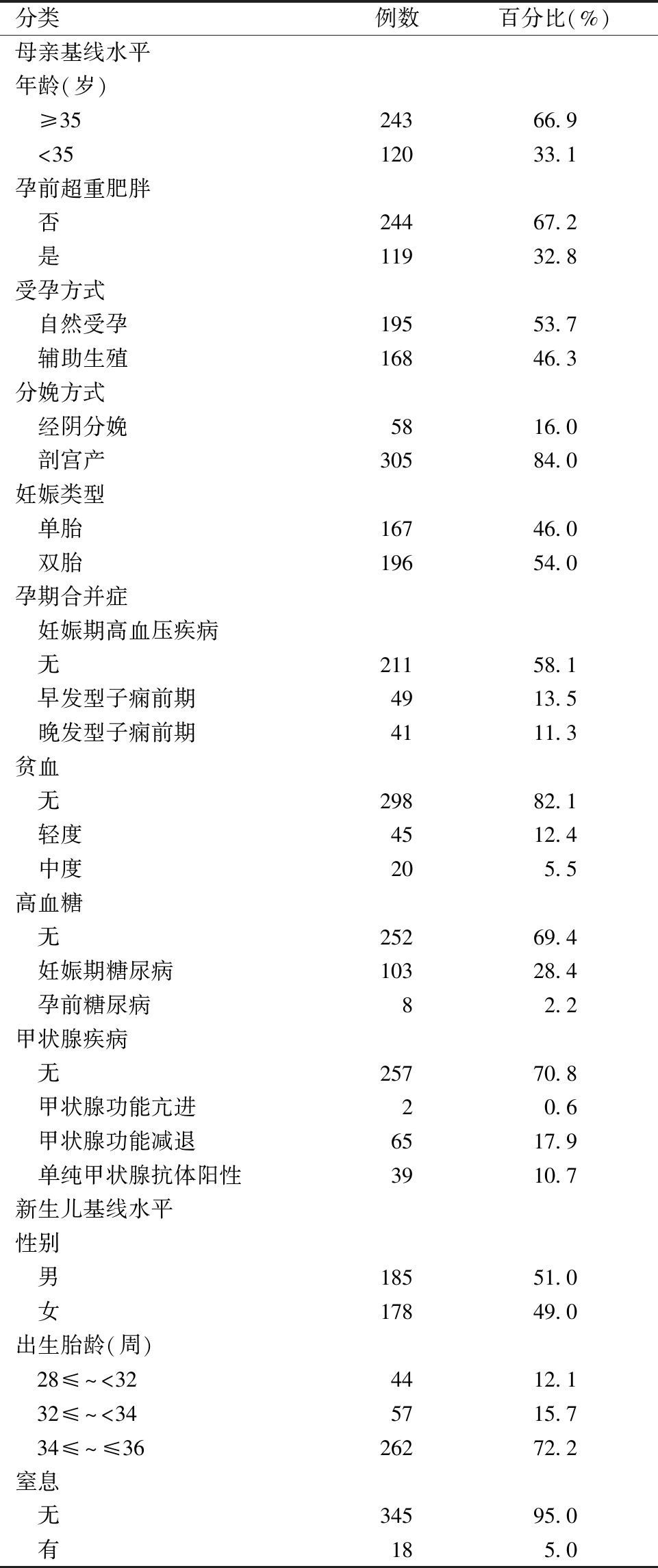
分类例数百分比(%)母亲基线水平年龄(岁) ≥3524366.9 <3512033.1孕前超重肥胖 否24467.2 是11932.8受孕方式 自然受孕19553.7 辅助生殖16846.3分娩方式 经阴分娩5816.0 剖宫产30584.0妊娠类型 单胎16746.0 双胎19654.0孕期合并症 妊娠期高血压疾病 无21158.1 早发型子痫前期4913.5 晚发型子痫前期4111.3贫血 无29882.1 轻度4512.4 中度205.5高血糖 无25269.4 妊娠期糖尿病10328.4 孕前糖尿病82.2甲状腺疾病 无25770.8 甲状腺功能亢进20.6 甲状腺功能减退6517.9 单纯甲状腺抗体阳性3910.7新生儿基线水平性别 男18551.0 女17849.0出生胎龄(周) 28≤~<324412.1 32≤~<345715.7 34≤~≤3626272.2窒息 无34595.0 有185.0
表2 早产儿体重分组(校正月龄6~24个月)[例(%)]

组别 6月龄12月龄18月龄24月龄低体重组36(9.9)14(3.9)8(2.2)5(1.4)中体重组318(87.6)337(92.8)342(94.2)346(95.3)高体重组9(2.5)12(3.3)13(3.6)12(3.3)
2.早产儿出生后体重发育影响因素的月龄变化特征分析:出生体重方面,单胎早产儿体重显著高于双胎(P=0.041),且胎龄与出生体重呈显著正相关(P<0.001)。早发型子痫前期组体重低于晚发型及血压正常组(P<0.05),无窒息史早产儿体重显著高于有窒息史者(P<0.05)。母亲年龄、分娩方式、受孕方式、贫血、妊娠期高血糖及甲状腺疾病对出生体重无显著影响(P>0.05)。
校正6月龄时,32≤胎龄<34周早产儿低体重率显著高于28≤胎龄<32周和34≤胎龄≤36周早产儿(18.2% vs 1.8% vs 10.3%,P=0.015),提示其存在明显的体重追赶不足。母亲年龄、分娩方式、受孕方式、单胎/双胎、子痫前期、贫血、妊娠期高血糖、甲状腺疾病及窒息史均未对体重分布产生显著影响(P>0.05)。
校正12月龄时,母亲年龄≥35岁(P=0.008)及剖宫产分娩(P=0.012)与高体重比例显著相关,提示过度追赶。受孕方式、单胎/双胎、子痫前期、贫血、甲状腺疾病及窒息史均未对体重分布产生显著影响(P>0.05),胎龄影响接近显著(P=0.053)。
校正18月龄时,高龄产妇(P=0.030)、剖宫产(P=0.004)及妊娠期轻度贫血(P=0.014)均与高体重比例显著相关,提示过度追赶。胎龄影响接近显著(P=0.116),而受孕方式、单胎/双胎、子痫前期、妊娠期高血糖、甲状腺疾病及窒息史无显著影响(P>0.05)。
校正24月龄时,高龄产妇(P=0.023)、剖宫产(P=0.007)及轻度贫血(P=0.010)仍与高体重比例显著相关。胎龄影响接近显著(P=0.086),单胎组低体重率略高(5.00% vs 0.00%),但差异无统计学意义。受孕方式、子痫前期、妊娠期高血糖、甲状腺疾病及窒息史对体重分布无显著影响(P>0.05)。见表3。
表3 围产期相关因素对早产儿校正0~24月龄体重影响[例(%)]
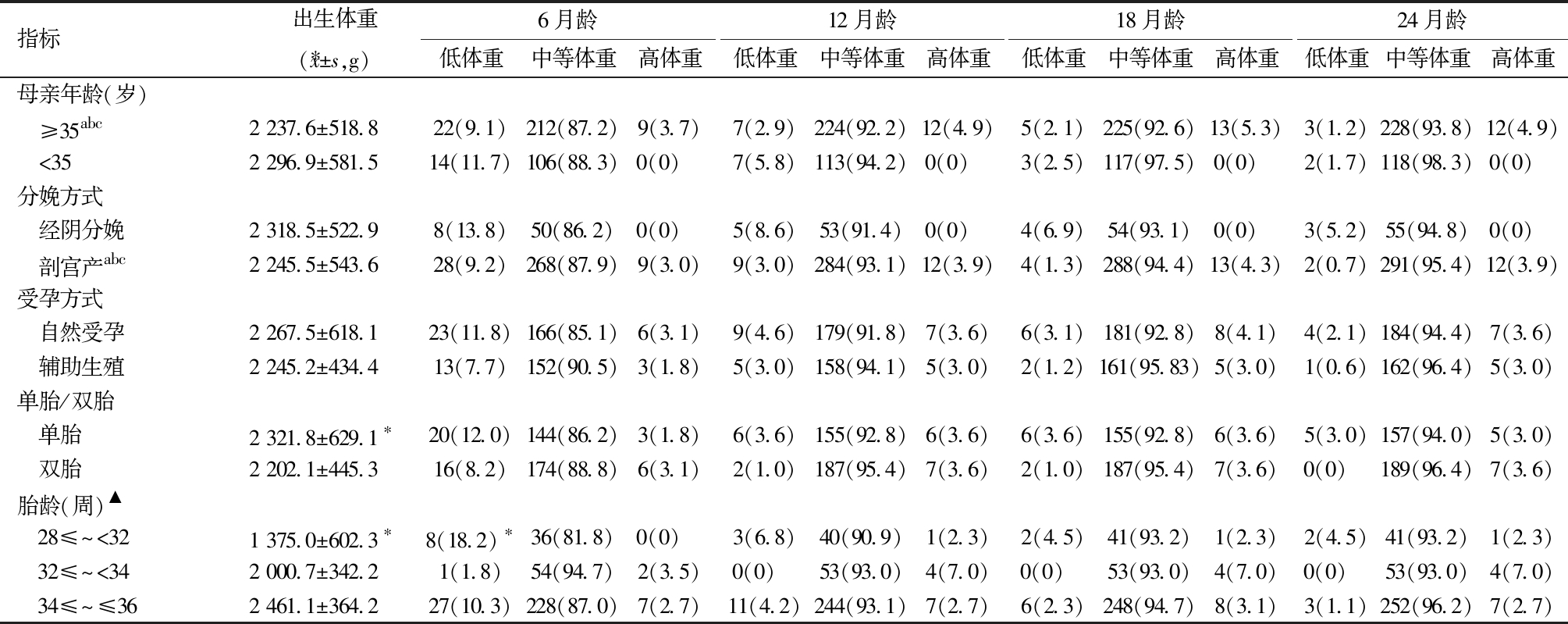
指标出生体重( x±s,g)6月龄低体重中等体重高体重12月龄低体重中等体重高体重18月龄低体重中等体重高体重24月龄低体重中等体重高体重母亲年龄(岁) ≥35abc2 237.6±518.822(9.1)212(87.2)9(3.7)7(2.9)224(92.2)12(4.9)5(2.1)225(92.6)13(5.3)3(1.2)228(93.8)12(4.9) <352 296.9±581.514(11.7)106(88.3)0(0) 7(5.8)113(94.2)0(0) 3(2.5)117(97.5)0(0) 2(1.7)118(98.3)0(0) 分娩方式 经阴分娩2 318.5±522.98(13.8)50(86.2)0(0) 5(8.6)53(91.4)0(0) 4(6.9)54(93.1)0(0) 3(5.2)55(94.8)0(0) 剖宫产abc2 245.5±543.628(9.2)268(87.9)9(3.0)9(3.0)284(93.1)12(3.9)4(1.3)288(94.4)13(4.3)2(0.7)291(95.4)12(3.9)受孕方式 自然受孕2 267.5±618.123(11.8)166(85.1)6(3.1)9(4.6)179(91.8)7(3.6)6(3.1)181(92.8)8(4.1)4(2.1)184(94.4)7(3.6) 辅助生殖2 245.2±434.413(7.7)152(90.5)3(1.8)5(3.0)158(94.1)5(3.0)2(1.2)161(95.83)5(3.0)1(0.6)162(96.4)5(3.0)单胎/双胎 单胎2 321.8±629.1∗20(12.0)144(86.2)3(1.8)6(3.6)155(92.8)6(3.6)6(3.6)155(92.8)6(3.6)5(3.0)157(94.0)5(3.0) 双胎2 202.1±445.316(8.2)174(88.8)6(3.1)2(1.0)187(95.4)7(3.6)2(1.0)187(95.4)7(3.6)0(0) 189(96.4)7(3.6)胎龄(周)▲ 28≤~<321 375.0±602.3∗8(18.2)∗36(81.8)0(0) 3(6.8)40(90.9)1(2.3)2(4.5)41(93.2)1(2.3)2(4.5)41(93.2)1(2.3) 32≤~<342 000.7±342.21(1.8)54(94.7)2(3.5)0(0) 53(93.0)4(7.0)0(0) 53(93.0)4(7.0)0(0) 53(93.0)4(7.0) 34≤~≤36 2 461.1±364.227(10.3)228(87.0)7(2.7)11(4.2)244(93.1)7(2.7)6(2.3)248(94.7)8(3.1)3(1.1)252(96.2)7(2.7)
表3(续)
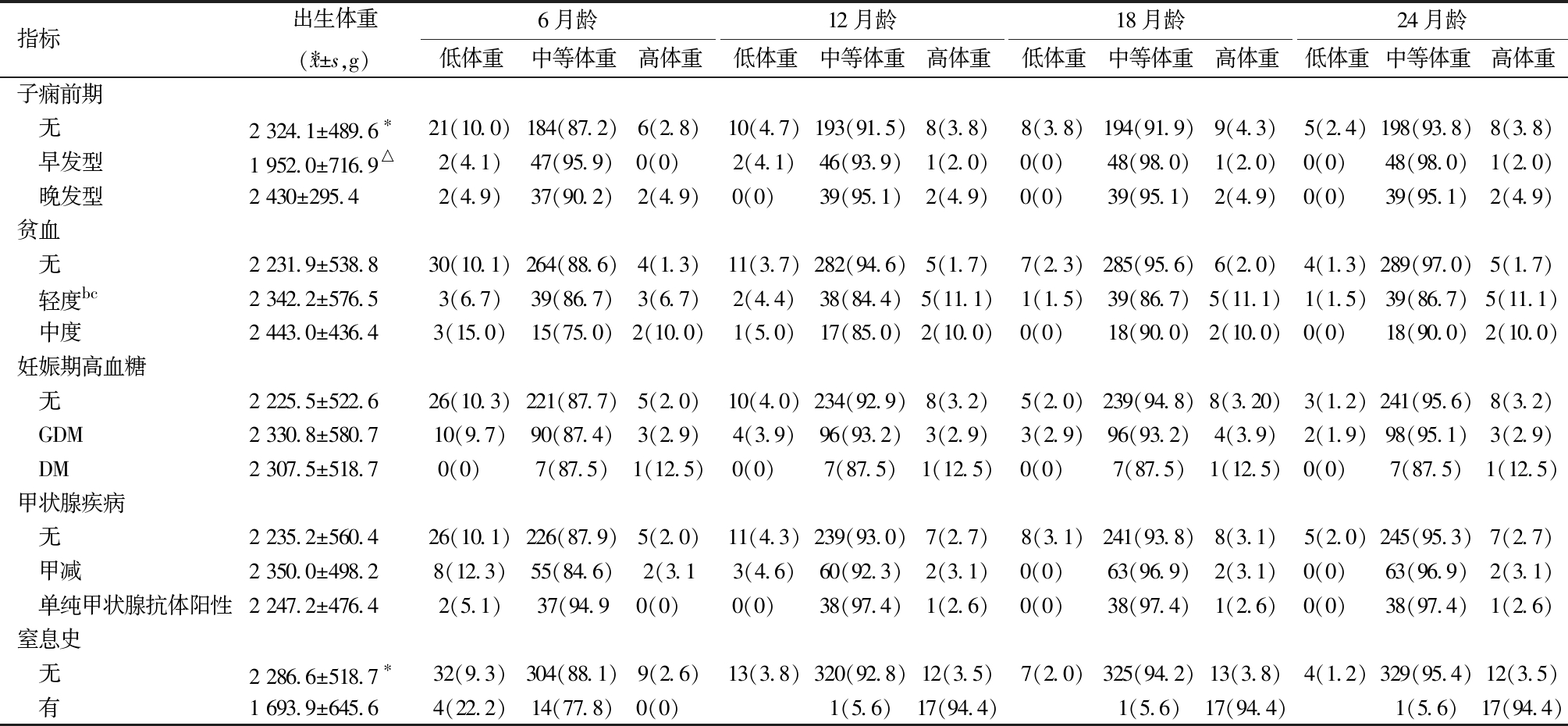
*P<0.05; ▲胎龄与出生体重呈显著正相关: P<0.05; 校正6月龄时,与晚发型及血压正常组比较,△P<0.05;校正12月龄时,a母亲年龄≥35岁(P=0.008)及剖宫产分娩(P=0.012)与高体重比例显著相关;校正18月龄时,b高龄产妇(P=0.030)、剖宫产(P=0.004)及妊娠期轻度贫血(P=0.014)均与高体重比例显著相关; 校正24月龄时,c高龄产妇(P=0.023)、剖宫产(P=0.007)及轻度贫血(P=0.010)与高体重比例显著相关。
指标出生体重( x±s,g)6月龄低体重中等体重高体重12月龄低体重中等体重高体重18月龄低体重中等体重高体重24月龄低体重中等体重高体重子痫前期 无2 324.1±489.6∗21(10.0)184(87.2)6(2.8)10(4.7)193(91.5)8(3.8)8(3.8)194(91.9)9(4.3)5(2.4)198(93.8)8(3.8) 早发型1 952.0±716.9△2(4.1)47(95.9)0(0) 2(4.1)46(93.9)1(2.0)0(0) 48(98.0)1(2.0)0(0) 48(98.0)1(2.0) 晚发型2 430±295.42(4.9)37(90.2)2(4.9)0(0) 39(95.1)2(4.9)0(0) 39(95.1)2(4.9)0(0) 39(95.1)2(4.9)贫血 无2 231.9±538.830(10.1)264(88.6)4(1.3)11(3.7)282(94.6)5(1.7)7(2.3)285(95.6)6(2.0)4(1.3)289(97.0)5(1.7) 轻度bc2 342.2±576.53(6.7)39(86.7)3(6.7)2(4.4)38(84.4)5(11.1)1(1.5)39(86.7)5(11.1)1(1.5)39(86.7)5(11.1) 中度2 443.0±436.43(15.0)15(75.0)2(10.0)1(5.0)17(85.0)2(10.0)0(0) 18(90.0)2(10.0)0(0) 18(90.0)2(10.0)妊娠期高血糖 无2 225.5±522.626(10.3)221(87.7)5(2.0)10(4.0)234(92.9)8(3.2)5(2.0)239(94.8)8(3.20)3(1.2)241(95.6)8(3.2) GDM2 330.8±580.710(9.7)90(87.4)3(2.9)4(3.9)96(93.2)3(2.9)3(2.9)96(93.2)4(3.9)2(1.9)98(95.1)3(2.9) DM2 307.5±518.70(0) 7(87.5)1(12.5)0(0) 7(87.5)1(12.5)0(0) 7(87.5)1(12.5)0(0) 7(87.5)1(12.5)甲状腺疾病 无2 235.2±560.426(10.1)226(87.9)5(2.0)11(4.3)239(93.0)7(2.7)8(3.1)241(93.8)8(3.1)5(2.0)245(95.3)7(2.7) 甲减2 350.0±498.28(12.3)55(84.6)2(3.13(4.6)60(92.3)2(3.1)0(0) 63(96.9)2(3.1)0(0) 63(96.9)2(3.1) 单纯甲状腺抗体阳性2 247.2±476.42(5.1)37(94.90(0) 0(0) 38(97.4)1(2.6)0(0) 38(97.4)1(2.6)0(0) 38(97.4)1(2.6)窒息史 无2 286.6±518.7∗32(9.3)304(88.1)9(2.6)13(3.8)320(92.8)12(3.5)7(2.0)325(94.2)13(3.8)4(1.2)329(95.4)12(3.5) 有1 693.9±645.64(22.2)14(77.8)0(0) 1(5.6)17(94.4)1(5.6)17(94.4)1(5.6)17(94.4)
3.喂养方式与照顾人员对早产儿体重分布的影响分析:喂养方式对早产儿体重分布具有持续显著影响(各月龄P<0.01)。母乳喂养组6~18月龄低体重率较高(14.6%~24.3%),提示存在追赶不足风险;人工喂养组各月龄高体重率均较高(6.7%~15.3%),提示存在过度追赶风险;混合喂养组体重分布最优,各月龄高体重率均<1%。照顾人员影响呈阶段性,即18~24月龄祖父母照顾组高体重率显著高于父母照顾组(P<0.05),而6~12月龄无显著差异(P>0.05)。见表4。
表4 喂养方式与照顾人员对早产儿体重分布的影响分析[例(%)]
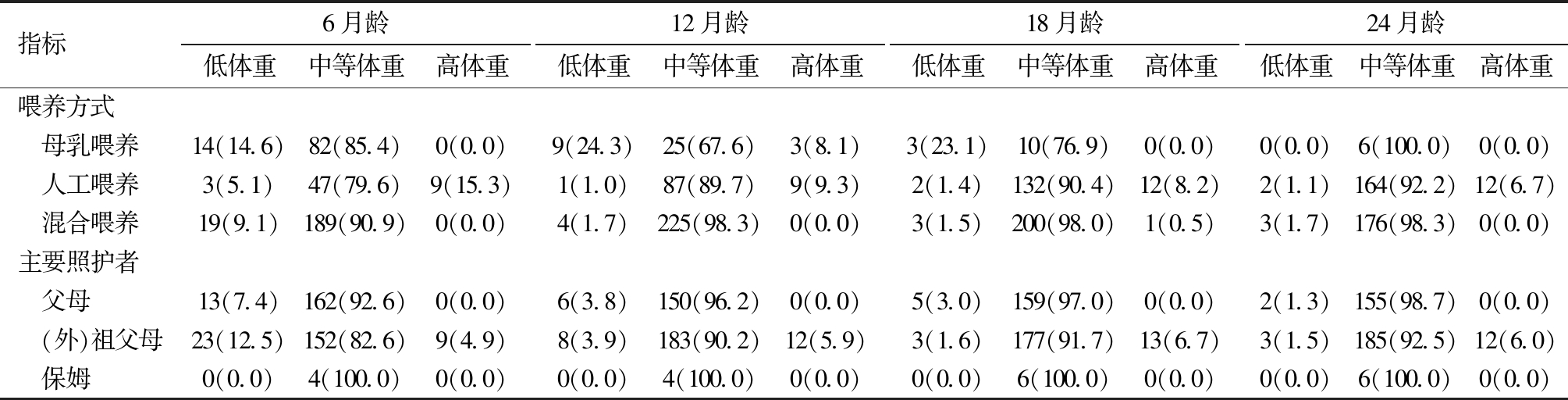
指标6月龄低体重中等体重高体重12月龄低体重中等体重高体重18月龄低体重中等体重高体重24月龄低体重中等体重高体重喂养方式 母乳喂养14(14.6)82(85.4)0(0.0)9(24.3)25(67.6)3(8.1)3(23.1)10(76.9)0(0.0)0(0.0)6(100.0)0(0.0) 人工喂养3(5.1)47(79.6)9(15.3)1(1.0)87(89.7)9(9.3)2(1.4)132(90.4)12(8.2)2(1.1)164(92.2)12(6.7) 混合喂养19(9.1)189(90.9)0(0.0)4(1.7)225(98.3)0(0.0)3(1.5)200(98.0)1(0.5)3(1.7)176(98.3)0(0.0)主要照护者 父母13(7.4)162(92.6)0(0.0)6(3.8)150(96.2)0(0.0)5(3.0)159(97.0)0(0.0)2(1.3)155(98.7)0(0.0) (外)祖父母23(12.5)152(82.6)9(4.9)8(3.9)183(90.2)12(5.9)3(1.6)177(91.7)13(6.7)3(1.5)185(92.5)12(6.0) 保姆0(0.0)4(100.0)0(0.0)0(0.0)4(100.0)0(0.0)0(0.0)6(100.0)0(0.0)0(0.0)6(100.0)0(0.0)
4.妊娠期危险因素及生后养育方式对早产儿体重分布的有序Logistic回归分析:以子代发生低体重和高体重为结局,将研究指标纳入有序Logistic回归分析,结果表明,母亲年龄≥35岁(校正12月龄)、窒息史(校正18、24月龄)、母乳喂养(校正12、18月龄)为早产儿体重等级提升的保护因素,剖宫产(校正12、18、24月龄)、胎龄32~34周(校正6、12、24月龄)、轻度贫血和中度贫血(校正12、24月龄)、人工喂养(各月龄)为早产儿体重等级提升的危险因素,见表5。
表5 妊娠期危险因素及生后养育方式对早产儿体重分布的有序Logistic回归分析
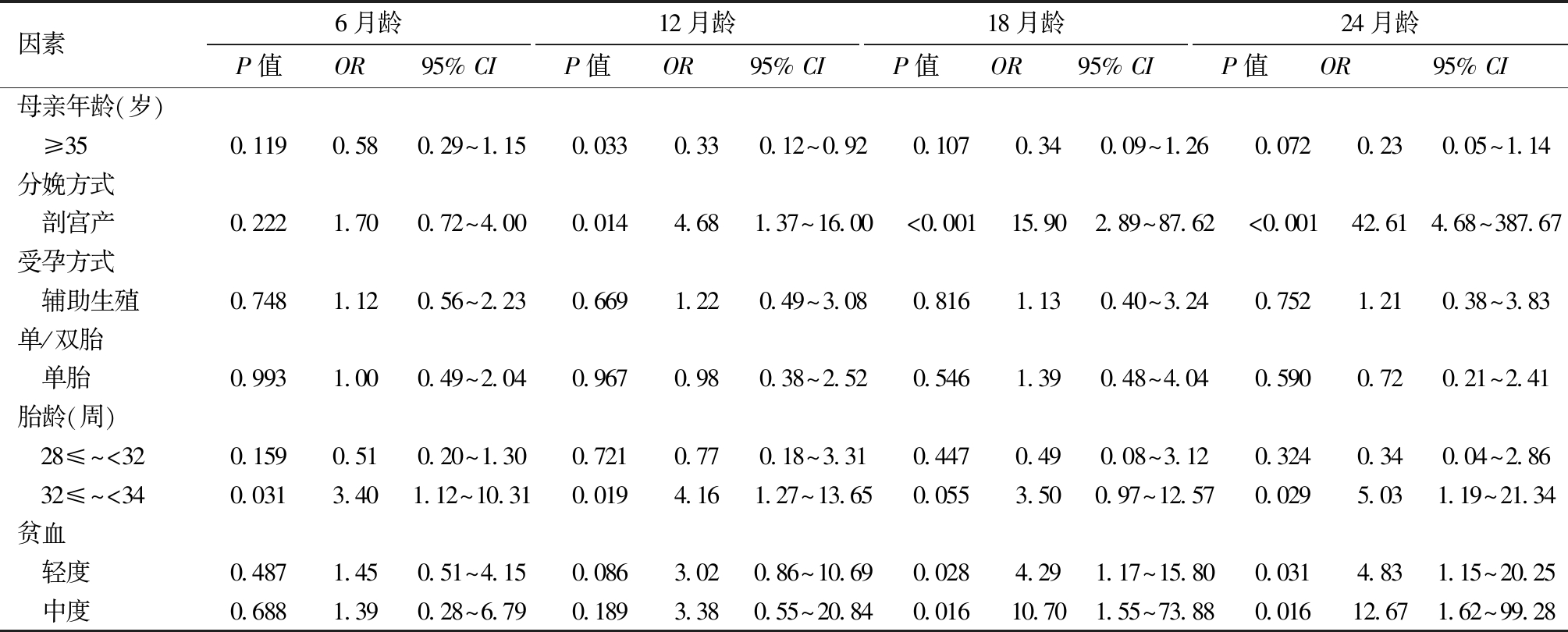
因素6月龄P值OR95% CI 12月龄P值OR95% CI 18月龄P值OR95% CI 24月龄P值OR95% CI 母亲年龄(岁) ≥350.1190.580.29~1.150.0330.330.12~0.920.1070.340.09~1.260.0720.230.05~1.14分娩方式 剖宫产0.2221.700.72~4.000.0144.681.37~16.00<0.00115.902.89~87.62<0.00142.614.68~387.67受孕方式 辅助生殖0.7481.120.56~2.230.6691.220.49~3.080.8161.130.40~3.240.7521.210.38~3.83单/双胎 单胎0.9931.000.49~2.040.9670.980.38~2.520.5461.390.48~4.040.5900.720.21~2.41胎龄(周) 28≤~<320.1590.510.20~1.300.7210.770.18~3.310.4470.490.08~3.120.3240.340.04~2.86 32≤~<340.0313.401.12~10.310.0194.161.27~13.650.0553.500.97~12.570.0295.031.19~21.34贫血 轻度0.4871.450.51~4.150.0863.020.86~10.690.0284.291.17~15.800.0314.831.15~20.25 中度0.6881.390.28~6.790.1893.380.55~20.840.01610.701.55~73.880.01612.671.62~99.28
表5(续)
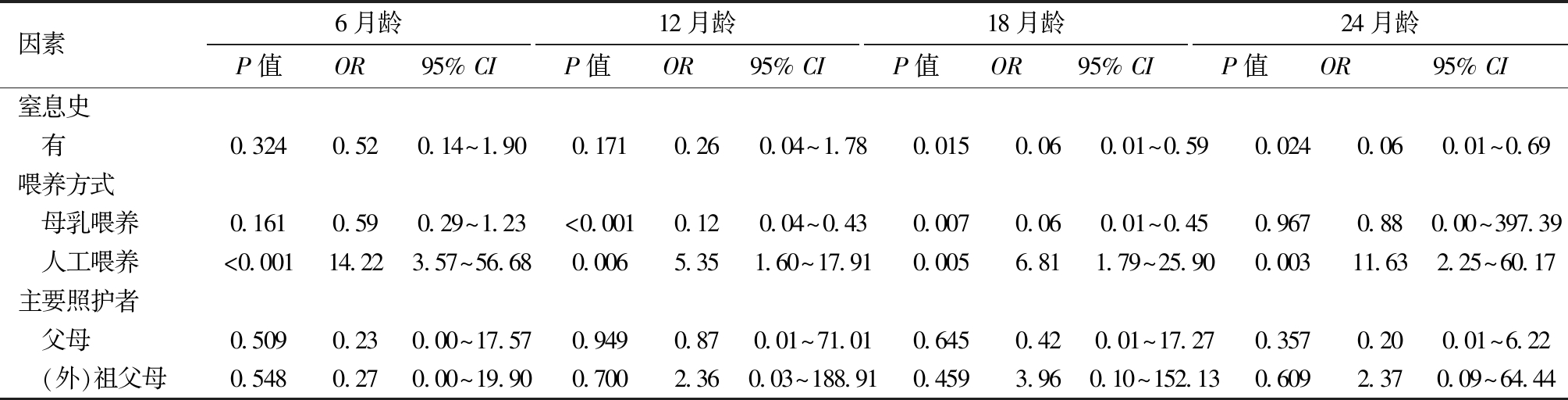
因素6月龄P值OR95% CI 12月龄P值OR95% CI 18月龄P值OR95% CI 24月龄P值OR95% CI 窒息史 有0.3240.520.14~1.900.1710.260.04~1.780.0150.060.01~0.590.0240.060.01~0.69喂养方式 母乳喂养0.1610.590.29~1.23<0.0010.120.04~0.430.0070.060.01~0.450.9670.880.00~397.39 人工喂养<0.00114.223.57~56.680.0065.351.60~17.910.0056.811.79~25.900.00311.632.25~60.17主要照护者 父母0.5090.230.00~17.570.9490.870.01~71.010.6450.420.01~17.270.3570.200.01~6.22 (外)祖父母0.5480.270.00~19.900.7002.360.03~188.910.4593.960.10~152.130.6092.370.09~64.44
讨论
早产儿健康发育受母体-养育连续体共同调控。孕期因素(高龄妊娠、合并症等)不仅增加早产风险,还可能通过表观遗传机制影响子代长期代谢;而产后养育(喂养方式、照护行为等)则直接调节营养摄入和能量代谢。现有研究多孤立分析单一阶段影响,本研究创新性地纵向追踪早产儿2年体重发育,系统揭示妊娠合并症与养育因素的动态影响。本研究选择体重作为主要观察指标,因其较身高受遗传因素影响更小,能更准确反映营养状况和追赶生长情况。
本研究发现,单因素分析中高龄产妇(≥35岁)子代在各月龄均呈现更高的高体重风险,在12月龄时,母亲高龄反而成为体重等级提升的保护因素(0R=0.33),提示高龄产妇群体中某些促进体重增长的强风险因素(如剖宫产率、人工喂养比例较高等)掩盖了高龄本身可能存在的独立效应。剖宫产子代体重过度追赶风险从6月龄(4.3% vs 0.0%)即显现,持续至24月龄(4.2% vs 0.0%,P=0.007),这种现象可能与微生物群紊乱及早期喂养模式改变有关[6]。本研究辅助生殖技术应用率达46.3%,这与本院作为国家辅助生殖优势科室及危重孕产妇转诊中心的定位相关,但受孕方式未显著影响子代结局;从胎儿自身情况分析,极早产儿6月龄低体重率最高(18.2%),但随月龄增长影响减弱(24月龄P=0.086);单胎出生体重显著高于双胎,但随访中未持续影响体重分布 。
妊娠期营养状态对胎儿发育具有重要影响,其中血红蛋白浓度是反映孕妇营养状况的关键指标,其与新生儿出生体重的关系已得到广泛研究。妊娠期血红蛋白浓度与新生儿体重呈倒U型关系,100~110 g/L时最佳[7]。本研究发现,虽然贫血对出生体重无显著影响(可能与中度贫血样本量小有关),但其子代在18月龄(11.1% vs 2.0%,P=0.014,轻度贫血:OR= 4.29,中度贫血:OR=10.70)和24月龄(11.1% vs 1.7%,P=0.010,轻度贫血:OR= 4.83,中度贫血:OR=12.67)呈现显著体重异常,提示铁代谢影响可能存在累积效应。
在机制方面,母体围产期铁限制可导致子代心脏线粒体功能受损,引起能量代谢障碍及早期体重增长受限[8],然而本研究发现围产期缺铁可能增加远期体重过度追赶的风险,提示缺铁通过早期代谢编程影响子代长期能量平衡,需进一步随访研究其代谢结局。相关研究显示,地中海饮食干预可改善妊娠期贫血状况[9],提示营养干预可能打破这一病理循环。在临床实践中,建议对妊娠期贫血子代实施长期生长监测。未来研究需进一步阐明铁代谢异常影响体重发育的具体分子机制,并探索针对性干预措施的最佳时间窗。
子痫前期是妊娠期高血压疾病的重要类型。子痫前期(尤其早发型)显著影响妊娠结局,其与胎盘功能不全密切相关,可导致胎儿生长受限和早产[10-11]。机制研究显示,子痫前期促炎细胞因子增多,损伤血管内皮、抑制滋养细胞侵袭、增强胎盘氧化应激、诱发过度炎症反应,并形成正反馈增加促炎细胞数量[12-13];子痫前期Treg 细胞减少,抑制滋养细胞侵袭致胎盘浅着床和过度激活炎症反应[14-15],二者共同促进子痫前期发生。临床数据显示,早发型子痫前期子代出生体重显著降低(1.8±0.5)kg[16],围产期死亡风险增加(RR:4.79~5.79)[17],与低出生体重关联最强(aOR=10.15)[18]。本研究发现其子代出生体重降低(P<0.001),但6~24月龄体重差异不显著。值得注意的是,Meta分析显示子痫前期子代10岁后BMI显著增加[19],青少年期体重更高[20],提示其影响可能持续至成年[21]。因此,建议对子痫前期孕产妇的子代实施长期生长监测。
本研究因妊娠期甲亢患者样本量不足(仅纳入2例),为减少偏倚,最终仅分析妊娠期甲状腺功能减退及单纯甲状腺抗体阳性病例。结果显示,这些甲状腺疾病与子代在校正24月龄内的体重分布无显著相关性。这一发现与传统观点认为甲状腺功能减退会导致胎儿生长受限的观点存在差异。然而,近年来,部分研究发现,甲状腺功能减退与低出生体重之间的直接关联并不明确。例如,有研究指出,单纯甲状腺抗体阳性仅会导致胎儿双顶径Z值轻微增加,而其他胎儿生长指标及胎儿生长受限在组间无显著差异[22]。一项Meta分析显示,母体TSH和FT4(在正常范围内)与出生体重呈反向剂量反应关系[23] ,即使是外源补充左旋甲状腺素,也会导致轻度亚甲减患儿头围Z值显著低于正常组及未治疗组[24]。虽然本研究晚期早产儿占总早产儿的比例为72.2%,可能影响结果外推,但仍提示临床中对于甲状腺功能轻度受损人群的诊治需谨慎。
新生儿窒息是国内新生儿死亡及远期神经发育障碍的主要病因[25]。窒息事件与神经系统发育结局相关,即使是未进展至缺氧缺血性脑病的轻度窒息儿,2岁时仍存在神经发育风险[26-28]。在早产儿人群中,体重适量而匀速的增长是脑正常发育最直观的表现,本研究发现,窒息组早产儿出生体重显著低于非窒息组(P<0.001),提示围产期缺氧可能导致多器官发育受限,虽然校正月龄6月龄时两组体重差异消失(P=0.061),但是在18月龄和24月龄仍然与体重增长缓慢相关(OR=0.06),这一现象提示窒息史早产儿的生后存在体重追赶不足风险。目前在窒息后神经损伤风险预警领域,多维度研究已取得明确进展:生物标志物层面,脐带血脑源性tau蛋白(BD-tau)的升高与胎儿缺氧替代标志物存在显著关联[29];影像学层面,MRI检查显示异常的婴幼儿,其格里菲斯儿童发育量表第3版(GMDS-III)总分较正常者降低约15% [28];高危因素叠加效应层面,Apgar评分<7分的婴儿出现发育迟缓的风险较正常评分婴儿增加3倍[27],且妊娠期抗生素暴露会进一步放大窒息对神经发育的负面影响[26]。基于现有研究基础,建议建立“生物标志物-影像学-行为学”多模态评估体系,通过量化窒息复苏后神经修复的关键窗口期,以优化窒息新生儿的干预方案。
本研究对0~24月龄早产儿进行纵向随访,结果显示,人工喂养方式显著增加高体重风险(P<0.05),可能与配方奶的高能量密度、蛋白质含量有关[30],这种营养构成差异可能导致早产儿能量摄入过剩,促进体重过快增长。现有证据表明,住院期间采用混合喂养的早产儿其体重增长轨迹较单纯配方奶喂养更为理想[31]。6月龄内纯母乳喂养不会增加学龄前期营养不足风险,而配方奶的引入则显著提升3~5岁儿童的体格发育水平[32]。这些发现提示,在早产儿营养管理中,混合喂养可能是平衡短期营养需求和长期健康结局的较优选择。
本研究发现,不同照顾人员(包括父母、祖父母与保姆)对婴幼儿体重发育的作用,具有明显的时间依赖性。在6~12月龄阶段,体重发育无差异;18~24月龄祖父母照顾组高体重率显著高于父母组(P<0.05),但是回归分析中这种影响消失,表明祖父母照顾与儿童高体重之间的初始关联很可能并非由照顾者身份本身直接导致,而是反映了与祖父母照顾相关的特定喂养行为或生活方式差异(如过度喂养、高能量零食摄入增加或大运动活动减少等)。此外,出生体重与胎龄呈显著正相关(P<0.001),这一基础特征可能进一步与后期照养方式产生交互作用,共同影响婴幼儿的体重发育轨迹。建议在儿童保健实践中,加强人工喂养及祖父母照顾婴幼儿的生长监测,适时调整喂养策略。
综上所述,绝大多数早产儿在2岁内能实现良好的体重追赶,但高龄产妇、剖宫产、贫血和早发型子痫前期母亲以及生后有窒息史的子代需要特别关注体重过度增长和追赶不足风险。
本研究创新性地采用回顾性分析结合问卷随访的研究方法,通过6、12、18和24月龄四个标准化随访时间点,系统评估了围产期因素与生后养育方式对早产儿体重发育的联合影响,提出了包含妊娠期合并症、新生儿窒息史、喂养模式和家庭养育观念的四维评估体系,突破了既往单一因素研究的局限性。纵向数据分析揭示了子痫前期、贫血等危险因素对体重影响的动态变化规律,特别是发现了18~24月龄是养育方式影响显现的关键窗口期。这些发现为优化早产儿营养干预策略提供了重要时序依据,对改善生命早期1 000 d的健康管理具有重要临床指导价值。
1 Krasevec J,Blencowe H,Coffey C,et al.Study protocol for UNICEF and WHO estimates of global,regional,and national low birthweight prevalence for 2000 to 2020.Gates Open Res,2022,6:80.
2 Chawanpaiboon S,Vogel JP,Moller AB,et al.Global,regional,and national estimates of levels of preterm birth in 2014:a systematic review and modelling analysis.Lancet Glob Health,2019,7:e37-e46.
3 王卫平,孙锟,常立文,主编.儿科学.第9版.北京:人民卫生出版社,2018:86.
4 谢幸,孔北华,段涛,主编.妇产科学.第9版.北京:人民卫生出版社,2024:83-128.
5 WHO.Weight-for-ageEB/OL.(2006)2025-09-05.https://www.who.int/tools/child-growth-standards/standards/weight-for-age.
6 Martinez KA,Devlin JC,Lacher CR,et al.Increased weight gain by C-section:Functional significance of the primordial microbiome.Sci Adv,2017,3:eaao1874.
7 Liu D,Li S,Zhang B,et al.Maternal Hemoglobin Concentrations and Birth Weight,Low Birth Weight (LBW),and Small for Gestational Age (SGA):Findings from a Prospective Study in Northwest China.Nutrients,2022,14:858.
8 Holody CD,Woodman AG,Nie C,et al.Perinatal iron deficiency alters the cardiac proteome and mitochondrial function in neonatal offspring.Am J Physiol Heart Circ Physiol,2025,328:H101-H112.
9 Morales-Suárez-Varela M,Peraita-Costa I,Perales-Marín A,et al.Effect of adherence to the Mediterranean Diet on maternal iron related biochemical parameters during pregnancy and gestational weight gain.Life (Basel,Switzerland),2023,13:1138.
10 Li L,Lu X,Lian Q,et al.Apoptotic vesicles of mesenchymal stem cells promote M2 polarization and alleviate early-onset preeclampsia via miR-191-5p.Stem Cell Res Ther,2025,16:414.
11 Gestational Hypertension and Preeclampsia:ACOG Practice Bulletin,Number 222.Obstet Gynecol,2020,135:e237-e260.
12 Murray EJ,Gumusoglu SB,Santillan DA,et al.Manipulating CD4+ T Cell Pathways to Prevent Preeclampsia.Front Bioeng Biotechnol,2021,9:811417.
13 Guan C,Zhao F,Yang Z,et al.A review of key cytokines based on gene polymorphism in the pathogenesis of pre-eclampsia.Am J Reprod Immunol,2022,87:e13503.
14 Robertson SA,Green ES,Care AS,et al.Therapeutic Potential of Regulatory T Cells in Preeclampsia-Opportunities and Challenges.Front Immunol,2019,10:478.
15 Robertson SA,Care AS,Moldenhauer LM.Regulatory T cells in embryo implantation and the immune response to pregnancy.J Clin Invest,2018,128:4224-4235.
16 Gandham R,C D D,S R S.Maternal serum apelin-13 levels in early- and late-onset preeclampsia.Turk J Obstet Gynecol,2024,21:235-241.
17 Pembe AB,Dwarkanath P,Kikula A,et al.Hypertensive disorders of pregnancy and perinatal outcomes:two prospective cohort studies of nulliparous women in India and Tanzania.BMJ Glob Health,2025,10:e016339.
18 Teka H,Yemane A,Abraha HE,et al.Clinical presentation,maternal-fetal,and neonatal outcomes of early-onset versus late onset preeclampsia-eclampsia syndrome in a teaching hospital in a low-resource setting:a retrospective cohort study.PloS One,2023,18:e0281952.
19 Davis EF,Lazdam M,Lewandowski AJ,et al.Cardiovascular risk factors in children and young adults born to preeclamptic pregnancies:a systematic review.Pediatrics,2012,129:e1552-1561.
20 Vatten LJ,Romundstad PR,Holmen TL,et al.Intrauterine exposure to preeclampsia and adolescent blood pressure,body size,and age at menarche in female offspring.Obstet Gynecol,2003,101:529-533.
21 吕莉娟,段红丽,李慧,等.子痫前期对子代远期不良影响.中华围产医学杂志,2019,22:357-360.
22 Xu JH,Han N,Su T,et al.Association of maternal isolated thyroid peroxidase antibody positive in the first trimester with fetal growth.Beijing Da Xue Xue Bao Yi Xue Ban,2023,55:886-892.
23 Derakhshan A,Peeters RP,Taylor PN,et al.Association of maternal thyroid function with birthweight:a systematic review and individual-participant data meta-analysis.Lancet Diabetes Endocrinol,2020,8:501-510.
24 Ji Y,Xu J,Su T,et al.Effect of levothyroxine treatment on fetal growth among women with mild subclinical hypothyroidism and thyroid peroxidase antibody negative:a cohort study.BMC Pregnancy Childbirth,2023,23:362.
25 Guideline for the diagnosis and treatment of common neonatal diseases in primary healthcare institutions:neonatal resuscitation (2025).Zhongguo Dang Dai Er Ke Za Zhi,2025,27:887-896.
26 Ionescu MI,Maria Catrina A,Dogaru IA,et al.MICROBIOME:The trials and errors of developing an experimental model to study the impact of maternal gut microbiome disruption on perinatal asphyxia.Reprod Fertil,2024,5:e240050 pii.
27 Torvik IA,Moshiro R,Ersdal H,et al.Neurodevelopmental Outcome at 6 Months Following Neonatal Resuscitation in Rural Tanzania.Children (Basel),2023,10:957.
28 Tuiskula A,Stjerna S,Saure E,et al.Perinatal asphyxia with no or mild hypoxic-ischaemic encephalopathy:Two-year neurodevelopmental outcome.Early Hum Dev,2025,205:106266.
29 Payne E,Gonzalez-Ortiz F,Kramer K,et al.Umbilical cord blood pTau217 and BD-tau are associated with markers of neonatal hypoxia:a prospective cohort study.medRxiv,2025:2024.12.20.24319360 pii.
30 李子一,宁一冰,马德福,等.生后0~6月不同喂养方式对7~12月龄婴儿能量摄入和体格发育的影响.中华围产医学杂志,2013,16:416-421.
31 胡玉芳,吴建英,杨阳,等.不同喂养方式对住院早产儿体重增长及喂养不耐受的影响分析.中华现代护理杂志,2023,29:3316-3320.
32 段一凡,杨振宇,毕烨,等.基于中国母婴营养与健康队列婴儿6月龄内不同喂养方式与3~5岁儿童体格生长的关联研究.中华预防医学杂志,2025,59:30-38.