若育龄期妇女保持规律性生活未避孕超过12个月仍未怀孕即可诊断为不孕症[1]。输卵管性不孕指女性因输卵管结构或功能异常无法妊娠,在女性不孕症中约占1/3[2]。不注意个人卫生或免疫力低下导致内、外源性微生物入侵输卵管会引发急、慢性输卵管炎,导致输卵管炎性不孕。若炎症未得到及时控制,长期刺激输卵管也会导致输卵管阻塞。
引发输卵管炎症的病原体主要有淋球菌、支原体、衣原体、大肠杆菌、厌氧菌、葡萄球菌。支原体、衣原体会使纤毛运动减弱,炎症反应也会诱发上皮细胞损伤使基底细胞分化异常,导致纤毛细胞减少、纤毛运动频率降低[3]。黏膜层、平滑肌层和浆膜层组成输卵管壁,在黏膜层约有1/4为纤毛柱状细胞。纤毛的摆动帮助受精卵向宫腔移动,如果输卵管纤毛摆动功能降低,受精卵不能顺利在宫腔着床,就会发生输卵管性不孕、宫外孕或者生化妊娠。炎症的发生与纤毛功能减弱会降低输卵管上皮细胞活性,影响输卵管正常蠕动。圆柱瘤蛋白(cylindroma protein,CYLD)是一种介导机体炎症反应、免疫应答、肿瘤抑制的去泛素化酶,其不仅可调控由NF-kB介导的炎症通路,还可诱导影响炎症的不同类型细胞凋亡,CYLD的缺失或突变可能与肿瘤发生关系密切[4]。研究发现,CYLD可抑制前列腺癌细胞增殖,影响溃疡性结肠炎的发病过程[5-6]。目前尚未有文献指出CYLD与输卵管炎性不孕的关联。文献报道,CYLD与微管相互作用,调节微管动力学,刺激细胞迁移[7]。研究表明,CYLD敲除小鼠表现出多种纤毛相关疾病[8-9]。吴丹丹等[10]研究表明CYLD去泛素化抑制炎症小体活化。本研究建立了以LPS诱导的输卵管上皮细胞炎症模型,在此基础上探究了CYLD从炎症与纤毛两个方面影响输卵管炎性不孕的机制,旨在为输卵管炎性不孕的治疗提供新的思路。
材料和方法
1.动物:性成熟但未交配生育的SPF级雌性健康SD大鼠,体重250~300 g,8~10周龄,每组10只,购自中国医学科学院实验动物研究所(生产许可证号:SCXK(湘)2019-0004)。动物饲养于标准动物房,温度22~25℃,相对湿度30%~70%,自然光照周期,自由进食饮水。
2.主要试剂:PBST缓冲液、电泳液缓冲液、转膜缓冲液、RIPA裂解液(AWI0130、AWB0083、AWC0114、AWB0136,中国abiowell)、IL-1β(JL20884,江莱生物)、IL-8(ml002885,上海酶联生物)、IL-6、TNF-α(CSB-E04640r、CSB-E11987r,武汉华美生物工程有限公司)、琼脂糖(111860,西班牙BIOWEST)、mRNA逆转录试剂盒、miRNA逆转录试剂盒(CW2569、CW2141,中国北京康为世纪)、核酸染料(PB11141,中国北京普利莱)。
3.仪器:台式冷冻离心机(H1650R,中国湖南湘仪)、荧光定量RCP仪、荧光PCR板、荧光定量RCP仪(PIKOREAL96,SPL0960,QuantStudio1,美国Thermo)、旋涡混合器(GL-88B,中国江苏其林贝尔)、化学发光成像系统(ChemiScope6100,中国勤翔)、全自动酶标洗板机、多功能酶标分析仪(PW-812、MB-530,深圳市汇松科技发展有限公司)。
4.方法:
(1)大鼠输卵管上皮细胞分离培养。大鼠吸入过量麻醉剂(2%的戊巴比妥钠0.5 mL)后处死,取出输卵管洗净,组织剪碎成糜状后转移并酶解。离心后弃去上清,随后将组织转移至装有1 mg/mL collagenase(HBSS)的培养瓶中于37℃酶解30 min。再次离心弃上清,制成细胞悬液并转移到培养瓶中。在培养箱中培养约4 h后吸出上层细胞悬液并离心。弃上清,加入培养基吹打混匀后接种至一次性培养皿中继续培养,每48 h更换一次培养液。待输卵管上皮细胞长至 80%汇合或铺满皿底时进行传代培养。大鼠输卵管上皮细胞培养于含10%FBS+1%双抗的DMEM/F12培养基中,环境为37℃,5%CO2,饱和湿度。
(2)细胞鉴定。取出爬片清洗后用4%多聚甲醛固定30 min并PBS冲洗3次,随后用0.3%曲拉通37 ℃处理30 min后再次PBS冲洗;继而以5%BSA在37℃条件下封闭60 min;冲洗后进行孵育一抗,即滴加适当稀释的一抗(Cytokeratin 18、Vimentin),4℃孵育过夜。冲洗后再进行孵育二抗,即滴加50~100 uL抗- Rabbit、Rabbit -IgG标记荧光抗体,37℃孵育90 min后冲洗;采用DAPI工作液37℃染核10 min后PBS冲洗;最后用缓冲甘油封片。将制备好的玻片避光保存或于荧光显微镜下观察。
(3) 大鼠输卵管上皮细胞炎症模型的建立及分组。模型细胞制备前先进行转染,设立沉默对照组(sh-NC组)、沉默CYLD组(sh-CYLD组)与过表达对照组(oe-NC组)、过表达CYLD组(oe-CYLD组)。制作输卵管上皮细胞炎症模型,为避免炎症程度减轻影响药物对炎性细胞治疗作用的观察,选择未造模空白组大鼠的输卵管,取上皮细胞进行原代及传代培养,利用脂多糖(lipopolysaccharides,LPS)诱导细胞炎症模型。在培养的大鼠输卵管上皮细胞中添加200 ng/mL浓度的LPS进行刺激,以培养基替代LPS作为阴性对照(0 ng/mL LPS)。并在24 h不同时间点收取样品。
(4)RT-qPCR检测CYLD表达。将过表达干预的各实验组中加入1 mL Trizol于匀浆器中充分研磨匀浆,按照Trizol法标准提取细胞总RNA,通过微量分光光度计检测RNA在260 nm和280 nm处的吸光度以评估其浓度与纯度。合格的RNA逆转录为cDNA后配制为RT-PCR反应体系。反应条件设置为:95℃变性10 min,95℃退火15 s,共进行40个循环,60℃延长30 s,采用2-ΔΔCt法进行数据分析。并以β-actin作为内部参考基因,引物序列信息见表1。
表1 各组炎症因子水平比较![]()
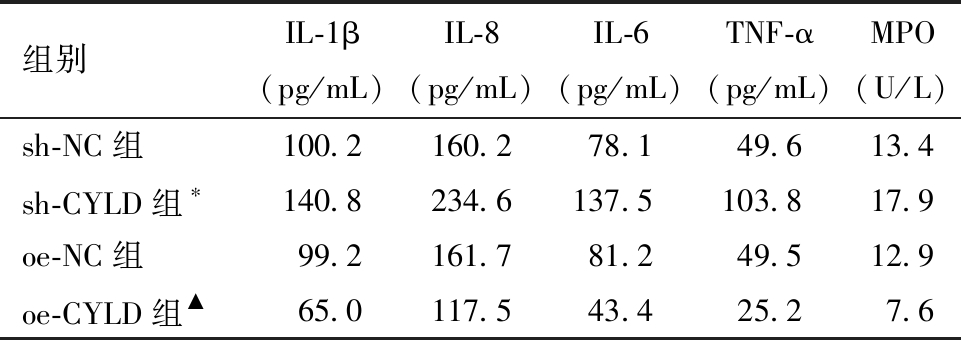
与sh-NC组比较,*P<0.05; 与sh-NC组、sh-CYLD组和oe-NC组比较,▲P<0.05
组别IL-1β(pg/mL)IL-8(pg/mL)IL-6(pg/mL)TNF-α(pg/mL)MPO(U/L)sh-NC组100.2160.278.149.613.4sh-CYLD组∗140.8234.6137.5103.817.9oe-NC组99.2161.781.249.512.9oe-CYLD组▲65.0117.543.425.27.6
表1 引物序列信息

引物序列(5′-3′)长度/bpβ-actin 上游:ACATCCGTAAAGACCTCTATGCC 下游:TACTCCTGCTTGCTGATCCAC223(β-actin)CYLD 上游:CATCATCCCAGATAGCGTGACA 下游:TGCAGGGTCTTCTGCAACTTCA244(CYLD)
(5)Western blot检测CYLD表达量。细胞样本经RIPA裂解液离心后取上清液即为细胞全蛋白,以BCA法测定蛋白浓度后进行电泳及转膜,用1×PBST配制5%脱脂奶粉或BSA溶液对膜进行封闭,一抗4℃孵育10 min后用PBST漂洗3次;二抗4℃孵育15 min后同样漂洗3次。再将膜与ECL化学发光液孵育1 min,用滤纸吸尽残留液体后用塑封膜将膜包裹杂交膜,最后通过凝胶成像系统采集图像。免疫印迹采用CYLD和内参β-actin抗体。
(6)CCK8检测细胞活力。将细胞以每孔1×104个的密度接种于48孔板中,每孔300 μL。每组设置3个复孔;培养贴壁处理完成后每孔加入30 μL/孔的cck8试剂,去除含药培养基每孔加入300 uL含有cck8的培养基;将细胞置于37℃,5%CO2环境下继续孵育4 h,使用汇松酶标仪分析450 nm处吸光度(OD)值,各组重复孔的OD值取均值,绘制柱状图呈现实验结果。
(7)ELISA检测细胞上清中IL-1β、IL-8、IL-6、TNF-α、MPO含量。标本离心后取细胞上清,按照试剂盒说明书操作,使用专业制作曲线软件"Curve Expert"以标准品的浓度为纵坐标,OD值为横坐标制作标准曲线并计算出标准曲线的回归方程式,将样本OD值代入回归方程计算获得样本浓度。稀释样本后检测,计算时乘以相应的稀释倍数以得到实际浓度,最终取3次实验的平均值。
(8)输卵管上皮细胞中纤毛运动频率的检测。在37℃条件下使用配备40倍物镜的倒置亮场显微镜下观察纤毛跳动频率(CBF)。通过一个12位的高速摄像机以30帧的速率采集移动纤毛的图像,每个区域持续记录10 s。所有样本均经相同药物处理。由于CBF读数存在不一致性,故未对单个纤毛细胞和小组纤毛细胞进行分析。每个处理的样本随机抽取5个区域视野进行成像,并测量其中5个片段的CBF,每组重复测量3次取平均值。
(9)统计学处理。本研究采用Graphpad Prism 8.0软件进行数据分析,计量资料以均值±标准差表示,组间比较采用t检验或单向因素方差分析(ANOVA),P<0.05表示差异有统计学意义。
结果
1.大鼠输卵管上皮细胞的分离:IF显示细胞中有细胞角蛋白18存在,阳性信号为Cytokeratin 18(绿)、Vimentin(绿)色荧光,蓝色为核染信号。结果显示所得细胞角蛋白呈阳性,波形蛋白呈阴性,证明实验分离出了大鼠输卵管上皮细胞。见图1。
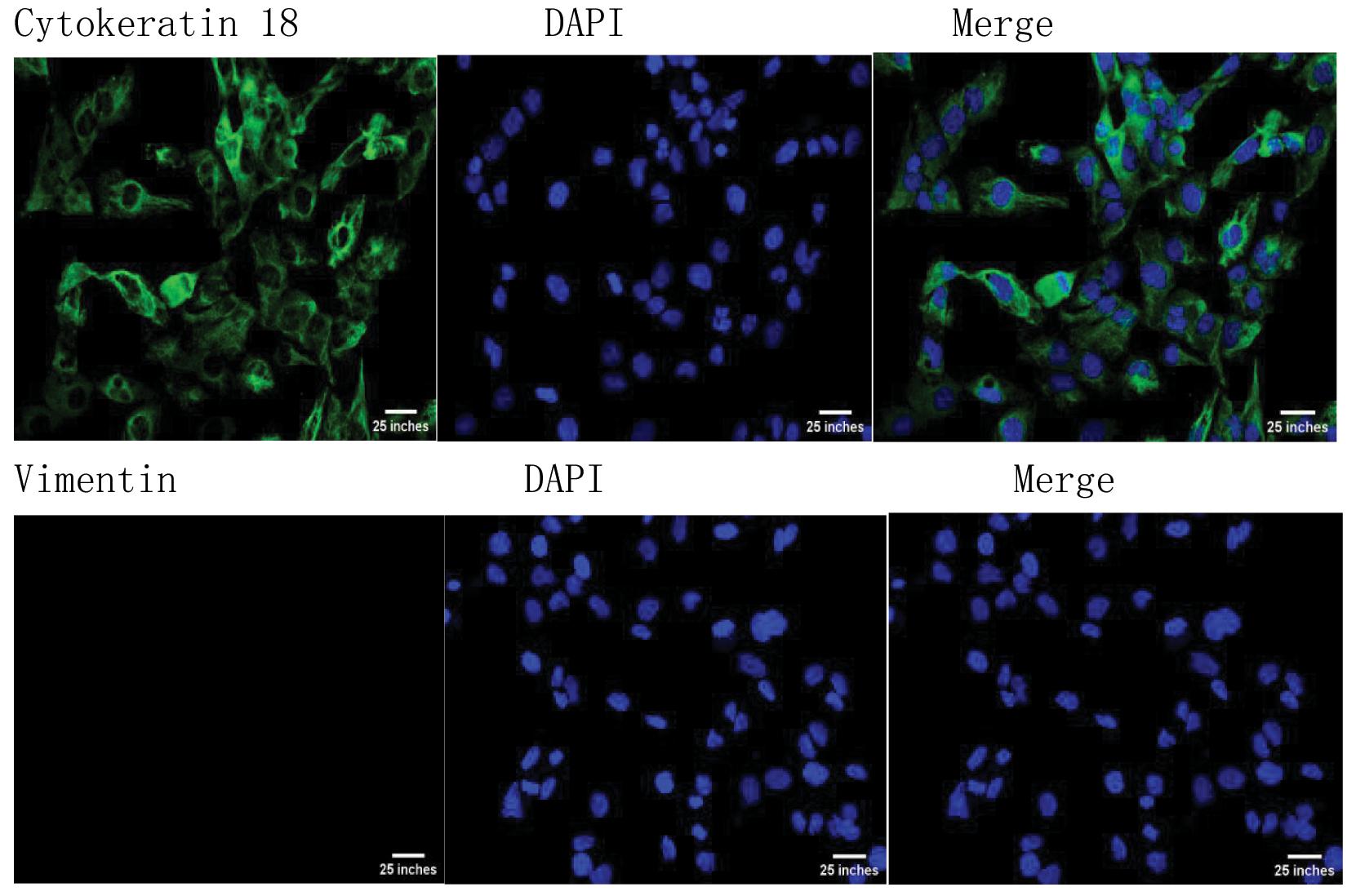
图1 大鼠输卵管上皮细胞免疫荧光鉴定结果(Cytokeratin 1∶100,Vimentin 1∶50)
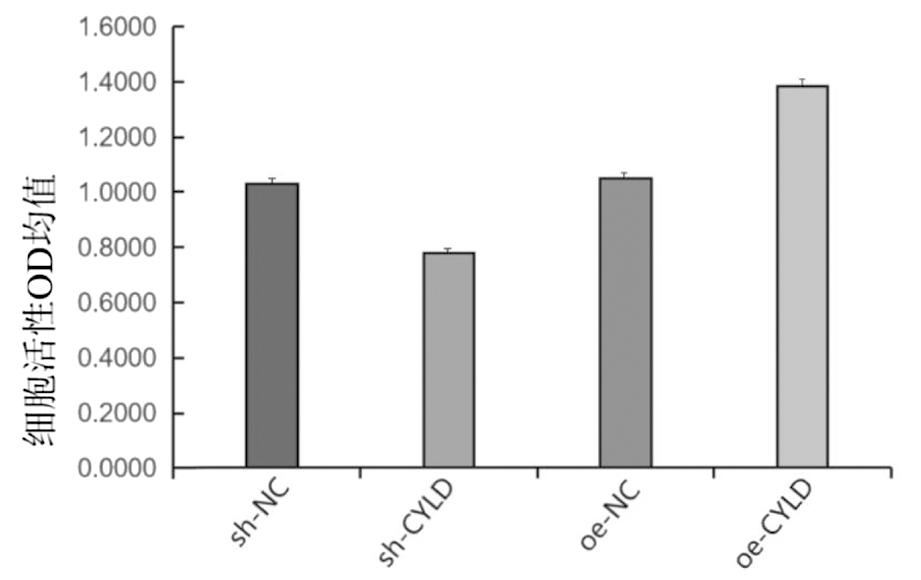
2.各组输卵管炎症上皮细胞CYLD表达对比:图2A所示,sh-NC组与oe-NC组的CYLD表达量相比,差异无统计学意义;sh-CYLD组CYLD的表达量低于sh-NC组,sh-NC组的CYLD表达量明显低于oe-CYLD组,差异均具有统计学意义。如图2B,以内参β-actin为空白对照,sh-NC组与oe-NC组CYLD灰度持平,sh-CYLD组CYLD的灰度 图2 各组CYLD表达量 3.各组输卵管炎症上皮细胞炎症因子的对比:sh-NC组与oe-NC组的各炎症因子水平相比,差异无统计学意义。sh-CYLD组的炎症因子水平显著高于sh-NC高于oe-CYLD组,且各组中oe-CYLD组炎症因子释放最少,以上差异均具有统计学意义。见表1。 4.各组输卵管炎症上皮细胞纤毛跳动频率的对比:sh-NC组与oe-NC组的纤毛跳动频率相比,差异无统计学意义;与sh-NC组、oe-NC组相比,sh-CYLD组的纤毛跳动频率较低;各组中oe-CYLD组的模型细胞跳动频率最高;以上差异均有统计学意义。见表2。 表2 各组纤毛跳动频率比较 与sh-NC组、oe-NC组比较,*P<0.05 组别纤毛跳动频率sh-NC组3.7sh-CYLD组2.3∗oe-NC组3.3oe-CYLD组5.3∗ 5.各组输卵管炎症上皮细胞活性对比:sh-NC组与oe-NC组的细胞活性相比,差异无统计学意义。oe-CYLD组细胞活性最高,sh-CYLD组细胞活性最低,其间oe-NC组的细胞活性优sh-CYLD组,差异具有统计学意义。见图3、表3。 图3 各组细胞活性OD均值 表3 各组细胞活性的比较 与sh-NC组、oe-NC组比较,*P<0.05 组别OD均值sh-NC组1.05sh-CYLD组0.79∗oe-NC组1.07oe-CYLD组1.41∗ 随着现代社会生活方式的改变,输卵管性不孕发病率显著上升且趋于年轻化[11]。研究发现,盆腔炎性疾病(pelvic inflammatory disease,PID)是导致输卵管性不孕的重要原因[12]。输卵管炎是PID中常见的类型,输卵管炎性因素则占输卵管因素不孕的30%,输卵管与周围组织粘连后蠕动及拾卵功能下降,增加受孕难度[13]。每发生一次PID,不孕的概率就逐次增加。可导致不孕的输卵管病变还包括子宫内膜异位症、输卵管先天性发育异常、盆腹部手术、宫腔操作、异位妊娠、长时间放置IUD等[14]。这些疾病会导致输卵管不同部位不同程度的阻塞、输卵管周围炎、输卵管功能异常。因急慢性盆腔炎症致使输卵管发生炎性病理改变,并影响精卵结合的正常生理过程,引发的育龄期妇女不孕症称为输卵管炎性不孕。 输卵管纤毛形态结构和跳动功能的正常有利于受精卵顺利着床与胚胎早期发育,输卵管内壁的纤毛会将卵母细胞推向子宫[15-16]。输卵管急性炎症病理可见输卵管充血增粗、周围与腹膜粘连、黏膜上皮与肌层呈水肿状态和大量中性白细胞浸润。输卵管黏膜上皮呈高柱状,由纤毛细胞、分泌细胞、嵌入细胞、储备细胞组成,故输卵管黏上皮水肿会对纤毛生长与运动产生负面作用。慢性输卵管炎可见输卵管肥大、增粗、蜷曲、与周围组织粘连、伞端形态改变、输卵管各层皆有广泛淋巴细胞与浆细胞浸润、官腔黏膜皱裂变平、上皮低柱状甚至萎缩。输卵管纤毛周围组织肿胀积液,也会干扰纤毛的运动,增加受精卵在输卵管内停留时间,造成不良妊娠结局。输卵管炎症是导致输卵管性不孕的重要原因,病原体侵入女性生殖器及附件发生炎症反应,炎性分泌物渗出刺激输卵管内细胞增生,形成纤维粘连组织,导致输卵管炎性阻塞[17]。病原体感染、手术损伤、子宫内膜异位症、免疫损伤、输卵管结核等因素引发盆腔炎,致使输卵管发生粘连,影响输卵管管腔通畅度,不利于精卵结合与着床,进而引发输卵管炎性不孕[1]。输卵管的内层是黏膜层,黏膜层主要由纤毛细胞与分泌细胞构成,炎症发生时纤毛细胞形态功能发生异常会降低输卵管上皮细胞活性,影响输卵管对配子的运输,导致输卵管炎性不孕。洪金妮等[18]发现用脂多糖(LPS)干预大鼠输卵管上皮细胞24 h、48 h后细胞活性分别为58%、37%,证明大量长期的炎症刺激会使大鼠输卵管上皮细胞活性降低。研究证实,CYLD具有去泛素化活性,其可以去泛素化负向调节NF-kB炎症信号通路[19]。Zhang等[20]研究发现CYLD是抑制NF-kB炎症通路激活的必需调节剂,认为CYLD可能参与类风湿性关节炎成纤维细胞样滑膜细胞的促炎作用和过度增殖。CYLD可能成为应激诱导的肝脏炎症和损伤的治疗靶点[21]。CYLD与14-3-3γ/ε/η三种亚型存在相互作用,参与炎症应答等众多生物学过程[22]。但目前缺乏相关实验研究证明CYLD与输卵管炎症等女性生殖道炎症存在明确关系。此外,纤毛的发生与运动也与CYLD有密不可分的关系,CYLD使Cep70去泛素化并与γ-微管蛋白相互作用并定位于中心体,抑制促进微管蛋白乙酰化,影响纤毛的发生与运动;CYLD在多个器官的纤毛生成与运动中发挥关键作用,CYLD基因敲除小鼠存在多器官发育缺陷,如皮肤与气管发育异常、肺成熟受损、睾丸发育不良导致雄性不孕[23]。CYLD与CAP-Gly结构域相互作用,发挥其泛素化功能促进纤毛形成[24]。CYLD参与炎症反应与纤毛生长运动,故本研究推测CYLD间接影响上皮细胞活性。输卵管炎症水平和输卵管内纤毛运动与输卵管炎性不孕密切相关,CYLD可能参与调控输卵管炎症和输卵管纤毛运动,影响输卵管上皮细胞活性,进而在一定程度上改善妊娠结局。 本研究采用免疫荧光(immunofluorescence,IF)鉴定大鼠输卵管上皮细胞,分别设立阴性对照组、过表达对照组、阴性实验组、过表达实验组验证CYLD与输卵管炎症和纤毛的关系,观察各组输卵管炎症上皮细胞中CYLD表达量、炎症因子含量,纤毛跳动频率、细胞活性,发现各实验中sh-NC组与oe-NC组差异均无统计学意义。本研究结果发现,各组间CYLD表达量比较,oe-CYLD组的CYLD表达量最高,sh-CYLD组最低;oe-CYLD组的炎症因子显著低于sh-CYLD组,表明高水平的CYLD可以有效抑制输卵管炎症,CYLD表达量与炎症呈负相关;oe-CYLD组输卵管炎症上皮细胞纤毛跳动频率比对照组高,而sh-CYLD组纤毛跳动频率低于对照组,证明CYLD高表达可促进输卵管炎症上皮细胞内的纤毛跳动;各组输卵管炎症上皮细胞活性相比,oe-CYLD组高于对照组,sh-CYLD组低于对照组,表明高水平的CYLD有助于输卵管炎症上皮细胞活性的提升。本研究结果表明,CYLD可调控输卵管炎症上皮细胞的炎症水平与纤毛运动,且高水平的CYLD有助于降低输卵管炎症水平、增加纤毛跳动频率、提高上皮细胞活性,从而促进输卵管的拾卵运卵。 综上所述,CYLD从炎症水平和纤毛运动两个方面调节输卵管炎性不孕,CYLD高表达可降低输卵管炎症水平、促进输卵管纤毛运动,本研究为治疗女性输卵管炎性不孕提供了CYLD这一新的切入点。 1 Penzias A,Azziz R,Bendikson K,et al.Fertility evaluation of infertile women:a committee opinion.Fertil Steril,2021,116:1255-1265. 2 林小娜,黄国宁,孙海翔,等.输卵管性不孕诊治的中国专家共识.生殖医学杂志,2018,27:1048-1056. 3 谢敏,黄荷,易飞,等.氨溴特罗口服溶液联合阿奇霉素治疗小儿肺炎支原体肺炎的效果及对IL-2、IL-10水平的影响.中国医学创新,2022,19:40-43. 4 Marín-Rubio JL,Raote I,Inns J,et al.CYLD in health and disease.Dis Model Mech,2023,16:dmm050093. 5 Gu Y,Wu S,Fan J,et al.CYLD regulates cell ferroptosis through Hippo/YAP signaling in prostate cancer progression.Cell Death Dis,2024,15:79. 6 雷媛,陈刚,欧士钰,等.肿瘤抑制因子在溃疡性结肠炎肠黏膜的表达及其对NF-κB信号通路的影响.中华保健医学杂志,2023,25:685-687. 7 Li D,Gao J,Yang Y,et al.CYLD coordinates with EB1 to regulate microtubule dynamics and cell migration.Cell Cycle,2014,13:974-983. 8 Hongbo M,Yanjiao D,Shuo W,et al.Podocyte RNF166 deficiency alleviates diabetic nephropathy by mitigating mitochondria impairment and apoptosis via regulation of CYLD signal.Biochem Biophys Res Commun,2021,545:46-53. 9 Ji YX,Huang Z,Yang X,et al.The deubiquitinating enzyme cylindromatosis mitigates nonalcoholic steatohepatitis.Nat Med,2018,24:213-223. 10 吴丹丹,蒋小丽,张双艳,等.Spata2-CYLD去ASC线性泛素化抑制NLRP3炎症小体活化.现代免疫学,2021,41:272-277. 11 刘佳,杨丽.经阴道超声参数在输卵管妊娠诊断及保守治疗后卵巢储备功能恢复中的评估效果.中国计划生育学杂志,2025,33:692-695. 12 李桂美,孙萍,杨维浩.自拟盆腔炎汤治疗盆腔炎性疾病所致输卵管性不孕疗效观察.青岛医药卫生,2023,55:295-298. 13 徐玉贵,罗春玲,庄芳,等.桂枝茯苓胶囊联合宫腹腔镜手术治疗盆腔炎性不孕的临床效果.临床合理用药杂志,2022,15:142-145. 14 江小蓉,CHEN Ya-qiong.输卵管病变与不孕的研究进展.海南医学,2013,24:1328-1331. 15 Zhao W,Zhu Q,Yan M,et al.Levonorgestrel decreases cilia beat frequency of human fallopian tubes and rat oviducts without changing morphological structure.Clin Exp Pharmacol Physiol,2015,42:171-178. 16 Davis SD,Rosenfeld M,Lee HS,et al.Primary Ciliary Dyskinesia:Longitudinal Study of Lung Disease by Ultrastructure Defect and Genotype.Am J Respir Crit Care Med,2019,199:190-198. 17 Francis Stuart SD,De Jesus NM,Lindsey ML,et al.The crossroads of inflammation,fibrosis,and arrhythmia following myocardial infarction.J Mol Cell Cardiol,2016,91:114-122. 18 洪金妮,林达涛,陈仔颖,等.少腹逐瘀汤对输卵管炎性不孕大鼠NLRP3炎症小体的作用研究.药物评价研究,2022,45:2486-2493. 19 Li Y,Huang W,Xu Y,et al.CYLD Deubiquitinase Negatively Regulates High Glucose-Induced NF-κB Inflammatory Signaling in Mesangial Cells.Biomed Res Int,2017,2017:3982906. 20 Zhang LM,Zhou JJ,Luo CL.CYLD suppression enhances the pro-inflammatory effects and hyperproliferation of rheumatoid arthritis fibroblast-like synoviocytes by enhancing NF-κB activation.Arthritis Res Ther,2018,20:219. 21 Huang Z,Tan Y.The Potential of Cylindromatosis (CYLD) as a Therapeutic Target in Oxidative Stress-Associated Pathologies:A Comprehensive Evaluation.Int J Mol Sci,2023,24:8368. 22 杨羽淇,安冬洁,何飞,等.炎症应答中去泛素化酶圆柱瘤蛋白相互作用分子筛选和验证.空军军医大学学报,2024,45:617-624. 23 Yang Y,Ran J,Liu M,et al.CYLD mediates ciliogenesis in multiple organs by deubiquitinating Cep70 and inactivating HDAC6.Cell Res,2014,24:1342-1353. 24 Chiticariu E,Regamey A,Huber M,et al.CENPV Is a CYLD-Interacting Molecule Regulating Ciliary Acetylated α-Tubulin.J Invest Dermatol,2020,140:66-74.e4.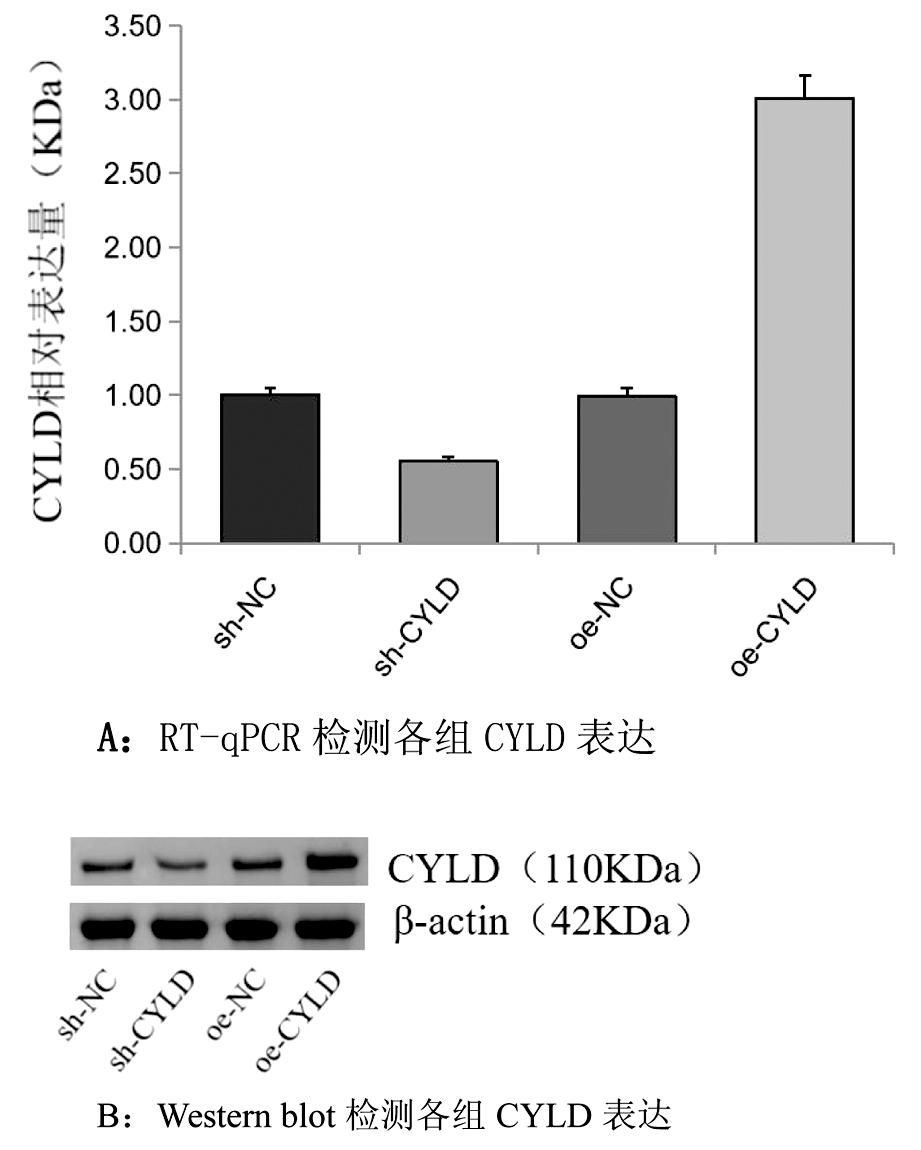
![]()

![]()

讨论