子痫前期(preeclampsia,PE)是一种多器官疾病,定义为妊娠20周以后新发的高血压和(或)蛋白尿及器官损害。PE是最常见的妊娠期并发症之一,也是导致母婴不良结局的最常见原因之一[1]。PE的全球发病率为2%~5%[2],在低危人群中的发病率为2%~3%,但在高危人群其发病率升高4倍[3]。目前PE的诊断依赖于临床诊断,缺乏可靠的预测方法,绝大多数PE所导致的不良妊娠结局源于诊断和干预的延迟[4]。因此,临床亟需一种可靠的PE预测方法。
目前PE的病因尚未完全阐明,多数研究认为,PE是一种胎盘源性疾病,血管生成失衡是PE的主要病理生理基础,而反映这一失衡状态的可溶性血管内皮生长因子受体1(soluble fms-like tyrosine kinase-1,sFlt-1)/胎盘生长因子(placental growth factor,PlGF)对于PE具有重要的预测和诊断价值。在发生PE的孕妇中,sFlt-1/PlGF自妊娠中期开始升高,国际推荐以38作为预测PE的截断值[5-6]。但鉴于sFlt-1/PlGF具有随孕周动态变化的特征,在PE高危人群中,该截断值是否适用,抑或是否应确定各妊娠阶段相应的截断值和阈值以及筛查的最佳时机,这方面相关的研究较少。
本研究通过对PE高危人群整个妊娠期sFlt-1/PlGF进行序贯检测,探索sFlt-1/PlGF在不同结局人群中的变化规律,确定各妊娠阶段预测PE的相应截断值和阈值,并探讨最佳筛查时间,以实现对PE高危人群的最优管理模式,更好地协助临床决策。
对象和方法
1.对象:2022年7月—2023年7月孕20周前在南京医科大学附属苏州医院(苏州市立医院)进行规律产检的具有PE高危因素的单胎孕妇纳入研究。本研究共纳入577例PE高危孕妇,最终有146例孕妇发生PE,其中重度子痫前期(severe preeclampsia,SPE)孕妇64例。根据是否发生PE将577例孕妇分为PE组(发生PE,146例)和未发生PE组(未发生PE,431例)。纳入标准为(1)孕妇年龄≥18岁;(2)单胎;(3)妊娠20周前在本院进行规律产检,并确定有意愿在本院分娩;(4)签署书面知情同意书;(5)具有以下至少1项PE高危因素,即孕妇存在或潜在的基础内科疾病及病理状况,包括高血压病、肾脏疾病、糖尿病、自身免疫性疾病(如系统性红斑狼疮、抗磷脂综合征等);既往PE病史;肥胖[指妊娠前体质指数(body mass index,BMI)≥28 kg/m2)[7]。排除标准为(1)胎儿畸形;(2)研究现场的员工或研究者的亲属或配偶;(3)孕妇年龄<18岁;(4)数据不完整或失访。本研究已通过本院伦理委员会批准(K-2022-110-K01),所有研究对象均签署了知情同意书。
2.方法:所有纳入研究的孕妇按照常规产检流程定期产检,如期间出现PE相关症状,如头晕、头痛、眼花、上腹部不适、水肿等情况需要额外就诊。在既定的妊娠窗口期进行sFlt-1/PlGF的检测,分别为≤20周、23~25周、28~30周、33~35周、≥36周,过程中如临床诊断PE,则停止sFlt-1/PLGF的检测。其余按本地流程进行常规产检,随访直至分娩。PE的治疗根据本院诊疗规范执行,终止妊娠时机和方式由本院高年资主治医师以上决定并实施。
PE的诊断标准[7]为妊娠20周后孕妇出现收缩压≥140 mmHg和(或)舒张压≥90 mmHg,伴有下列任意1项:尿蛋白定量≥0.3 g/24 h,或尿蛋白/肌酐比值≥ 0.3,或随机尿蛋白≥(+)(无条件进行蛋白定量时的检查方法);无蛋白尿但伴有以下任何1种器官或系统受累:心、肺、肝、肾等重要器官,或血液系统、消化系统、神经系统的异常改变,胎盘-胎儿受到累及等。在发生PE孕妇中,若出现血压和(或)尿蛋白水平持续升高不可控制,或孕妇器官功能受累,或出现胎盘-胎儿并发症,诊断为SPE。
3.sFlt-1和PlGF的检测:根据标准操作程序收集母体血清样品(2 mL)于促凝管中,离心后保存于-20℃冰箱,并在48 h内分析。在本地区的独立中心实验室(苏州铂金埃尔默医学检验实验室)对样本进行了回顾性分析。sFlt-1和PlGF的母体血清水平(以pg/mL测量)通过SuperFlex分析平台(Roche Diagnostics,Mannheim,Germany)上的全自动Elecsys sFlt-1 和PlGF免疫测定法根据方法表进行测定。
4.观察指标:临床数据由专业人员从电子病例系统采集,包括孕妇的年龄、孕产次、BMI、基础平均动脉压(mean arterial pressure,MAP)(孕20周前)、PE高危因素及妊娠结局。sFlt-1和PlGF测量结果由中心实验室的系统以电子方式捕获,记录各既定窗口期的sFlt-1/PlGF及具体检测孕周。
5.统计学处理:采用SPSS 26.0统计软件进行数据分析。定量资料采用Kolmogorov-Smirov检验对其进行正态性检验,均为非正态分布,采用中位数和四分位数[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验。定性资料用例数(百分比)表示,组间比较采用卡方检验。绘制受试者工作特征(receiver operator characteristic,ROC)曲线,计算曲线下面积(area under curve,AUC),比较不同窗口期sFlt-1/PlGF对PE的预测能力。通过Kaplan-Meier生存曲线和COX比例风险回归分析sFlt-1/PlGF与PE发病时间的风险比例。P<0.05为差异有统计学意义。
结果
1.一般情况比较:577例高危人群中PE的发生率为25.3%(146/577),PE组的基础BMI、MAP、有慢性高血压者占比、及有PE病史者占比均高于未发生PE组,差异均有统计学意义;两组年龄、流产≥2次占比、经产妇占比、有免疫异常者占比、有肾脏疾病者占比、本次妊娠为IVF占比、有死胎史者占比比较,差异均无统计学意义。见表1。
表1 两组孕妇的一般情况及高危因素比较
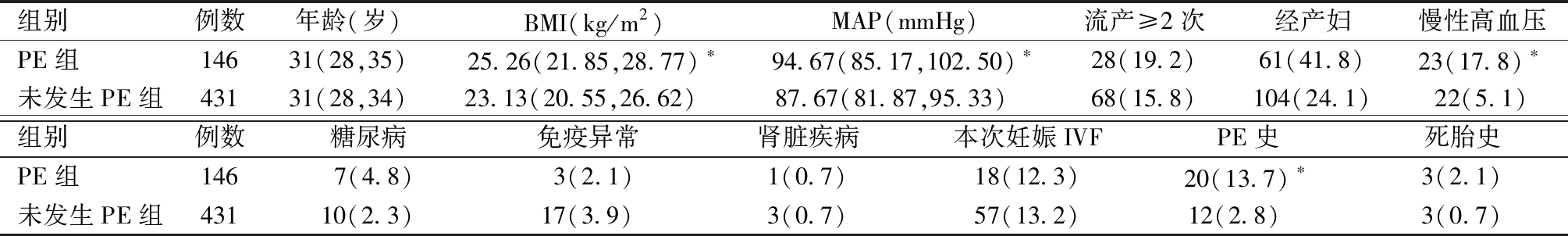
年龄、BMI、MAP用M(P25,P75)表示;流产≥2次、经产妇、慢性高血压、糖尿病、免疫异常、肾脏疾病、本次妊娠IVF、PE史、死胎史用[例(%)]表示;与未发生PE组比较,*P<0.05
组别例数年龄(岁)BMI(kg/m2)MAP(mmHg)流产≥2次经产妇慢性高血压PE组14631(28,35)25.26(21.85,28.77)∗94.67(85.17,102.50)∗28(19.2)61(41.8)23(17.8)∗未发生PE组43131(28,34)23.13(20.55,26.62) 87.67(81.87,95.33) 68(15.8)104(24.1)22(5.1)组别例数糖尿病免疫异常肾脏疾病本次妊娠IVFPE史死胎史PE组1467(4.8)3(2.1)1(0.7)18(12.3)20(13.7)∗3(2.1)未发生PE组43110(2.3)17(3.9)3(0.7)57(13.2)12(2.8) 3(0.7)
2.妊娠期内sFlt-1/PlGF比值的动态变化趋势:根据各妊娠窗口检测sFlt-1/PlGF比值结果显示,未发生PE组sFlt-1/PlGF比值保持稳定,直至孕36周后缓慢上升,而在PE组,该比值在孕23~25周前保持稳定,至孕28~30周突然迅速升高达到高峰,孕33~35周出现下降,见图1。在146例发生PE孕妇中,发病时间集中在36~37周,见图2。除了孕20周之前,其余4个窗口期PE组的sFlt-1/PlGF比值均高于未发生PE组,差异均有统计学意义,且在孕28~30周两组sFlt-1/PlGF比值差异最大(Z=-15.828)。见表2。
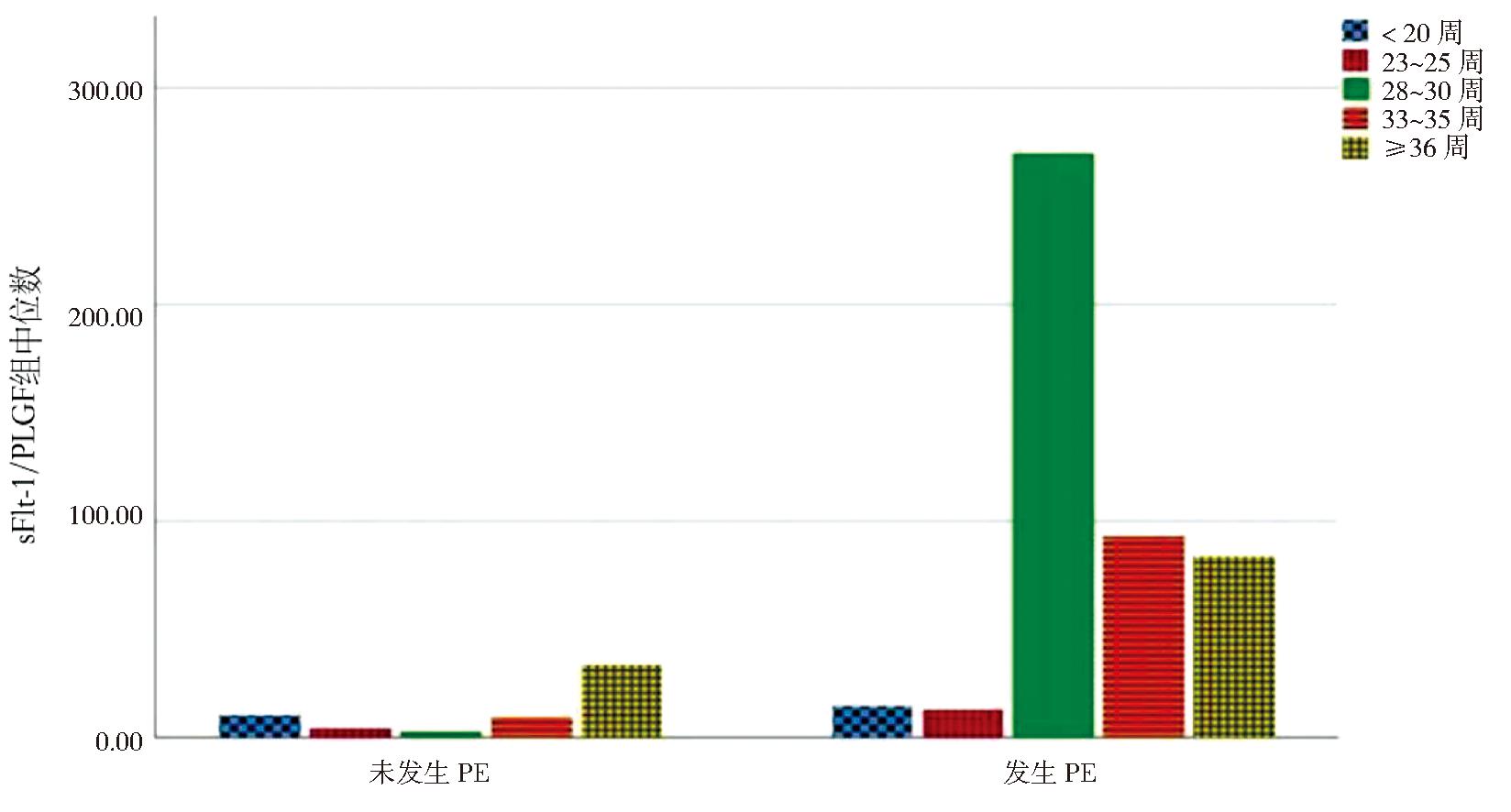
图1 PE组和未发生PE组sFlt-1/PlGF随孕周变化趋势
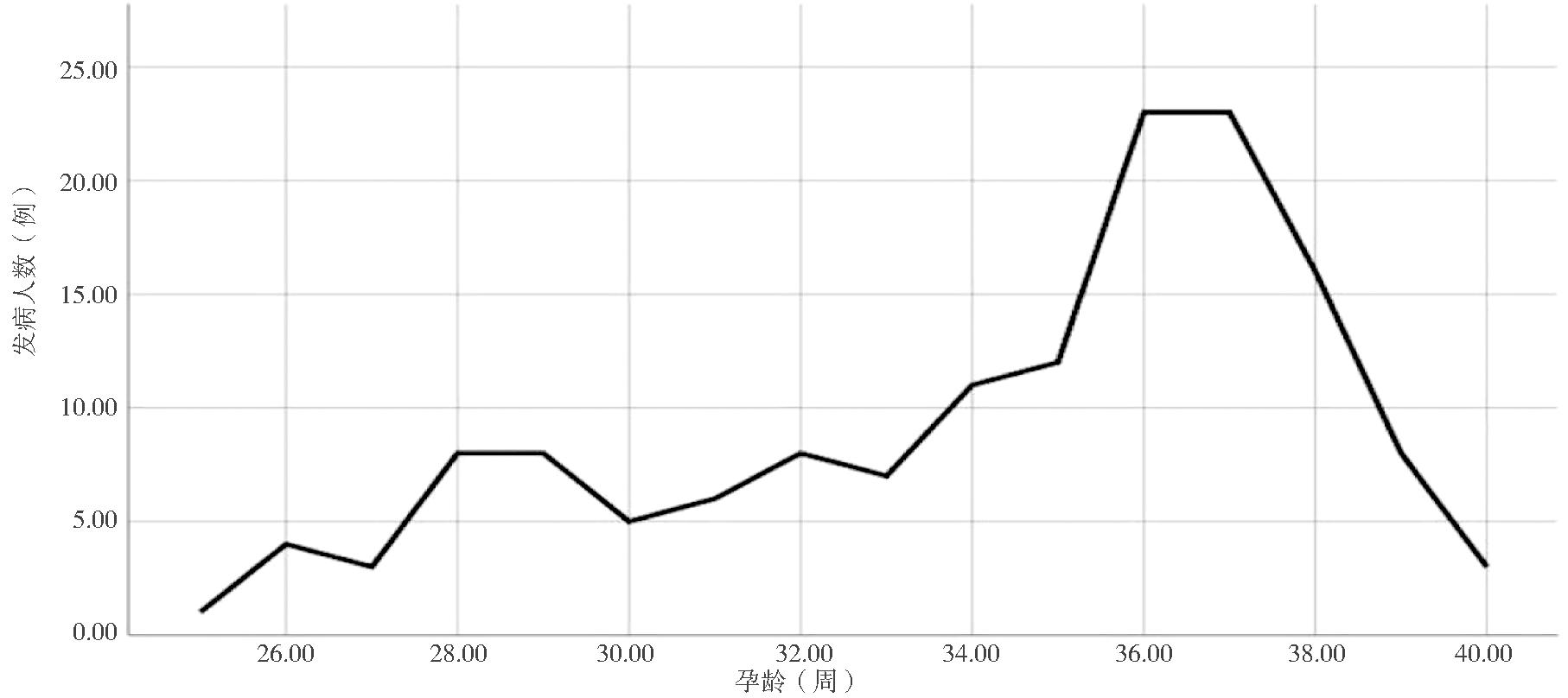
图2 146例PE孕妇各孕周PE发病人数
表2 两组各窗口期sFlt-1/PlGF比值比较[M(P25,P75)]
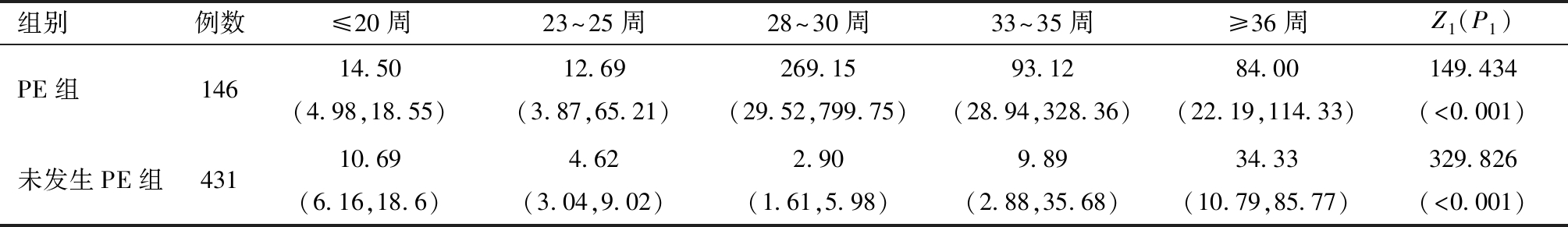
Z1(P1)为同一组各窗口期之间比较,Z2(P2)为两组间同一窗口期比较。
组别例数≤20周23~25周28~30周33~35周≥36周Z1(P1)PE组14614.50(4.98,18.55)12.69(3.87,65.21)269.15(29.52,799.75)93.12(28.94,328.36)84.00(22.19,114.33)149.434(<0.001)未发生PE组43110.69(6.16,18.6)4.62(3.04,9.02)2.90(1.61,5.98)9.89(2.88,35.68)34.33(10.79,85.77)329.826(<0.001)
3.各窗口期sFlt-1/PlGF比值预测PE和SPE的效能:由于孕36周以后预测PE发生的临床意义不大,故采用孕36周前4个窗口期的sFlt-1/PlGF比值对PE的预测价值绘制ROC曲线,结果显示,除了孕20周前,其余3个窗口期的sFlt-1/PlGF比值对PE的发生均有区分能力(均P<0.001),其中以28~30周时AUC最大,在此窗口期对于预测PE具有最佳的区分能力,最佳截断值为24.06,敏感度为82.9%,特异度为92.6%,阳性预测值为43.9%,阴性预测值为91.7%。见图3和表3。
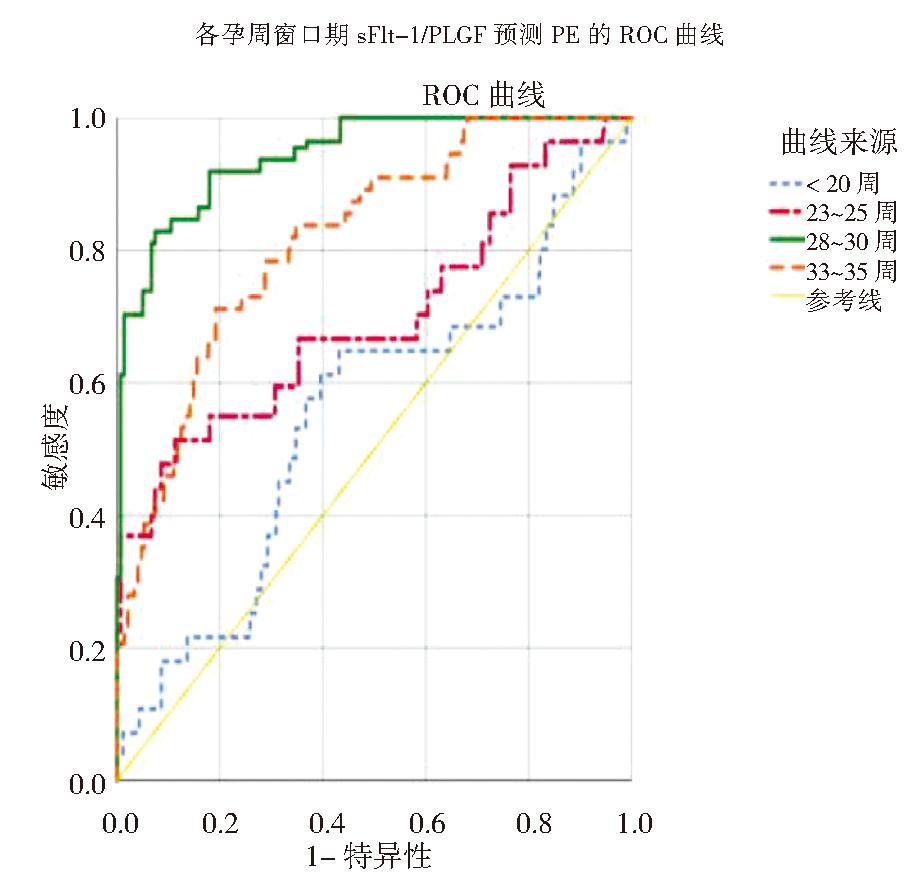
图3 4个窗口期sFlt-1/PlGF比值预测PE的ROC曲线
表3 4个窗口期sFlt-1/PlGF对PE的预测效能和最佳截断值
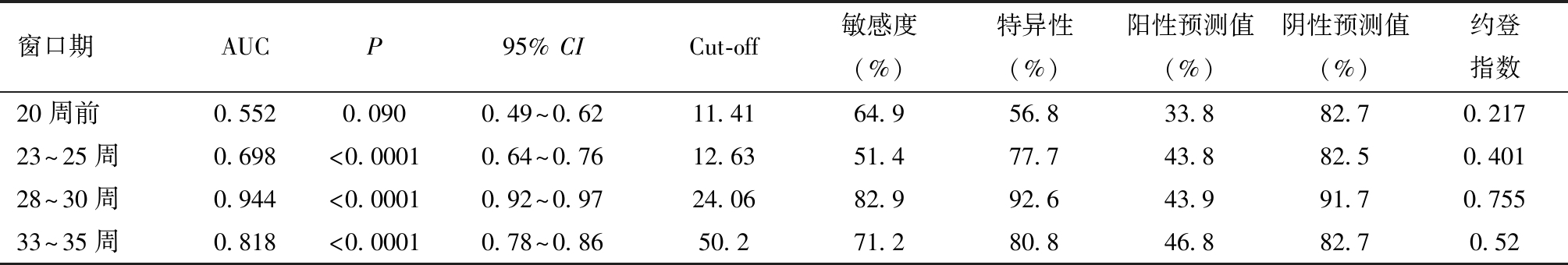
窗口期AUCP95% CICut-off敏感度(%)特异性(%)阳性预测值(%)阴性预测值(%)约登指数20周前0.5520.0900.49~0.6211.4164.956.833.882.70.21723~25周0.698<0.00010.64~0.7612.6351.477.743.882.50.40128~30周0.944<0.00010.92~0.9724.0682.992.643.991.70.75533~35周0.818<0.00010.78~0.8650.271.280.846.882.70.52
进一步绘制ROC曲线比较孕36周前4个窗口期sFlt-1/PlGF比值对SPE的预测价值,结果显示,4个窗口期sFlt-1/PlGF比值对SPE的发生均有区分能力(P均<0.001),以孕28~30周时AUC最大,其最佳截断值为86.03时,敏感度为77.6%,特异度为97.8%,阳性预测值为88.8%,阴性预测值为95.3%。见图4和表4。此外,前三个窗口期sFlt-1/PlGF比值预测SPE的AUC均大于PE,提示孕早中期sFlt-1/PlGF对SPE的预测准确性优于PE。
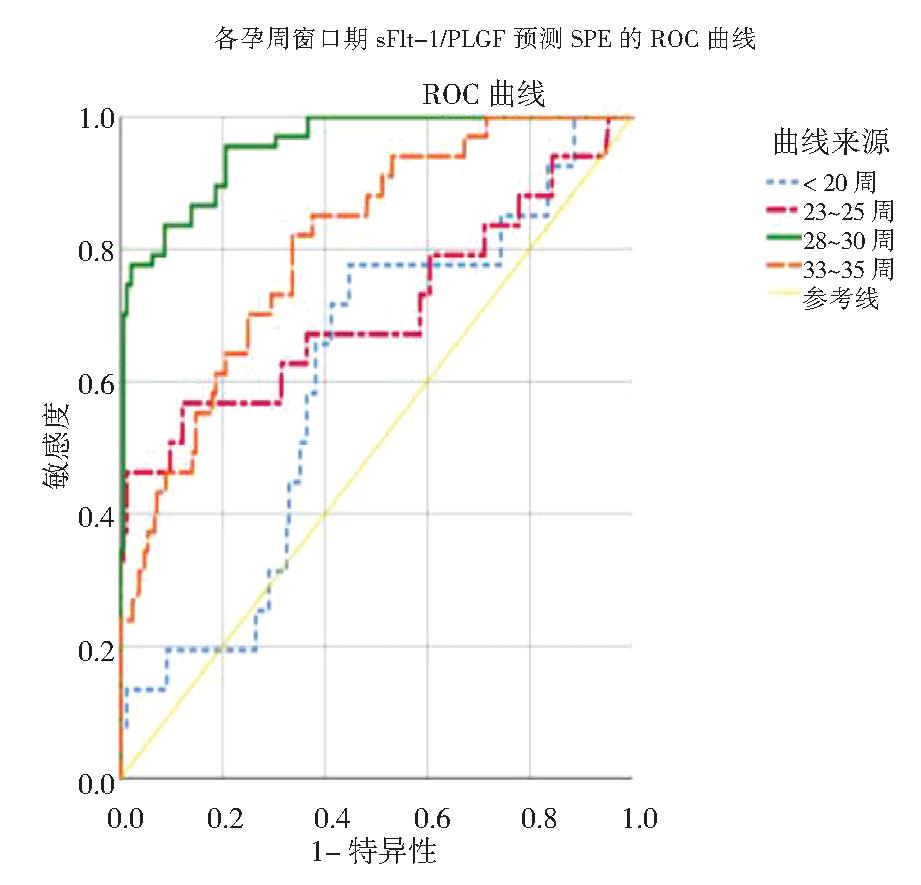
图4 4个窗口期sFlt-1/PlGF比值预测SPE的ROC曲线
表4 4个窗口期sFlt-1/PlGF对SPE的预测效能和最佳截断值
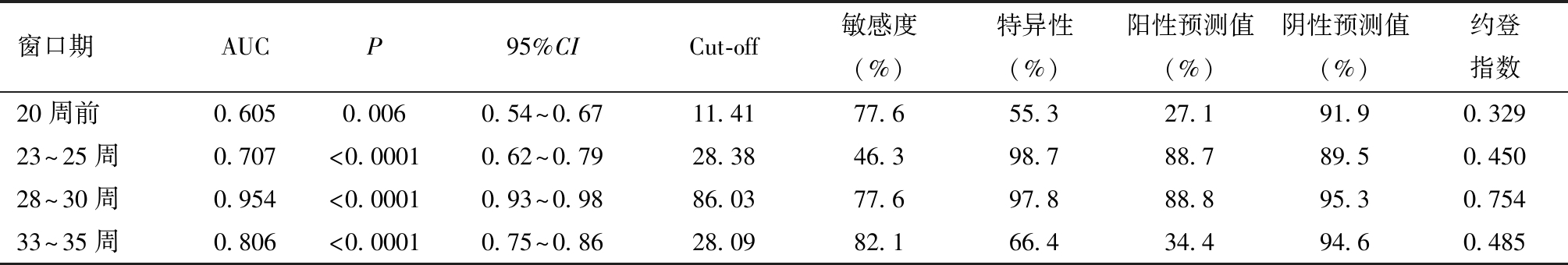
窗口期AUCP95%CICut-off敏感度(%)特异性(%)阳性预测值(%)阴性预测值(%)约登指数20周前0.6050.0060.54~0.6711.4177.655.327.191.90.32923~25周0.707<0.00010.62~0.7928.3846.398.788.789.50.45028~30周0.954<0.00010.93~0.9886.0377.697.888.895.30.75433~35周0.806<0.00010.75~0.8628.0982.166.434.494.60.485
4.sFlt-1/PlGF与PE发病时间的关系:按照最终发生PE孕妇的sFlt-1/PlGF比值的四分位数分组,分为四组,即sFlt-1/PLGF≤14(Q1组)、14
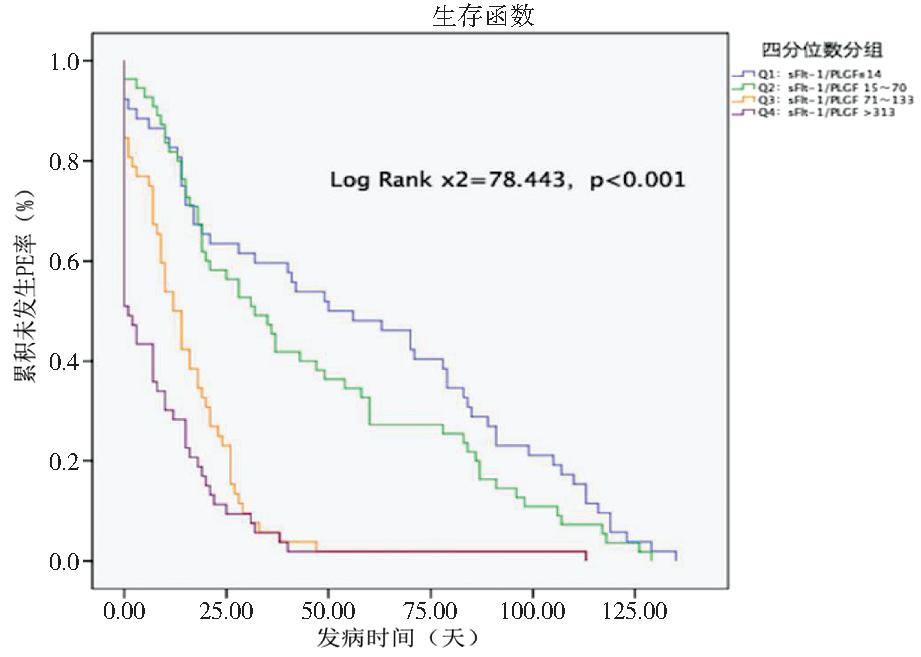
图5 sFlt-1/PlGF四分位数分组与PE发病时间的Kaplan-Meier生存曲线
表5 sFlt-1/PlGF的四分位值与PE发病的比例风险模型
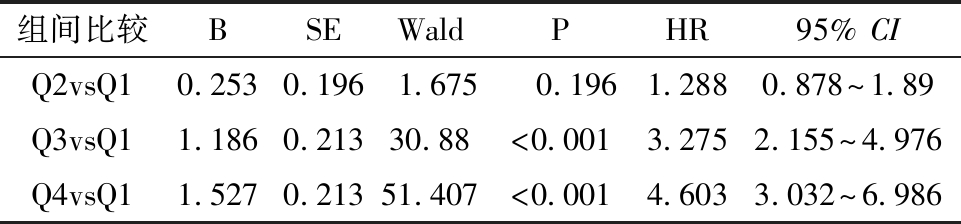
组间比较BSEWaldPHR95% CIQ2vsQ10.2530.1961.675 0.1961.2880.878~1.89Q3vsQ11.1860.21330.88<0.0013.2752.155~4.976Q4vsQ11.5270.21351.407<0.0014.6033.032~6.986
讨论
在临床工作中,由于缺乏可靠的生物学标志物,预测PE仍是一个难题。随着对PE病理生理基础研究的深入,sFlt-1和PlGF及其比值作为血管生成失衡的标志物正逐渐为临床所重视和应用。近年来,多个国家指南将sFlt-1/PlGF作为PE预测、诊断和管理的重要工具[1,8-13],但由于sFlt-1/PlGF具有随孕周动态变化的特征,各孕周用于预测PE的截值以及妊娠期内最佳筛查时间的研究相对匮乏。本研究的目的在于针对PE高危人群,在妊娠期内对sFlt-1/PlGF进行序贯检测,以揭示其随孕周动态变化趋势,探索最佳筛查时间以及各妊娠阶段的截值以预测PE的发生,同时探讨sFlt-1/PlGF与PE发病时间的关系。
使用sFlt-1/PlGF预测PE在不同人群中具有各自的潜在价值。大部分PE发生在具有高危因素的孕妇中,包括肥胖、糖尿病、慢性高血压、辅助生殖等孕妇发生PE的风险更高,更易发生不良妊娠结局[14-15]。中国整体人群中PE发病率为4.5%[16],本研究中高危人群PE的发生率为25.3%,是国内整体人群发病率的5倍左右。有研究认为PE在高危人群中的发生率较一般人群增加了4~5倍[3],与本研究一致。目前大部分研究集中于评估血管生成因子在低危孕妇中预测PE的性能[17],但是针对PE高危人群的筛查研究,在临床表现出现之前准确预测则更具实际意义。
1.sFlt-1/PlGF随孕周动态变化趋势:本研究通过前瞻性队列研究,显示在未发生PE的孕妇中,sFlt-1/PlGF比值在妊娠早期和妊娠中期保持稳定,至33~35周后缓慢升高,这一变化趋势与既往研究[18-19]一致,认为妊娠中期高PlGF和低sFlt-1形成了一种促血管生成状态,妊娠晚期sFlt-1/PlGF比值升高则表示胎盘血管生成的抑制状态,可能与胎盘和血管的缓和生长和生理"成熟"有关。在发生PE的孕妇中,sFlt-1/PlGF比值在孕23~25周前保持稳定,至28~30周突然升高达到高峰,33~35周后出现下降,可见在发生PE的孕妇中,抗血管生成的发生突然且强烈,过早放大了胎盘生长的正常调控机制,而34周后的下降趋势则说明迟发型PE其抗血管生成作用较早发性PE相对缓和。本研究中,发生PE孕妇在各检测窗口期的sFlt-1/PlGF比值均大于未发生PE的孕妇,在23~25周、28~30周、33~35周均存在显著差异,尤其在28~30周差异最为显著。有研究表明,sFlt-1/PlGF在临床表现出现前5周开始升高[18,20-21],本研究中PE发病人数从34周开始增多,集中于孕36~37周左右,这也就解释了在孕28~30周sFlt-1/PlGF比值出现了最大变异的原因。
2.序贯监测sFlt-1/PlGF对PE的预测能力和最佳筛查孕周:本研究显示,孕36周前4个窗口期的sFlt-1/PlGF比值对PE和SPE的发生均有区分能力(均P<0.001)(除了20周前sFlt-1/PlGF对于PE发生显示无区分能力,P=0.09),其中孕28~30周sFlt-1/PlGF比值对PE和SPE的区分度均为最佳,且该比值对SPE的预测效能优于PE。与Kumar等[22]研究一致,该研究认为在PE高危人群中,sFlt-1/PlGF比值预测PE的最佳筛查时间为28~30周。另有研究发现[23-24],sFlt-1/PlGF高比值 (>85)比低比值的孕妇更有可能患有具有严重特征的 PE(90.9% vs 8.0%,P<0.001)和更高的复合孕产妇不良结局率(18.2% vs 0%,P=0.04),并且分娩孕周提前(32.6 vs 37.4周,P=0.001)。同时本研究初步计算了各妊娠窗口期sFlt-1/PlGF比值预测PE的截值和阈值,预测PE时,28~30周时截值为24.06,NPV=91.7%,高NPV值可用于排除PE,从而更好的配置医疗资源,避免不必要的住院和焦虑情绪,但PPV值较低;预测SPE时,28~30周时截值为86.03,PPV=88.8%,NPV=95.3%,高PPV值则可以减少漏诊,以实现对PE高危孕妇更好的监管。Zeisler等 [6]研究中以sFlt-1/PlGF<38为整个孕周的截值,认为可以排除一周内发生PE或相关并发症,本研究中28~30周最为最佳筛查窗口期,该孕周sFlt-1/PLGF≤24.06时可以排除90%以上的PE发生,sFlt-1/PLGF>86.03时可以预测80%以上的SPE,兼顾了保障医疗安全及合理配置医疗资源,临床意义显著。
尽管有研究认为,孕期连续监测sFlt-1/PlGF相较于单次测量能更好的预测PE,例如Moore Simas等提出的两步筛查法[25],以及有学者提出将sFlt-1/PlGF作为连续变量以预测PE[26],等等。Zeisler等[27]研究认为间隔两到三周内的两次测量之间的增量,能够更好的预测的子痫前期,在最终发展为先兆子痫的孕妇中,两周内 sFlt-1/PlGF 的平均增量为 31.2,而在未发生PE的孕妇中,该数值是 1.45.但是连续监测必将增加检验费用和抽取血样,这些增加的负担对预测效能的提升是否相当,仍值得进一步探讨。
3.sFlt-1/PlGF与PE发病时间的关系:除了预测PE的发生,预测PE何时发生也是关键的临床问题,以实施严密的临床监管和干预措施。目前众多研究聚焦于研究sFlt-1/PlGF与分娩时间之间的相关性。Zeister等[28]认为在24~36+6周疑似PE的孕妇中,sFlt-1/PlGF大于38时近期分娩的风险相较于低sFlt-1/PlGF值孕妇高出2.9倍。Baltajian等[29]分析了确诊PE孕妇自入院至分娩的时间间隔,显示sFlt-1/PlGF≥85时,平均分娩时间为6 d,<85时平均分娩时间为14 d 。近期有研究提示在诊断PE孕妇中,sFlt-1/PlGF的纵向变化与较短的分娩时间相关,sFlt-1/PlGF急剧增加的孕妇分娩时间明显缩短(P<0.001)[30]。大部分研究都是在确诊PE的人群中开展,关于在PE高危孕妇中sFlt-1/PlGF预测PE发病时间的研究相对较少。本研究发现,PE的中位发病时间随着sFlt-1/PlGF增加明显缩短(P<0.001),当sFlt-1/PlGF介于70~313时,PE的中位发病时间为12 d,即该人群在检测sFlt-1/PlGF后平均12 d发生PE;当sFlt-1/PlGF>313时,PE的中位发病时间为1 d,即该人群在检测sFlt-1/PlGF后平均1 d发生PE;高sFlt-1/PlGF值是PE发病时间的危险因素,当sFlt-1/PlGF增加50%时,PE即刻发病风险增加2.275倍,即sFlt-1/PlGF>70时,PE的即刻发病风险较低比值的孕妇增加2倍以上。本研究认为,sFlt-1/PlGF可用于预测PE发病时间,高比值预示近期发生PE的高风险,更能将临床措施实施的关口前移,同时能够减少由于各医疗机构终止妊娠指征的差异而产生的研究偏倚。至于高比值的界值目前国际尚无统一结论,有待于今后开展多中心高质量研究,以建立本地区的统一标准。
本研究也存在一定的局限性。第一,本研究为单中心队列研究,样本量相对较小;第二,本研究未纳入低危人群,导致了PE发病率高,由于组间基线差异的减少增加了sFlt-1/PlGF的预测效能,但影响了本研究的临床转化,该结果并不适用于PE低危人群;第三,本研究未进行多因素分析及模型构建,同样未进行验证集的检验;第四,未纳入13周之前的数据,也就无法给予PE预防策略的指导,例如阿司匹林的干预;最后,本研究未将其他妊娠结局纳入研究中,有研究显示sFlt-1/PlGF与众多不良妊娠结局相关,例如胎儿生长受限、早产、死胎等[31]。
综上所述,本研究通过单中心前瞻性队列研究,揭示了在PE高危孕妇中,sFlt-1/PlGF具有随孕周动态变化的趋势,在发生PE孕妇其变化规律与未发生PE孕妇具有显著差异。sFlt-1/PlGF预测PE的准确性在28~30周时最高,认为28~30周为sFlt-1/PlGF的最佳筛查时间,当sFlt-1/PlGF≤24时可以排除90%以上的PE发生;同时高sFlt-1/PlGF是PE发病时间的危险因素,该比值越大,PE的中位发病时间越短,当sFlt-1/PlGF>70时,PE分发病风险比sFlt-1/PlGF≤70的孕妇增加约2倍以上。
1 Gestational Hypertension and Preeclampsia:ACOG Practice Bulletin,Number 222.Obstet Gynecol,2020,135:e237-e260.
2 Ives CW,Sinkey R,Rajapreyar I,et al.Preeclampsia—Pathophysiology and Clinical Presentations:JACC State-of-the-Art Review - Science Direct.J Am Coll Cardiol,2020,76:1690-1702.
3 Kumar M,Sharma K,Singh R,et al.Role of maternal factors,PAPP-A,and Doppler in screening for early- and late-onset pregnancy hypertension in Asian population.HypertensPregnancy,2016,35:382-393.
4 Petersen EE,Davis NL,Goodman D,et al.Vital Signs:Pregnancy-Related Deaths,United States,2011-2015,and Strategies for Prevention,13 States,2013-2017.MMWRMorb Mortal Wkly Rep,2019,68:423-429.
5 Zeisler H,Llurba E,Chantraine F,et al.Prediction of short-term outcome in pregnant women with suspected preeclampsia (PROGNOSIS):The prognosis study.2014.
6 Zeisler H,Llurba E,Chantraine F,et al.Predictive Value of the sFlt-1:PlGF Ratio in Women with Suspected Preeclampsia.N Engl J Med,2016,374:13-22.
7 杨孜,张为远.妊娠期高血压疾病诊治指南(2020).中华妇产科杂志,2020,55:227-238.
8 Magee LA,Brown MA,Hall DR,et al.The 2021 International Society for the Study of Hypertension in Pregnancy classification,diagnosis &management recommendations for international practice.PregnancyHypertens,2022,27:148-169.
9 NICE.PlGF-based testing to help diagnose suspected preeclampsia (Triage PlGF test,Elecsys immunoassay sFlt-1/PlGF ratio,DELFIA Xpress PlGF 1-2-3 test,and BRAHMS sFlt-1 Kryptor/BRAHMS PlGF plus Kryptor PE ratio).Diagnostics guidance [DG23].https://www.nice.org.uk/guidance/dg23/ [Accessed 20 July 2021].
10 Danish Society for Obstetrics and Gynecology:Danish 2018 national clinical guideline for hypertensive disorders in pregnancy and preeclampsia.[Accessed 3 November 2021].
11 Regitz-Zagrosek V,Roos-Hesselink JW,Bauersachs J,et al.2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy.Eur Heart J,2018,39:3165-3241.
12 German Society of Obstetrics and Gynecology (DGGG),Austrian Society of Obstetrics and Gynecology (OEGGG),and Swiss Society for Obstetric and Gynecology (SGGG) Guidelines for Hypertensive Disorders in Pregnancy:Diagnosis and therapy.[Accessed 28 June 2019].
13 Spanish Society ofGynaecology and Obstetrics (SEGO):Practical assistance guide:hypertensive disorders in pregnancy.Prog Obstet Ginecol,2020,63:244-272.
14 Maynard SE,Moore Simas TA,Bur L,et al.Soluble endoglin for the prediction of preeclampsia in ahigh risk cohort.Hypertens Pregn,2010,29:330-341.
15 Nzelu D,Biris D,Karampitsakos T,et al.First trimester serum angiogenic and anti-angiogenic factors in women with chronic hypertension for the prediction of preeclampsia.Am J Obstet Gynecol,2020,222:374.e1-374.e9.
16 Li F,Qin J,Zhang S,et al.Prevalence of hypertensive disorders in pregnancy in China:A systematic review and meta-analysis.Pregnancy Hypertens,2021,24:13-21.
17 Fillion A,Guerby P,Lachance C,et al.Placental Growth Factor and Soluble,Fms-Like Tyrosine Kinase-1 in Preeclampsia:A Case-Cohort (PEARL) Study.J Obstet Gynaecol Can,2020,42:1235-1242.
18 Levine RJ,Maynard SE,Qian C,et al.Circulating angiogenic factors and the risk of preeclampsia.NEngl J Med,2004,350:672-683.
19 Taylor RN,Grimwood J,Taylor RS,et al.Longitudinal serum concentrations of placental growth factor:evidence for abnormal placental angiogenesis in pathologic pregnancies.Am J Obstet Gynecol,2003,188:177-182.
20 Caughey AB.Placental growth factor predicts time to delivery in women with signs orsymptoms of early preterm preeclampsia:a prospective multicenter study EDITORIAL COMMENT.Obstet Gynecol Surv,2020:75.
21 Agrawal S,Shinar S,Cerdeira AS,et al.Predictive Performance of PlGF (Placental Growth Factor) for Screening Preeclampsia in Asymptomatic Women:A Systematic Review and Meta-Analysis.Hypertension,2019,74:1124-1135.
22 Kumar M,Balyan K,Debnath E,et al.Antenatal risk stratification for preeclampsia with sFlt-1/PlGF ratio:Which is the best time to test.Pregnancy Hypertens,2023,34:39-46.
23 Soundararajan R,Suresh SC,Mueller A,et al.Real life outpatient biomarker use in management of hypertensive pregnancies in third trimester in a low resource SeTting:ROBUST study.Pregnancy Hypertens,2021,23:97-103.
24 Lea os-Miranda A,Graciela Nolasco-Lea
os-Miranda A,Graciela Nolasco-Lea os A,Ismael Carrillo-Juárez R,et al.Usefulness of the sFlt-1/PlGF (Soluble fms-Like Tyrosine Kinase-1/Placental Growth Factor) Ratio in Diagnosis or Misdiagnosis in Women With Clinical Diagnosis of Preeclampsia.Hypertension,2020,76:892-900.
os A,Ismael Carrillo-Juárez R,et al.Usefulness of the sFlt-1/PlGF (Soluble fms-Like Tyrosine Kinase-1/Placental Growth Factor) Ratio in Diagnosis or Misdiagnosis in Women With Clinical Diagnosis of Preeclampsia.Hypertension,2020,76:892-900.
25 Moore Simas TA,Crawford SL,Bathgate S,et al.Angiogenic biomarkers for prediction of early preeclampsia onset in high-risk women.JMatern Fetal Neonatal Med,2014,27:1038-1048.
26 Khalil A,Maiz N,Garcia-Mandujano R,et al.Longitudinal changes in maternal serum placental growth factor and soluble fms-like tyrosine kinase-1 in women at increased risk of pre-eclampsia.Ultrasound Obstet Gynecol,2016,47:324-331.
27 Zeisler H,Llurba E,Chantraine FJ,et al.Soluble fms-like tyrosine kinase-1 to placental growth factor ratio:ruling out pre-eclampsia for up to 4 weeks and value of retesting.Ultrasound Obstet Gynecol,2019,53:367-375.
28 Zeisler H,Llurba E,Chantraine F,et al.Soluble fms-Like Tyrosine Kinase-1-to-Placental Growth Factor Ratio and Time to Delivery in Women With Suspected Preeclampsia.Obstet Gynecol,2016,128:261-269.
29 Baltajian K,Bajracharya S,Salahuddin S,et al.Sequential plasma angiogenic factors levels in women with suspected preeclampsia.Am J Obstet Gynecol,2016,215:89.e1-89.e10.
30 Peguero A,Fernandez-Blanco L,Mazarico E,et al.Added prognostic value of longitudinal changes of angiogenic factors in early-onset severe pre-eclampsia:a prospective cohort study.BJOG,2021,128:158-165.
31 Boutin A,Guerby P,Gasse C,et al.Pregnancy outcomes in nulliparous women with positive first-trimester preterm preeclampsia screening test:the Great Obstetrical Syndromes cohort study.Am J Obstet Gynecol,2021,224:204.e1-204.e7.