·实验研究·
核桃低聚肽改善睡眠作用及机制
珠娜 郝云涛 刘欣然 李勇
【摘要】 目的 探讨核桃低聚肽(WOPs)的改善睡眠作用及其可能的机制。 方法 150只健康SPF级雌性BALB/c小鼠购自北京大学医学部实验动物中心,随机分为5个组,分别为空白对照组、乳清蛋白对照组(440 mg/kg BW)、WOPs低、中、高剂量组(依次为WOPs-LG:220 mg/kg BW、WOPs-MG:440 mg/kg BW、WOPs-HG:880 mg/kg BW)。连续灌胃30 d后进行直接睡眠实验、延长戊巴比妥钠睡眠时间实验、戊巴比妥钠阈下剂量催眠实验和巴比妥钠睡眠潜伏期实验,并采用酶联免疫吸附测定法检测脑内γ-氨基丁酸、5-羟色胺和多巴胺含量。 结果 WOPs没有直接睡眠作用;与空白对照组相比,WOP-LG、WOPs-MG小鼠睡眠时间显著延长,巴比妥钠睡眠潜伏期显著缩短,脑内5-HT、γ-氨基丁酸含量显著增加(P<0.05);与乳清蛋白组相比,WOPs-MG小鼠睡眠时间显著延长,巴比妥钠睡眠潜伏期显著缩短,脑内5-HT、γ-氨基丁酸含量显著增加(P<0.05);乳清蛋白及WOPs干预对戊巴比妥钠阈下剂量小鼠入睡发生率没有影响(P>0.05);脑内多巴胺含量在各组之间没有显著差异(P>0.05)。 结论 WOPs没有直接睡眠作用,但WOPs具有一定程度改善睡眠的作用,其机制可能与调节脑内5-HT、γ-氨基丁酸含量有关。
【关键词】 核桃低聚肽; 改善睡眠; 睡眠潜伏期; 戊巴比妥钠
作者单位:100191 北京,北京大学公共卫生学院营养与食品卫生学系
通讯作者:李勇(liyongbmu@163.com)
Effects of walnut oligopeptides on sleep and its mechanism
ZHU Na, HAO Yuntao, LIU Xinran, LI Yong. Department of Nutrition and Food Hygiene, School of Public Health, Peking University, Beijing 100191, China
[Abstract] Objective To investigate the effect of walnut oligopeptides (WOPs) on improving sleep and its possible mechanism. Methods Totally 150 female specific pathogen free (SPF) BALB/c mice were randomly divided into 5 groups:a control group, a whey protein (440mg/kg BW) group, and three WOPs groups (WOPs-LG, WOPs-MG, WOPs-HG) (220, 440, 880 mg/kg BW). After 30 days of continuous intragastric administration, direct sleep test, prolonged pentobarbital sodium sleep time test, hypnotic dose of the pentobarbital sodium-induced sleeping assay and barbital sodium-induced sleeping latency test were carried out, and enzyme-linked immunosorbent assay was used to detect γ-aminobutyric acid, serotonin and dopamine content in brain. Results WOPs could not directly induce sleep. Compared with the blank control group, the sleep time of WOP-LG,WOPs-MG mice was significantly prolonged, the barbital sodium-induced sleeping latency was shortened significantly, and the contents of 5-HT and γ-aminobutyric acid in brain were significantly increased (P<0. 05). Compared with the whey protein group, the sleep time of WOPs-MG mice was significantly prolonged, the barbital sodium-induced sleeping latency was shortened significantly, and the contents of 5-HT and γ-aminobutyric acid in brain were significantly increased (P<0. 05). The intervention of whey protein and WOPs had no effect on the incidence of hypnotic dose of the pentobarbital sodium-induced sleep in mice (P>0. 05), and there was no significant difference in the content of dopamine in brain among all the groups (P>0.05). Conclusion WOPs have a certain degree of sleep improvement, and its mechanism may be related to the regulation of 5-HT, γ -aminobutyric acid in brain.
[Key words] walnut oligopeptides; sleep improvement; sleep latency; pentobarbital sodium
睡眠是指人或动物的相对“静止”或“休息”的时段。根据简单的行为学定义,人与动物的睡眠是指知觉解除对周围环境反应的一种可逆性行为状态[1]。现如今,由于生活节奏的加快,大多数人没有充足的睡眠时间并处于高压力的生活方式、缺乏锻炼、咖啡的摄入量大大增加、噪音和光照时间延长等均可影响人群的睡眠质量。睡眠质量差无疑对白天的功能和身体状态有明显的不良影响,导致白天容易疲劳、情绪不稳、更容易感到焦虑和压力等。而持续的睡眠不足和昼夜节律改变会导致睡眠障碍,进而引起高血压、心血管疾病、肥胖和糖尿病等[2-4]。通过药物的手段改善睡眠存在许多副作用及不良影响,如过度镇静、耐受性、成瘾性、反跳性失眠、精神神经异常反应、记忆障碍和中毒反应等[5]。因此,利用安全、毒副作用小的天然营养物质改善睡眠是重要手段之一。
核桃是公认的褪黑素的天然来源,富含蛋白质,且氨基酸种类齐全,其中色氨酸可以促进血清素和褪黑激素的分泌,谷氨酸可促进γ-氨基丁酸的合成,这些都是核桃中改善睡眠的功能成分[6-8]。动物实验结果也显示,核桃具有良好的改善睡眠的作用[9]。核桃低聚肽(walnut oligopeptides, WOPs)是水解核桃蛋白提取的小分子生物活性肽,其吸收优于核桃蛋白,且有丰富的氨基酸含量,尤其是与合成γ-氨基丁酸有关的谷氨酸,对改善睡眠有积极的作用。WOPs具有显著的抗氧化功能,可有效清除自由基,对脑神经有保护[10-11]。本研究以BALB/c小鼠为研究对象,研究WOPs对改善小鼠睡眠功效的影响,为开发安全、毒副作用小的天然催眠食品提供科学依据。
材料与方法
一、 材料
1.主要试剂:核桃低聚肽(北京天肽生物科技有限公司,淡黄色固体粉末,分子量小于1 000 Da的低聚肽占86.3%,小于2 000 Da的肽类总量96.5%,游离氨基酸含量2.98 g/100 g,精氨酸、苯丙氨酸、酪氨酸、亮氨酸、谷氨酸含量较多),戊巴比妥钠(上海三抒生物科技公司),巴比妥钠(北京化学试剂公司),小鼠γ-氨基丁酸ELISA试剂盒(andygene),小鼠5-羟色胺ELISA试剂盒(andygene),小鼠多巴胺ELISA试剂盒(andygene)。
2.实验动物:健康SPF级雌性BALB/c小鼠150只,6~8 周龄,体重 18~22 g,由北京大学医学部实验动物中心提供,实验动物生产许可证号SCXK(京)2016-0010,实验动物使用许可证号SYXK(京)2016-0041。
二、 方法
1.动物分组与处理:将小鼠随机分为5个剂量组,分别为空白对照组、乳清蛋白对照组(440 mg/kg BW)、WOPs低、中、高剂量组(WOPs-LG:220 mg/kg BW、WOPs-MG:440 mg/kg BW、WOPs-HG:880 mg/kg BW)。各组小鼠饲养于屏障级动物室,喂饲SPF级生长繁殖饲料,自由饮食和饮水,连续灌胃不同受试物水溶液30 d。
2.直接睡眠实验:末次灌胃后,观察各组小鼠是否出现睡眠现象。睡眠以翻正反射(当正常小鼠处于背卧位时会立即翻正身位)消失为指标。如超过30~60 s不能翻正者,即认为翻正反射消失,进入睡眠。翻正反射恢复即为动物觉醒。翻正反射消失至恢复这段时间为动物睡眠时间,记录各组入睡动物数及睡眠时间。
3.延长戊巴比妥钠睡眠时间实验:末次灌胃1 h后,给各组动物腹腔注射36 mg/kg BW戊巴比妥钠,注射量为0.2 ml/20 g,以反正反射消失为指标,观察受试物样品能否延长戊巴比妥钠睡眠时间。
4.戊巴比妥钠阈下剂量催眠实验:末次灌胃1 h后,给各组动物腹腔注射30 mg/kg BW戊巴比妥钠,注射量为0.2 ml/20 g,以小鼠翻正反射消失达1s以上者为入睡标准,记录30 s内入睡动物数。
5.巴比妥钠睡眠潜伏期实验:末次灌胃1 h后,给各组动物腹腔注射260 mg/kg BW巴比妥钠,注射量为0.2 ml/20 g,以反正反射消失为指标,观察受试物样品对巴比妥钠睡眠潜伏期的影响。
6.脑内神经递质的检测:末次灌胃1 h后,颈椎脱臼处死小鼠,迅速取出脑组织,酶联免疫吸附测定法检测小鼠脑内γ-氨基丁酸(GABA)、五羟色胺(5-HT),多巴胺(DA)含量。
7.统计学处理:应用SPSS 22.0软件对各实验原始数据进行数据处理,采用方差分析进行显著性检验。直接睡眠实验的入睡动物数、戊巴比妥钠阈下剂量催眠实验入睡动物数为计数资料,用χ2 检验,四格表总例数小于40,或总例数等于或大于40 但出现理论数等于或小于1 时,应改用确切概率法。各组间率的多重比较采用调整检验水准的Step—down Bonferroni 法,P′j =(c -j +1)Pj。
结 果
一、 WOPs对小鼠直接睡眠的影响
空白对照组、乳清蛋白组、WOP-LG、WOPs-MG及WOPs-HG在给予受试物60 s内,均未发生直接睡眠现象。
二、WOPs对戊巴比妥钠诱导小鼠睡眠时间的影响
乳清蛋白、WOP-LG、WOPs-MG及WOPs-HG的干预不同程度的延长了戊巴比妥钠诱导小鼠睡眠时间。与空白对照组相比,WOP-LG、WOPs-MG小鼠睡眠时间显著延长(P<0.05);与乳清蛋白组相比,WOPs-MG小鼠的睡眠时间显著延长(P<0.05)。见表1。
表1 WOPs对戊巴比妥钠诱导小鼠睡眠时间的影响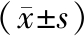
Table 1 Effect of WOPs on the sleep time of mice induced by pentobarbital sodium 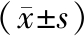

GroupSleep time(s)PControlPWhey proteinControl group18.49±10.53——Whey protein group24.03±12.550.35—WOPs-LG31.02±13.05∗0.040.24WOPs-MG36.42±17.49∗#0.000.04WOPs-HG27.01±14.090.150.61
Note: *P<0.05 versus control group; #P<0.05 versus whey protein group
三、 WOPs对戊巴比妥钠阈下剂量小鼠入睡发生率的影响
与空白对照组相比,乳清蛋白、WOP-LG、WOPs-MG及WOPs-HG干预可以增加在 30 s内小鼠的入睡比率,分别增加了20、50、70和60个百分点,差异均无统计学意义;与乳清蛋白组相比,WOP-LG、WOPs-MG及WOPs-HG小鼠30 min内入睡比例分别增加了30、50和40个百分点,差异均无统计学意义。见表2。
四、 WOPs对小鼠巴比妥钠睡眠潜伏期的影响
与空白对照组相比,不同受试物干预均显著缩短了小鼠的巴比妥钠睡眠潜伏期(P<0.05),其中,WOPs-MG可将小鼠巴比妥钠睡眠潜伏期时间最大由空白对照组(41.62±7.93) s缩短至(22.73±4.72) s;与乳清蛋白组相比,WOPs-LG、WOPs-MG及WOPs-HG小鼠巴比妥钠睡眠潜伏期亦显著缩短(P<0.05)。见表3。
五、 WOPs对脑内神经递质的影响
与空白对照组相比,WOPs-LG和WOPs-MG小鼠脑内5-HT含量显著增高(P<0.05),WOPs-LG、WOPs-MG和WOPs-HG小鼠脑内γ-氨基丁酸含量显著增高(P<0.05);与乳清蛋白组相比,WOPs-MG小鼠脑内5-HT含量显著增高(P<0.05),WOPs-MG和WOPs-HG小鼠脑内γ-氨基丁酸含量显著增高(P<0.05);脑内多巴胺含量在各组之间没有显著变化(P>0.05)。见表4。
表2 WOPs对戊巴比妥钠阈下剂量小鼠入睡发生率的影响
Table 2 Effect of WOPs on the incidence of sleep in mice induced by hypnotic dose of the pentobarbital 

GroupNo. of miceNo. of sleeping miceIncidence(%) PControlPWhey proteinp′ControlP′Whey proteinControl group10110.00————Whey protein group10330.000.21———WOPs-LG10660.000.060.37——WOPs-MG10880.000.000.070.050.56WOPs-HG10770.000.020.180.18—
Note:Values were analyzed by Fisher exact probability test and followed by Step-down Bonferroni test among multiple groups,  (c -j +1)Pj
(c -j +1)Pj
表3 WOPs对巴比妥钠睡眠潜伏的影响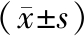
Table 3 Effect of WOPs on the barbital sodium-induced sleeping 

GroupSleeping latency(s)PControlPWhey proteinControl group41.62±7.93——Whey protein group31.76±5.60∗0.00—WOPs-LG26.14±6.80∗#0.000.04WOPs-MG22.73±4.72∗#0.000.00WOPs-HG24.01±3.51∗#0.000.00
Note:*P<0.05 versus control group; #P<0.05 versus whey protein group
表4 WOPs对脑内神经递质的影响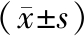
Table 4 Effect of WOPs on neurotransmitters in 

Group5-HT(ng/L)γ-aminobutyric acid(μmol/L)Dopamine(ng/L)Control group182.07±9.486.16±0.3390.82±3.55Whey protein group188.11±11.486.33±0.3492.65±5.25WOPs-LG192.92±10.43∗6.56±0.29∗93.05±3.92WOPs-MG197.11±10.78∗#6.95±0.28∗#90.17±3.73WOPs-HG186.40±9.646.69±0.26∗#88.98±1.37
Note:*P<0.05 versus control group; #P<0.05 versus whey protein group
讨 论
睡眠是人类维持生命活动所必需的生理现象,与机体健康及生长发育密切相关。通过睡眠可以维持内环境稳态、消除疲劳,从而保证高效的工作效率及良好的生活质量。虽然短暂的失眠是大多数人都会经历的一种亚健康状态,但是长期的失眠不仅会严重的影响机体健康,还会降低生产力,增加事故的发生率。因此,良好的睡眠不仅对个人还是社会的良性发展都是至关重要的。近年,生物医学领域学者研究证实了酸枣、白芍提取物,茶氨酸及复合维生素B等许多天然营养物质改善睡眠方面的功能,具有重大的公共卫生学意义[12-14]。生物活性肽具有肽唯有的独特的生理活性,例如抗氧化、改善学习记忆、保护脑神经、改善认知障碍等[15-17],具备改善睡眠的潜力。但生物活性肽改善睡眠方面的研究较少,只见菜籽多肽改善睡眠方面的报道[18-19]。本实验探讨了WOPs的改善睡眠作用,为避免单纯增加蛋白质的摄入量而出现假阳性结果特设立了乳清蛋白对照组,结果显示,WOPs没有直接诱导睡眠的作用,可延长戊巴比妥钠诱导小鼠睡眠时间,显著缩短巴比妥钠睡眠潜伏期,但对戊巴比妥钠阈下剂量小鼠入睡发生率没有显著影响。
本研究为了探讨WOPs改善睡眠作用的相关机制,检测了脑内睡眠相关神经递质,包括5-HT,γ-氨基丁酸及多巴胺。5-HT能神经元位于脑干的延髓、脑桥和中脑中线或“中缝”的核团内,在睡眠-觉醒状态中起了非常重要的作用,参与了睡眠的发生和维持[20]。据文献报道,破坏猫的中缝核5-HT 能神经元可引起脑内5-HT 含量减少,导致实验动物不同程度的失眠,而对1例严重失眠患者进行5-羟色氨酸治疗, 发现一定程度的改善了失眠症状[21]。γ-氨基丁酸是由谷氨酸经过谷氨酸脱羧酶催化而来,是中枢神经系统内重要的抑制性神经递质。γ-氨基丁酸可以延长猫及小鼠的睡眠时间,并能改善猫的失眠症状[22]。多巴胺是中枢神经系统内与觉醒相关的兴奋性神经递质,多巴胺水平升高导致觉醒增加而睡眠减少[23]。本实验条件下,WOPs可显著增加脑内γ-氨基丁酸含量,也可增加脑内5-HT含量,但对多巴胺水平无显著影响。到目前为止尚未发现WOPs对上述三种神经递质调节作用的相关报道,而有文献显示核桃可以增加脑内5-HT和γ-氨基丁酸含量[24-25]。
综上所述,WOPs可延长戊巴比妥钠诱导小鼠睡眠时间,显著缩短巴比妥钠睡眠潜伏期,具有辅助睡眠作用,其机制可能与增加脑内5-HT、γ-氨基丁酸等抑制性神经递质有关。
参考文献
1 张熙.现代睡眠医学.北京:人民军医出版社,2007.
2 Essa MM,Subash S,Dhanalakshmi C,et al.Dietary Supplementation of Walnut Partially Reverses 1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine Induced Neurodegeneration in a Mouse Model of Parkinson′s Disease.Neurochem Res,2015,40:1283-1293.
3 Hassan SD,Frank AS,Paul FJ,et al.Short Sleep Duration and Dietary Intake:Epidemiologic Evidence,Mechanisms,and Health Implications.Adv Nutr,2015,6:648.
4 Faraut B,Boudjeltia KZ,Vanhamme L,et al.Immune,inflammatory and cardiovascular consequences of sleep restriction and recovery.Sleep Med Rev,2012,16:137-149.
5 Zisapel N.Drugs for insomnia.Expert Opin Emerg Dr,2012,17:299-317.
6 Reiter RJ,Manchester LC,Tan DX.Melatonin in walnuts:Influence on levels of melatonin and total antioxidant capacity of blood.Nutrition,2005,21:920-924.
7 徐宏化.不同薄壳山核桃无性系中功能性成分分析.浙江:浙江农林大学,2015.
8 李敏,刘媛,孙翠,等.核桃营养价值研究进展.中国粮油学报,2009,24:166-170.
9 王帅,李汉洋,戴涟漪,等.核桃改善小鼠睡眠功能及其作用机制研究.营养学报,2017,39:189-193.
10 Li W,Zhao T,Zhang J,et al.Effect of walnut protein hydrolysate on scopolamine-induced learning and memory deficits in mice.J Food Sci Technol,2017,54:3102-3110.
11 Zou J,Cai PS,Xiong CM,et al.Neuroprotective effect of peptides extracted from walnut (Juglans Sigilata Dode) proteins on Abeta25-35-induced memory impairment in mice.J Huazhong Univ Sci Technol [Med Sci],2016,36:21-30.
12 刘华荣,陈卫英,黄宗锈.酸枣仁提取物改善小鼠睡眠的研究.海峡药学,2016,28:14-16.
13 李越峰,张泽国,徐福菊,等.白芍改善睡眠作用的药效物质基础研究.中国实验方剂学杂志,2014,20:127-130.
14 李靓,林智,何普明,等.茶氨酸改善小鼠睡眠状况的实验研究.食品科学,2009,30:214-216.
15 郝江伟,徐德峰,赵谋明,等.核桃肽NP-1对大鼠酒精性情绪及认知损伤的改善效应.食品工业科技:2017,38:300-305.
16 Chen H,Zhao M,Lin L,et al.Identification of antioxidative peptides from defatted walnut meal hydrolysate with potential for improving learning and memory.Food Res Int,2015,78:216-223.
17 Hicyilmaz H,Vural H,Delibas N,et al.The effects of walnut supplementation on hippocampal NMDA receptor subunits NR2A and NR2B of rats.Nutr Neurosci,2014,20:1-6.
18 王禹程.菜籽多肽与天麻及五味子协同改善睡眠作用研究.江苏无锡:中国食品科学技术学会第十四届年会暨第九届中美食品业高层论坛,2017.
19 王禹程,李云亮,杨雪,等.菜籽多肽改善小鼠睡眠功效的研究.粮食与油脂,2017,30:57-60.
20 张美娅,王平,丁莉,等.睡眠及睡眠剥夺与5-羟色胺及其受体的相关性探讨.中华中医药学刊,2018,36:805-807.
21 赵宏杰,樊官伟,罗毅杨,等.参竹精片协同戊巴比妥钠对小鼠睡眠及5-HT的影响.天津中医药,2016,33:307-310.
22 李晓娜,赵庆华,王爱华,等.γ-氨基丁酸对小鼠睡眠的影响.产业与科技论坛,2018,17:68-69.
23 赵仁云,郑竹宏,丁玉婷,等.栀子厚朴汤对失眠模型小鼠行为学及脑内单胺类神经递质的影响.国际药学研究杂志,2018,45:436-442.
24 虞立霞,姚奎章,夏君霞,等.核桃对发育期小鼠认知功能的改善作用及对脑内递质性氨基酸的影响.北京:全国营养科学大会,2015.
25 Saida H,Zehra B,Saiqa T,et al.Effects of walnuts (Juglans regia) on learning and memory functions.Plant Food Hum Nutr,2011,66:335-340.
(收稿日期:2018-12-28)
![]()
![]()



