子宫颈癌是一种恶性妇科肿瘤,在全世界范围内每年约有50万人新确诊为子宫颈癌,同时约有30万人死于子宫颈癌,9%的女性肿瘤患者的死因是子宫颈癌,子宫颈癌已成为对世界妇女健康构成威胁的恶性肿瘤[1]。每个国家子宫颈癌发病率不尽相同,每年新确诊病例中80%发生在发展中国家[2]。子宫颈癌是非洲、中美洲、南亚和中亚妇女因肿瘤死亡的最主要原因[3]。在中国,子宫颈癌的发生也不容乐观,每年新确诊宫颈癌病例约为13万人,占全球宫颈癌新发病例的28.8%,每年因宫颈癌死亡的人数约5万人[4],子宫颈癌在中国妇女恶性肿瘤中排第一位。宫颈癌是可预防、可早发现、早期可治愈的肿瘤,因癌前病变持续时间长,通过筛查可发现癌前病变和早期浸润癌,可有效地降低宫颈癌发病率和因病致死率。本文就P16/Ki-67免疫细胞学双染能否在宫颈癌筛查中有效筛查和分流患者进行讨论。
对象与方法
1.对象:2017年9月到2018年3月在本院门诊及住院自愿行宫颈防癌筛查的妇女,HC-2 HPV检测结果阳性,同时行宫颈细胞学检查,后进一步行组织病理检查明确诊断的妇女59例,年龄21~60岁,平均年龄(44.3±9.5)岁。纳入标准包括自愿行宫颈癌筛查并且(1)HC-2 HPV检测结果阳性;(2)有宫颈细胞学检查结果;(3)有病理检测结果。排除标准包括(1)既往有宫颈癌或者宫颈局部不明肿瘤史;(2)目前正在妊娠或者妊娠终止3个月内及哺乳期妇女;(3)宫颈发育异常如双宫颈、先天性子宫缺如者;(4)具有宫颈局部切除史或放疗、化疗者;(5)手术切除子宫者,剩余液基细胞不符合样本制作过程;(6)样本结果不符合判定标准及样本信息不全的标本。
2.HC-2 HPV DNA基因分型检测(第二代反向点杂交捕获技术):用Digene公司圆锥形采样刷,采集宫颈脱落细胞放在Digene样本保存液中储存。按照Digene公司提供的专用检测试剂盒说明进行,HPV的结果以RLU/CO比值≥1.0界定为阳性。
3.宫颈液基薄层细胞学检查(TCT):采用超薄液基细胞检测系统,制成单层细胞涂片。由2名妇科细胞病理学专业医生严格执行双阅片,细胞学结果分为(1)良性反应性细胞改变(NILM);(2)宫颈未明确诊断意义的非典型鳞状上皮细胞(ASC包括ASC-US、ASC-H);(3)低级别宫颈鳞状上皮内病变(LSIL);(4)高级别宫颈鳞状上皮内病变(HSIL);(5)宫颈鳞状细胞癌(SCC);(6)未明确诊断意义的非典型腺细胞(AGUS)和腺癌(ACC)。
4.阴道镜检查及宫颈活检:按照纳入标准为TBS提示ASC以上和(或)高危型HPV阳性者。对入组的研究对象行阴道镜检查,包括醋酸实验和碘实验。由病理科专业医生阅片判读,将病理诊断结果作为诊断实验的金标准。
5.P16/Ki-67免疫细胞化学双染检测(CINTEC PLUS):CINtec© PLUS细胞学实验是一种免疫细胞化学测定方法,用于同时定性检测宫颈细胞学制片中的P16INK4a和Ki-67蛋白。阳性结果为至少检测到一个双染细胞,独立的细胞或在细胞群中,如果一个或多个宫颈上皮细胞在同一个细胞中同时存在特异性棕色细胞浆免疫染色和特异性红色细胞核免疫染色,便可视为CINtec PLUS细胞学检测结果阳性
6.统计学处理:应用SPSS17.0软件包对数据进行处理及统计学分析。以宫颈标本组织学结果为金标准,计算诊断实验灵敏度、特异度、总符合率、阳性预测值、阴性预测值,对定性资料用卡方检验,对两种检测方法比较用一致性时用Kappa检验,以P<0.05为差异有统计学意义。
灵敏度=真阳性人数/(真阳性人数+假阴性人数)×100%;特异度=真阴性人数/(真阴性人数+假阳性人数))×100%;总符合率=(真阳性人数+真阴性人数)/(病例总数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%
结果
1.P16/Ki-67细胞学双染的结果:59例妇女病理组织中,未见病变组织5例(8.5%,5/59),慢性宫颈炎19例(32.2%,19/59),CIN Ⅰ10例(16.9%,10/59)、CIN Ⅱ及CIN Ⅲ 共23 例(39.0%,23/59),宫颈癌2例(3.4%,2/59)。检测P16/Ki-67细胞双染结果P16/Ki-67示34例为阳性,25例为阴性,见表1。
表1 P16/Ki-67细胞学双染检测方法结果情况
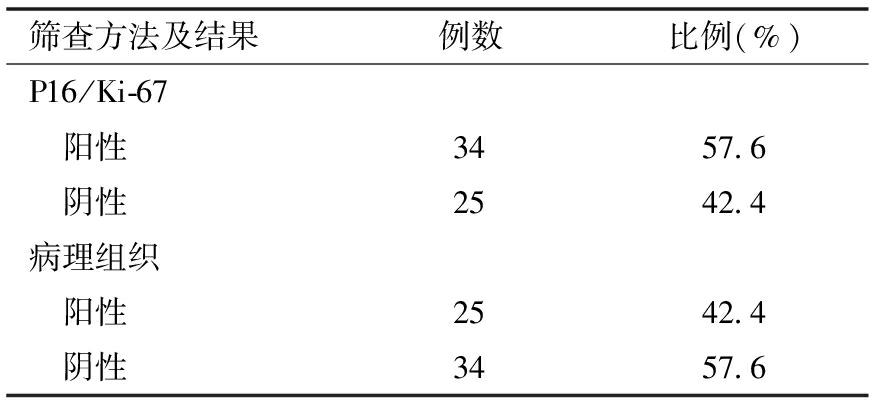
筛查方法及结果例数比例(%)P16/Ki-67 阳性3457.6 阴性2542.4病理组织 阳性2542.4 阴性3457.6
2.病理组织学结果与P16/Ki-67细胞学双染结果比较:细胞学双染阳性中病理组织学诊断为CIN Ⅱ及以上(包括CIN Ⅱ、CIN Ⅲ及宫颈癌)宫颈病变为23例,诊断为CIN Ⅰ及炎症为11例,细胞学双染在诊断CIN Ⅱ及以上宫颈病变的灵敏度(阳性符合率)为92.0%,特异度(阴性符合率)为67.6%,总体符合率为78.0%,阳性预测值为67.6%,阴性预测值为92.0%。细胞学双染阳性结果在诊断CIN Ⅱ及以上宫颈病变与阴性结果(CIN Ⅰ及炎症)比较差异有统计学意义,说明细胞学双染阳性其病理诊断更有可能为CIN Ⅱ及以上宫颈病变,其与病理诊断的一致性较高(Kappa=0.569,P<0.05)。见表2。
表2 病理组织学结果与细胞学双染的结果比较
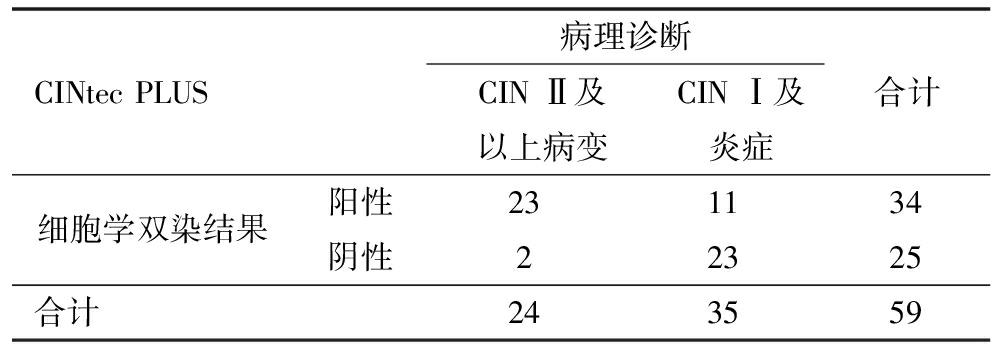
CINtecPLUS病理诊断CINⅡ及以上病变CINⅠ及炎症合计细胞学双染结果阳性231134阴性22325合计243559
P16/Ki-67细胞学双染在宫颈不同组织病理结果中阳性率不同,其中炎症为37.5%(9/23),CIN Ⅰ为20%(2/10),CIN Ⅱ和CIN Ⅲ为91.3%(21/23)宫颈癌为100%(2/2)。由此可见,P16/Ki-67细胞学双染阳性率随宫颈组织病理学诊断分级升级呈上升趋势。见表3。
表3 不同组织病理分级中细胞学双染阳性率[例(%)]
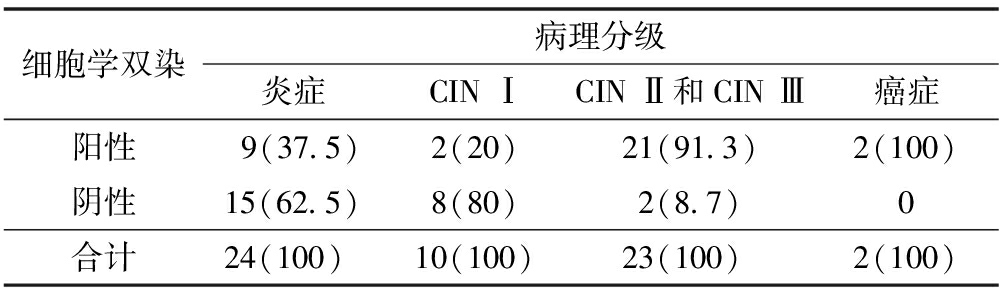
细胞学双染病理分级炎症CINⅠCINⅡ和CINⅢ癌症阳性9(37.5)2(20)21(91.3)2(100)阴性15(62.5)8(80)2(8.7)0合计24(100) 10(100)23(100) 2(100)
讨论
子宫颈癌是女性生殖道高发恶性肿瘤之一,在病变发生的最初阶段通常无特殊症状,早期诊断及治疗宫颈癌前病变是阻断宫颈癌发生发展的有效手段。目前,常见宫颈癌筛查方案有三种,即(1)宫颈细胞学筛查;(2)HPV检测;(3)VIA/VIL4、HPV+TCT,宫颈癌的最佳筛查方案就是既能发现有高危风险的妇女,又能排除不具有风险的正常妇女,既避免漏诊又避免误诊,只有当二者平衡后宫颈癌筛查方案才能称之为最优方案。
目前,最常见及应用最广的筛查技术就是TCT和HPV检测技术。TCT检查假阴性率高,易导致漏诊。子宫颈癌假阳性结果也常见,细胞学筛查最多的病理诊断就是ASC-US,ASC-US并不是一个确定的诊断,但它又囊括了宫颈各级别组织病理学结果,ASC-US通常在显微镜下观察结果为细胞散在、量较少,具有表层或中层鳞状细胞的大小和形状,细胞核面积为正常中层鳞状细胞核的2.5倍,细胞核轻度深染或染色不规则。ASC-US不是一种单独的存在形式,而是一个分类,包含与HPV感染相关的细胞学改变和类似于这些改变但与HPV感染不相关的细胞学变化。造成细胞学结果为ASC-US的原因有以下7点[5],即(1)成熟细胞胞质;(2)细胞形态不典型;(3)形态不规则的萎缩细胞;(4)角化不全的宫颈鳞状细胞;(5)炎性修复细胞;(6)化生细胞;(7)HPV感染的反应细胞以及细胞量少无法确定诊断不能归为正常或不正常。造成ASC-US的原因很多,但需要找到与HPV感染有关的细胞学的改变,才能达到筛查的真正目的。研究发现,在对细胞学检查结果为ASC-US妇女中进行病理组织学检查,超过50%的为炎症的检查结果并不是宫颈癌前病变或更高级别病变[6]。ASC-US诊断在各细胞病理学专家之间诊断的重复性较低,美国国立癌症研究所发起的多中心随机临床试验中,其诊断的重复性仅32.4%[7-9]。ASC-US中究竟有多少是真正患有宫颈病变的妇女,还有多少是可能发展成为宫颈病变的高危妇女,这就需要寻找一个有效的分流手段,将这些妇女从众多ASC-US妇女中寻找出来,而且这个分流手段必须是灵敏度和特异度均衡的方法。在这种情况下,可以选择灵敏度和特异度均不高的重复细胞学检测,也可以是灵敏度高、特异度低的HPV作为分流检测。本研究采用P16/Ki-67细胞学双染检测对ASC-US及HPV检测中的阳性结果进行研究,从而提高宫颈上皮内瘤变和宫颈癌的检出率,减少宫颈癌的发生风险。
细胞学结果为ASC-US时,在电子阴道镜下病理组织检查结果从正常组织学改变到宫颈癌前病变及宫颈癌均有分布[10]。研究显示,ASC-US中可以有20%左右的CIN Ⅰ以及5%左右的的CIN Ⅱ,更有CIN Ⅲ及宫颈癌的发生[11]。本研究以病理组织学结果为金标准,验证细胞学双染的宫颈癌筛查应用的可行性及检测结果的可靠性。共收集符合要求的宫颈液基细胞学为ASC-US及以上剩余标本59例,P16/Ki-67细胞双染检测灵敏度(阳性符合率)为92%,特异度(阴性符合率)为67.6%,总体符合率为78.0% 与组织病理学结果符合率高(Kappa=0.569,P<0.05),P16/Ki-67细胞学双染阳性结果在诊断CIN Ⅱ及以上宫颈高级别病变与阴性结果比较,差异有统计学意义,说明P16/Ki-67细胞学双染阳性其病理诊断更有可能为CIN Ⅱ及以上宫颈高级别病变。本研究中P16/Ki-67细胞学双染阳性率随宫颈组织病理学诊断升级有上升趋势。更好的说明P16/Ki-67细胞学双染阳性能够诊断高级别宫颈病变,为分流ASC-US提供依据。
一项入组妇女大于27 000人的多国、多个医疗中心协同参与的前瞻性研究[12]中,试验期间对所有妇女进行传统的巴氏涂片细胞学检测、P16/Ki-67双染(CINtec PLUS)及HC2 HPV检测,并以活检确认CIN Ⅱ及以上宫颈病变为检测终点。该研究证实,相比传统细胞学,CINtec PLUS检测在不影响特异性的前提下,对CIN Ⅱ及以上宫颈病变的敏感性提高18%(86.7% vs 68.5%);对于HPV阳性妇女的分流,相比传统细胞学,CINtec PLUS双染检测对CINⅢ的敏感性提高17%(88% vs 71%)。在575例细胞学检测为ASC-US的患者中,18例患者经活检证实为CIN Ⅰ以上,CINtec PLUS双染的灵敏度为94%,特异性为78%,与本研究的灵敏度结果相接近(92%),但本研究特异度(67.6%)低于文献报道的78%,这可能与本研究并非在正常人群中进行,而是在本院门诊及住院患者HC-2阳性患者中进行有关。本研究中ASC-US/ASC-H共49例,其中细胞学双染阳性为25例,阴性为24例,病理组织诊断为CIN Ⅱ和CIN Ⅲ的为18例,CIN Ⅰ及宫颈炎症为31例,对ASC-US/ASC-H进行P16/Ki-67细胞学双染分流,P16/Ki-67细胞学双染阳性能够更好诊断CINⅡ及以上的宫颈病变,差异具有统计学意义,P16/Ki-67细胞学双染检测与病理检测的一致性较好,P16/Ki-67细胞学双染检测的灵敏度为88.9%,特异度为71.0% 总体符合率为77.6%,本组数据与PALMS研究中的数据结果相符,说明在TCT 检查为ASC-US、ASC-H中进行P16/Ki-67细胞学双染阳性能够预测其病理结果。Kisser 等[13]总结文献得出的结论,发现在ASC-US患者中,同时进行P16/Ki-67细胞学双染检测及HR-HPV检测预测宫颈高级别病变的灵敏度分别为92%、97%,特异度分别为81%、44%;在不降低灵敏度同时,P16/Ki-67细胞学双染检测的特异性更高;同时鉴于P16/Ki-67细胞学双染的阳性诊断结果的重复性较好。这意味着与HPV检测相比较,P16/Ki-67细胞学双染检测在分流ASC-US中将大大减少转诊阴道镜的人数,尤其是在年轻人群中其分流诊断的意义更大,P16/Ki-67细胞学双染有望成为对ASC-US分流的重要辅助手段。
中国宫颈癌发病情况:经济发展上,东部优于西部,南部优于北部,宫颈癌在经济发展较为落后地区高发。地理位置上,山区高于平原,医疗水平不同表现出不同地区不同特点,每年新发病例及病死率各地区也不同。当按照宫颈癌筛查新指南无法切实可行时,需要探讨适合中国不同地区的筛查策略。目前,筛查已从群体筛查管理走向精准分层筛查和个体化处理。新疆作为宫颈癌高发区,患病率和死亡率均较高,HPV感染率不高[14]。因此,对HPV检测为高危型别HPV感染者进行P16/Ki-67细胞学双染可以明确是否有高级别宫颈病变存在,可有效减少阴道镜检测带来的创伤,避免了严密随访中患者焦虑情绪,同时也可对同一份样本进行重复检测,减少重复取样给患者带来的经济负担。因此,P16/Ki-67细胞学双染在HPV检测后患者的分流管理中是一种有效的方案。
本研究是对P16/Ki-67进行免疫细胞化学染色,采用宫颈脱落细胞,取样无创伤,同一份样本可行TCT、HPV及CINtec PLUS检测,降低耗材成本,减少患者经济费用;经过TCT制片系统制片后可以直接固定用于免疫细胞化学检测,与组织病理学标本相比少了固定、脱水、浸蜡、包埋等步骤,染色时省去组织病理标本的脱蜡和水化过程,其原理同免疫组织化学一样,应用的是抗原抗体相结合,结果更直观、客观可靠。希望在将来能够进行系统分析,通过长期前瞻性研究,探讨适用于临床的宫颈癌筛查、癌前病变分流方案。
1 Ferlay J,Autier P,Boniol M,et al.Estimates of the cancer incidence and mortality in Europe in 2006.Ann Oncol,2007,18:581-592.
2 Parin DM,Bray F,Ferlay J,et al.estimating the world cancer burden Globocan 2000.Int J Cancer,2001,94:153-156.
3 Arbyn M,Castellsague X,de Sanjose S,et al.Worldwide burden of cervical cancer in 2008.Ann Oncol,2011,22:2675-2686.
4 Walboomers JM,Jacobs MV,Manos MM,et al.Human Papillomavirus is a necessary cause of invasive cervical cancer worldwide.J Pathol,1999,189:12-19.
5 王玥元,石清芳,田芳.宫颈液基薄层细胞学筛查中非典型鳞状细胞研究进展国际病理科学与临床杂志,2013,33:365-368.
6 Katki HA,Schiffman M,Castle PE,et al.Five-year risks of CIN 3+ and cervical cancer for women with HPV testing of ASC-US PaP results.J Low Genit Tract Dis,2013,17:S36-42.
7 ASCUS-LSIL Traige Study(ALTS)Group.Results of a randomized trial on the management of cytology interpretations of atypical squamous cells of undetermined significance.Am J Obstet Gynecol,2003,188:1383-1392.
8 Renshaw AA,Deschenes M,Auger M.ASC/SIL Ratio for Cytotechnologists A Surrogate Marker of Screening Sensitivity.Am J Clin Pathol,2009,131:776-781.
9 Origoni M,Carminati G,Sideri M,et al.Low-grade Positivity of HPV viral load after atypical squamous cells of undetermined significance(ASC-US)cytology identifies women at low-risk for cervical intraepithelial neoplasia grade 2 and 3.Eur J Gynaecol Oncol,2011,33:261-264.
10 Waldstrom M,Ornskov D.Clinical Performance of a human Papillomavirus messenger RNA test(APtima HPV Assay)on residual material from archived 3-year-old PreservCytsamPles with low-grade squamous intraepithelial lesion.Arch Pathol Lab Med,2011,135:1052-1056.
11 Wright Jr TC,Massad LS,Dunton CJ,et al.2006 consensus guidelines for the management of women with abnormal cervical screening tests.J Lower Genital Tract Dis,2007,11:201-222.
12 Ikenberg H,Bergeron C,Schmidt D,et al.Screening for cervical cancer Precursors with P16/Ki-67 dual-stainedcytology:results of the PALMS study.Natl Cancer Inst,2013,105:1550-1557.
13 Kisser A,Zechmeister-Koss I.A systematic review of P16/Ki-67 immuno-testing For triage of low grade cervical cytology.BJOG,2015,122:64-70.
14 王鹤.中国五个地区妇女HPV感染型别研究与中国生殖器疣低危HPV型别感染的meta分析.北京:中国协和医科大学,2008.