母乳可以提供充足的营养素和生物活性物质,是6月龄以内婴儿的理想食物,对婴儿生长发育和生命后期健康有深远影响[1]。母乳中的宏量营养素可以提供生长发育所必需的能量,并与大脑认知系统、免疫系统以及肠道微生态平衡的建立相关[2-3]。α-生育酚是母乳中重要的脂溶性维生素,可促进子代的认知、呼吸以及免疫功能发育[4-5],其主要的食物来源为植物油和坚果。膳食中的α-生育酚随脂肪一起被小肠细胞吸收,以乳糜微粒的形式被运输到肝脏,经肝脏整合到极低密度脂蛋白再分泌到血液循环,因此,α-生育酚的吸收和代谢都与脂类密切相关。为适应婴儿的需求,母乳中的营养素会随着哺乳阶段的进展发生变化。同时,母乳中的营养素还会受到乳母膳食、体质指数(body mass index,BMI)、产次、胎龄、基因背景等因素的影响[6-8]。母体因素可以影响母乳质量,只有营养状况良好的健康乳母分泌的乳汁才是指导婴配食品研发的金标准。上海地区乳母对孕产期健康关注度高,饮食摄入均衡且母乳喂养婴儿发育状况良好,是开展母乳研究的理想城市。
本研究通过招募上海地区单胎足月分娩的健康产妇,收集其母体资料和不同阶段母乳,分析母乳α-生育酚和宏量营养素的阶段性变化、内部关联及母体脂代谢因素的可能影响,以期为婴儿摄入推荐量的制定和婴儿配方食品研发提供参考意见。
对象与方法
一、研究对象
选择2017.7—2018.6在上海交通大学医学院附属新华医院定期产检并分娩的单胎足月健康产妇89例,年龄20~35岁,均无代谢性、传染性和遗传性疾病,计划哺乳时间超过2个月。研究经过新华医院伦理委员会审批(XHEC-2017-064),所有参与课题的产妇均签署知情同意书。
二、研究方法
1.围产期母体数据收集:通过医院病历系统和问卷收集病史和人体测量学信息(身高、孕前体重、分娩前体重、孕周、分娩方式、胎儿性别及身长、体重),计算孕前BMI并根据美国IOM 孕期增重推荐指南(2009) (单胎)[9]评价孕期增重,其中BMI<18.5kg/m2的孕妇孕期增重推荐范围为12.5~18.0 kg,BMI在18.5~24.9 kg/m2的孕妇孕期增重推荐范围为11.5~16.0 kg,BMI≥25.0 kg/m2的孕妇孕期增重推荐范围为5.0~11.5 kg。在推荐范围为“增重适宜”,超出增重上限为“增重过度”,低于增重下限为“增重不足”;同时收集分娩前一周内血脂代谢指标包括血总胆固醇(total cholesterol,TC) 、血总甘油三酯(total triacylglycerol,TG)。
2.乳汁采集:在产后1~5 d,10~15 d和40~45 d,上午9:00-11:00,通过吸奶器吸取单侧乳房的全部乳汁,充分混匀后取出15 mL置于洁净试管,通过低温冷链在5 h内运输到实验室,立即冻存于-80 ℃冰箱。
3.乳汁测定:将母乳样本取出,超声均质化后取5 mL注入母乳自动分析仪(MIRIS母乳分析仪,瑞典)测定脂肪、蛋白质、乳糖含量;取均质后的母乳0.5 mL,按照文献方法[10],依次加入0.5 g的抗坏血酸钠,5 mL的水和10 mL甲醇,最后加入45%的氢氧化钾溶液,在80 ℃水浴中进行皂化反应。用10 mL正己烷提取得到的产物,提取液在氮气下吹干,再复溶于1 mL异辛烷中进样。使用的检测仪器是高效液相色谱配荧光检测器 (Agilent 1260 Infinity),色谱柱Thermo Scientific BETASIL Silica-100,3 μm,3.0 mm×30 mm,流动相是异辛烷:二氯甲烷:异丙醇(98.94:1:0.06,v/v/v),进样量20 μL,单针运行时间20 min,梯度流速设置为0~7min 0.3 mL/min,7~7.5min流速上升到0.6 mL/min并保持到14 min,之后14~14.5min内流速降低回到0.3 mL/min。在激发波长295 nm,发射波长330 nm下检测,取标准品α-生育酚(Sigma分析标准品)溶于异辛烷,配制7个浓度(0.2,0.4,1,2,4,12,20 mg/L)作为标准曲线进行定量。
4.统计学方法:所有计量数据用![]() 表示,用SPSS 21.0进行统计分析,以P<0.05为有统计学意义。用多因素方差分析对不同阶段母乳营养素含量进行分析,有显著性差异的数据再用Bonferroni检验进行组内的两两比较。用偏相关分析进行母乳宏量营养素和α-生育酚含量相关性分析,用Pearson相关进行母乳营养素和母体因素的相关性分析。
表示,用SPSS 21.0进行统计分析,以P<0.05为有统计学意义。用多因素方差分析对不同阶段母乳营养素含量进行分析,有显著性差异的数据再用Bonferroni检验进行组内的两两比较。用偏相关分析进行母乳宏量营养素和α-生育酚含量相关性分析,用Pearson相关进行母乳营养素和母体因素的相关性分析。
结 果
一、入组母婴的一般情况
入组产妇阴道分娩(60.67%)和初产(75.28%)较多,新生儿女性(52.81%)略高于男性。94.38%的产妇有本科、大专及以上学历,因此本次研究中产妇的教育背景较高。增重不足人数较少(15.73%),增重适宜(47.19%)和增重过多(37.08%)的人数较多,见表1。分析母体人口学和病史资料分析,母血总甘油三酯与母体孕前BMI(r=0.368,P<0.001)、产前BMI(r=0.317,P=0.002)有显著正相关关系,但与孕期增重与增重评级及年龄、孕周等资料均无关。未发现母血总胆固醇与母体因素有任何相关性。
表1 入组89对母婴的一般情况和血脂指标
Table 1 Characteristics and blood lipids index among 89 mother-infant pairs

Characteristics x±s/[n(%)]Age(y)28.7±3.3Pre-gestationBMI(kg/m2)23.54±4.28Pre-deliveryBMI(kg/m2)26.60±3.66Gestationalweightgain(kg)13.68±4.97Gestationalweeks(week)39.6±1.0Gestationalweightgainrating Insufficient14(15.73) Appropriate42(47.19) Excessive33(37.08)Deliverymode Cesarean35(39.33) Vaginal54(60.67)Educationalbackground Highschool5(5.62) Undergraduate75(84.27) Graduateandabove9(10.11)Parity 167(75.28) 2orabove22(24.72)Neonate′sgender Male42(47.19) Female47(52.81)Maternalbloodlipidsindex Totalcholesterol(mmol/L)6.10±1.04 Totaltriacylglycerol(mmol/L)2.69±1.03
二、不同哺乳阶段母乳中α-生育酚和宏量营养素、能量的含量
随着哺乳期进展,α-生育酚含量显著下降,从初乳到成熟乳α-生育酚含量发生56%左右的骤降(P<0.001);同时脂肪含量从初乳阶段上升了104%到成熟乳(P<0.001);乳糖和蛋白质在初乳和过渡乳阶段基本保持稳定而在成熟乳阶段发生轻度下降,与初乳相比,成熟乳蛋白质下降幅度23%,而乳糖仅仅下降8%,见表2。
表2 不同哺乳阶段母乳中宏量营养素和α-生育酚含量
Table 2 The concentrations of macronutrients and α-tocopherol in breast milk by lactation stage

MilknutrientsColostrumTransitionalmilkMaturemilkFat(g/dL)1.58±0.773.03±0.94∗3.23±1.19∗Protein(g/dL)1.29±0.461.20±0.290.99±0.31∗#Lactose(g/dL)7.54±1.117.62±1.016.95±1.38∗#Calorie(kcal/dL)49.50±9.2562.53±9.12∗61.12±9.52∗α-tocopherol(mg/L)9.72±5.224.58±1.81∗4.23±1.95∗
*P<0.05,compared to colostrum; #P<0.05,compared to transitional milk
三、母乳α-生育酚与宏量营养素的相关性
在控制了母体因素后发现,随着哺乳期进展,尽管母乳脂肪含量上升而α-生育酚含量下降,母乳脂肪与α-生育酚含量在初乳(r=0.509;P<0.001)和成熟乳阶段(r=0.278,P=0.033)明显正相关,在过渡乳阶段边缘性正相关(r=0.270,P=0.051)。未发现其他宏量营养素与母乳α-生育酚含量在三个哺乳阶段有任何相关性,见表3。
表3 不同阶段母乳α-生育酚与宏量营养素的偏相关分析†
Table 3 Partial correlation between milk levels of α-tocopherol and macro-nutrients during different lactation†
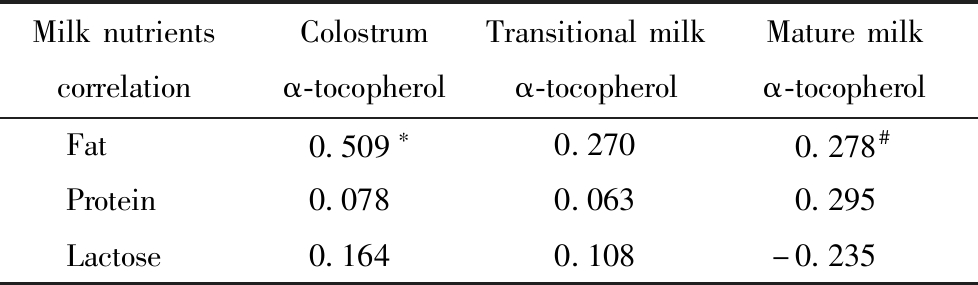
MilknutrientscorrelationColostrumα-tocopherolTransitionalmilkα-tocopherolMaturemilkα-tocopherol Fat0.509∗0.2700.278# Protein0.0780.0630.295 Lactose0.1640.108-0.235
*P<0.01; #P<0.05;†Adjusted by maternal BMI,gestational weight gain and blood lipids indexes.
四、母乳营养素与母体指标相关性分析
未发现母体年龄、产次、胎龄、胎儿性别等一般资料与母乳营养素含量存在有统计学意义的相关性。母体脂代谢因素(BMI、孕期增重及评级、血脂等)和不同阶段母乳营养素存在一定的相关性,见表4。
表4 母体指标与母乳营养素相关性分析
Table 4 Correlation between maternal indexes and nutrients contentin breast milk
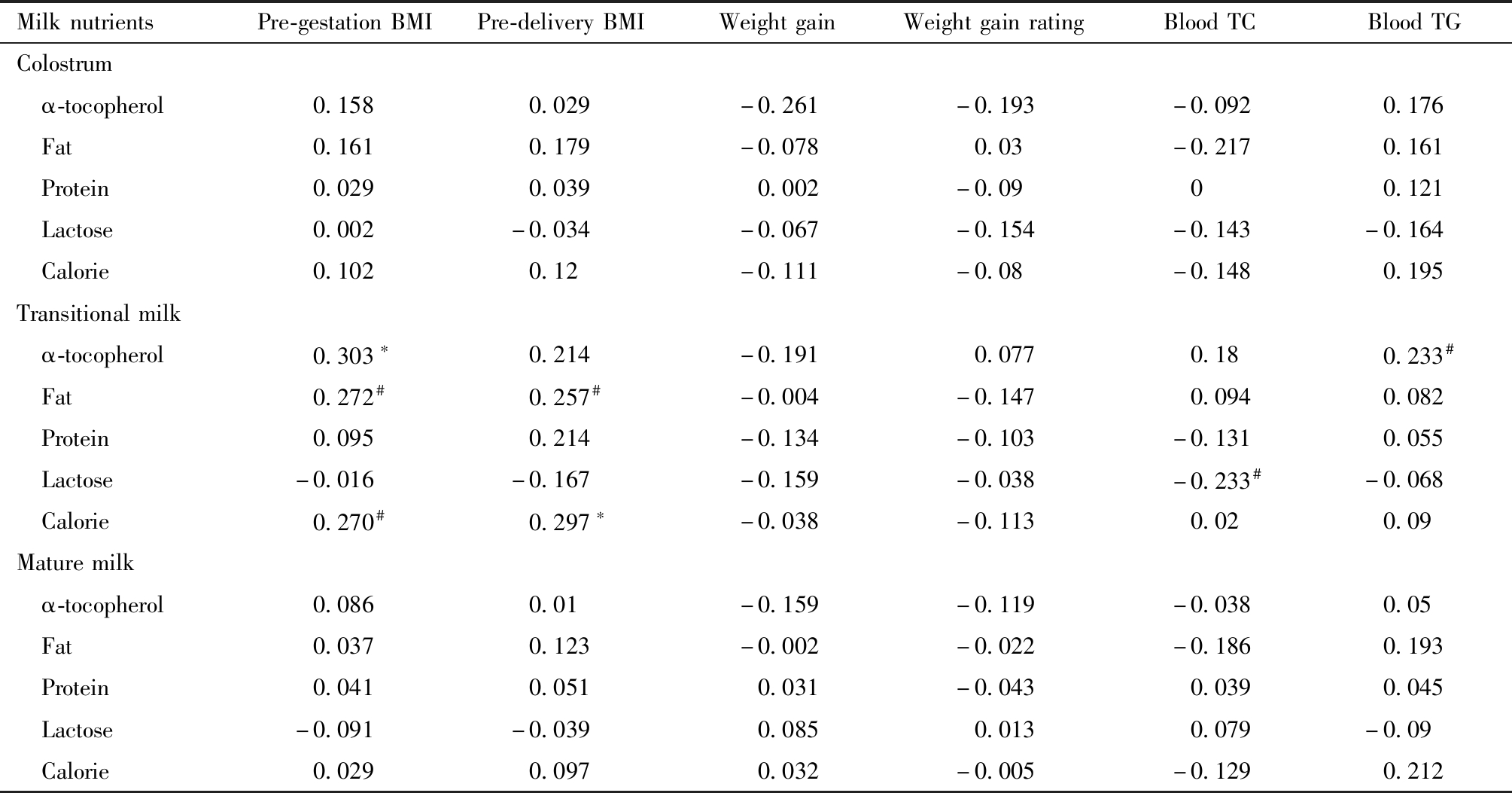
MilknutrientsPre-gestationBMIPre-deliveryBMIWeightgainWeightgainratingBloodTCBloodTGColostrum α-tocopherol0.1580.029-0.261-0.193-0.0920.176 Fat0.1610.179-0.0780.03-0.2170.161 Protein0.0290.0390.002-0.0900.121 Lactose0.002-0.034-0.067-0.154-0.143-0.164 Calorie0.1020.12-0.111-0.08-0.1480.195Transitionalmilk α-tocopherol0.303∗0.214-0.1910.0770.180.233# Fat0.272#0.257#-0.004-0.1470.0940.082 Protein0.0950.214-0.134-0.103-0.1310.055 Lactose-0.016-0.167-0.159-0.038-0.233#-0.068 Calorie0.270#0.297∗-0.038-0.1130.020.09Maturemilk α-tocopherol0.0860.01-0.159-0.119-0.0380.05 Fat0.0370.123-0.002-0.022-0.1860.193 Protein0.0410.0510.031-0.0430.0390.045 Lactose-0.091-0.0390.0850.0130.079-0.09 Calorie0.0290.0970.032-0.005-0.1290.212
*P<0.01;#P<0.05
孕前BMI与过渡乳中α-生育酚(r=0.303;P=0.007),脂肪含量(r=0.272;P=0.015)和能量(r=0.270;P=0.016)成正相关关系;分娩前BMI与过渡乳脂肪含量(r=0.257;P=0.022)和能量(r=0.297;P=0.008)成正相关;母血TG与过渡乳α-生育酚成正相关关系(r=0.233;P=0.041),母血TC与过渡乳乳糖负相关(r=-0.233;P=0.038)。并没有发现孕期增重和增重分级与母乳营养素存在相关性。
讨 论
α-生育酚是母乳中重要的脂溶性维生素,可以通过抗氧化、基因转录、免疫调节等机制影响儿童期乃至成人期的健康。最新研究指出,人类婴儿大脑选择性富集天然的RRR-α-生育酚(RRR-α-tocopherol,RRR),对婴幼儿大脑发育可能有重要意义[11]。妊娠期母体经胎盘转运给胎儿的α-生育酚非常有限,当分娩后,新生儿进入高氧环境而体内抗氧化屏障薄弱,此时母乳尤其是初乳的α-生育酚供给尤为重要[6]。
本研究中,α-生育酚水平从初乳阶段的9.72 mg/L骤降50%以上到过渡乳的4.58 mg/L和成熟乳的4.23 mg/L,与绝大多数西方报道水平非常接近(初乳8.86~15.0 mg/L,过渡乳2.26~4.45 mg/L,成熟乳2.07~5.68 mg/L)[6]。近年来,我国对母乳α-生育酚的研究较为有限,其中呼和浩特报道的初乳α-生育酚含量为(9.3 ±5.4)mg/L,与本研究基本相当,但其成熟乳(2.9 ± 1.5)mg/L低于本研究[12]。无锡地区103例纵向母乳研究的水平略低于本研究(初乳7.2 mg/L,过渡乳3.7 mg/L,成熟乳3.1 mg/L)[13],而杭州、兰州和北京进行的多中心研究的平均水平则明显低于本研究(初乳612.6 μg/100g,过渡乳 248.5μg/100g,成熟乳 177.1 μg/100g,1μg/100g相当于1mg/L×100),同时存在非常明显的地区差异[14]。文献报道上海地区孕产妇存在高维生素E补充剂摄入[15],其是否会影响乳汁中α-生育酚含量还有待于进一步研究。目前母乳α-生育酚影响因素尚未完全确认,要衡量中国母乳的适宜水平,除了膳食摄入外,可能还需要同时对母体影响因素(基因、膳食、脂代谢、人口学信息等)进行研究。
α-生育酚是脂溶性维生素,母乳研究中通常默认脂肪和α-生育酚含量正相关,使用脂含量校正α-生育酚,但与其他研究一致,本研究中随着α-生育酚的下降,母乳脂肪从初乳的1.58 g/dL上升到3.03-3.23 g/dL。过去的研究中认为,母乳脂肪和α-生育酚含量呈现截然相反的变化趋势,可能的原因除了从血浆到母乳转运通路不同外,还包括乳脂以脂肪球形式存在,甘油三酯分布在脂肪球内部,而外层是胆固醇、磷脂和脂溶性维生素组成的脂肪球膜,乳脂球粒径随哺乳期进展变大,甘油三酯含量相应增加,而球膜上的维生素相应稀释[16]。很少有研究对二者含量进行相关性分析,不过现有的研究数据[17]都佐证了本研究结果,不同阶段乳脂和α-生育酚含量成正相关关系。可能因为在对应的哺乳阶段,高脂母乳对应的乳脂球数量更多,因此相对应有较高的α-生育酚。
脂类是母乳中最容易受到母体膳食和其他因素影响的营养素。本研究未发现母婴一般情况与母乳营养素存在相关性,可能是因为严格限定了入组年龄以及单胎足月分娩的正常妊娠产妇。同时,研究发现母体长期脂代谢营养指标(BMI和血脂)与母乳脂肪及α-生育酚含量明显正相关,但却没有发现孕期增重及增重评级等短期指标有关联。可能的解释是:α-生育酚作为一种可以在人体储存的脂溶性维生素,其含量可能受到长期膳食和短期膳食的综合影响,其中长期膳食更能体现其膳食模式,母体BMI和血脂可以一定程度上提示长期的高脂肪和脂溶性维生素的摄入及机体水平,从而对母乳含量产生影响,而母体的短期摄入情况并不会明显影响乳汁成分。尽管本研究中提示高BMI与母乳营养素浓度有正相关关系,但有研究指出,高BMI产妇的泌乳量和全母乳喂养的概率都明显低于BMI较低的产妇[18-19],在之后的研究中应该同时收集母乳分泌量,再结合营养素浓度来计算不同BMI产妇的母乳营养素供给。
值得一提的是,在本研究中,母体脂代谢对母乳成分的影响主要体现在过渡乳阶段,这一现象在其他研究中也有发现。部分研究者认为,新生儿处于高营养需求期,母体会尽可能保证初乳营养素的供给,因此初乳的营养素往往不与母体营养状况相关,而过渡乳和成熟乳可能有关[6]。
乳糖和蛋白质是母乳中相对恒定的宏量营养素,受到母体因素的影响较小。本研究中,初乳和过渡乳期母乳的乳糖含量稳定在7.54~7.62 g/dL左右,在成熟乳阶段发生轻微下降(6.95 ± 1.38 g/dL),与苏州地区(6.81~7.48 g/dL)[20]和北京地区(6.67~7.47g/dL)[21]报道的各阶段乳糖值均基本相当。内蒙(6.65~6.97 g/dL)[22]和陕西(6.6 ± 1.5 g/dL)[23]也报道了类似的成熟乳乳糖含量,并且不受婴儿性别、乳汁收集月龄等母婴因素的影响。韩国[24]和日本[25]也同样发现了恒定在7mg/dL左右的乳糖水平。母乳中80%以上的乳糖是由乳腺直接摄取血浆中的葡萄糖和半乳糖而合成的,正常母体都可以提供充足的合成原料,因此母乳乳糖含量非常稳定,基本不受母体因素影响[26]。
本研究中母乳蛋白质从初乳和过渡乳的1.20~1.29 g/dL 降低到成熟乳阶段的0.99 g/dL,明显低于内蒙(1.20~1.33 g/dL)[22],韩国(2.2~1.5 g/dL)[24]和日本(1.25~1.84 g/dL)[25],陕西(1.5 g/dL)[23],但与苏州 (1.10~1.20 g/dL)[20]和北京(1.03~1.15 g/dL)[21]等发达地区报道的水平非常接近。充足的蛋白质对婴儿的生长发育至关重要,但乳蛋白摄入过多可以增加生命后期肥胖的发生风险。世界卫生组织和我国食品安全风险评估中心等机构和研究人员均指出,目前婴儿蛋白质摄入推荐量和婴儿配方奶粉的国际标准及中国标准设定值可能过高[27-28]。要确认合适的中国婴儿蛋白质需要量,可能需要更大范围的母乳蛋白质研究。
中国母乳宏量营养素水平与国外数据存在较大差异,α-生育酚报道有限且国内不同地区的研究结果各异。与其他城市相比,上海地区的人口密度大且组成丰富,降低了地域因素影响,更能反映中国的平均水平;同时,上海地区经济文化层次高,乳母膳食均衡且婴儿发育良好,母乳成分可能更加理想。本研究纳入高教育背景、营养状况良好的上海乳母,纵向收集母乳,分析宏量营养素和α-生育酚含量及影响因素,可能可以为开展下一步母婴营养研究提供新思路。
1 Pérez-Escamilla R,Buccini G S ,Segura-Pérez S,et al.Perspective:Should Exclusive Breastfeeding Still Be Recommended for 6 Months?Adv Nutr,2019,10:931-943.
2 Grenov B,Briend A,Sangild PT,et al.Undernourished Children and Milk Lactose.Food Nutr Bull,2016,37:85-99.
3 Slomski A.Human Milk Protein Prevents Infections in Preterm Infants.JAMA,2016,316:2078-2078.
4 Cook-Mills JM.Maternal influences over offspring allergic responses.Curr Allergy Asthma Rep,2015,15:501-510.
5 Sanchez-Hernandez D,Anderson G H,Poon A N,et al.Maternal fat-soluble vitamins,brain development,and regulation of feeding behavior:an overview of research.Nutr Res,2016,36:1045-1054.
6 Lima MS,Dimenstein R,Ribeiro KD.Vitamin E concentration in human milk and associated factors:a literature review.J Pediatr (Rio J),2014,90:440-448.
7 Dritsakou K,Liosis G,Valsami G,et al.The impact of maternal- and neonatal-associated factors on human milk′s macronutrients and energy.J Matern-fetal Neo M,2017,30:1302-1308.
8 Sosa-Castillo E,Rodriguez-Cruz M,Molto-Puigmarti C.Genomics of lactation:role of nutrigenomics and nutrigenetics in the fatty acid composition of human milk.Br J Nutr,2017,118:161-168.
9 Institute of Medicine (US) and National Research Council (US) Committee to Reexamine IOM Pregnancy Weight Guidelines.Weight Gain During Pregnancy:Reexamining the Guideline.National Academies Press,2009.
10 Jensen SK,Norgaard JV,Lauridsen C.Bioavailability of alpha-tocopherol stereoisomers in rats depends on dietary doses of all-rac- or RRR-alpha-tocopheryl acetate.Br J Nutr,2006,95:477-87.
11 Kuchan MJ,Jensen SK,Johnson EJ,et al.The naturally occurring alpha-tocopherol stereoisomer RRR-alphatocopherol is predominant in the human infant brain.Br J Nutr,2016,116:126-131.
12 方芳,李婷,李艳杰,等.呼和浩特地区母乳中脂溶性VA、VD、VE含量.乳业科学与技术,2014,37:5-7.
13 Wei W,Yang J,Xia Y,et al.Tocopherols in human milk:Change during lactation,stability during frozen storage,and impact of maternal diet.Int Dairy J,2018,84:1-5.
14 Jiang J,Xiao H,Wu K,et al.Retinol and alpha-tocopherol in human milk and their relationship with dietary intake during lactation.Food Funct,2016,7:1985-1991.
15 宓铭.上海市孕妇营养素补充剂摄入情况分析.卫生研究,2008,37:460-462.
16 Macias C,Schweigert FJ.Changes in the concentration of carotenoids,vitamin A,alpha-tocopherol and total lipids in human milk throughout early lactation.Ann Nutr Metab,2001,45:82-85.
17 Antonakou A,Chiou A,Andrikopoulos NK,et al.Breast milk tocopherol content during the first six months in exclusively breastfeeding Greek women.Eur J Nutr,2011,50:195-202.
18 Nazlee N,Bilal R,Latif Z,et al.Maternal Body Composition and Its Relationship to Infant BreastMilk Intake in Rural Pakistan.Food Nutr Sci,2011,2:932-937.
19 董胜雯.母乳喂养效能及乳汁成分含量与产妇体重指数的相关性研究.中国妇幼保健,2015,30:30-33.
20 王静.母乳营养成分纵向调查及其影响因素.苏州大学,2015.
21 郭倩颖,赵世隆,王勃诗,等.高学历产妇产后不同阶段母乳成分及喂养方式变化的随访.中国生育健康杂志,2017,28:6-9.
22 Shi YD,Sun GQ,Zhang ZG,et al.The chemical composition of human milk from Inner Mongolia of China.Food Chem,2011,127:1193-8.
23 曹敏辉,安琪,李艳,等.渭南市4317例母乳成分检测结果分析.中国儿童保健杂志,2016,24:739-741.
24 Chang N,Jung JA,Kim H,et al.Macronutrient composition of human milk from Korean mothers of full term infants born at 37-42 gestational weeks.Nutr Res Pract,2015,9:433-438.
25 Yamawaki N,Yamada M,Kan-No T,et al.Macronutrient,mineral and trace element composition of breast milk from Japanese women.J Trace Elem Med Biol,2005,19:171-181.
26 Sunehag A,Tigas S,Haymond M W.Contribution of plasma galactose and glucose to milk lactose synthesis during galactose ingestion.J Clin Endocrinol Metab,2003,88:225-229.
27 European Food Safety Authority.Scientific Opinion on the essential composition of infant and follow-on formulae.EFSA Journal,2014,12:3760.
28 房爱萍,吴尚灵,韩军花,等.婴幼儿配方食品中蛋白质适宜含量值的系统综述.营养学报,2018,40:7-16.