·妇幼保健·
巨大儿(fetal macrosomia)是指出生体重达到或超过4 000 g的新生儿。研究表明,与正常出生体重的新生儿相比,巨大儿发生母婴不良并发症的风险增加,同时会导致母亲剖宫产率的上升[1]。远期看,巨大儿成年后罹患肥胖、糖尿病、高血压、肿瘤等疾病的风险也会相应增加[1-3]。近年来,巨大儿的发生率逐年上升[4]。因此,降低巨大儿发生率对社会具有重要意义。
研究表明妊娠期糖尿病(gestational diabetes mellitus,GDM)、孕前超重及孕期增重过多均为影响巨大儿发生的危险因素[5-7]。针对妊娠期糖尿病,2011年美国糖尿病学会(American Diabetes Association,ADA)糖尿病诊断治疗指南推荐孕妇常规在妊娠24~28周进行口服糖耐量测试(oral glucose tolerance test,OGTT)诊断GDM;对已诊断GDM的孕妇,首先进行饮食和运动干预。如果饮食和运动不能将血糖控制在合理范围,则需使用胰岛素控制血糖[8]。GDM患者通过系统的生活方式管理,可以降低巨大儿等不良结局的发生率。但是,临床中部分GDM孕妇血糖控制满意,仍然会分娩巨大儿。有研究针对不同类型的糖尿病人群,探究孕期血糖情况与巨大儿的关系[9-11],但鲜有研究针对规范管理下血糖控制良好的GDM孕妇探讨其发生巨大儿的影响因素。因此进一步分析影响这些孕妇的新生儿体重的因素,对指导GDM孕妇的管理、进一步改善GDM患者妊娠结局具有重要临床意义。
本研究通过病例对照研究,探究影响GDM孕妇新生儿体重的相关因素,从而为进一步改善GDM孕妇的妊娠结局提供思路。
1.对象选择:利用医院病历系统对2016年1月1日至2016年12月31日在北京某三甲医院分娩的产妇进行检索,将符合纳入排除标准、诊断GDM、分娩巨大儿的全部70例产妇作为巨大儿组,并按照匹配标准进行1:1匹配选择70例符合纳入排除标准、诊断为GDM但分娩新生儿体重正常的产妇作为对照组。
2.纳入标准:(1)在本院规律产检和分娩,病历资料完整,且诊断GDM后进行饮食和运动的调整。(2)单活胎。(3)分娩孕周为37~42周。(4)诊断GDM后规范管理,空腹血糖控制在3.3~5.3 mmol/L,餐后2小时血糖控制在4.4~6.7 mmol/L之间。(5)两组新生儿体重:巨大儿组新生儿出生体重≥4 000 g,对照组新生儿出生体重在2 500~3 999 g之间。
3.排除标准:(1)孕前患有高血压、糖尿病、器质性心脏病、肾病等、妊娠期间诊断的严重器质性疾病等可能影响胎儿发育的疾病;(2)诊断前置胎盘等影响孕期活动的疾病;(3)新生儿缺陷。
4.对照组的匹配标准:(1)匹配年龄:年龄±3岁。(2)匹配胎龄:妊娠天数±6 d。(3)匹配分娩时间:分娩月份相同。
1.资料收集:采用资料回顾的方法,从医疗病历中采集数据。内容包括:(1)产妇的基本资料:年龄、身高、孕前体重、受孕方式、产次、有无GDM病史、有无巨大儿分娩史;(2)不同孕周的体重及对应产检日期:末次月经(记为T0)、孕前体重(记为W0)、孕妇妊娠12~16周产检的体重及日期(记为W1和T1)、OGTT时体重及日期(记为WOG和TOG)、妊娠28~30周体重及日期(记为W2和T2)、分娩前体重及日期(记为Wd和Td);(3)孕期血糖情况,包括孕早期空腹血糖、OGTT结果、糖化血红蛋白等指标。
2.指标定义:孕期增重是随孕周动态变化的数据。既往研究中通常采取两次产检的体重差计算特定孕期的体重增长,但因各人产检的实际孕周不同,体重差存在孕周差异,本研究采用两次产检的体重差除以两次产检间隔天数衡量特定孕期的体重增长情况,将孕期分为孕早期(0~12周)、孕中期(13~28周)、孕晚期(29~37周)三个阶段,根据产检数据计算出孕前BMI(BMI=W0/身高2)[12]、孕期总增重(GWG,Wd-W0)、孕早期周均增重(W1-W0/T1-T0)×7、孕中期周均增重(W2-W1/ T2-T1)×7、孕晚期周均增重(Wd-W2/ Td-T2)×7。根据早孕期周均增重和孕中期周均增重,计算孕妇妊娠24周需要进行OGTT时的体重增加,定义为OGTT前总增重。计算方法:孕早期周均增重×12+孕中期周均增重×12。
根据微积分原理,以近似梯形面积计算OGTT曲线下面积,计算方法为:AUC=空腹血糖/2+餐后1 h血糖+餐后2 h血糖/2。对测定空腹血糖和空腹胰岛素水平的孕妇,通过稳态模型计算胰岛素抵抗指数(HOMA-IR),HOMA-IR =空腹血糖(FPG,mmol/L)×空腹胰岛素(FINS,μU/mL)/22.5[13]。
3.统计方法:利用Excel和SPSS 26.0统计软件进行录入和分析。根据资料类型及分布,采用描述性统计、两组均数t检验、χ2检验、Mann-Whitney检验、多因素Logistic回归分析等方法对数据进行处理和分析。根据K-S正态检验的结果,对符合正态分布的数据用![]() 描述,不符合正态分布的数据用中位数(四分位数间距)描述。多因素Logistic回归分析时,将已知孕前高危因素及单因素分析P<0.1的变量作为自变量,是否发生巨大儿作为因变量,采用Backward:LR法筛选分娩巨大儿的影响因素。P<0.05为差异具有统计学意义。
描述,不符合正态分布的数据用中位数(四分位数间距)描述。多因素Logistic回归分析时,将已知孕前高危因素及单因素分析P<0.1的变量作为自变量,是否发生巨大儿作为因变量,采用Backward:LR法筛选分娩巨大儿的影响因素。P<0.05为差异具有统计学意义。
140名孕妇按照孕前BMI分组发现,孕前BMI(18.5~23.9 kg/m2)正常的孕妇娩出巨大儿比例为44.3%(39/88),超重及肥胖孕妇(BMI≥24 kg/m2)分娩巨大儿比例为63.0%(29/46),偏瘦(BMI<18.5 kg/m2)孕妇娩出巨大儿比例为33.3%(2/6),三者比较有统计学差异。
巨大儿组产妇孕前BMI超重或肥胖(BMI≥24 kg/m2)的比例显著高于对照组,差异有统计学意义。巨大儿组和对照组的孕妇在是否高龄(年龄≥35岁)、是否经产妇、妊娠方式及新生儿性别构成上均无统计学差异。具体见表1。
表1 两组产妇一般资料比较
Table 1 Demographic characteristics for cases and controls
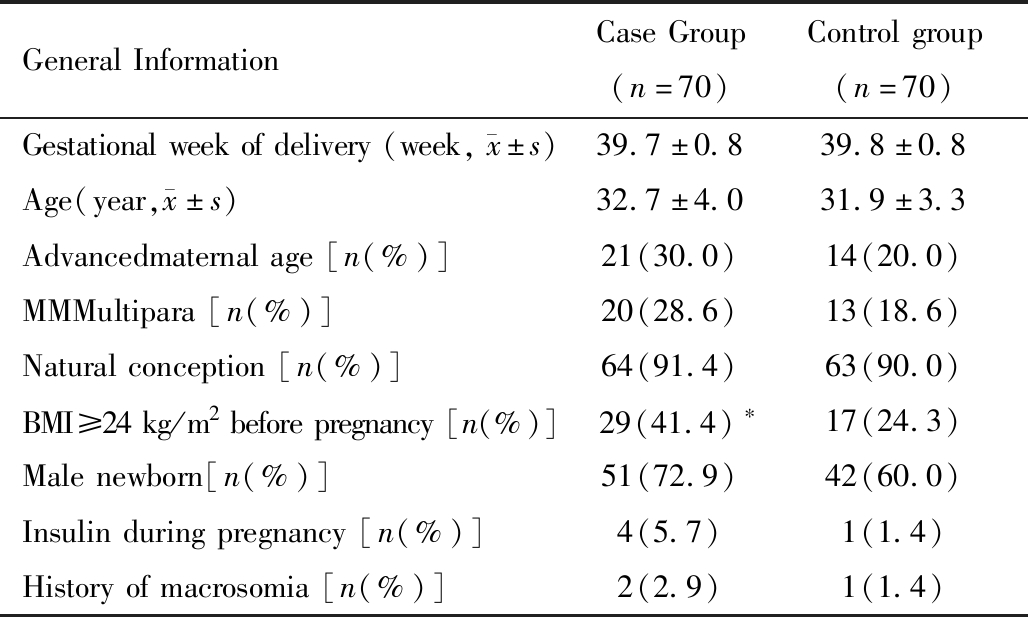
GeneralInformationCaseGroup(n=70)Controlgroup(n=70)Gestationalweekofdelivery(week, x±s)39.7±0.839.8±0.8Age(year, x±s)32.7±4.031.9±3.3Advancedmaternalage[n(%)]21(30.0)14(20.0)MMMultipara[n(%)]20(28.6)13(18.6)Naturalconception[n(%)]64(91.4)63(90.0)BMI≥24kg/m2beforepregnancy[n(%)]29(41.4)∗17(24.3)Malenewborn[n(%)]51(72.9)42(60.0)Insulinduringpregnancy[n(%)]4(5.7)1(1.4)Historyofmacrosomia[n(%)]2(2.9)1(1.4)
note:compared with control group,*P<0.05
巨大儿组产妇早期测定空腹血糖者67例,对照组64例,两组之间比较t检验无统计学差异。两组产妇OGTT的血糖结果比较如表2所示,巨大儿组OGTT时空腹血糖高于对照组,且有统计学意义。孕早期空腹血糖及糖化血红蛋白因缺失较多,未进行统计分析。
表2 两组产妇孕期血糖情况比较![]()
Table 2 Summary of OGTT results for ![]()
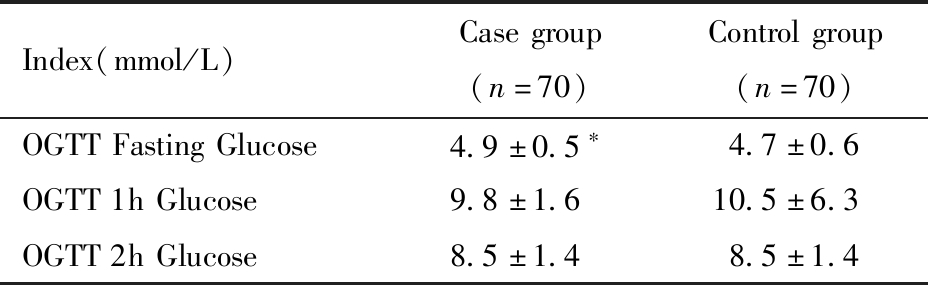
Index(mmol/L)Casegroup(n=70)Controlgroup(n=70)OGTTFastingGlucose4.9±0.5∗4.7±0.6OGTT1hGlucose9.8±1.610.5±6.3OGTT2hGlucose8.5±1.48.5±1.4
note:compared with control group,*P<0.05
巨大儿组产妇的孕期总增重为(13.0±4.3)kg,对照组为(9.9±7.5)kg,差异具有统计学意义。结果如表3所示,巨大儿组的孕期总增重显著高于对照组;两组孕早、中期以及OGTT前的周均增重也是巨大儿组高于对照组,差异具有统计学意义;孕晚期的周均增重无统计学差异。
表3 两组产妇孕期体重增加情况比较![]()
Table 3 Summary of gestational weight gain for cases and controls ![]()

IndexCasegroup(n=70)Controlgroup(n=70)TotalWeightGain(kg)13.0±4.3∗9.9±7.5WeightGainperweekin1stTrimester(g)△80.1(16.7)∗0(9.7)WeightGainperweekin2ndTrimester(g)508.3±190.3∗421.2±167.7WeightGainperweekin3rdTrimester(g)△429.2(31.0)∗371.7(23.0)
note:compared with control group, *P<0.05;△Median (interquartile range)
多因素Logistic回归分析,最终进入方程的变量包括孕早期周均增重、孕中期周均增重、OGTT空腹血糖、孕前BMI≥24 kg/m2。回归结果显示孕早期周均增重、孕中期周均增重及孕前BMI≥24 kg/m2为巨大儿的危险因素,P均<0.05。详见表4。
表4 GDM孕妇分娩巨大儿危险因素的Logistic回归分析
Table 4 Associations between multiple risk factors and macrosomia in GDM patients,estimated by a logistic regression model
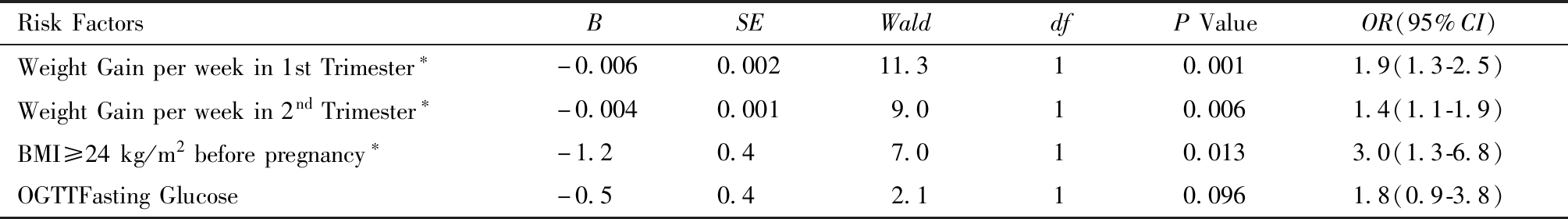
RiskFactorsBSEWalddfPValueOR(95%CI)WeightGainperweekin1stTrimester∗-0.0060.00211.310.0011.9(1.3-2.5)WeightGainperweekin2ndTrimester∗-0.0040.0019.010.0061.4(1.1-1.9)BMI≥24kg/m2beforepregnancy∗-1.20.47.010.0133.0(1.3-6.8)OGTTFastingGlucose-0.50.42.110.0961.8(0.9-3.8)
note:*P<0.05
140例产妇中,52例产妇在测量OGTT时同时测定了空腹血糖和空腹胰岛素水平。通过稳态模型计算HOMA-IR,显示HOMA-IR对于预测巨大儿的ROC曲线下面积为0.839(P<0.001)。
对该52例产妇的OGTT前总增重与HOMA-IR进行Kendall相关分析,两者呈正相关,相关系数为0.26,P=0.006。HOMA-IR与孕前BMI的Pearson相关系数为0.51,P<0.001。
研究表明,妊娠晚期是胎儿生长最迅速、胎体内储存营养素最多、孕妇代谢和组织增长的最高峰,而胰岛素抵抗也在妊娠晚期最明显[14]。因而,临床中也更加重视妊娠晚期的体重增加,并且重视控制孕期的总增重。对于GDM孕妇的孕期管理,目前各大指南也主要强调在妊娠24~28周进行OGTT试验后,对于诊断为GDM的孕妇进行饮食和运动的调整。而进行这些调整时,孕妇也即将或已经进入妊娠晚期。
本研究显示即使规范管理的GDM孕妇,即在妊娠晚期进行了系统的饮食和运动的生活方式调整、血糖控制良好的孕妇,仍然会分娩巨大儿。而妊娠早期和妊娠中期的体重增加是这些GDM孕妇分娩巨大儿的独立危险因素。本研究中尽管仅有52例产妇在OGTT时测定了空腹胰岛素,但结果显示预期HOMA-IR预测GDM巨大儿的曲线下面积高达0.84。而更值得注意的是,孕前BMI和24周前的体重增加均和HOMA-IR呈正相关。说明孕妇在因为基因、肥胖等各种因素造成的可能增加胰岛素抵抗的背景下,妊娠早中期过度的体重增加造成过度的脂肪细胞堆积,加重孕期的胰岛素抵抗,从而造成了GDM的发生,并且即使晚孕期合理控制体重和血糖也并不一定能避免巨大儿的结局。且本研究表明,无论对于孕前BMI正常的孕妇,还是超重的孕妇,妊娠中期的过度增重都是分娩巨大儿的危险因素。有很多研究表明,过度的脂肪堆积可以影响一系列细胞因子,从而导致胰岛素抵抗[14-15]。这些研究佐证了本研究结果的理论基础。以往的临床工作和指南重点强调控制孕期总增重和妊娠晚期增重,而本研究结果说明妊娠早、中期的体重管理更为重要。
本研究结果中孕前正常BMI的妇女娩出巨大儿的比例为44.32%。尽管研究表明孕前超重的GDM产妇更容易分娩巨大儿,但是由于育龄妇女中正常体重范围的女性比例更高,因而临床工作中并不能忽视孕前BMI正常孕妇的妊娠早期和中期的管理。最新流行病学显示中国15~49岁育龄妇女营养不良率6.9%,超重率与肥胖率分别为25.4%和9.2%[16],中国孕前BMI在正常范围内的孕妇基数大,远超于超重及肥胖人群,因此针对BMI正常的孕妇进行体重管理具有实际意义。
现在很多医疗机构均利用孕妇学校,向孕妇进行孕期体重和生活方式的宣教,但何时进行并无统一要求。本研究提示,孕期营养和体重控制应该在妊娠早期即开始进行。而对于孕期体重控制不好的孕妇,应该利用助产士门诊或者医生产检的过程,进行早期更严格的管理,从而更好地改善GDM孕妇的妊娠结局。
结论:降低GDM孕妇巨大儿的发生率,不仅需要在诊断后进行系统的孕晚期管理,而且应该从妊娠确立的早期即开始进行系统的生活方式和体重的管理。尤其对于孕前超重的孕妇,更应该加强孕期的全程管理。
1 万里,朱萍.巨大儿对母婴健康不良影响的研究进展.中国计划生育和妇产科,2018,10:33-37.
2 Yu Z,Sun JQ,Haas JD,et al.Macrosomia is associated with high weight-for-height in children aged 1-3 years in Shanghai,China.Int J Obes (Lond),2008,32:55-60.
3 Wang Y,Gao E,Wu J,et al.Fetal macrosomia and adolescence obesity:results from a longitudinal cohort study.Int J Obes (Lond),2009,33:923-928.
4 Koyanagi A,Zhang J,Dagvadorj A,et al.Macrosomia in 23 developing countries:an analysis of a multicountry,facility-based,cross-sectional survey.Lancet,2013,381:476-483.
5 张淙越,苏世萍,刘春红.口服葡萄糖耐量试验时间-血糖曲线的曲线下面积及体质指数与妊娠期糖尿病孕妇围产结局的关系.中华妇产科杂志,2015,9:658-663.
6 Jolly M C,Sebire N J,Harris J P,et al.Risk factors for macrosomia and its clinical consequences:a study of 350,311 pregnancies.Eur J Obstet Gynecol Reprod Biol,2003,111:9-14.
7 Alberico S,Montico M,Barresi V,et al.The role of gestational diabetes,pre-pregnancy body mass index and gestational weight gain on the risk of newborn macrosomia:results from a prospective multicentre study.BMC Pregnancy Childbirth,2014,14:23.
8 Committee on Practice Bulletins—Obstetrics.ACOG Practice Bulletin No.190:Gestational Diabetes Mellitus.Obstet Gynecol,2018,131:49-64.
9 Combs CA,Gunderson E,Kitzmiller JL,et al.Relationship of fetal macrosomia to maternal postprandial glucose control during pregnancy.Diabetes Care,1992,15:1251-1257.
10 Hillier TA,Pedula KL,Vesco KK,et al.Excess gestational weight gain:modifying fetal macrosomia risk associated with maternal glucose.Obstet Gynecol,2008,112:1007-1014.
11 Page RC,Kirk BA,Fay T,et al.Is macrosomia associated with poor glycaemic control in diabetic pregnancy?.Diabetic Medicine,1996,13:170-174.
12 中华人民共和国卫生和计划生育委员会.Ws/T428-2013成人体重判定中华人民共和国卫生行业标准《成人体重判定》.北京:中国标准出版社,2013.
13 Wallace T,Levy J,Matthews D.Use and abuse of HOMA modelling.Diabetes care,2004,27:1487-1495.
14 Fasshauer M,Blüher M,Stumvoll M.Adipokines in gestational diabetes.Lancet Diabetes Endocrinol,2014,2:488-499.
15 Galic S,Oakhill JS,Steinberg GR.Adipose tissue as an endocrine organ.Mol Cell Endocrinol,2010,316:129-139.
16 房红芸,赵丽云,琚腊红,等.中国15~49岁育龄妇女营养不良及超重肥胖状况分析.中国公共卫生,2018,34:1229-1232.