多囊卵巢综合征(Polycystic Ovary Syndrome,PCOS)是育龄期妇女最常见的内分泌代谢性疾病,临床上常以月经异常、不孕、多毛、卵巢多囊样改变为主要表现,是导致妇女无排卵性不孕的主要原因,其发生率为5%~10% [1]。目前治疗PCOS患者无排卵或者稀发排卵的首选方案是药物诱排。治疗的一线药物是克罗米芬(Clomiphene citrate,CC),但是约20%~25%的妇女会出现CC抵抗导致诱排失败[2]。另外,CC存在外周抗雌激素效应,影响子宫内膜的生长及宫颈粘液的分泌,不利于精子穿行,从而降低妊娠率[3-4]。
对于CC抵抗的PCOS患者,外源性促性腺激素(Gonadotropin,Gn)是二线促排卵药[5]。但是Gn导致多卵泡发育,多胎妊娠以及卵巢过度刺激综合征的风险较高。因此,生殖医生一直在探索尝试安全有效的促排卵方案。来曲唑(Letrozole,LE)是第三代芳香化酶抑制剂,近年来广泛用于促排卵。由于LE无外周抗雌激素效应以及具有诱导单卵泡发育的优势,因此LE被认为可以替代CC作为一线排卵药[6-7]。针对CC抵抗的PCOS患者,课题组前期研究采用LE联合尿促性腺激素(Human menopausal gonadotropins,HMG)治疗 PCOS患者,发现其不仅排卵率高,而且促排时间短,所需Gn剂量低,因卵巢过度刺激风险的取消率低[8]。但是目前很少有研究关注LE+HMG促排卵中HMG不同添加时机对助孕结局的影响。本研究通过回顾性分析LE+HMG促排卵方案中早卵泡期和中卵泡期添加HMG的疗效以及安全性差异,探索更好的用药方案,以便获得更优的临床结局。
对象与方法
1.研究对象:选择2015年1月到2018年12月期间于本院生殖中心接受LE+HMG(珠海丽珠制药)促排卵并指导同房的162例CC抵抗(指CC最大剂量达100 mg/d,共3个周期仍不排卵者)的PCOS患者。PCOS诊断参照美国生殖医学学会鹿特丹工作组修正的标准:(1)月经稀发(月经周期≥35 d并<6个月)或闭经(无阴道出血至少6个月);(2)高雄激素的临床表现和(或)生物化学表现;(3)卵巢的多囊样改变:一侧或双侧卵巢直径在2~9 mm的卵泡≥12个,和(或)卵巢体积≥10 mL。上述3条中符合2条,并排除其他高雄激素病因,如先天性肾上腺皮质增生、库欣综合征、分泌雄激素的肿瘤。纳入标准如下:(1)患者符合PCOS诊断;(2)年龄<35岁;(3)婚后有正常性生活,未避孕,至少2年未孕;(4)经输卵管造影(HSG)检查证实至少一侧输卵管通畅;(5)B超检查无卵巢囊肿;(6)男方精液检查正常。
2.分组:每例患者在月经来潮或者孕激素撤退性出血的第3~5天,接受LE 5 mg,共5 d。根据开始接受HMG的时机不同分为早卵泡期添加组(n=95)和中卵泡期添加组(n=67)。
3.用药方案:早卵泡期添加组在口服LE同时,于月经第5天开始加用HMG 75 U/隔日,7 d后如无优势卵泡(>10 mm)发育,HMG剂量增加至75 U/日,后每周剂量增加37.5 U。中卵泡期添加组口服LE后于月经周期第11~12天开始添加HMG 75 U/隔日,后剂量增加同早卵泡期添加组。B超监测卵泡发育、子宫内膜厚度和形态。当最大卵泡平均直径(MFD)≥18 mm时酌情注射人绒毛膜促性腺激素(HCG)10 000 U,并且指导同房。同时记录HCG注射日≥12 mm卵泡数、≥18mm卵泡数、子宫内膜厚度、内膜形态。B超示:MFD≥18 mm的卵泡多于3个,或者有7个以上MFD≥12 mm,取消HCG注射。月经周期第28~35天如无优势卵泡发育则终止周期,认为卵巢反应不良。如促排卵后患者出现腹胀、恶心呕吐、胸闷气短甚至少尿等症状;B超提示卵巢增大(直径大于5cm),胸腹腔积液;实验室检查提示红细胞比积升高,低蛋白血症认为卵巢过度刺激综合征(Ovarian hyperstimulation syndrome ,OHSS)。排卵后15 d尿HCG阳性提示妊娠,35 d阴道超声检查宫腔内有胎心搏动确诊为临床妊娠。
4.内分泌测定:均于月经周期第2~5天清晨空腹采集肘静脉血,离心收集血清,采用电化学发光法测定卵泡刺激素(FSH)、黄体生成素(LH)、睾酮(T)、雌二醇(E2)、空腹胰岛素(FINS);采用葡萄糖氧化酶法测定空腹血糖(FPG)。试剂均来自罗氏公司。胰岛素抵抗指数(HOMA-IR)=FINS×FPG/22.5。
5.统计学方法:采用 SPSS17.0软件包进行统计分析实验数据。计量资料以![]() 表示,采用t检验。计数资料用百分比表示,统计分析采用χ2检验。P<0.05认为差异有统计学意义。
表示,采用t检验。计数资料用百分比表示,统计分析采用χ2检验。P<0.05认为差异有统计学意义。
结果
1.两组促排卵方案患者一般情况的比较:共162例PCOS患者纳入本研究,年龄范围 22~ 36岁,平均年龄为(27.3±3.3)岁,平均BMI (24.4±2.5)kg/m2。两组患者的年龄、BMI、不孕时间、月经紊乱类型(月经稀发或闭经)、HOMA-IR、血LH和T水平无统计学差异。两组患者B超均显示多囊卵巢(Polycystic Ovary,PCO)改变。见表1。
表1 两组患者的一般情况分析
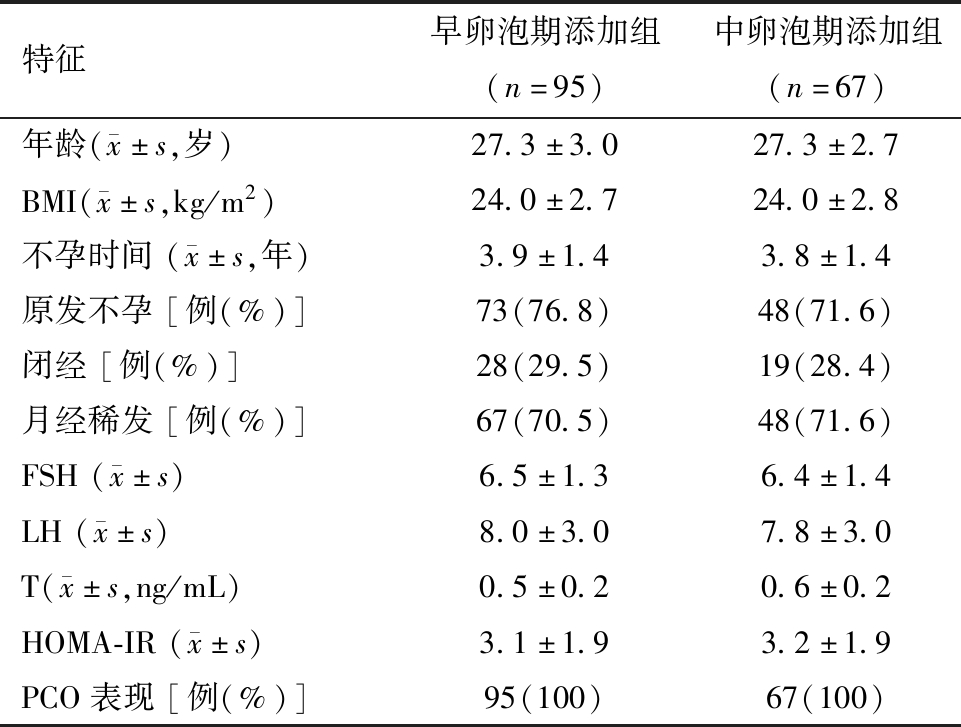
特征早卵泡期添加组(n=95)中卵泡期添加组(n=67)年龄( x±s,岁)27.3±3.027.3±2.7BMI( x±s,kg/m2)24.0±2.724.0±2.8不孕时间( x±s,年)3.9±1.43.8±1.4原发不孕[例(%)]73(76.8)48(71.6)闭经[例(%)]28(29.5)19(28.4)月经稀发[例(%)]67(70.5)48(71.6)FSH( x±s)6.5±1.36.4±1.4LH( x±s)8.0±3.07.8±3.0T( x±s,ng/mL)0.5±0.20.6±0.2HOMA-IR( x±s)3.1±1.93.2±1.9PCO表现[例(%)]95(100)67(100)
注:BMI=身体质量指数;FSH=促卵泡生成素;LH=黄体生成素;T=雄激素;HOMA-IR=胰岛素抵抗指数
2.两组促排卵方案结局的比较:162例PCOS妇女完成139个诱排周期。有11例因OHSS风险取消周期。12例因卵巢无反应取消周期。早卵泡期添加组和中卵泡期添加组分别有5例(5.3%)和6例(9.0%)因为OHSS风险取消周期,两组没有统计学差异。早卵泡期添加组和中卵泡期添加组因为卵巢无反应取消的分别为4例(4.2%)和8例(11.9%),虽然中卵泡期添加组取消率高于早卵泡期添加组,但差异没有统计学意义。早卵泡期添加组诱排时间及HMG剂量明显低于中卵泡期添加组(P<0.01)。两组的HCG日子宫内膜厚度、E2 水平及妊娠率无差异(P>0.05)。早卵泡期添加组排卵率高于中卵泡期添加组(90.1%比79.1%),但无统计学差异。见表2。
表2 早卵泡期添加组和中卵泡期添加组的促排卵结局比较
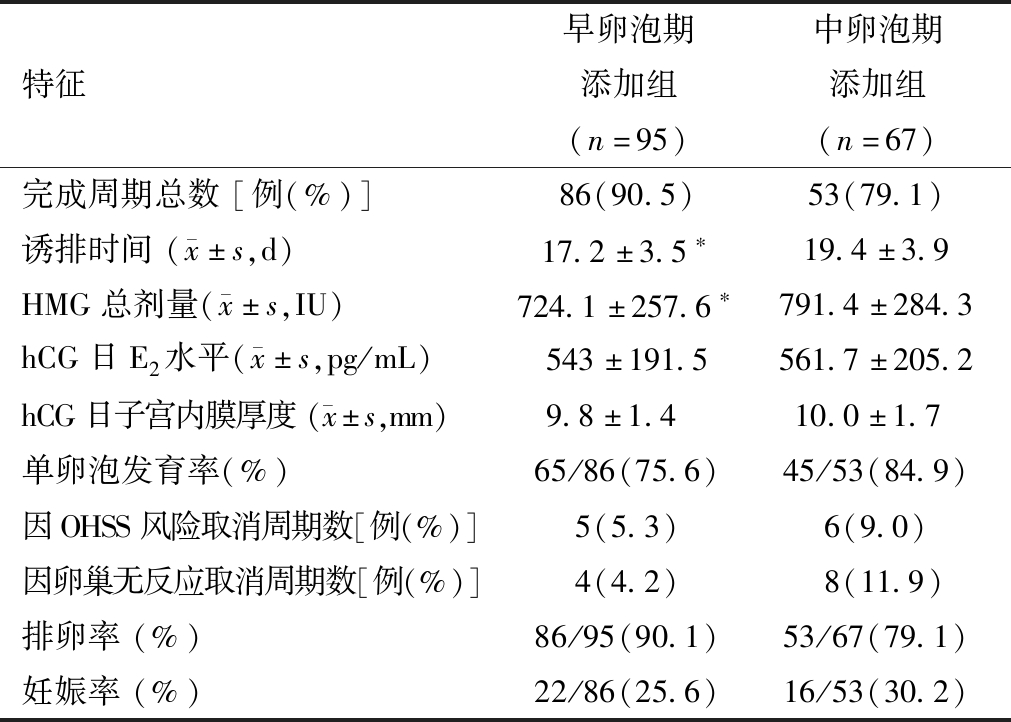
特征早卵泡期添加组(n=95)中卵泡期添加组(n=67)完成周期总数[例(%)]86(90.5)53(79.1)诱排时间( x±s,d)17.2±3.5∗19.4±3.9HMG总剂量( x±s,IU)724.1±257.6∗791.4±284.3hCG日E2水平( x±s,pg/mL)543±191.5561.7±205.2hCG日子宫内膜厚度( x±s,mm)9.8±1.4 10.0±1.7 单卵泡发育率(%)65/86(75.6)45/53(84.9)因OHSS风险取消周期数[例(%)]5(5.3)6(9.0)因卵巢无反应取消周期数[例(%)]4(4.2)8(11.9)排卵率(%)86/95(90.1)53/67(79.1)妊娠率(%)22/86(25.6)16/53(30.2)
注:E2 =雌激素;hCG=人绒毛促性腺激素;与中卵泡期添加组比较,*P<0.01
讨论
在正常排卵周期中,FSH于黄体晚期开始升高,当FSH水平超过卵泡发育的阈值时,FSH窗打开,一群具有FSH受体的卵泡离开静止卵泡池,开始生长发育。之后由于卵泡生长产生的雌激素和抑制素B的负反馈作用,使FSH水平开始下降,到阈值以下时FSH窗关闭。此时,发育最快、最敏感的优势卵泡较少依赖FSH,进入LH依赖期继续发育,其余募集的窦卵泡由于FSH的下降不足以支持他们继续发育而闭锁。因此,FSH及时下降,持续有限的时间是自然周期单卵泡发育的关键。该理论机制指导了临床的促排卵治疗。比如在卵泡早期添加FSH,使之超过许多卵泡的阈值,使这些卵泡都进入生长轨道。在中、晚卵泡期添加FSH,有效地防止了FSH的下降,挽救即将闭锁的中、小卵泡,促使它们进一步发育,从而诱发了多个卵泡的生长。
对于不准备行IVF的PCOS患者,诱导排卵的主要目的是在保证排卵率和妊娠率的前提下,使用更少的促排卵药物,促使单卵泡发育,以降低多胎妊娠和OHSS的风险。尤其对CC抵抗的PCOS患者,诱排的安全范围比较窄,很容易出现无反应或者过度反应。虽然推荐的二线治疗方案为外源性的促性腺激素促排,但是其导致多卵泡发育、多胎妊娠以及OHSS的风险仍高。课题组近期的研究发现LE联合HMG促排卵治疗CC抵抗的PCOS患者,不仅排卵率高,而且因OHSS风险取消率低,该方案优于单用HMG[8]。基于上述HMG不同添加时机导致不同的助孕结局,猜测早卵泡期添加Gn优于中、晚卵泡期添加者,但目前尚没有研究证实。因此本研究中比较了LE+HMG促排卵时早卵泡期添加HMG与中卵泡期添加助孕结局是否有差异。结果显示:早卵泡期添加组因为卵巢无反应取消率(4.2%)低于晚卵泡期添加组(11.9%),但差异没有统计学差异。两组因OHSS风险的取消率分别是5.3%和9.0%,没有统计学差异。但早卵泡期添加组的促排卵时间及HMG剂量明显低于中卵泡期添加组(P<0.01)。两组的妊娠率无差异。可以认为对于CC抵抗的PCOS患者,早期开始添加HMG促排卵可以缩短助孕时间,减少促排卵药物的剂量,是一种安全经济的促排卵方案。
杨学周等[9]探讨了采用CC+HMG促排时自早卵泡期或中晚卵泡期加入HMG对PCOS不孕患者的治疗效果。结果提示早卵泡期低剂量HMG序贯方案的HMG用量、用药天数和中小卵泡数明显少于中晚卵泡期方案,前者卵巢反应不良的发生率明显低于后者,与本研究结果基本一致。但与本研究结果不同的是,国外学者Cedrin-Durnerin[10]等以正常排卵的不孕妇女作为研究对象,随机分为两组,分别于月经周期的第2~6天(早卵泡组)和第7~11天 (中晚卵泡组) 给予rFSH 112.5 IU,连续5 d,并分别于月经第2、7、12天B超监测。结果显示,早卵泡组2个以上≥14 mm的卵泡的发生率远小于后者 (4% 比 42%)。但早卵泡组有8个周期因为过度反应而终止治疗,而中晚卵泡组只有1例取消。作者认为在正常排卵的妇女中,中晚期添加Gn阻止FSH窗的关闭比早卵泡期添加更有利于控制成熟卵泡的数量。
本研究结果与Cedrin-Durnerin等[10]的研究结论相反,分析原因认为有以下三方面:首先,研究对象不同。本研究以CC抵抗的PCOS患者作为研究对象,而PCOS患者LH水平升高为其临床特征之一,如果PCOS患者在促排中血FSH不能及时超过卵泡发育的阈值,很容易出现LH提前升高,升高的LH超过发育卵泡的上限值而使其闭锁。所以在本研究中,早卵泡期添加HMG可以使FSH尽快达到卵泡发育的阈值,出现优势卵泡的选择,也缩短了促排卵的时间和减少促排药物的剂量。而Cedrin-Durnerin以正常排卵妇女为研究对象,根据上述的正常排卵周期中晚卵泡期FSH开始下降,此时添加外源性的FSH,可以人为阻止FSH下降,进一步阻止将要闭锁的卵泡,从而导致多个卵泡发育。因此,正常月经周期与无排卵月经周期在促排卵时卵泡发育的特征以及激素变化不同,决定了促排卵后不同的结局;其次,在Cedrin-Durnerin等研究中,早卵泡期rFSH启动的剂量112.5 IU,远大于本研究中采用的HMG 75 IU/隔日。早期较大剂量的rFSH可使卵泡募集过多,而诱发多个卵泡发育,导致因OHSS风险取消的发生率相应增高。最后,在本研究以LE联合HMG促排,LE作为第三代非甾体高效选择性的芳香化酶抑制剂,其通过抑制芳香化酶活性,阻碍雄激素向雌激素转化,降低体内雌激素水平,从而解除雌激素对下丘脑和垂体的负反馈作用,使内源性促性腺激素分泌增加,促进卵泡发育。由于LE并未消耗雌激素受体(ER),并且LE口服后半衰期相对较短(约45 h),能很快从体内消除,正常负反馈机制未受损。随着优势卵泡生长,雌激素合成增加,产生负反馈使FSH受抑制,小的生长卵泡闭锁,而出现单个优势卵泡发育。因此认为即使LE联合HMG,仍比其他方案具备单卵泡发育的优势,可降低OHSS风险。
综上所述,对于CC抵抗的患者,使用LE联合HMG促排时,早期低剂量HMG序贯的促排卵方案,相对于中卵泡期加用HMG的方案,更加有效、安全、经济。在CC抵抗的PCOS诱导排卵治疗中可优先考虑使用。
1 Norman RJ,Dewailly D,Legro RS,et al.Polycystic ovary syndrome.Lancet,2007,370:685-697.
2 Tanbo T,Mellembakken J,Bjercke S.et al.Ovulation induction strategies in polycystic ovary syndrome.Acta Obstet Gynecol Scand,2019,98:263.
3 Gadalla MA,Huang S,Wang R,et al.Effect of clomiphene citrate on endometrial thickness,ovulation,pregnancy and live birth in anovulatory women:systematic review and meta-analysis.Ultrasound Obstet Gynecol,2018,51:64-76.
4 Amer SA,Smith J,Mahran A.et al.Double-blind randomized controlled trial of letrozole versus clomiphene citrate in subfertile women with polycystic ovarian syndrome.Hum Reprod,2017,32:1631-1638.
5 Weiss NS,Kostova E,Nahuis M,et al.Gonadotrophins for ovulation induction in women with polycystic ovary syndrome.Cochrane Database Syst Rev,2019,16:1-72.
6 Yu Q,Hu S,Wang Y.et al.Letrozole versus laparoscopic ovarian drilling in clomiphene citrate-resistant women with polycystic ovary syndrome:a systematic review and meta-analysis of randomized controlled trials Reprod.Biol Endocrinol,2019,17:17.
7 Hu S,Yu Q,Wang Y,Wang M,et al.Letrozole versus clomiphene citrate in polycystic ovary syndrome:a meta-analysis of randomized controlled trials.Arch Gynecol Obstet,2018,297:1081-1088.
8 Xi WY,Liu SK,Mao Hui,et al.Use of letrozole and clomiphene citrate combined with gonadotropins in clomiphene-resistant infertile women with polycystic ovarian syndrome:a prospective study.Drug Des Devel Ther,2015,11:6001-6008.
9 杨学周,张汉汪.PCOS不孕患者CC/HMG促排卵方案中自早卵泡期或中晚卵泡期加入HMG的结果比较.中国妇幼保健,2009,24 :3864-3866.
10 Cedrin-Durnerin I,Massin N,Galey-Fontaine J,et al.Timing of FSH administration for ovarian stimulation in normo-ovulatory women:comparison of an early or a mid follicular phase initiation of a short-term treatment.Hum Reprod,2006,21:2941-2947.