·妇幼保健·
胎儿先天性肺囊性腺瘤样畸形妊娠结局及出生后手术治疗的影响因素分析
钮玉洁 岑立微
【摘要】 目的 探讨影响胎儿先天性肺囊性腺瘤样畸形(CCAM)的妊娠结局和出生后需接受手术治疗的相关因素,为CCAM的临床处理提供参考依据。方法收集2006年6月~2017年6月在复旦大学附属妇产科医院经产前超声诊断的131例胎儿CCAM的临床资料,随访过程中14例失访。根据病理组织学特征将CCAM分为3型,即CCAM I型、CCAM II型和CCAM III型;计算CCAM患儿的肺头比(CVR),分为CVR≤1.6 cm和CVR>1.6 cm;依据CCAM患儿的妊娠结局分为引产和活胎分娩,分析CCAM不同妊娠结局及出生后手术的影响因素。结果2006—2010年CCAM的妊娠结局以引产为主,2011—2017年以活产分娩为主,差异具有统计学意义;CVR>1.6 cm的CCAM患儿的妊娠结局以引产为主,CVR≤1.6 cm者以活胎分娩为主,差异具有统计学意义。CCAM的分型是CCAM患儿出生后手术的主要因素,其中III型的手术率较I和II型显著升高,差异具有统计学意义。结论病例年限和CVR是CCAM患儿不同妊娠结局的主要影响因素,而CCAM的分型是出生后手术的主要影响因素。
【关键词】 胎儿先天性肺囊性腺瘤样畸形; 肺头比; 妊娠结局; 危险因素; 手术
作者单位:200011上海,复旦大学附属妇产科医院妇产科
通讯作者:岑立微(cenliwei2009@126.com)
胎儿先天性肺囊性腺瘤样畸形(congenital cystic adenomatoid malformation,CCAM)是一种较为罕见的胎儿畸形,系终末支气管增殖异常及缺乏正常肺泡组织所形成的肺部良性错构瘤之一,血供来源于肺循环,占先天性肺发育畸形的25%[1]。超声是目前产前诊断CCAM的主要手段,通过产前超声对患儿肺部肿块的随访发现,大多数CCAM在妊娠约20~26周时表现出快速进行性生长,并在约25周时达到峰值,然后生长进入平台期,部分肿块甚至会随着妊娠进展逐渐变小或消失[2]。1977年Stocker等[3]根据病理组织学特征将CCAM分为3型。CCAM的发病率在活产胎儿中约为1/25 000~1/35 000[4],但其围产期病死率却高达9%~49%[5]。为了更好地了解CCAM患儿的妊娠结局及影响妊娠结局的相关因素,以及CCAM患儿出生后是否需要手术及其相关影响因素,本研究对131例经产前超声诊断为CCAM 的胎儿及母体的临床资料进行研究分析,为产前咨询和临床处理提供正确的指导,帮助CCAM患者家属做出相对正确的决定,避免盲目引产的发生。
资料与方法
1.一般资料:收集2006年6月~2017年6月131例经复旦大学产前超声诊断的CCAM,其中2006—2010年37例,2011—2017年94例,这些病例均来自复旦大学附属妇产科医院产科产前门诊及其他地区超声发现胎儿肺部异常而转诊至复旦大学附属妇产科医院的产前多科会诊中心。同时,收集CCAM患儿母亲的年龄、就诊的时间、B超发现时的孕周、肿块的大小、肿块的位置、CCAM分型及CCAM患儿的妊娠结局(引产和活胎分娩)、分娩方式(引产、顺产和剖宫产)、分娩孕周、新生儿性别、出生后肿块情况及是否行手术治疗等基本信息。131例CCAM病例在后期的随访中失访14例,最后共随访到了117例CCAM患儿的妊娠结局。
2.超声诊断及分型:131例病例均由本院2名副主任医师以上职称的超声科医师独立诊断后确诊。超声诊断CCAM的分型采用1977年Stocker的病理组织学分型标准[3]进行,将CCAM分为3型,即Ⅰ型为大囊肿型,肺实质见单个或数个圆形无回声区,边界清楚,囊肿直径大于2 cm;Ⅱ型为小囊肿型,由多个小囊肿组成,且囊肿直径通常小于1cm;Ⅲ型为实质性肿块,超声表现为均匀一致的强回声区,无任何囊肿可见。根据产前超声测得的肿块的长、宽、高各径线值,计算出CCAM患儿的肺头比(CVR),即CVR(cm)=(肿块长度×宽度×高度×0.523)/头围,同时根据公式计算出肿块的体积V=(肿块最长径×肿块最短径2)/2。
3.统计学处理:应用SPSS 13.0 进行统计学分析,卡方检验和卡方趋势检验分析CCAM患儿和母体的临床资料变化趋势及妊娠结局的情况,运用多元Logistic回归分析胎儿CCAM妊娠结局相关危险因素及患儿出生后手术的相关危险因素,P<0.05为差异有统计学意义。
结果
1.基本信息的比较:经本院产前超声诊断发现的131例CCAM患儿中,1例CCAM III型伴有纵隔移位,CCAMⅠ型和Ⅱ型中各有1例为双胎,其余病例均无并发症。其中肿块位于左侧的病例有86例(65.6%,86/131),肿块位于右侧的有45例(34.4%,45/131),CCAM左侧的发病率高于右侧,差异具有统计学意义。CVR≤1.6 cm的有121例(92.4%,121/131),明显多于CVR>1.6 cm的10例(7.6%,10/131),差异具有统计学意义。随着产前超声技术的发展和提高,经本院产前超声诊断的CCAM,2011—2017年共94例(71.8%,94/131),明显多于2006—2010年的37例(28.2%,37/131),差异具有统计学意义。CCAM分型情况见表1,其中经产前超声发现Ⅲ型的孕周,明显早于Ⅰ型和Ⅱ型,差异具有统计学意义。
2. CCAM的妊娠结局危险因素分析:多元Logistic回归分析CCAM患儿妊娠结局的相关危险因素发现,病例年份是影响CCAM患儿妊娠结局的主要危险因素。见表2。
3.CVR≤1.6 cm和CVR>1.6 cm的CCAM患儿的妊娠结局:CVR≤1.6 cm的CCAM患儿107例,其中引产48例(44.9%,48/107),活胎分娩59例(55.1%,59/107)。CVR>1.6 cm的CCAM患儿10例,其中引产9例(90.0%,9/10),活胎分娩1例(10.0%,1/10)。CVR>1.6 cm的CCAM患儿引产率显著高于CVR≤1.6 cm的CCAM的患儿引产率,两者差异有统计学意义。
4.CCAM不同分型出生后情况:CCAM Ⅰ型和CCAM Ⅱ型患儿出生后肿块缩小或消失的占大多数,而CCAM III型患儿出生后肿块缩小或消失占总例数的50.0%。出生后肿块缩小或消失的患儿均未行手术治疗,而出生后肿块无变化或增大的患儿均进行了后期的手术治疗。见表3。
5.CCAM患儿手术的相关危险因素分析:将CCAM患儿出生后情况分为手术和非手术。采用多元Logistic回归分析CCAM患儿手术的相关危险因素,结果发现CCAM分型是影响CCAM患儿出生后手术的主要危险因素。见表4。
表1 CCAM分型后的基本信息
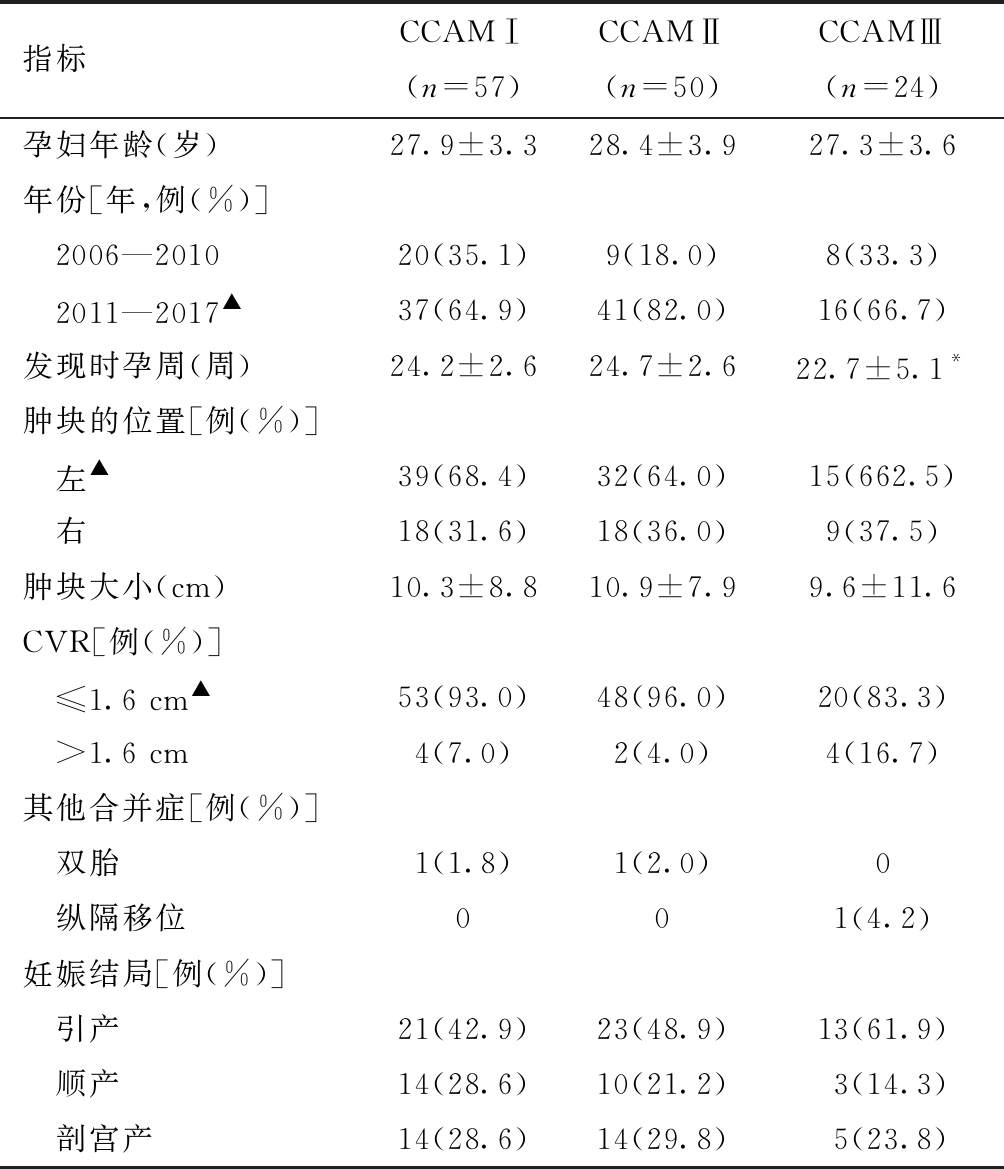
指标CCAMⅠ(n=57)CCAMⅡ(n=50)CCAMⅢ(n=24)孕妇年龄(岁)27.9±3.328.4±3.927.3±3.6年份[年,例(%)] 2006—201020(35.1)9(18.0)8(33.3) 2011—2017▲37(64.9)41(82.0)16(66.7)发现时孕周(周)24.2±2.624.7±2.622.7±5.1*肿块的位置[例(%)] 左▲39(68.4)32(64.0)15(662.5) 右18(31.6)18(36.0)9(37.5)肿块大小(cm)10.3±8.810.9±7.99.6±11.6CVR[例(%)] ≤1.6 cm▲53(93.0)48(96.0)20(83.3) >1.6 cm4(7.0)2(4.0)4(16.7)其他合并症[例(%)] 双胎1(1.8)1(2.0)0 纵隔移位001(4.2)妊娠结局[例(%)] 引产21(42.9)23(48.9)13(61.9) 顺产14(28.6)10(21.2)3(14.3) 剖宫产14(28.6)14(29.8)5(23.8)
分别与CCAM Ⅰ型和Ⅱ型比较,*P<0.05;同一指标间比较,▲P<0.05
表2 CCAM的妊娠结局危险因素的Logistic回归分析
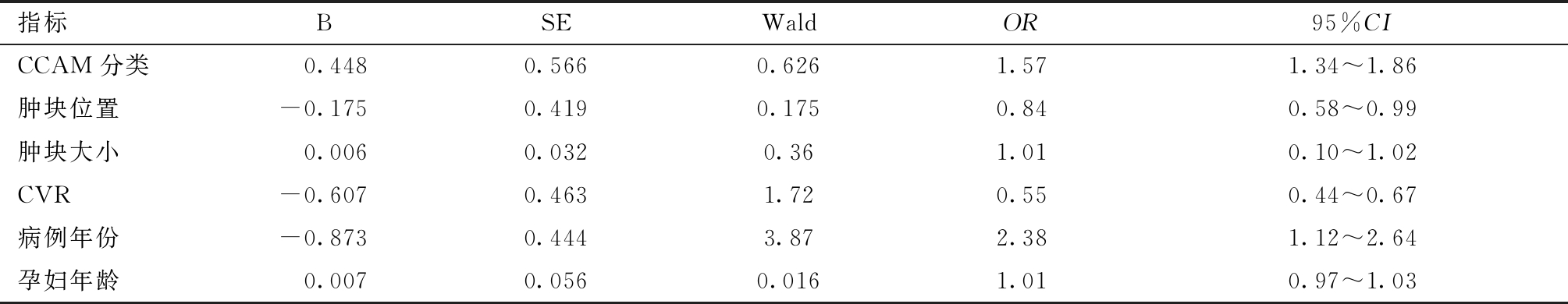
指标BSEWaldOR95%CICCAM分类 0.4480.5660.6261.571.34~1.86肿块位置-0.1750.4190.1750.840.58~0.99肿块大小 0.0060.0320.361.010.10~1.02CVR-0.6070.4631.720.550.44~0.67病例年份-0.8730.4443.872.381.12~2.64孕妇年龄 0.0070.0560.0161.010.97~1.03
表3 CCAM不同分型出生后情况
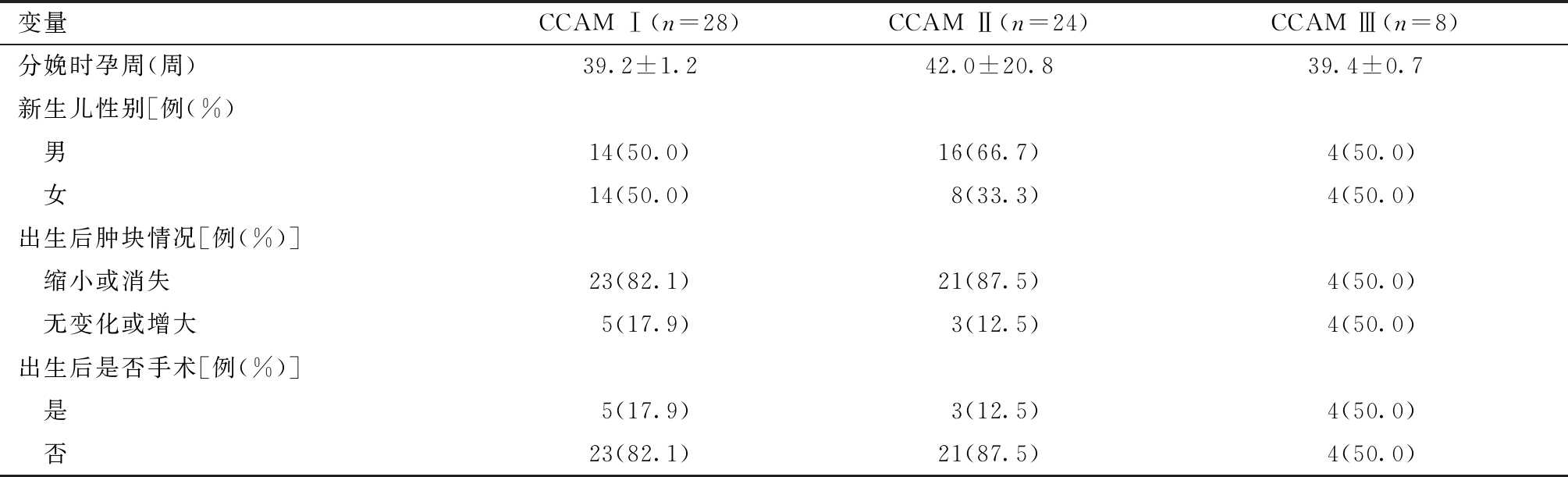
变量CCAM Ⅰ(n=28)CCAM Ⅱ(n=24)CCAM Ⅲ(n=8)分娩时孕周(周)39.2±1.242.0±20.839.4±0.7新生儿性别[例(%) 男14(50.0)16(66.7)4(50.0) 女14(50.0)8(33.3)4(50.0)出生后肿块情况[例(%)] 缩小或消失23(82.1)21(87.5)4(50.0) 无变化或增大5(17.9)3(12.5)4(50.0)出生后是否手术[例(%)] 是5(17.9)3(12.5)4(50.0) 否23(82.1)21(87.5)4(50.0)
表4 CCAM患儿出生后手术危险因素Logistic 回归分析
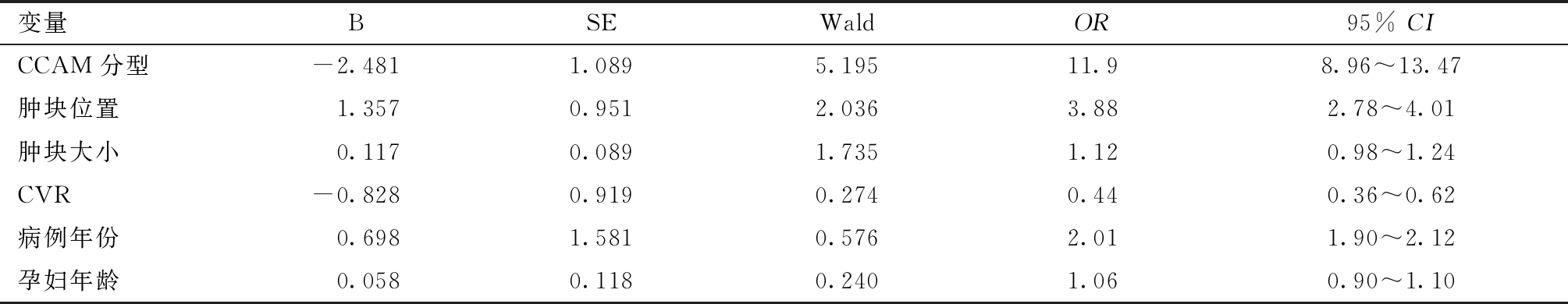
变量BSEWaldOR95% CICCAM分型-2.4811.0895.19511.98.96~13.47 肿块位置 1.3570.9512.0363.882.78~4.01肿块大小 0.1170.0891.7351.120.98~1.24CVR-0.8280.9190.2740.440.36~0.62病例年份 0.6981.5810.5762.011.90~2.12孕妇年龄 0.0580.1180.2401.060.90~1.10
讨论
1.CCAM的临床特点:目前,CCAM确切病因尚不完全清楚,无明显的种族差异及家族遗传倾向。文献报道CCAM多发生于左侧肺部,病灶常累及整个肺叶,多个肺叶同时受累的约占17%,很少双侧肺部同时受累,一旦双侧同时受累均为致死性[6]。本研究131例CCAM病例中,病变位于左侧肺叶的有86例(66%),位于右侧肺叶的有45例(34%),未发现双侧肺部同时受累的病例。CCAM和所有的先天性胸腔占位性病变一样,会产生一定的肿块效应,引起同侧和对侧的肺发育不良,同时由于肿块的压迫出现心脏和纵隔移位,肿块压迫心脏和血管可引起全身水肿及腹水等。本研究的131例CCAM患儿中有1例出现了纵隔移位,最终以引产终止妊娠。文献报道CCAM在孕18周以后超声声像图就会出现异常改变,但是绝大多数CCAM患儿在妊娠21~24周通过产前超声被诊断[7]。本研究也发现Ⅲ型被诊断的孕周较Ⅰ型和Ⅱ型提前2周左右,这可能与CCAM Ⅲ型的超声声像图特征与Ⅰ型和Ⅱ型不同有关。
2.CCAM影响妊娠结局的重要因素:CCAM的病程特点和临床表现多种多样,其中肿块的大小及其导致的继发的并发症状是影响患儿妊娠结局的重要因素。本研究的131例CCAM患儿中,除失访的14例,剩余的117例中引产的有57例,活胎分娩的有60例。Thorpe-Beeston等[8]报道的132 例CCAM 患儿中44个家庭选择终止妊娠( 33.3%),61 例患儿存活。本研究将监测年份分为2006—2010年(前5年)及2011—2017年(后7年),前5年37例CCAM病例中引产的有23例,活胎分娩的14例。后七年80例病例中引产的有34例,活胎分娩的有46例。本研究多元Logistic 回归分析发现,病例年份是影响CCAM患儿妊娠结局的主要危险因素。原因可能与当时医学发展水平和医生、孕妇及患儿家属对CCAM的认知水平有限有关,对多数CCAM患儿并未进行积极、恰当的处理,终止妊娠便成为了主要的医疗手段。近年来,随着医学水平的发展,尤其是胎儿医学的不断发展,人们对胎儿CCAM疾病的认识不断加深,对CCAM患儿的处理理念也发生了重大的变化。2014年郭晓玲等对51例CCAM患儿的分析发现,2007—2009年(前3年)和2010—2012年(后3年)两个时间段的患儿的妊娠结局的差异具有统计学意义 [9]。这一发现在一定的程度上支持本研究结果。
对CCAM 患儿的肿块及其水肿情况进行产前密切随访,了解胎儿病变情况是至关重要的。大量的研究表明,CVR可用于评估CCAM患儿的预后,CVR>1.6 cm的CCAM患儿水肿的发生率较CVR≤1.6 cm者明显升高,CVR>1.6 cm 的CCAM 胎儿90%以上发展为胎儿水肿,提示胎儿需要密切观察甚至宫内干预[10-11]。因此,CVR成为了预测CCAM患儿预后及指导临床处理的重要指标,是影响妊娠结局的危险因素之一。本研究的131例CCAM病例中,14例随访的过程中失访,剩下的117例病例中,CVR>1.6 cm的共10例,其中9例患儿引产终止妊娠,只有1例活胎分娩;CVR≤1.6 cm的共107例,其中48例以引产终止妊娠,59例最终活胎分娩;发现CVR>1.6 cm的CCAM患儿的引产率显著高于CVR≤1.6 cm的患儿。Markhardt等[12]统计了101例在产前17~38周经产前超声诊断为CCAM病例,其中76例未发生水肿,妊娠结局均较好(其中66例生后行肿块切除,10例仅需要随访);25例出现水肿的,均在妊娠25~36周时死亡;CVR≤1.6 cm者,14%出现水肿;CVR>1.6 cm者,75%出现水肿;而没有出现水肿的病例中,大概在25~28周之后,其肿块呈现逐渐缩小的趋势;而出现水肿者,死亡率高。这一研究发现在一定的程度上支持了本研究结果。目前,对于CCAM 胎儿,CVR≤1.6 cm者,胎儿发生水肿的可能性较低,可选择继续妊娠;对于水肿胎儿或CVR>1.6 cm 者,在无产前干预的情况下是胎儿预后不良的指征,是否继续妊娠仍存在一定的争议。
3.CCAM患儿出生后手术治疗的危险因素:本研究CCAM Ⅲ中肿块无变化或增大的病例所占的比例明显高于CCAM Ⅰ型和Ⅱ型,且出生后肿块的变化情况直接影响到患儿出生后是否行手术治疗。本研究的12例出生后肿块无变化或增大的患儿均接受了手术切除治疗,48例出生后肿块缩小或消失的病例均未行手术治疗。本研究多元Logistic 回归分析发现,CCAM的分型是决定患儿出生后手术与否的重要危险因素。这可能与CCAM Ⅲ型常易出现纵隔移位及胎儿水肿有关。Adzick等[1]对22例经产前超声诊断为CCAM的病例的回顾分析中发现,微小病变即CCAM Ⅲ型合并胎儿水肿提示预后不良;巨大病变(单一或多个)即CCAMⅠ型或Ⅱ型,无合并胎儿水肿预后良好;4例为巨大病变,并在随后的超声随访中完全消失(18%)。本研究的131例病例中只有1例出现了纵隔移位的情况,且该例病例的病理分型为CCAMⅢ。因此,单纯的CCAM Ⅰ型、Ⅱ型预后较好,但Ⅲ型常易出现胎儿水肿,预后不良。
综上所述,病例年份及CVR是影响CCAM妊娠结局的主要危险因素,CCAM的分型是CCAM患儿出生后手术治疗的重要危险因素。这些发现将对以后CCAM的临床处理及产前咨询提供重要的指导和建议,可以帮助CCAM患儿的家属做出相对正确的决定,避免孕妇盲目引产的发生,改善CCAM患儿的妊娠结局,提高CCAM患儿出生率和成活率。
参考文献
1 Adzick NS,Harrison MR,Glick PL,et al.Fetal cystic adenomatoid malformation:prenatal diagnosis and naturalhistory.J Pediatr Surg,1985,20:483-488.
2 Kunisaki SM,Fauza DO,Barnewolt CE,et al.Ex utero intrapartum treatment with placement on extracorporeal membrane oxygenation for fetal thoracic masses.J Pediatr Surg,2007,42:420-425.
3 Stocker JT,Madewell JE,Drake RM.Congenital cystic adenomatoid malformation of the lung.Classification and morphologicspectrum.Hum Pathol,1977,8:155-171.
4 Laberge JM,Flageole H,Pugash D,et al.Outcome of the prenatally diagnosed congenital cystic adenomatoid lung malformation:a Canadianexperience.Fetal Diagn Ther,2001,16:178-186.
5 Ierullo AM,Ganapathy R,Crowley S,et al.Neonatal outcome of antenatally diagnosed congenital cystic adenomatoidmalformations.Ultrasound Obstet Gynecol,2005,26:150-153.
6 Miller RK,Sieber WK,Yunis EJ.Congenital adenomatoid malformation of the lung.A report of 17 cases and review of the literature.Pathol Annu 1980,15:387-402.
7 ChenWS,Yeh GP,Tsai HD,et al.Prenatal diagnosis of congenital cystic adenomatoid malformations:evolution andoutcome.Taiwan J Obstet Gynecol,2009:48:278-281.
8 Thorpe-Beeston JG,Nicolaides KH.Cystic adenomatoid malformation of the lung:prenatal diagnosis andoutcome.Prenat Diagn,1994,14:677-688.
9 郭晓玲,王茜,刘正平,等,2007-2012年佛山市胎儿先天性肺囊性腺瘤样畸形发病况及妊娠结局临床分析.中国妇幼保健,2014,30:4927-4931.
10 Crombleholme TM,Coleman B,Hedrick H,et al.Cystic adenomatoid malformation volume ratio predicts outcome in prenatally diagnosed cystic adenomatoid malformation of thelung.J Pediatr Surg,2002,37:331-338.
11 Adzick NS.Fetal thoracic lesions.Semin Pediatr Surg,1993,2:103-108.
12 Markhardt BK,Farmer DL,Filly RA.Presumptive intrahepatic congenital cystic adenomatoidmalformation.J Ultrasound Med,2003,22:531-536.
(收稿日期:2019-07-16)



