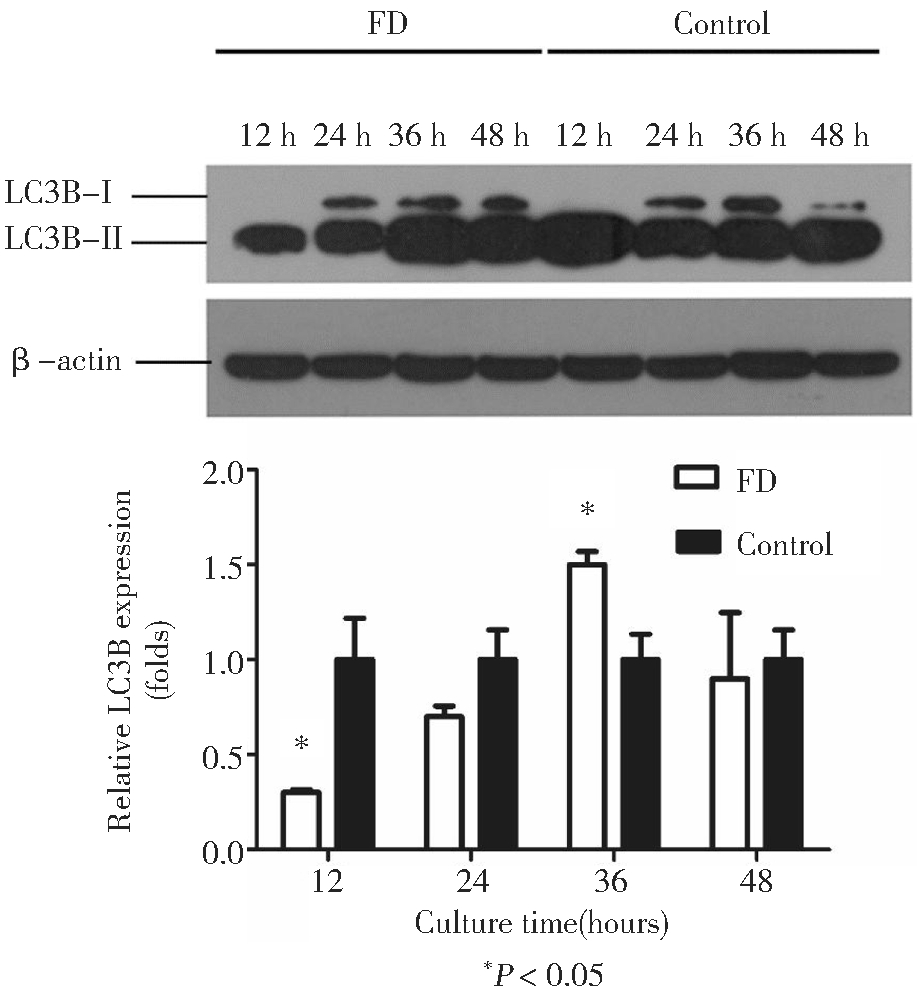
图1 叶酸缺乏对自噬关键蛋白LC3B表达水平的影响
·实验研究·
随着国内人民生活水平的提高以及二胎政策的放开,补充叶酸等优生优育措施被越来越多的民众所重视。叶酸是水溶性维生素B9,作为一碳单位的载体,主要参与DNA 合成和DNA甲基化这两个重要的生物化学过程[1]。叶酸缺乏在发育异常、衰老、肿瘤等各种疾病中发挥着重要作用,可诱导细胞死亡[2]。本团队前期研究发现叶酸缺乏可诱导小鼠胚胎干细胞(mESCs)发生凋亡[3]。细胞自噬是细胞死亡的一种类型,但是叶酸缺乏和自噬关系尚未明确。因此,本研究选取mESCs为研究模型,探索叶酸缺乏是否可能诱发自噬。
1.材料:小鼠胚胎干细胞由本实验室冻存;叶酸粉末购自Sigma公司;DMEM高糖培养基(含叶酸)、胎牛血清、非必需氨基酸、丙酮酸钠、DPBS(无钙镁)、L-谷氨酰胺、青霉素/链霉素、2-巯基乙醇、胰酶替代品均购自GIBCO公司;重组小鼠白血病抑制因子购自Millipore公司;DMEM高糖培养基(不含叶酸)购自北京思赛因公司;明胶购自Amresco公司;哺乳动物蛋白提取试剂盒、总RNA提取试剂盒、荧光定量PCR试剂盒购自北京康为世纪公司;cDNA逆转录试剂盒购自Promega公司;LC3和β-actin抗体均购自Cell Signal Technology公司。
2.mESCs常规培养和分组:胚胎干细胞完全培养基(正常对照组,Control)包括DMEM高糖培养基(葡萄糖含量4 500 mg/L、叶酸含量4 mg)、15%胎牛血清、L-谷氨酰胺2 mmol/L、青霉素/链霉素100 U/L、2-巯基乙醇0.1 mmol/L、非必需氨基酸0.1 mmol/L、丙酮酸钠1 mmol/L、重组小鼠白血病抑制因子1 000 U/L。叶酸缺乏组(FD)完全培养基为DMEM高糖培养基(不含叶酸)中添加叶酸2 mg,其余成分同正常对照组,且细胞培养条件不变。在0.2%明胶包被培养板,将液氮中冻存的mESCs取出进行复苏后,置于明胶上,加入正常对照组培养基,于37℃,5% CO2饱和湿度的培养箱中培养,每24 h更换正常对照组完全培养基将细胞培养至48 h进行传代,收集细胞离心去上清后,往细胞沉淀中加入FD组的完全培养基吹打混匀至单细胞状态,将等量细胞分别加入Control组和FD组的完全培养基中继续培养,每24 h更换两组细胞各自的完全培养基。分别在培养12 h、24 h、36 h、48 h这4个时间点收集Control组和FD组的细胞,离心去上清后保留细胞沉淀用于后续实验。
3.荧光实时定量PCR法检测LC3B和Foxo3的表达:分别在4个时间点(12 h,24 h,36 h,48 h)下,收获培养的两组细胞(Control组和FD组),根据试剂盒步骤分别提取两组细胞的总RNA,Nanodro P1000分光光度计测总RNA浓度;Promega反转录试剂盒将RNA反转录成cDNA,反转录条件为42 ℃ 15 min,95 ℃ 5 min,0~5 ℃ 5 min;然后根据Fast SYBR Mixture试剂盒步骤进行real time PCR反应,体系为25 μl;LC3引物序列为F:5′-CCAGTGATTATAGAGCGATAC-3′,R:5′-AGGAAGAAGGCTTGGTTAG-3;Pik3r1引物序列为F:5′-CATTGACAGTAGGAGGAGGTTGGAA-3′,R:5′- TTTCTGCGTCAGCCACATCAAGTAT-3′;Pik3r3引物序列为F:5′- TCACAAATGGAATGAAGGACAG-3′,R:5′-AGGCATCACGAACTAAGAAGGT-3′;Akt1引物序列为F:5′-ACTCATTCCAGACCCACGACC-3′,R:5′-CAGACACAATCTCCGCACCAT-3′;内参β-actin引物序列为F:5′-TTCCAGCCTTCCTTCTTG-3′,R:5′-GGAGCCAGAGCAGTAATC-3′;扩增条件为95℃ 20 s预变性,95℃ 3 s,60℃ 30 s,40个循环,每份样品做3个复孔;基因表达变化均采用2 - △△ Ct相对定量分析法。以β-actin为内参基因,荧光实时定量PCR法检测两组细胞中LC3B和Foxo3的表达,检测三者在mRNA水平的表达量[4-5]。
4.免疫印记实验检测LC3B的表达:根据试剂盒步骤分别裂解两组细胞,提取总蛋白,Bradford法测定蛋白浓度,40 g蛋白样品以15%SDS-PAGE胶分离后每份样品做3个复孔,通过湿转法转至PVDF膜上,5%脱脂奶粉室温摇床封闭1 h,分别加兔抗LC3单克隆抗体(1:1 000)、兔抗Actin单克隆抗体(1:1 000)过夜;TBST洗膜3次,10 分钟/次,然后与HRP标记的山羊抗兔二抗(1:2 000),室温孵育1 h,TBST洗膜3次,10 分钟/次,增强型 ECL化学发光成像,X胶片曝光显影,扫描为照片,最后利用Quantity One软件对条带行分析。
5.统计学处理:应用Excel 2007统计软件包处理数据,计量资料采用均数±标准差形式表示,两组间比较采用独立样本t检验,P值<0.05认为差异有统计学意义。
1.叶酸缺乏对自噬关键蛋白LC3B表达水平和mRNA水平的影响:mESCs分别在FD组和Control组中培养12 h、24 h、36 h、48 h后,通过免疫印迹杂交法以β-actin作为内参,检测自噬关键蛋白LC3B的表达量。在LC3B的免疫印迹中(图1),LC3B通常出现两条带,即LC3B-I的表观分子量为18 KDa,LC3B-II的表观分子量为16 KDa,但是LC3B抗体与LC3B-II的亲和力高于LC3B-I。图1的结果进行灰度扫描后,将Control组的灰度值均设为1,观察4个时间点下FD组的LC3B表达量变化(图1),仅12 h、36 h的变化具有统计学意义,而且36 h的LC3B表达量上调。该实验提示当叶酸缺乏条件培养mESCs 36 h,自噬活性可能增强。
通过相对定量PCR法,检测自噬关键基因LC3B在mRNA水平的相对表达量。结果显示(图2),与Control组相比,FD组在4个时间点中仅36 h的差异为1.63倍具有统计学意义(P<0.05),且表达上调,提示叶酸缺乏条件下培养mESCs 36 h,自噬活性可能增强。
LC3B在mRNA和蛋白水平的趋势,以36 h最为显著,48 h出现下降,而12 h时FD组表达量反而低于Control组。

图1 叶酸缺乏对自噬关键蛋白LC3B表达水平的影响
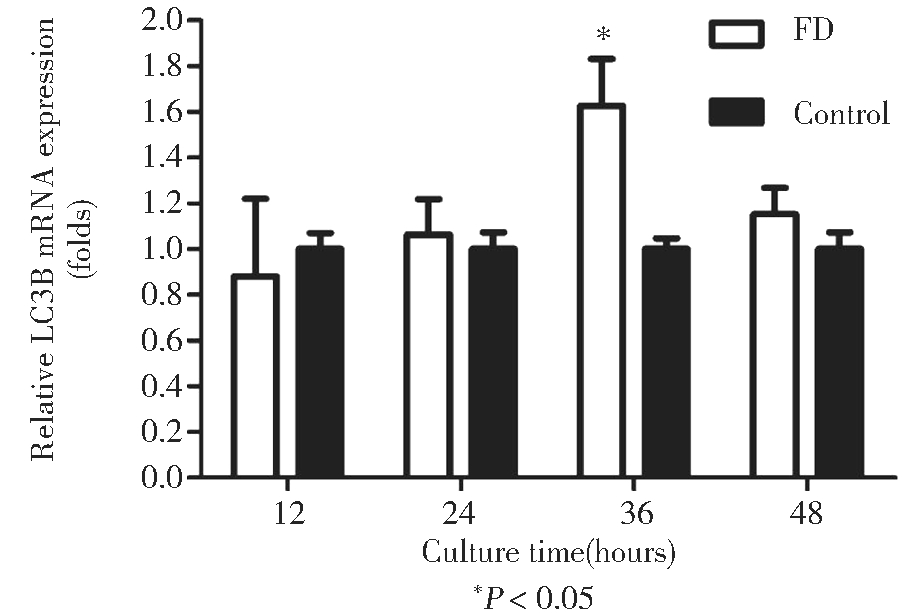
图2 叶酸缺乏对自噬关键蛋白LC3B的mRNA水平影响
2.叶酸缺乏对自噬信号通路上相关基因的影响:FD组和Control组培养36 h的mESCs提取总RNA经反转录后,采用SYB Green法实时相对定量PCR检测叶酸缺乏条件下,PI3K/Akt信号通路上的4个关键分子Pi3r1、Pi3r3、Akt1和Foxo3相对正常对照组的表达量变化(图3)。相对于Control组,FD组中这4个基因中仅Foxo3表达上调1.3倍,差异有统计学意义;而Pi3r1表达下调1.1倍,Pi3r3和Akt1的表达分别上调1.04和1.03倍均未发现有统计学意义。说明Foxo3可能参与叶酸缺乏诱导自噬过程的主要途径。
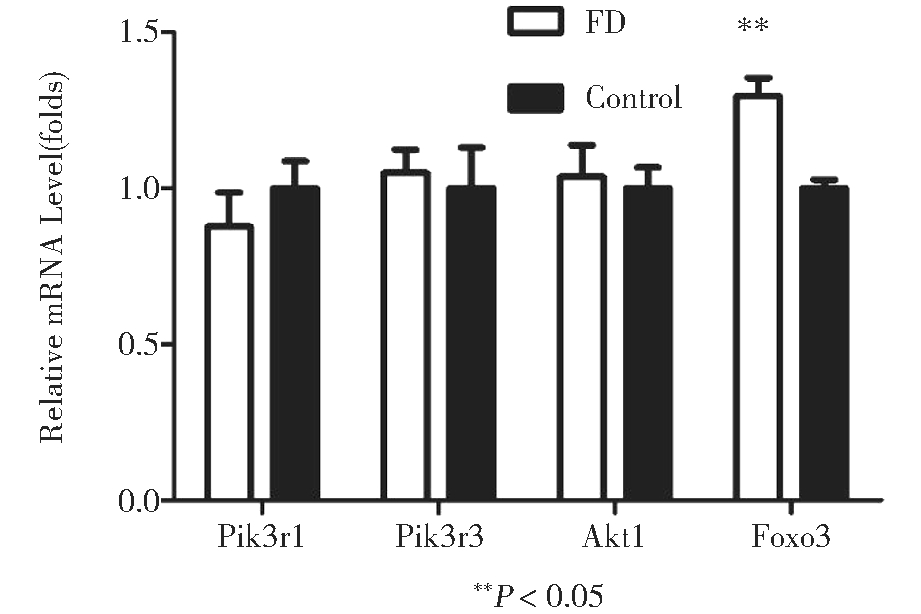
图3 叶酸缺乏对自噬信号通路上相关基因的影响
本实验分别在叶酸缺乏(FD组)和正常叶酸(Control组)水平两种条件下培养mESCs,然后在蛋白水平和mRNA水平均对两组细胞进行自噬关键蛋白LC3B的检测,结果提示细胞培养36 h,FD组的自噬关键蛋白LC3B的表达量出现上调且差异有统计学意义,反映自噬活性可能增强,提示叶酸缺乏可能诱导自噬的发生。通常认为当细胞受到外界环境的刺激或在内部环境或条件发生变化时都可以发生自噬上调。其中常见的外部因素包括氨基酸或游离脂肪酸等在内的营养缺乏,以及激素、缺血、缺氧是细胞自噬的重要诱导因素。另外雌激素、雄激素和纤维生长因子-2(FGF-2)等均可诱导细胞发生自噬。内部因素包括细胞器损伤、异常成分积聚或必需成分存在和病原体存在[6]。本实验证实以叶酸缺乏为例的营养缺乏同样可能诱导自噬的发生。
LC3B-II的含量或 LC3B-II/LC3B-I的比例与自噬泡的数量呈正相关,在某种程度上反映了细胞的自噬活性[4]。本研究FD组的自噬关键蛋白LC3B在mRNA水平和蛋白水平均显著上调,提示叶酸缺乏诱导的自噬在转录水平调控LC3B的表达,有LC3B在mRNA和蛋白水平的趋势是随着细胞培养时间的推移,表达量逐渐上调,以36 h最为显著,48 h出现下降,考虑可能与该时间点部分细胞活性降低有关。而12 h时FD组表达量反而低于Control组,分析可能与培养时间尚短,细胞尚未适应该组的培养基条件,故影响细胞活性,从而影响了蛋白的表达。研究表明,在人和大鼠的自噬过程中,LC3B通常在翻译后水平受到调控[7]。本研究与现有的研究结论不同的是调控阶段的差异,这可能与物种、细胞系和诱导因素的不同有关。
选择与自噬相关的PI3K/Akt信号通路上的4个关键分子Pi3r1、Pi3r3、Akt1和Foxo3,在mRNA水平检测它们的表达情况[5,8]。本实验经荧光定量PCR验证,Pik3r1、Pik3r3、和Akt1在mRNA水平并无明显变化,但是Foxo3表达上调1.3倍,差异有统计学意义。Pik3r1、Pik3r3和Akt1没有变化,后续应通过蛋白水平的检测如免疫印迹杂交证明PI3K/Akt通路是否参与叶酸缺乏诱导的自噬。Foxo3属于转录因子,Mammucari等[9]研究发现肌肉生长中Akt激活了由mTOR介导的蛋白合成,而Foxo介导的蛋白降解则受到抑制。在许多生物体内,Foxo反向调控mTOR信号通路。Foxo3在骨骼肌的自噬中发挥了必要的作用,饥饿状态下可激活自噬相关蛋白LC3B和Bnip3的转录,这个过程正是受到Foxo3的调控。Foxo3作为转录因子参与对LC3B的诱导,它是饥饿诱导的自噬中所必需的;在肌肉萎缩中,同时调控着泛素蛋白酶体和自噬溶酶体。由此可以推断,叶酸缺乏可能使PI3K/Akt通路的信号转导减弱,对转录因子Foxo3的抑制作用减弱从而使促自噬因子Foxo3的表达增加,DNA转录水平提高,大量的自噬相关基因如LC3B和Beclin1的高表达最终诱导了自噬的发生。因此,叶酸缺乏诱导的自噬可能主要是通过PI3K/Akt通路参与信号转导。
本研究提出了叶酸缺乏可能诱导自噬的发生,探索了叶酸缺乏可能与自噬相关,为深入研究神经管畸形的发病机制提供了新的思路[10-11],为孕期补充叶酸的必要性提供了理论依据。
1 Sexton S.Folic Acid Supplementation for the Prevention of Neural Tube Defects:Recommendation Statement.Am Fam Physician,2017,95:652A-652C.
2 Sheridan M,Jamieson A.Life-threatening folic acid deficiency:Diogenes syndrome in a young woman?.Am J Med,2015,128:e7-8.
3 Liang Y,Li Y,Li Z,et al.Mechanism of folate deficiency-induced apoptosis in mouse embryonic stem cells:Cell cycle arrest/apoptosis in G1/G0 mediated by microRNA-302a and tumor suppressor gene Lats2. Int J Biochem Cell Biol,2012,44:1750-1760.
4 Corona Velazquez AF,Jackson WT.So Many Roads:the Multifaceted Regulation of Autophagy Induction.Mol Cell Biol,2018,38:e00303-18.
5 Wang Y,Yang Y,Zuo R,et al.FOXO3 protects nucleus pulposus cells against apoptosis under nutrient deficiency via autophagy.Biochem Biophys Res Commun,2020,524:756-763.
6 成军,主编.现代细胞自噬分子生物学.北京:科学出版社,2011:10-15.
7 Kabeya Y,Mizushima N,Ueno T,et al.LC3,a mammalian homologue of yeast Apg8p,is localized in autophagosome membranes after processing.EMBO J,2000,19:5720-5728.
8 Zhou W,Wang J,Qi Q,et al.Matrine induces senescence of human glioblastoma cells through suppression of the IGF1/PI3K/AKT/p27 signaling pathway.Cancer Med,2018,7:4729-4743.
9 Mammucari C,Schiaffino S,Sandri M.Downstream of Akt:FoxO3 and mTOR in the regulation of autophagy in skeletal muscle.Autophagy,2008,4:524-526.
10 Chang S,Jing J,Shangguan S,et al.The effect of folic acid deficiency on Mest/Peg1 in neural tube defects.Int J Neurosci,2020,4:1-12.
11 秦佳星,牛勃,王建华.自噬调节基因AMBRA1在神经管发育中的作用及机制研究进展.中国生育健康杂志,2019,30:386-388.