在中国,不孕不育的发生率约10%,越来越多的不孕夫妇选择辅助生殖技术,全球已有500万的试管婴儿诞生[1]。研究表明,辅助生殖妊娠可能增加妊娠期糖尿病(GDM)的发生,从而增加分娩风险[2-3]。因此,了解试管婴儿孕妇GDM的影响因素、妊娠结局,并采取有效的干预措施,对改善孕产妇的预后尤为重要。目前对于试管婴儿孕妇群体,主要集中在双胎风险及增加不良妊娠结局方面,对试管婴儿孕妇合并GDM的研究尚少。本研究探讨试管婴儿孕妇GDM发生的影响因素及对妊娠结局的影响,为临床防治试管婴儿孕妇合并GDM提供科学依据。
资料与方法
一、资料
选取2017年1月至2019年9月在上海市浦东新区妇幼保健院产检并分娩的通过体外受精-胚胎移植(IVF-ET)受孕的试管婴儿孕妇648例为研究对象,年龄24~45岁,平均(34.1±3.1)岁,648例孕妇包括合并GDM 112例,非GDM 536例,应用多因素Logistics回归分析试管婴儿孕妇GDM的危险因素。纳入标准:(1)IVF-ET受孕的试管婴儿孕妇;(2)均在该院产检;(3)无认知功能障碍和精神障碍者;(4)无吸烟、饮酒习惯者。排除标准:(1)行未成熟卵体外培养的患者;(2)妊娠前合并糖尿病、高血压等内外科疾病;(3)减胎术后;(4)孕前有利尿剂、糖皮质激素等可能影响糖代谢药物长期应用史。
试管婴儿孕妇合并GDM的妊娠结局分析:研究分为三组,即试管婴儿孕妇合并GDM作为研究组,试管婴儿孕妇非GDM和自然受孕合并GDM孕妇作为对照组。研究组于纳入的112例试管婴儿孕妇合并GDM中选取,由于有些孕妇产检次数过少或资料不全等因素,最终纳入研究组共106例;试管婴儿孕妇非GDM从536例试管婴儿孕妇非GDM中选取,并选择同期住院的自然受孕合并GDM孕妇,按照实验对照1∶1∶1原则,由于试管婴儿孕妇双胎比率较高、年龄偏大,为了排除年龄、双胎等因素对妊娠结局的干扰,对照组试管婴儿孕妇非GDM、自然受孕GDM组分别纳入了120例。三组年龄、孕次、产次、孕前BMI、单双胎比较,差异均无统计学意义,具有可比性。
二、方法
1. GDM诊断标准:孕前无糖尿病,采用75 g口服葡萄糖耐量试验测量孕24~28周血糖,有1项达到或超过正常值即可确诊。血糖正常值上限分别为空腹5.1 mmol/L、1 h 10.0 mmol/L、2 h 8.5 mmol/L。
2. 观察指标:(1) 收集所有试管婴儿孕妇的年龄、胎次、单多胎、孕前BMI(BMI=体重/身高2,kg/m2)、多囊卵巢综合征(PCOS)史、糖尿病家族史、孕期增重、孕期日运动、睡眠时间等情况,分析试管婴儿孕妇GDM的高危因素。(2) 观察试管婴儿孕妇合并GDM、试管婴儿孕妇非GDM、自然受孕GDM三组的分娩方式、孕产妇并发症(妊娠期高血压、子痫前期、羊水过多、羊水过少、胎膜早破、胎儿生长受限、早产、产后出血)及围产儿情况(巨大儿、低出生体重儿、新生儿窒息),诊断标准根据人民卫生出版社《妇产科学》第9版[4]。
3. 统计学处理:应用SPSS 22.0软件对数据进行统计学分析。正态分布的计量资料以![]() 表示,采用t检验;计数资料用频数(百分比)表示,采用χ2检验或Fisher确切概率法;多因素分析采用 Logistic 回归方程。以P<0. 05 为差异有统计学意义。
表示,采用t检验;计数资料用频数(百分比)表示,采用χ2检验或Fisher确切概率法;多因素分析采用 Logistic 回归方程。以P<0. 05 为差异有统计学意义。
结 果
一、试管婴儿孕妇GDM影响因素的单因素分析
本研究中648例试管婴儿孕妇发生GDM 112例,发生率为17.3%。单因素分析结果显示,GDM的发生与孕妇高龄(年龄≥35岁)、孕前BMI≥24 kg/m2、PCOS史、糖尿病家族史、接受胚胎移植次数≥3次、双胎、睡眠时间≤6小时/晚、日活动量≥1 h有关。见表1。
二、试管婴儿孕妇GDM危险因素的多因素Logistics回归分析
试管婴儿孕妇以是否为GDM为因变量,将上述单因素分析中差异有统计学意义的因素作为自变量,进行多因素Logistic分析,结果显示,高龄(OR=1.65,95% CI:1.06~2.58)、孕前BMI≥24 kg/m2(OR=1.55,95% CI:1.004~2.38)、PCOS史(OR=2.25,95% CI:1.40~3.61)、糖尿病家族史(OR=2.96,95% CI:1.61~5.44)、接受胚胎移植次数≥3次(OR=2.25,95% CI:1.40~3.60)、睡眠时间≤6小时/晚(OR=1.94,95% CI:1.14~3.31)均为试管婴儿孕妇GDM的独立危险因素,日活动量≥ 1 h(OR=0.55,95% CI:0.35~0.86)为试管婴儿孕妇GDM的保护因素,见图1。
三、试管婴儿孕妇合并GDM组、试管婴儿孕妇非GDM组、自然受孕GDM组剖宫产率、并发症的比较
试管婴儿合并GDM组产妇的剖宫产率、妊娠期高血压、胎儿生长受限、早产的发生率明显高于试管婴儿非GDM组 、自然受孕GDM组产妇,差异具有统计学意义,试管婴儿非GDM组和自然受孕GDM组组间差异无统计学意义。试管婴儿合并GDM组产妇的羊水过多发生率明显高于试管婴儿非GDM组(P<0.05),但与自然受孕GDM组比较,差异无统计学意义。各组间子痫前期、羊水过少、胎膜早破、产后出血发生率比较,差异均无统计学意义。见表2。
四、三组围产儿情况的比较
试管婴儿孕妇合并GDM组的巨大儿发生率明显高于试管婴儿非GDM组(P<0.05),但与自然受孕GDM组差异无统计学意义。各组间低出生体重儿和新生儿窒息的发生率比较,差异均无统计学意义。见表3。
表1 试管婴儿孕妇GDM影响因素的单因素分析[例![]()
Table 1 Univariate analysis of factors influencing GDM in IVF-pregnant women [n(%),x±s]
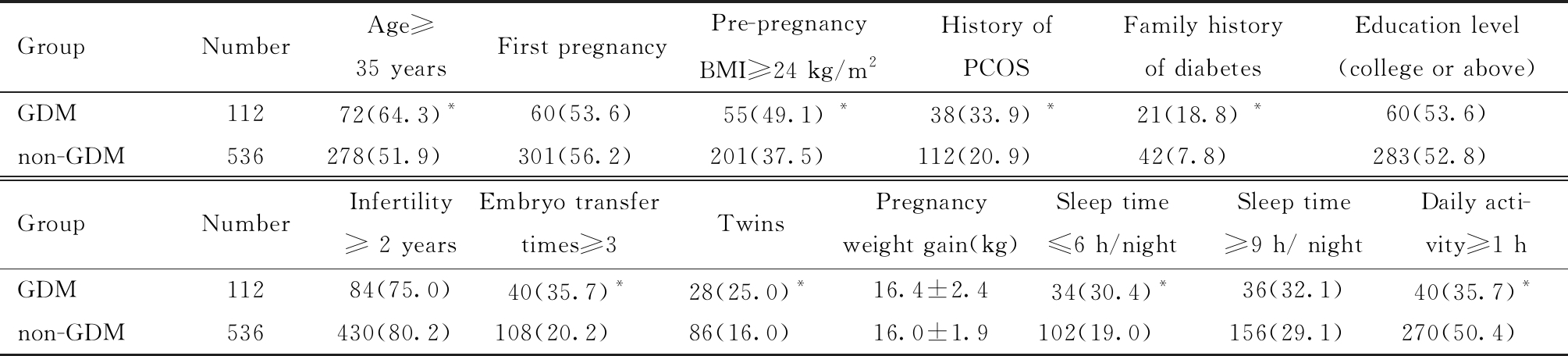
GroupNumberAge≥35 yearsFirst pregnancyPre-pregnancyBMI≥24 kg/m2History of PCOSFamily history of diabetesEducation level (college or above)GDM11272(64.3)* 60(53.6) 55(49.1) *38(33.9) *21(18.8) *60(53.6)non-GDM536278(51.9)301(56.2)201(37.5)112(20.9)42(7.8) 283(52.8)GroupNumberInfertility≥ 2 yearsEmbryo transfer times≥3TwinsPregnancy weight gain(kg) Sleep time≤6 h/nightSleep time≥9 h/ nightDaily acti-vity≥1 hGDM11284(75.0)40(35.7)*28(25.0)*16.4±2.4 34(30.4)*36(32.1)40(35.7)*non-GDM536430(80.2)108(20.2)86(16.0)16.0±1.9102(19.0)156(29.1)270(50.4)
Compared with the non-GDM group,*P<0.05

图1 试管婴儿孕妇GDM多因素logistic回归分析的森林图
Figure 1 Forest plot of multivariate logistic regression of risk factors of GDM in IVF-pregnant women
表2 三组孕产妇剖宫产率、并发症的比较 [例(%)]
Table 2 Comparison of cesarean section rate andgestational complications among three groups [n(%) ]
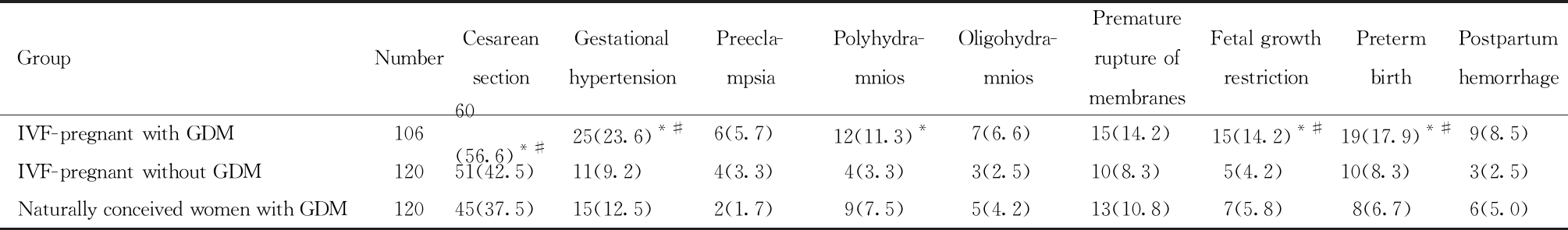
GroupNumberCesarean section Gestational hypertension Preecla- mpsia Polyhydra- mnios Oligohydra- mnios Premature rupture of membranes Fetal growth restriction Preterm birth Postpartum hemorrhage IVF-pregnant with GDM 10660(56.6)*#25(23.6)*#6(5.7)12(11.3)*7(6.6)15(14.2)15(14.2)*#19(17.9)*#9(8.5)IVF-pregnant without GDM 12051(42.5)11(9.2)4(3.3)4(3.3)3(2.5)10(8.3)5(4.2)10(8.3)3(2.5)Naturally conceived women with GDM12045(37.5)15(12.5)2(1.7)9(7.5)5(4.2)13(10.8)7(5.8)8(6.7)6(5.0)
*comparison between IVF-pregnant women with GDM and those without GDM, #comparison between IVF-pregnant women with GDM and naturally conceived women with GDM,*#P<0.05
表3 三组围产儿情况的比较 [例(%)]
Table 3 Comparison of perinatal outcomes among the three groups [n(%) ]

GroupNumberMacrosomiaLow birth weight infantsNeonatal asphyxiaIVF-pregnant with GDM 10614(13.2)*11(10.4)9(8.5)IVF-pregnant without GDM 1206(5.0) 7(5.8)6(5.0)Naturally conceived women with GDM12010(8.3) 5(4.2)8(6.7)
Compared with the group of IVF-pregnant without GDM,*P<0.05
讨 论
随着生活节奏的加快、工作压力的增加、环境污染的恶化、观念的转变及不断成熟的辅助生殖技术,越来越多的不孕症夫妇接受试管婴儿,满足妊娠需求。通过体外受精受孕的妇女患妊娠并发症的风险更高,包括GDM和高血压疾病等,风险的增加可能部分归因于多胎妊娠,但Qin 等[5]对试管婴儿单胎妊娠与相关并发症进行系统分析,发现试管婴儿受孕的单胎妊娠也显著增加GDM的风险(RR=1.31,95% CI:1.13~1.53)。GDM发病率逐年升高,可对母儿产生近期不良妊娠结局及增加远期患2型糖尿病及心血管疾病的几率[6-7],且试管婴儿妊娠显著增加GDM的风险,因此,有效预防和管理试管婴儿孕妇合并GDM,对改善妊娠结局、降低母婴并发症及有效预防成人2型糖尿病有重要意义。
一、试管婴儿孕妇GDM高危因素的分析
本研究结果显示,试管婴儿孕妇的GDM发生率高达17.3%,增加的风险可能是在寻求不孕不育治疗时往往年龄较大,由于年龄增长,患GDM的风险较高。但Ashrafi等[8]在排除了可能存在的混淆因素,包括年龄≥40岁孕妇、糖尿病一级亲属家族史、GDM史、巨大儿分娩史等,试管婴儿妊娠中GDM的发生率仍明显高于自然妊娠组。因此,即使在控制了混杂因素之后,试管婴儿仍增加GDM的发生率,表明试管婴儿作为一项辅助生殖技术,其程序本身可能有分子水平的改变,使孕妇易于罹患GDM[9]。
GDM发病原因比较复杂,是由多种易感基因-环境相互作用产生,与生活水平不断提高,尤其是孕妇日常生活、饮食、运动等多方面有关[10]。众多研究表明,高龄、肥胖、家族史是自然受孕GDM患病的高危因素[11-13]。对于试管婴儿孕妇,2017年Cai等[14]研究表明,孕早期BMI>25 kg/m2明显增加GDM的风险(OR=3.54,95% CI:1.44~8.72),并使空腹血糖及服糖后2 h血糖值升高,提出超重或肥胖的妇女在体外受精前减肥、控制体重,能减少妊娠糖尿病及相关不良后果的风险,但该研究采用的是1999年WHO GDM的诊断标准,而不是2013年修订的WHO诊断标准,且缺乏OGTT 1 h的血糖。本研究结果显示,除高龄、孕前BMI≥24 kg/m2、糖尿病家族史三个高危因素外,还有PCOS、接受胚胎移植次数≥3次、睡眠时间≤6 h均为试管婴儿孕妇GDM的独立危险因素。PCOS是常见的内分泌紊乱疾病,其增加GDM的患病风险可能与肥胖、胰岛素抵抗有关[15-16],高雄激素血症、试管婴儿孕前肥胖、对胎儿的珍贵、减少活动等加重脂肪蓄积,脂肪组织产生的炎性因子如白细胞介素(IL-6)、肿瘤坏死因子α(TNF-α)等增加,加重胰岛素抵抗,降低肝脏对胰岛素的清除,加之保胎药的应用等共同增加GDM发生的风险。
怀孕期间激素和身体的变化,会导致睡眠模式包括睡眠时间和睡眠质量的改变。2019年朱婧菡等[17]对睡眠时间与GDM的发病风险进行Meta分析,结果显示睡眠时间过短和过长均会增加GDM的风险。本研究发现,睡眠时间≥9 h组间差异无统计学意义,但睡眠时间≤6 h会增加试管婴儿孕妇GDM的风险(OR=1.94,95% CI:1.14~3.31),虽然目前孕妇睡眠不足与增加糖尿病风险的机制不明确,但在健康志愿者的实验研究中[18],睡眠被限制后,胰岛素敏感性降低了16%~24% ,没有代偿性胰岛素分泌增加,有可能是多种因素造成的,包括 交感神经活性升高,脑葡萄糖利用率降低,生长激素分泌和下丘脑-垂体-肾上腺轴改变,脂肪细胞功能异常,以及全身炎症反应增加,从而导致胰岛素抵抗。
目前,随着日益增多的GDM发生,人们呼吁正确的生活方式,以预防或阻碍疾病的发生发展。一项芬兰的GDM预防研究表明,坚持多运动的生活方式和富含水果、蔬菜和全麦谷物的饮食,可将患GDM的风险降低39%[19]。对于试管婴儿孕妇,Charkamyani等[20]研究表明,在保持积极生活方式干预的试管受精孕妇中,GDM的发病率显著降低。本研究结果显示,日活动量≥1 h为试管婴儿孕妇GDM的保护因素,孕期活动、锻炼可能通过改变骨骼肌葡萄糖摄取调节信号蛋白的表达,从而增加葡萄糖消耗和胰岛素敏感性,防止体重增加,降低GDM的发生。
二、 试管婴儿孕妇合并GDM妊娠结局的分析
既往报道认为,试管婴儿妊娠、GDM会增加不良妊娠结局的发生,严重影响孕产妇及胎儿健康,但对于试管婴儿孕妇合并GDM的妊娠结局,目前尚不明确。本研究结果显示,试管婴儿合并GDM的剖宫产率、妊娠期高血压、胎儿生长受限、早产发生率均明显高于试管婴儿非GDM及自然受孕GDM产妇。其可能原因为:(1)试管婴儿孕妇长期不孕,婴儿相对珍贵,害怕阴道试产增加新生儿的危险而选择剖宫产,加上产妇合并GDM,高血糖可能导致胎盘超微结构改变,如内质网肿胀,内质网应激诱导细胞凋亡,导致胎盘功能不全[21],容易诱发胎儿缺氧,使剖宫产率升高。(2)GDM糖代谢、脂代谢紊乱、血管生长因子、炎性介质、细胞因子等多因素、多方面致血管内皮功能障碍,血管收缩,导致妊娠期高血压[22-23];而且试管婴儿体外受精前控制性超促排卵(COH)影响免疫平衡[24],受孕后精神紧张,交感神经张力增加,激活肾素-血管紧张素-醛固酮系统(RAAS)等,共同增加妊娠期高血压的发病风险。(3)GDM胎盘中纤维素样坏死、脉络膜血管形成、缺血和绒毛不成熟显著增加等胎盘损伤影响胎儿生长发育,可能致胎儿并发症增加[25],试管婴儿与不孕症有关的因素或这些因素与体外受精程序相合,增加了产科不良妊娠结局的风险。(4)试管婴儿孕前存在宫腔操作史,子宫内膜的功能和形态可能会发生一系列的改变,子宫内膜容受性降低,进而引发早产;加之合并GDM引起其他并发症的发生,因病情需要提前终止妊娠,致早产、剖宫产率增加。
本研究结果显示,试管婴儿合并GDM产妇的羊水过多、巨大儿发生率明显高于试管婴儿非GDM,但与自然受孕GDM比较无差异,提示GDM致羊水过多、巨大儿发生增加,但试管婴儿并不增加此二类并发症的发生率。三组间子痫前期、羊水过少、胎膜早破、产后出血、低出生体重儿、新生儿窒息的发生率无统计学差异,这是由于研究入选时三组间的年龄、孕前BMI、双胎比例差异均无统计学意义,从而排除了年龄、肥胖及双胎对妊娠结局的干扰;另外,目前产检工作已普遍落实,定期复查、积极处理,及医疗水平的提高,有效控制了妊娠期高血压往子痫前期疾病的发展及产后出血、新生儿窒息等严重并发症的发生。但本研究对三组间妊娠结局的比较存在局限性,缺乏GDM关于血糖的信息,众所周知孕期对血糖的控制影响产科、新生儿并发症的发生率[26],但也有研究观察到GDM的胎盘血管病变在严格的代谢控制下仍然存在,并与胎儿和新生儿并发症的风险增加相关[25]。
综上所述,试管婴儿孕妇应关注GDM发生的各种危险因素,及早控制体重,适当运动,保持足够睡眠,有效预防GDM的发生。试管婴儿合并GDM的结合比任何一个单独因素的影响更大,因此应加强孕期管理,从而减少不良妊娠结局,保障母婴安全。但本研究所选病例局限于本院,地域差异无法兼顾,试管婴儿妊娠、GDM也存在个体差异,研究结果尚需要更大数据、大样本进一步证实。
1 Kissin DM,Jamieson DJ,Barfield WD.Monitoring health outcomes of assisted reproductive technology.N Engl J Med,2014,371:91-93.
2 Pandey S,Shetty A,Hamilton M,et al.Obstetric and perinatal outcomes in singleton pregnancies resulting from IVF/ICSI:a systematic review and meta-analysis.Hum Reprod Update,2012,18:485-503.
3 Zhu L,Zhang Y,Liu Y,et al.Maternal and live-birth outcomes of pregnancies following assisted reproductive technology:a retrospective cohort study.Sci Rep,2016,6:35141.
4 谢幸,孔北华,段涛.妇产科学.第九版.北京:人民卫生出版社,2018.
5 Qin J,Liu X,Sheng X,et al.Assisted reproductive technology and the risk of pregnancy -related complications and adverse pregnancy outcomes in singleton pregnancies:a meta-analysis of cohort studies .Fertil Steril,2016,105:73-85.
6 Hakkarainen H,Huopio H,Cederberg H,et al.Future risk of metabolic syndrome in women with a previous LGA delivery stratified by gestational glucose tolerance:a prospective cohort study.BMC Pregnancy Childbirth,2018,18:326.
7 Hakkarainen H,Huopio H,Cederberg H,et al.The risk of metabolic syndrome in women with previous GDM in a long-term follow-up.Gynecol Endocrinol,2016,32:920-925.
8 Ashrafi M,Gosili R,Hosseini R,et al.Risk of gestational diabetes mellitus in patients undergoing assisted reproductive techniques.Eur J Obstet Gynecol Reprod Biol,2014,176:149-152.
9 Sullivan-Pyke CS,Senapati S,Mainigi MA,et al.In Vitro fertilization and adverse obstetric and perinatal outcomes.Semin Perinatol,2017,41:345-353.
10 Mijatovic-Vukas J,Capling L,Cheng S,et al.Associations of Diet and Physical Activity with Risk for Gestational Diabetes Mellitus:A Systematic Review and Meta-Analysis.Nutrients,2018,10:698.
11 Ayd n H,Çelik Ö,Yaz
n H,Çelik Ö,Yaz c
c D,et al.Prevalence and predictors of gestational diabetes mellitus:a nationwide multicentre prospective study.Diabet Med,2019,36:221-227.
D,et al.Prevalence and predictors of gestational diabetes mellitus:a nationwide multicentre prospective study.Diabet Med,2019,36:221-227.
12 Eades CE,Cameron DM,Evans JMM.Prevalence of gestational diabetes mellitus in Europe:A meta-analysis.Diabetes Res Clin Pract,2017,129:173-181.
13 Najafi F,Hasani J,Izadi N,et al.The effect of prepregnancy body mass index on the risk of gestational diabetes mellitus:A systematic review and dose-response meta-analysis.Obes Rev,2019,20:472-486.
14 Cai S,Natarajan P,Chan JKY,et al.Maternal hyperglycemia in singleton pregnancies conceived by IVF may be modifified by first-trimester BMI.Hum Reprod,2017,32:1941-1947.
15 Yu HF,Chen HS,Rao DP,et al.Association between polycystic ovary syndrome and the risk of pregnancy complications:A PRISMA-compliant systematic review and meta-analysis.Medicine Baltimore,2016,95:e4863.
16 Rubin KH,Glintborg D,Nybo M,et al.Development and Risk Factors of Type 2 Diabetes in a Nationwide Population of Women With Polycystic Ovary Syndrome.J Clin Endocrinol Metab,2017,102:3848-3857.
17 朱婧菡,吕梦莲,尹洁云,等.睡眠时间与妊娠期糖尿病发病风险关系的Meta分析.现代预防医学,2019,46:1729-1747.
18 Broussard JL,Ehrmann DA,Van Cauter E,et al.Impaired insulin signaling in human adipocytes after experimental sleep restriction:a randomized,crossover study.Ann Intern Med,2012,157:549-557.
19 Koivusalo SB,Rönö K,Klemetti MM,et al.Gestational Diabetes Mellitus Can Be Prevented by Lifestyle Intervention:The Finnish Gestational Diabetes Prevention Study(RADIEL):A Randomized Controlled Trial.Diabetes Care,2016,39:24-30.
20 Charkamyani F,Hosseinkhani A,Samani LN,et al.Reducing the Adverse Maternal and Fetal Outcomes in IVF Women by Exercise Interventions During Pregnancy.Res Q Exerc Sport,2019,90:589-599.
21 Han Y,Zheng YL,Wu AM,et al.Effects of management in gestational diabetes mellitus with normal prepregnancy body mass index on pregnancy outcomes and placental ultrastructures:a prospective cohort study.Endocrine,2016,54:691-699.
22 Zhang J,Chi H,Xiao H,et al.Interleukin 6(IL -6)and Tumor Necrosis Factor α(TNF -α)Single Nucleotide Polymorphisms(SNPs),Inflammation and Metabolism in Gestational Diabetes Mellitus in Inner Mongolia.Med Sci Monit,2017,23:4149-4157.
23 王艳,查文慧,陈洋,等.妊娠期糖尿病与妊娠期高血压疾病病理机制的相关性.国际生殖健康/计划生育杂志,2020,39:63-66.
24 Jie Z,Yiling D,Ling Y.Association of assisted reproductive technology with adverse pregnancy outcomes.Iran J Reprod Med,2015,13:169-180.
25 Edu A,Teodorescu C,Dobjanschi CG,et al.Placenta changes in pregnancy with gestational diabetes.Rom J Morphol Embryol,2016,57:507-512.
26 李敏慧,胥红斌.妊娠期糖尿病血糖控制情况与妊娠结局的相关性研究.实用临床医药杂志,2019,23:106-108.