神经管畸形(neural tube defects, NTDs)是在胚胎发育过程中,表现出以神经管未闭引起的头部、脊柱部位畸形的出生缺陷疾病,包括无脑儿、脑膨出、脊柱裂[1]。由于NTDs是多病因、多层次复杂疾病,其作用机制尚不十分明确,目前研究发现,围孕期增补服用叶酸对胚胎发育早期有重要作用,可以有效降低NTDs的发生[2],但其具体机制还需要进一步阐明。由于体内强大的代偿机制,叶酸缺乏引起的NTDs的动物模型迄今尚未有建成的报道。
叶酸是一种水溶性B族维生素,不能被人体合成,需要通过饮食得到。进入体内被二氢叶酸还原酶(DHFR)形成有活性的四氢叶酸(THF),作为一碳单位的载体参与一碳单位的转运,四氢叶酸多聚谷氨酸接受和传递一碳单位介导细胞生物过程。胞浆中的叶酸介导一碳代谢有三个相互依赖的代谢过程,包括核苷酸的合成、胸苷酸的合成以及甲硫氨酸循环[3]。嘌呤合成N10-甲酰基四氢叶酸上的甲酰基提供了嘌呤环上的C-2的甲基。由胸苷酸合酶(TS)催化N5,10-亚甲基四氢叶酸携带一碳单位转移到脱氧鸟苷一磷酸(dUMP)上,形成脱氧胸苷一磷酸(dTMP)和二氢叶酸(DHF),DHF被还原成THF再次利用。本课题组前期依据叶酸代谢原理,选择抑制叶酸代谢通路中关键酶(二氢叶酸还原酶和胸苷酸合酶)靶点,诱导构建了NTDs小鼠模型。除dTMP是从dUMP转变而来,其他脱氧核苷酸是在二磷酸核糖水平上进行,由核苷酸还原酶催化形成的。核苷酸还原酶(ribonucleotide reductase,RR)负责将核糖核苷酸转化为脱氧核糖核苷酸,从而为DNA合成、修复生物过程提供所需的前体。羟基脲 (hydroxyurea,HU) 是迄今为止唯一用于临床的核糖核苷酸还原酶 (ribonucleotide reductase,RR) 抑制剂,主要机制是将自身的一个电子转移到RR小亚基酪氨酰自由基使其还原灭活,并可还原铁中心使其丢失结合的铁离子而抑制RR活性。HU将会阻断DNA合成的原料,直接影响DNA的合成[4-5]。利用神经嵴细胞增殖分化迁移形成神经管的关键时期,通过使用核苷酸还原酶的靶点抑制剂HU,观察NTDs小鼠模型中细胞增殖凋亡失衡对神经管发育的影响,并且与之前构建的叶酸代谢障碍的NTDs小鼠模型比较,为进一步研究NTDs的机制提供了新的动物模型。
材料与方法
一、材料与试剂
1. 实验动物:选用C57BL/6J小鼠,购买于北京华阜康公司,要求小鼠的年龄在7~8周,小鼠的体重在18~20 g,购买雌鼠60只和雄鼠30只,常规饲养于SPF级动物房,该研究由本单位的实验动物伦理委员会所批准(批准号:KSDWLL2017019)。
2. 试剂和仪器:注射用羟基脲 (HU;Sigma公司,美国);一步法动物组织活性蛋白提取试剂盒,Bradford法蛋白质定量检测试剂盒,Western Blot试剂盒(购买于生工生物工程公司),免疫组化试剂盒(北京中杉金桥生物技术有限公司),Cleaved Caspase-3抗体(CST,美国),PCNA 抗体(CST,美国),半胱天冬蛋白酶-3 (Caspase-3)抗体(CST,美国),β-actin 抗体(CST,美国);体式显微镜(OLYMPUS,SZ2-ILST、奥林巴斯有限公司)。
二、方法
1. 动物模型的诱导建立、标本采集及胚胎神经组织的病理切片:小鼠饲养一周后,选择晚上18∶00按照雄雌(1∶2)进行合笼,早上进行分笼,用镊子检查雌鼠的阴道,将有阴栓的挑选出来,并且标记为孕0.5 d(E 0.5)。按照随机分组的方法分为6组,实验组分为5组,在神经管闭合前的孕7.5 d(E 7.5),分别给予5种剂量的HU进行腹腔注射(即25 mg/kg、125 mg/kg、225 mg/kg、325 mg/kg、525 mg/kg,见表1);而正常对照,使用0.9%的氯化钠水溶液注射。断颈法处死,取出胚胎,然后剥离掉胎膜,观察胎鼠的情况、正常胚胎的数量、吸收胎的数量和畸形的数量,再次用磷酸缓冲盐溶液(PBS)清洗胎鼠,置于体视显微镜下观察畸形的具体情况。取材后用4%多聚甲醛固定,随后进行脱水,石蜡包埋,切片(厚度为5 μm)。标本以苏木精-伊红染色(HE 染色)。
动物模型诱导构建后,与前期本课题组建立的叶酸代谢中的关键酶-二氢叶酸还原酶(dihydrofolate reductase)抑制剂MTX(4.5 mg/kg)、胸苷酸合酶(thymidylate synthase, TS)抑制剂RTX(11.5 mg/kg)、5FU(12.5 mg/kg)诱导构建的不同模型的结果进行比较。
2. 检测神经上皮细胞的增殖和凋亡情况:采用免疫组化检测胚胎13.5 d端脑的神经上皮细胞的增殖情况,胎脑的石蜡切片脱蜡,脱水、抗原修复,增殖细胞核抗原 (PCNA) 的一抗浓度(1∶4 000),Caspase-3 一抗浓度(1∶1 000),其他步骤按照说明书进行,最后在显微镜下拍照统计分析。
3. Western blot检测正常对照组和NTDs组中PCNA蛋白和Cleaved Caspase-3蛋白的表达水平:利用PCNA抗体和Cleaved Caspase-3抗体对组织蛋白裂解液进检测,观察PCNA和Cleaved Caspase-3蛋白的表达水平在正常对照组和NTDs组中是否存在差异。收集胚胎13.5 d正常对照组和NTDs组的胎脑的神经组织,加入裂解液,置于冰上操作,提取组织中的总蛋白。采用Bradford法蛋白质定量检测蛋白,一抗PCNA(稀释比例1∶1 000)Cleaved Caspase-3(稀释比例1∶800),加入二抗(抗兔,稀释比例1∶2 000),采用Image J图像分析软件,以为β-actin内参,计算蛋白的相对表达水平。
4. 统计学处理:应用SPSS 23.0统计软件进行分析,本研究涉及到的数据为计量资料,两组均值的比较采用t检验,多组数据均值的比较采用方差分析,P < 0.05表示差异有统计学意义。
结 果
一、HU诱导神经管畸形小鼠的建立
在胚胎13.5 d(E 13.5)与正常对照组比较,随着HU剂量的增加,吸收胎的比率呈现逐渐增加,从4.7%增加到94.1%。伴随着HU剂量的增加,NTDs的发生率也在增加,在HU诱导225 mg/kg发生率最高,达到了最大畸形率(表1)。因此,225 mg/kg是诱导NTDs小鼠模型的最佳剂量。
二、HU诱导的NTDs小鼠胚胎体视镜结果和病理改变
选取最适剂量HU(225 mg/kg)诱导的13.5 d的胎鼠,对其进行观察,发现NTDs胎鼠与正常胎鼠外观比较,神经管发育闭合不全,主要呈现脑膨出的畸形表型。HE染色结果显示,HU诱导的NTDs胎鼠,其后脑未融合,组织结构紊乱,被一层间质和羊膜包裹,管腔不规则,界膜界限不清,室管膜边缘紊乱。正常胎鼠的神经管闭合完整,腔面发育良好,界膜平整,室管膜边缘整齐(如图1)。
三、HU诱导的NTDs小鼠模型与其他叶酸代谢通路障碍的NTDs小鼠模型的比较
本研究将HU诱导的NTDs小鼠模型,与前期本课题组建立的叶酸代谢中的关键酶-二氢叶酸还原酶(dihydrofolate reductase)、胸苷酸合酶(thymidylate synthase, TS)抑制剂-MTX(methotrexate)、RTX(raltitrexed)、5FU(fluorouracil)均通过腹腔注射诱导的模型,进行比较[6-8]。发现干扰叶酸代谢均可诱导NTDs表明,在诱导剂最适剂量下,NTDs发生率均在31.4%~42.3%之间。其中畸形率比较高的是5FU组,诱导出的畸形率在42.3%,随后是RTX,HU,MTX(表2)。其中NTDs大多数为露脑畸形。
四、HU诱导的小鼠模型的细胞增殖凋亡及与其他模型的比较
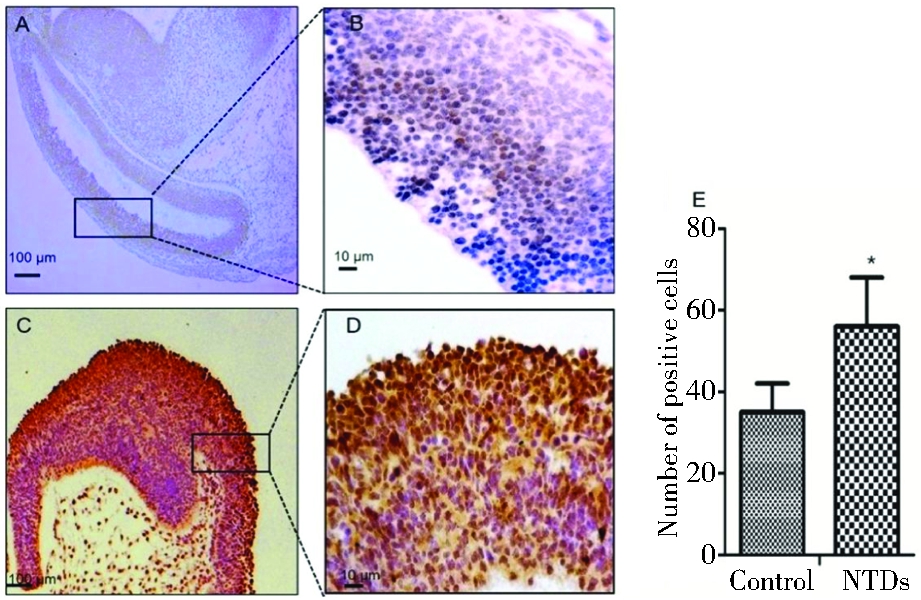
细胞增殖和凋亡贯穿于神经管发育的整个过程,Caspase-3是凋亡过程中重要的酶,可以代表细胞凋亡的情况;PCNA可以很好的反映细胞中DNA合成,是细胞增殖的特异性标记物。本研究选用HU最佳诱导剂量(225 mg/kg)诱导构建小鼠模型,对E13.5胎鼠端脑的神经上皮细胞进行了免疫组化的检测,在室管膜层和中间层中看到正常对照组的PCNA的阳性细胞高于畸形胚胎组(P<0.05,图2)。同时对Caspase-3进行了免疫组化的检测,在室管膜层和中间层中看到NTDs组Caspase-3的阳性细胞高于正常组(P<0.05,图3)。
表1 不同剂量HU对小鼠胚胎的影响
Table 1 The effects of different doses of HU on mouse embryos
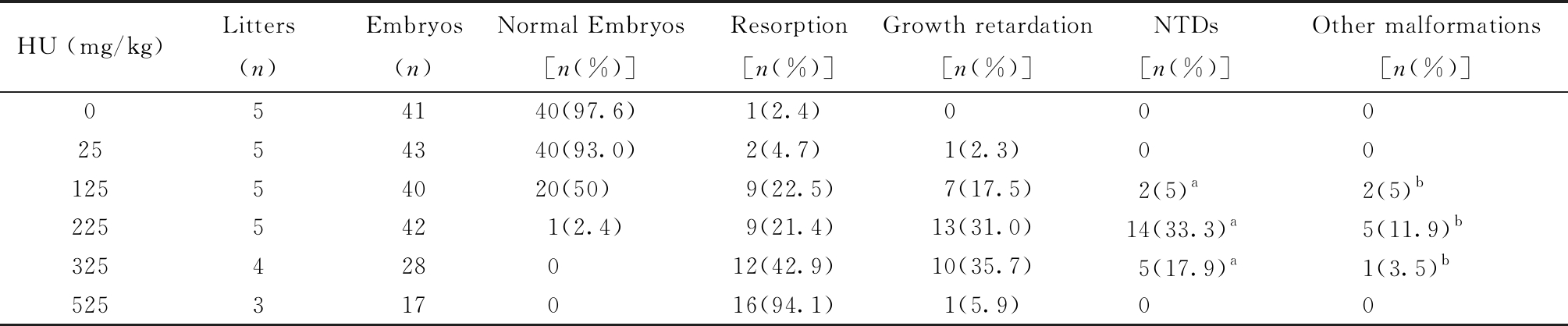
HU (mg/kg)Litters(n)Embryos(n)Normal Embryos[n(%)]Resorption[n(%)]Growth retardation[n(%)]NTDs[n(%)]Other malformations[n(%)]054140(97.6)1(2.4)0002554340(93.0)2(4.7)1(2.3)0012554020(50)9(22.5)7(17.5)2(5)a2(5) b2255421(2.4)9(21.4)13(31.0)14(33.3)a5(11.9)b325428012(42.9)10(35.7)5(17.9)a1(3.5)b525317016(94.1)1(5.9)00
a Exencephaly; b Facial malformation
表2 不同药物诱导对小鼠胚胎的影响
Table 2 The effects of different drugtreatment on mouse embryos
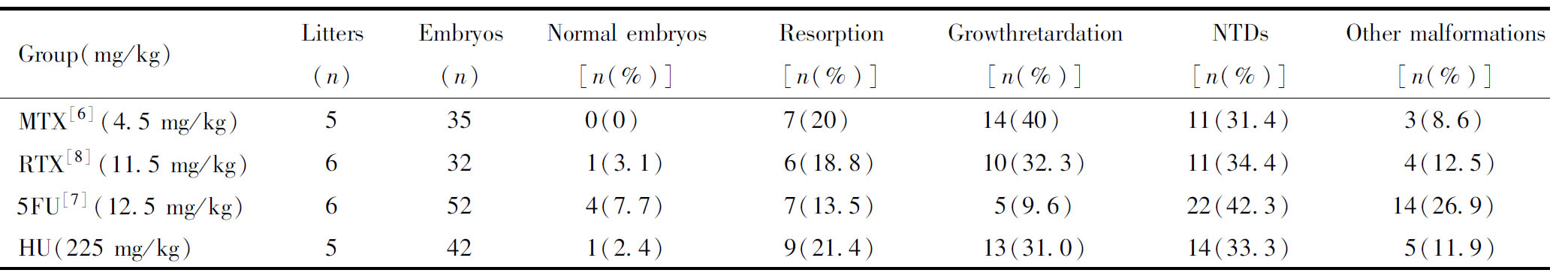
Group(mg/kg)Litters(n)Embryos(n)Normal embryos[n(%)]Resorption[n(%)]Growthretardation[n(%)]NTDs[n(%)]Other malformations[n(%)]MTX[6](4.5 mg/kg)5350(0) 7(20) 14(40) 11(31.4)3(8.6)RTX[8](11.5 mg/kg)6321(3.1)6(18.8)10(32.3)11(34.4)4(12.5)5FU[7](12.5 mg/kg)6524(7.7)7(13.5)5(9.6)22(42.3)14(26.9)HU(225 mg/kg)5421(2.4)9(21.4)13(31.0)14(33.3)5(11.9)
本研究利用Western blot检测HU(225 mg/kg)诱导的13.5 d的正常对照组的胎鼠和露脑畸形胎鼠神经组织的PCNA蛋白和Cleaved Caspase-3蛋白情况,并与课题组前期的3组不同诱导方式构建的NTDs小鼠模型进行比较[6-8] (见表3)。结果发现,PCNA蛋白在NTDs组中的表达水平低于正常对照组,并且差异有统计学意义(P<0.05,图4),和前期5FU诱导构建的NTDs小鼠模型相比较[7],均发现和增殖相关的PCNA蛋白在NTDs组明显低于正常对照组。
通过Western blot进一步验证凋亡的情况,与课题组前期诱导的3组不同的小鼠模型进行比较[6-8] (见表3),均发现Cleaved Caspase-3蛋白在NTDs组中的表达水平明显高于正常对照组,并且差异有统计学意义(P <0.05),其中HU组中略高于其他组(图5)。
表3 不同小鼠NTD模型中PCNA和Cleaved Caspase-3蛋白相对表达水平
Table 3 Expressions of PCNA and Cleaved Caspase-3 in embryonic neural tissuesfor different NTDs murine model.

GroupControlNTDsPPCNA HU3.48±0.841±0.49<0.05 5FU3.30±0.781±0.47<0.05Cleaved Caspase-3 HU1±0.292.89±0.61<0.05 MTX1±0.252.70±0.58<0.05 5FU1±0.261.98±0.50<0.05 RTX1±0.192.84±0.49<0.05

A:Expressions of PCNA in embryonic neural tissues of NTDs murine model induced by HU and 5FU. B:Fold changes of protein level. 图4 不同叶酸代谢通路中的PCNA蛋白的表达情况
Figure 4 Expression of PCNA proteins in different folic acid metabolic pathways

A:Expressions of Cleaved Caspase-3 in embryonic neural tissues of NTDs murine model induced by HU, MTX 5FU and RTX. B:Fold changes of protein level. 图5 不同叶酸代谢通路中的Cleaved Caspase-3的表达情况
Figure 5 Expression of Caspase-3 proteins in different folic acid metabolic pathways
讨 论
叶酸缺乏与NTDs密切相关,其分子机制是目前神经管发育中的研究热点。众所周知,叶酸缺乏引起叶酸及一碳单位代谢异常,后者是核酸合成与修复、甲基化等生物体重要生命活动不可缺少的原料。但叶酸缺乏通过哪个重要环节引起胚胎神经系统发育异常,即叶酸缺乏引起NTDs的核心机制是什么,目前尚无定论。单纯通过饮食缺乏叶酸构建的小鼠模型,大多数的表型为吸收胎和发育迟缓[9],因此需要制备出有NTDs表型的动物模型,来揭示叶酸缺乏引起NTDs的机制。
本课题组前期诱导出3种叶酸代谢障碍的NTDs小鼠模型,应用甲氨蝶呤抑制二氢叶酸还原酶[6];RTX、5FU抑制胸苷酸合成酶[7-8]分别阻断了由叶酸生成四氢叶酸及dUMP生成dTMP的过程。而HU阻断了由三磷酸核苷(NTP)生成脱氧核糖核苷三磷酸(dNTP)的过程,从而诱导出NTDs动物模型。通过比较发现,阻断叶酸代谢不同靶点,均可诱导出NTDs小鼠模型。叶酸是体内必须由食物供给的一种水溶性B族维生素。叶酸缺乏时,体内叶酸相关的代谢尤其是一碳单位的代谢发生紊乱,从而影响了核苷酸及胸苷酸的合成,影响蛋氨酸循环及多种物质的甲基化过程。因此叶酸在胚胎神经发育过程中发挥着重要的作用[10]。
NTDs是遗传因素(多基因遗传)和环境因素(叶酸缺乏、高温、高热、药物致畸、有害物质等)交互作用的结果。目前,已知有超过几百个基因的突变会导致小鼠NTDs的发生,在人群中同样发现这些基因与NTDs的发生相关[11],但基因突变小鼠模型改变了基因完整性,不能很好的模拟叶酸缺乏引起NTDs的真实情况。很早就有利用环境因素(高温)构建NTDs动物模型[12]来研究细胞增殖和凋亡对神经管闭合的影响。还有通过控制营养因素构建模型,研究结果显示孕鼠高糖引起神经上皮细胞过度凋亡,而细胞增殖受到抑制[13]。也有研究者选择了药物或者有害物质诱导构建小鼠NTDs模型。有的通过维甲酸灌胃诱导构建小鼠NTDs模型[14],在胚胎11.5 d时NTDs小鼠的脑部和脊椎观察到神经上皮细胞大面积的凋亡。有的研究者通过乙硫氨酸诱导NTDs小鼠模型,该模型中叶酸代谢产物降低,神经上皮细胞出现增殖和凋亡的失衡[15]。本研究通过HU诱导构建的NTDs小鼠模型中也发现了神经上皮细胞增殖和凋亡的失衡。这些研究为进一步揭示NTDs的发生机制提供了良好的动物模型。
细胞增殖和凋亡始终贯穿于神经管发育的整个过程,当环境因素改变会引起细胞增殖凋亡失衡,引起神经管闭合障碍。小鼠神经管的发育从E 7.5 d,开始出现神经板,E 8 d位于后脑和颈部交界的第一闭合点,以拉链方式同时向头侧方向和尾侧方向进行,分别形成将来的脑和脊髓,闭合失败会引起颅脊柱裂和开放式脊柱裂。在 E 9 d,位于中前脑和中脑的第二闭合点向头尾两端闭合,闭合失败会引起露脑畸形[16];位于前脑喙末端的第三闭合点单向闭合,闭合失败会造成颜面畸形[17]。本研究选择在孕7.5 d通过腹腔注射进行诱导,对第一闭合点和第二闭合点的影响最大,神经管闭合失败,因此,本研究诱导的4种NTDs小鼠模型中,其表型主要为露脑畸形,也有一部分颜面畸形。神经上皮细胞大量增殖,需要更多的DNA、RNA合成的原料[18]。而叶酸代谢通路参与了这些原料的合成过程,阻断代谢中关键酶的活性,造成代谢紊乱,发生DNA合成障碍。前期通过MTX诱导的NTDs小鼠中,观察到基因组不稳定性导致CNV的改变[19],细胞增殖凋亡异常,易引起结构缺陷。
胚胎发育是一个精准的生物调控过程,需要细胞的增殖和凋亡处于动态平衡。在神经管形成时期,细胞增殖旺盛其周期为4~6 h,在发育晚期细胞的增殖分裂速度才开始减慢。细胞凋亡有助于胚胎发育中脑泡的塑型,有报道,在孕8 d时,可以在胎脑的中脑发现大量的细胞凋亡[20]。神经管发育依赖神经上皮细胞增殖、凋亡相互平衡协调,如果这种平衡被打破,势必影响神经管发育,在本研究诱导的NTDs模型中发现,神经上皮细胞中的PCNA蛋白的表达水平在NTDs组显著降低,Caspase-3蛋白的表达水平在NTDs组中的表达水平明显高于正常对照组,其中HU组高于其他组。进一步通过免疫组化检测,发现在端脑的管壁室管膜层看到神经上皮细胞在周期性增殖的迁移,正常对照组的增殖高于畸形组,畸形组的凋亡高于正常对照组。DNA合成速率下降,DNA错掺比率增加,复制异常甚至DNA断裂影响修复,基因组不稳定性增加,诱导细胞发生过度凋亡。加剧了神经发育时期细胞增殖和凋亡的失衡。并且与本课题组前期诱导构建的叶酸代谢通路中其他3组不同靶点的NTDs小鼠模型进行比较,验证了叶酸涉及的不同的代谢途径可以独立地引起 NTDs 发生,同时再次验证和重复出细胞增殖凋亡失衡会引起NTDs的发生。
本研究从叶酸代谢障碍的角度,通过干扰新的叶酸相关代谢通路中的核苷酸还原酶,诱导构建出NTDs小鼠模型。并且与前期构建的NTDs小鼠模型进行比较,发现叶酸代谢涉及到的不同通路的异常,均可影响细胞增殖和凋亡的平衡,为进一步研究NTDs提供了更多的模型和思路,为NTDs的防控提供实验依据。
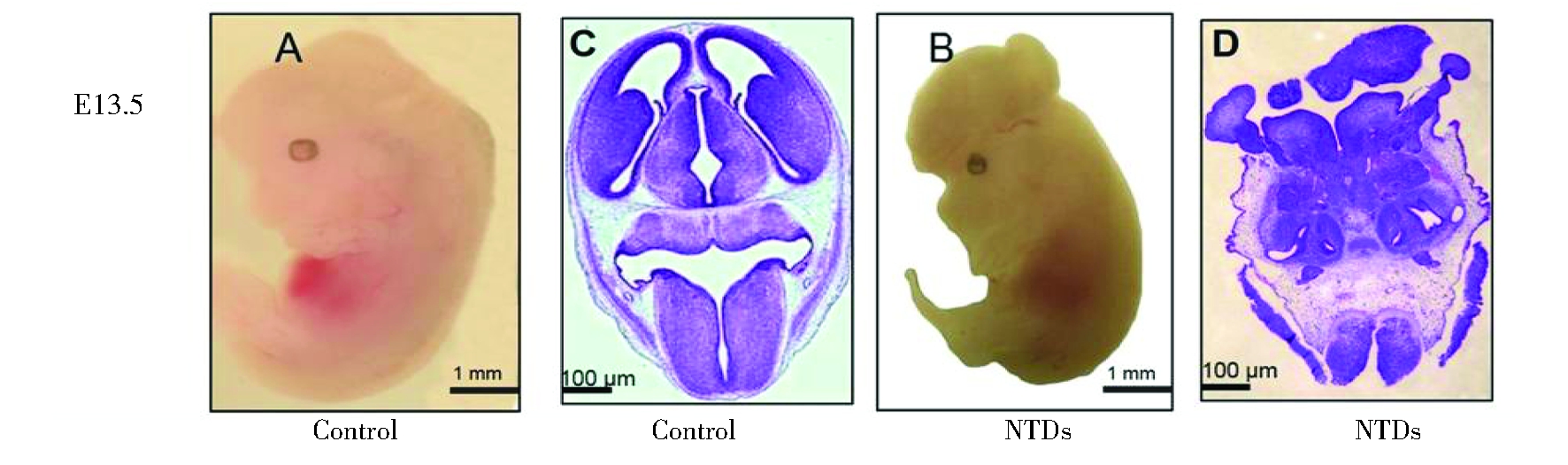
A-B showed theembryo development for control and HU treatment at GD13.5, under dissecting microscope (scale bars:1mm). A:control embryo; B:exencephaly. C-D showed the HE staining resultsfor control and exencephaly embryos at GD13.5 (scale bars:100um). C:control embryo; D:exencephaly.
图1 13.5 d正常胎鼠和HU诱导的脑膨出胎鼠的大体形态和HE染色情况
Figure 1 Morphological and HE staining results of normal and exencephaly embryos induced by HU at GD13.5.

A:PCNA immunohistochemical results of neuroepithelium from telencephalon in normal embryos. C:PCNA immunohistochemical results of neuroepithelium from telencephalon in exencephaly embryos. B, D:the magnification of black area in A and C, respectively.E:Statistical comparison on the number of positive cells.
图2 正常胎鼠和HU诱导的脑膨出胎鼠端脑的PCNA的免疫组化情况
Figure 2 Immunohistochemical analyses for the expressions of PCNA in the normal and exencephaly embryos induced by HU.
A:Caspase-3 immunohistochemical results of neuroepithelium from telencephalon in normal embryos. C:Caspase-3 immunohistochemical results of neuroepithelium from telencephalon in exencephaly embryos. B, D:The magnification of black area in A and C, respectively.E:Statistical comparison on the number of positive cells.
图3 正常胎鼠和HU诱导的脑膨出胎鼠端脑的Caspase-3的免疫组化情况
Figure 3 Immunohistochemical analyses for the expressions of Caspase-3 in the normal and exencephaly embryos induced by HU
1 Steele JW,Kim SE,Finnell RH.One-carbon metabolism and folate transporter genes:Do they factor prominently in the genetic etiology of neural tube defects?.Biochimie,2020,173:27-32.
2 Wallingford JB,Niswander LA,Shaw GM,et al.The continuing challenge of understanding,preventing,and treating neural tube defects.Science,2013,339:122-202.
3 Keunen K,Counsell SJ,Benders MJNL.The emergence of functional architecture during early brain development.Neuroimage,2017,160:2-14.
4 Cai CQ,Fang YL,Shu JB,et al.Association of neural tube defects with maternal alterations and genetic polymorphisms in one-carbon metabolic pathway.Ital J Pediatr,2019,45:37.
5 Liu J,Li Z,Ren A,et al.Folic acid supplementation and risk for congenital limb reduction defects in China.Int J Epidemiol,2019,48:2010-2017.
6 Zhao J,Guan T,Wang J,et al.Influence of the antifolate drug Methotrexate on the development of murine neural tube defects and genomic instability.J Appl Toxicol,2013,33:915-923.
7 Wang X,Guan Z,Dong Y,et al.Inhibition of thymidylate synthase affects neural tube development in mice.Reprod Toxicol,2018,76:17-25.
8 Dong Y,Wang X,Zhang J,et al.Raltitrexed′s effect on the development of neural tube defects in mice is associated with DNA damage,apoptosis,and proliferation.Mol Cell Biochem,2015,398:223-231.
9 Li B,Chang S,Liu C,et al.Low Maternal Dietary Folate Alters Retrotranspose by Methylation Regulation in Intrauterine Growth Retardation (IUGR) Fetuses in a Mouse Model.Med Sci Monit,2019,25:3354-3365.
10 Dong Y,Wang L,Ren A,et al.Gene variants in the folate pathway are associated with increased levels of folate receptor autoantibodies.Birth Defects Res,2018,110:973-981.
11 Zohn IE.Mouse Models of Neural Tube Defects.Adv Exp Med Biol,2020,1236:39-64.
12 Graham JM Jr.Update on the gestational effects of maternal hyperthermia.Birth Defects Res,2020,112:943-952.
13 Xu C,Chen X,Reece EA,et al.The increased activity of a transcription factor inhibits autophagy in diabetic embryopathy.Am J Obstet Gynecol,2019,220:108.e1-108.e12.
14 武荣.维甲酸致C57小鼠神经管畸形的实验动物研究.山西医科大学,2012:1-40.
15 Zhang L,Dong Y,Wang W,et al.Ethionine Suppresses Mitochondria Autophagy and Induces Apoptosis via Activation of Reactive Oxygen Species in Neural Tube Defects.Front Neurol,2020,11:242.
16 Caffrey A,McNulty H,Irwin RE,et al.Maternal folate nutrition and offspring health:evidence and current controversies.Proc Nutr Soc,2018,1-13.
17 Ji Y,Hao H,Reynolds K,et al.Wnt Signaling in Neural Crest Ontogenesis and Oncogenesis.Cells,2019,8:1173.
18 Leung KY,De Castro SC,Savery D,et al.Nucleotide precursors prevent folic acid-resistant neural tube defects in the mouse.Brain,2013,136:2836-2841.
19 Wang J,Wang X,Guan T,et al.Analyses of Copy Number Variation Reveal Putative Susceptibility Loci in MTX-Induced Mouse Neural Tube Defects.Dev Neurobiol,2014,74:877-893.
20 Cerrizuela S,Vega-Lopez GA,Aybar MJ.The role of teratogens in neural crest development.Birth Defects Res,2020,112:584-632.