宫颈癌是一种宫颈上皮细胞高度分化的恶性肿瘤,位列全球女性常见癌症第四位[1]。根据国际癌症研究机构(the International Agency for Research on Cancer,IARC)的最新统计数据显示,全球宫颈癌患者高达近52.7万人,其中2018年有近31.1万人死于此病,严重威胁着女性健康[1-2]。虽然包括手术治疗、放化疗在内的多种治疗方式对宫颈癌都有不错的治疗效果,然而其患者生存率依然极低[3-5]。因此,深入解析宫颈癌发生发展分子机制有助于探究新的有效可行的治疗策略。
临床数据显示,人乳头瘤病毒(human papillomavirus,HPV)DNA检测为阳性被认为是宫颈癌发病的高危因素[6]。然而,健康妇女中亦有HPV阳性表达,但是仅有少部分发展为宫颈癌[7]。因此,HPV并非为宫颈癌的唯一诱因。近年来,越来越多的研究发现,基因遗传的多态性也参与宫颈癌的发生发展,然而机制不详[8]。微小RNA(micro RNAs,miRNAs)是一种长约18~25个核苷酸的高度保守的非编码RNA,其与信使RNA结合而调节基因的表达。miRNAs调节机体的多个生理和病理学过程,包括癌症细胞的增殖分化、凋亡、侵袭和转移[9-10]。有研究报道,miR-499通过与PTEN、p21和MMP7结合,促进口咽癌增殖、迁移和侵袭[11-12],提示miR-499可能参与宫颈癌的发生发展。
最新研究证实,microRNA的遗传变异与宫颈癌发生发展相关[13]。成熟miR-499基因rs37346444位点单核苷酸多态性(single nucleotide polymorphism,SNP)与宫颈癌和肺癌等多种癌症发生发展密切相关[13-14]。miR-499 A/G具有抑制凋亡作用[15]。调控靶点包括转录因子Sox4、Sox6和CD200等[16],其中Sox6参与调控机体的多个生物学过程,包括红血球母细胞的增殖,中间神经节向皮质中心神经元的正常定位和成熟等[16]。此外,Sox6参与调控子宫内膜癌、体外抑制白血病细胞增殖[17]。由此可见,Sox6与癌症发病机制关系密切。然而,并未见Sox6在宫颈癌发生发展中相关报道。因此,本研究体外探讨miR-499 rs3746444位点多态性是否通过Sox6影响宫颈癌细胞增殖生长,为宫颈癌的诊断提供更好的生物标记和发病机制说明。
资料与方法
一、临床资料与样本采集
招募自2012年6月至2018年12月于内蒙古自治区人民医院就诊的857例宫颈癌患者作为实验组(宫颈癌组),年龄23~62岁。病理类型包括腺癌 (epitheloid cervical carcinoma, SCC) 523例、鳞癌234例和腺鳞癌98例;根据国际妇产科联盟 (International Federation of Gynecology and Obstetrics,FIGO) 之宫颈癌分期标准进行分期,其中Ⅰ期34例、Ⅱ期238例、Ⅲ期363例、Ⅳ期222例。分化程度包括高分化34例、中分化238例和低分化560例。873例同期健康志愿者作为对照组,年龄23~62岁。所选研究对象均由专业医师经盲法病理诊断证实,术前均未进行任何干预治疗。根据临床病历获得包括年龄、癌症分期、肿瘤尺寸、淋巴结转移等临床病例特征信息、HPV检测结果及实验组肿瘤大小及相关病理学检查结果。本研究经本院伦理委员会审核批准,所有研究对象均了解研究内容并签署知情同意书。
二、方法
1.主要试剂与仪器:实验期间收集各组人群外周血并分离血浆,宫颈癌患者收集肿瘤病变组织和癌旁组织共同冻存于-80℃备用。人宫颈上皮永生化细胞H8和人宫颈癌细胞系,即腺癌样SiHa、上皮样HeLa和C33A细胞购自中国科学院上海细胞库,外周血全基因组DNA提取纯化试剂盒与基因分型PCR Mix购自武汉擎科生物科技有限公司,miR-499 rs3746444位点TaqMan探针引物购自上海生工生物科技有限公司,pcDNA3.1-Sox6 (cDNA全长序列)质粒购自北京奥科生物科技有限公司,Lipo2000、DMEM高糖培养基购自美国Thermo Fisher公司,胎牛血清购自美国Ausgene公司,CCK-8试剂盒购自碧云天生物技术研究所,RIPA裂解液、Cocktail、磷酸化酶抑制剂、BCA 蛋白浓度测定试剂盒、ECL显影液和HRP-小鼠抗兔二抗购自武汉塞维尔生物技术有限公司,兔抗人Sox6、b-actin、Cyclin D1、Cyclin E1、CDK4和CDK6抗体购自武汉爱博泰克生物科技有限公司。
2. 血液基因组提取和miR-499 rs3746444位点基因分型:抽取受试者5 mL外周血,依据外周血全基因组DNA提取纯化试剂盒,提取DNA后检测OD260/OD280比例,并冻存于-80℃。取10 ng作为反应模板,按照TaqMan探针法对rs3746444位点的多态性进行基因分型。引物序列为上游5′‐CAAAGTCTT CACTTCCCTGCCA‐3′、下游5′‐GATGTTTAACTCCTCTCCACGTGATC‐3′。根据说明书采用10 ul体系进行PCR反应,完毕后在ABI 7900HT仪器上读板,获得分型结果。
3. 构建基于荧光素酶的报告质粒:设计Sox6 3′UTR全长成对PCR扩增引物、Sox6引物上游5′-GACATTTCGCTCCCTTTCCC-3′、下游5′-ACTGTGGCAGCCTTGCTCAT -3′,将PCR产生亚克隆到pGL3-无启动子荧光素酶的质粒中。设计针对人基因组DNA的PCR扩增引物,引物序列为上游5′- AGGTGAGGTCCAGACTGGGG - 3′、下游 5′- TGGTTAGGGACCAGAGGGGA -3′,基于PCR的点突变构建含有miR-499的GG和AA基因型的pSilence 2.1-U6质粒。
4. 双荧光素酶报告基因测定: 接种于12孔板的Hela和SiHa细胞,24 h采用3 mL 的Lipo2000转染pGL3- Sox6 3′UTR和miR-499的GG或AA的pSilence 2.1-U6质粒48 h后,收集细胞并用Fluoroskan酶标仪测量每组的荧光素酶活性,每组复孔3个,独立重复3次。
5. 细胞增殖实验: 使用试剂盒-8测定细胞活力。将细胞以每孔1×104个细胞的密度接种到96孔板中; 在24 h后,加入CCK-8溶液(每孔含10 μl,含有100 μl培养基)。将板在37℃下孵育4 h,然后测量450 nm处的吸光度。所有实验复孔3个,重复3次。
6. Western blot 实验: 用含有PMSF的RIPA裂解缓冲液裂解提取处理的Hela和SiHa总蛋白质,BCA法检测蛋白浓度。30 μg通过在8%SDS-聚丙烯酰胺凝胶上电泳分离蛋白质,转移到PVDF膜上,5% BSA封闭30 min后,4℃一抗孵育12 h。兔多克隆抗Sox6抗体(1∶800),抗CyclinD1抗体(1∶800)和抗CyclinE抗体(1∶800),抗CDK4抗体(1∶1 000)和抗CDK6抗体(1∶1 000),以抗b-actin抗体(1∶2 000)作为上样对照。HHRP-小鼠抗兔二抗IgG二抗(1∶5 000)孵育1 h,并使用ECL显影液显色,以Image J分析灰度变化。
7. 统计学处理: 应用SPSS 23.0软件进行统计学分析,计量资料以![]() 表示,两组比较采用Student′t检验,检验水平a为0.05(双尾),P<0.05为差异有统计学意义,统计图均采用Graphpad Prism 7.0作图。
表示,两组比较采用Student′t检验,检验水平a为0.05(双尾),P<0.05为差异有统计学意义,统计图均采用Graphpad Prism 7.0作图。
结 果
一、研究对象临床病理资料分析
结果如表1所示。宫颈癌组和对照组的年龄分布无明显差异。宫颈癌组HPV16阳性率为97.5%,HPV18阳性率为96.0%,明显高于对照组(HPV16为0.2%;HPV18为0.1%),符合临床诊断标准。
表1 宫颈癌病人临床病理参数特点[例(%)]
Table 1 Characteristics of clinicopathological parameters of patients with cervical cancer [n(%)]

Clinicopathological parametersControl group(N=873)Cervical cancer group (N=857)Age(year) <30264(30.2)284(33.1) 30≤-<55255(29.2)245(28.6) ≥55354(40.6)328(38.3)Tumor size(cm) <4—576(67.2) ≥4—281(32.8)HPV16 <35 (Negative)871(99.8)21(2.5) ≥35 (Positive)2(0.2)836(97.5)HPV18 <35 (Negative)872(99.9)34(4.0) ≥ 35 (Positive)1(0.1)823(96.0)Cancer type Adenocarcinoma—525(61.3) Squamous cell carcinoma—234(27.3) Adenosquamous cell carcino-ma—98(11.4)FIGO cancer staging Ⅰ—34(4.0) Ⅱ—238(27.8) Ⅲ—363(42.4) Ⅳ—222(25.9)Differentiation High—34(4.0) Moderate—238(27.8) Complicate—585(68.3)
二、miR-499基因位点rs3746444基因型频率分布
miR-499基因rs3746444位点基因型频率分布结果如表2所示。Hardy-Weinberg 遗传平衡定律检验miR-499基因rs3746444位点的基因型及等位基因频率在健康志愿者中的分布均符合遗传平衡,通过校正年龄的混杂因素影响后,AG和GG基因型宫颈癌发生风险分别是AA基因型个体的1.1倍和2.4倍,携带G等位基因的个体患宫颈癌的风险是AA基因型个体的1.3倍,差异均具有统计学意义(P<0.001)。
表2 宫颈癌患者和健康志愿者miR-499基因rs3746444位点基因型频率分布
Table 2 The genotype frequency distribution of miR-499 gene rs3746444 in cervical cancer patients and healthy volunteers, n(%)
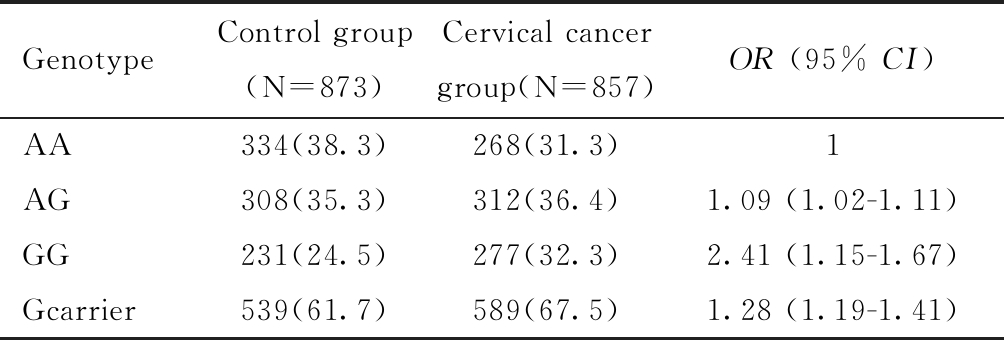
GenotypeControl group (N=873) Cervical cancer group(N=857)OR (95% CI)AA334(38.3)268(31.3)1AG308(35.3)312(36.4)1.09 (1.02-1.11)GG231(24.5)277(32.3)2.41 (1.15-1.67)Gcarrier539(61.7)589(67.5)1.28 (1.19-1.41)
三、 rs3746444基因型在宫颈癌患者临床特征中的分层分析
宫颈癌患者中,GG基因型在55岁及以上妇女中比例最低(9.0%),与AA基因型(71.1%)相比,差异具有统计学意义。GG基因型个体HPV16和HPV18型阳性率均比AA基因型高,差异具有统计学意义。从肿瘤尺寸来看,GG基因型宫颈癌患者肿瘤与AA基因型比较,差异无统计学意义。AA基因型中I、II、III和IV型癌症分期比例与GG基因型的癌症分布差异具有统计学意义,GG基因型宫颈癌患者II期和IV的比例显著高于AA基因型。其次,从肿瘤分化程度来看,AA基因型患者肿瘤分化程度与GG基因型患者相比,两种基因型在肿瘤分化程度上的分布差异具有统计学意义。见表3。
四、miR-499 rs3746444基因型调节宫颈癌相关细胞体外增殖能力情况
为了研究miR-499 rs3746444对Sox6蛋白表达与细胞增殖作用影响,通过构建突变质粒并转染细胞检测细胞活力。rs3746444不同基因型对正常宫颈H8细胞的增殖无显著影响(图1)。miR-499 GG+Sox6-3′UTR处理组Hela、C33A和SiHa细胞72 h时OD450显著低于miR-499 AA+Sox6-3′UTR组,且高于Sox6-3′UTR组(P均<0.05)。
表3 miR-499基因位点rs3746444基因型在宫颈癌患者临床特征中的分层分析[例(%)]
Table 3 Stratified analysis of miR-499 locus rs3746444 genotype in the clinical characteristics of cervical cancer patients, n(%)
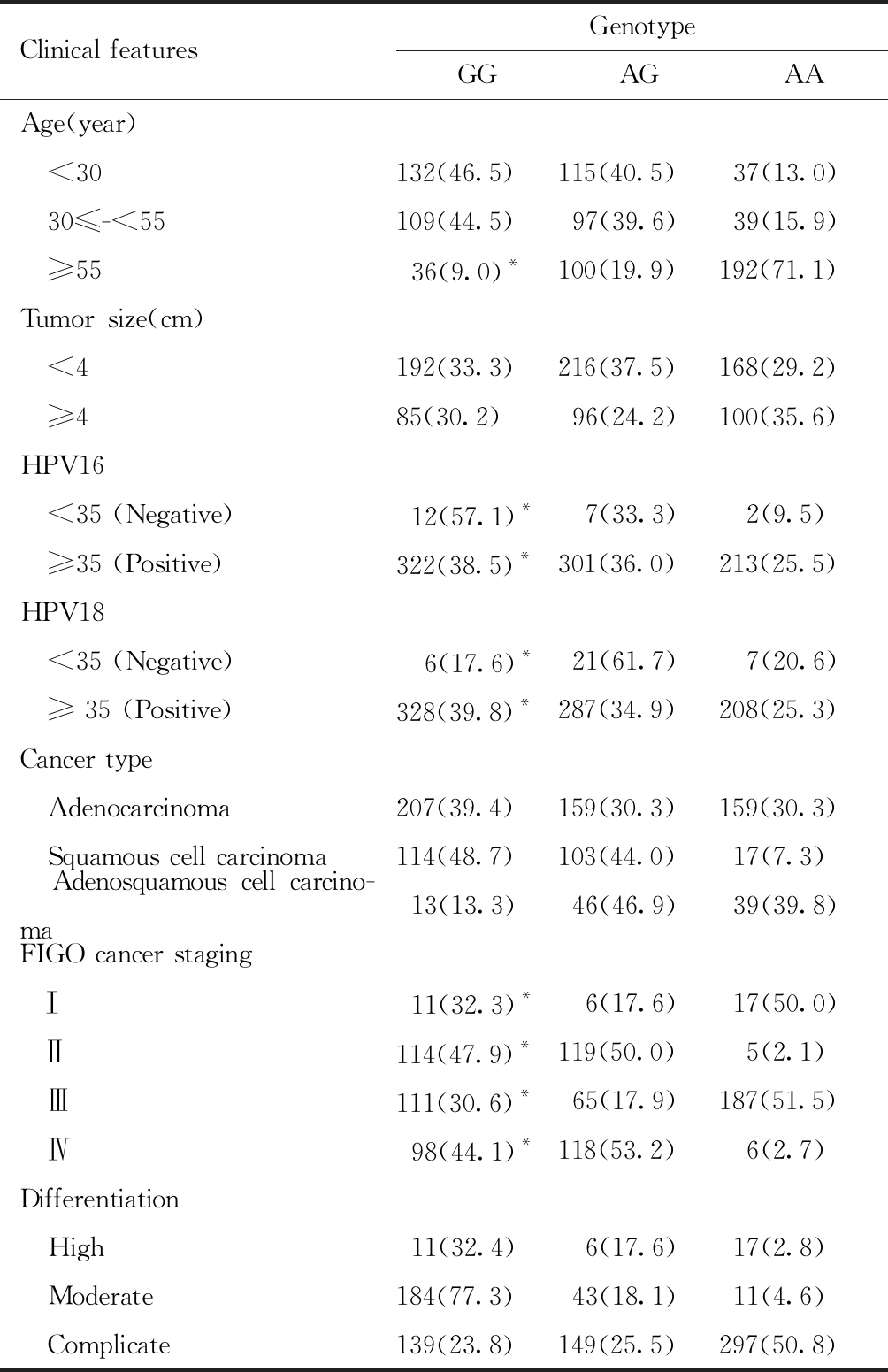
Clinical featuresGenotypeGGAGAAAge(year) <30132(46.5)115(40.5)37(13.0) 30≤-<55109(44.5)97(39.6)39(15.9) ≥5536(9.0)*100(19.9)192(71.1)Tumor size(cm) <4192(33.3)216(37.5)168(29.2) ≥485(30.2)96(24.2)100(35.6)HPV16 <35 (Negative)12(57.1)* 7(33.3) 2(9.5) ≥35 (Positive)322(38.5)*301(36.0)213(25.5)HPV18 <35 (Negative) 6(17.6)*21(61.7) 7(20.6) ≥ 35 (Positive)328(39.8)*287(34.9)208(25.3)Cancer type Adenocarcinoma207(39.4)159(30.3)159(30.3) Squamous cell carcinoma114(48.7)103(44.0)17(7.3) Adenosquamous cell carcino-ma13(13.3)46(46.9)39(39.8)FIGO cancer staging Ⅰ11(32.3)* 6(17.6)17(50.0) Ⅱ114(47.9)*119(50.0) 5(2.1) Ⅲ111(30.6)*65(17.9)187(51.5) Ⅳ98(44.1)*118(53.2) 6(2.7)Differentiation High11(32.4) 6(17.6)17(2.8) Moderate184(77.3)43(18.1)11(4.6) Complicate139(23.8)149(25.5)297(50.8)
Compared with AA,*P<0.05
五、miR-499 A/G对人宫颈癌Hela和SiHa细胞周期相关蛋白表达的影响
如图2所示,miR-499 GG+Sox6-3′UTR处理组Hela和SiHa细胞Cyclin D1、CyclinE、CDK4和CDK6显著高于miR-499 AA+Sox6-3′UTR组,低于Sox6-3′UTR组(P<0.05)。
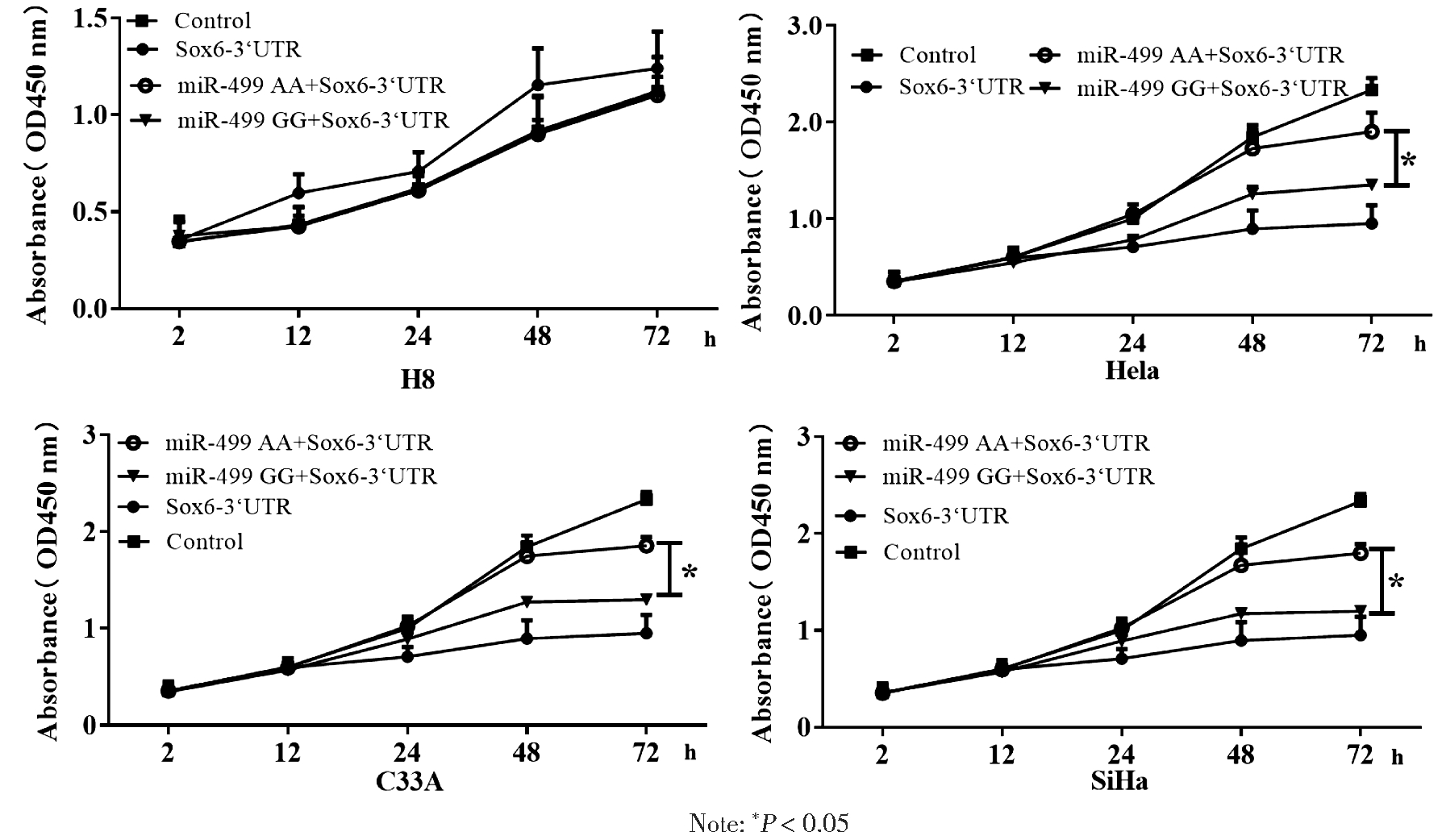
图1 miR-499 A/G对不同宫颈癌细胞系增殖能力的影响
Figure 1 Effects of miR-499 A/G on the proliferation of different cervical cancer cell lines

图2 miR-499 A/G对宫颈癌Hela和SiHa细胞周期相关蛋白的影响
Figure 2 The effect of miR-499 A/G on cell cycle-related proteins of cervical cancer Hela and SiHa
六、miR-499 A/G对人宫颈癌Hela和SiHa细胞Sox6蛋白表达水平的影响
如图3所示,与miR-499 AA+Sox6-3′UTR处理组相比,miR-499 GG+Sox6-3′UTR处理组Sox6的表达水平增加(P<0.05)。且均低于Sox6-3′UTR对照组(P<0.05)。
七、miR-499 A/G对人宫颈癌Hela细胞Sox6转录活性的影响
如图4所示,与Control组相比,miR-499 AA处理组的Sox6 3′UTR WT的fre y和Renilla荧光素酶活性显著降低,miR-499 GG处理组的Sox6 3′UTR WT的fre
y和Renilla荧光素酶活性显著降低,miR-499 GG处理组的Sox6 3′UTR WT的fre y和Renilla荧光素酶活性没有明显的变化,miR-499 AA处理组fre
y和Renilla荧光素酶活性没有明显的变化,miR-499 AA处理组fre y和Renilla荧光素酶活性显著低于miR-499 GG处理组(P<0.05)。Control,miR-499 AA,miR-499 GG处理组的Sox6 3′UTR 突变的fre
y和Renilla荧光素酶活性显著低于miR-499 GG处理组(P<0.05)。Control,miR-499 AA,miR-499 GG处理组的Sox6 3′UTR 突变的fre y和Renilla荧光素酶活性之间没有明显的变化。
y和Renilla荧光素酶活性之间没有明显的变化。

图3 miR-499 A/G对人宫颈癌细胞系Hela和SiHa细胞SOX6蛋白表达水平的影响
Figure 3 The effect of miR-499 A/G on the expression of Sox6 protein in human cervical cancer cell lines Hela and SiHa
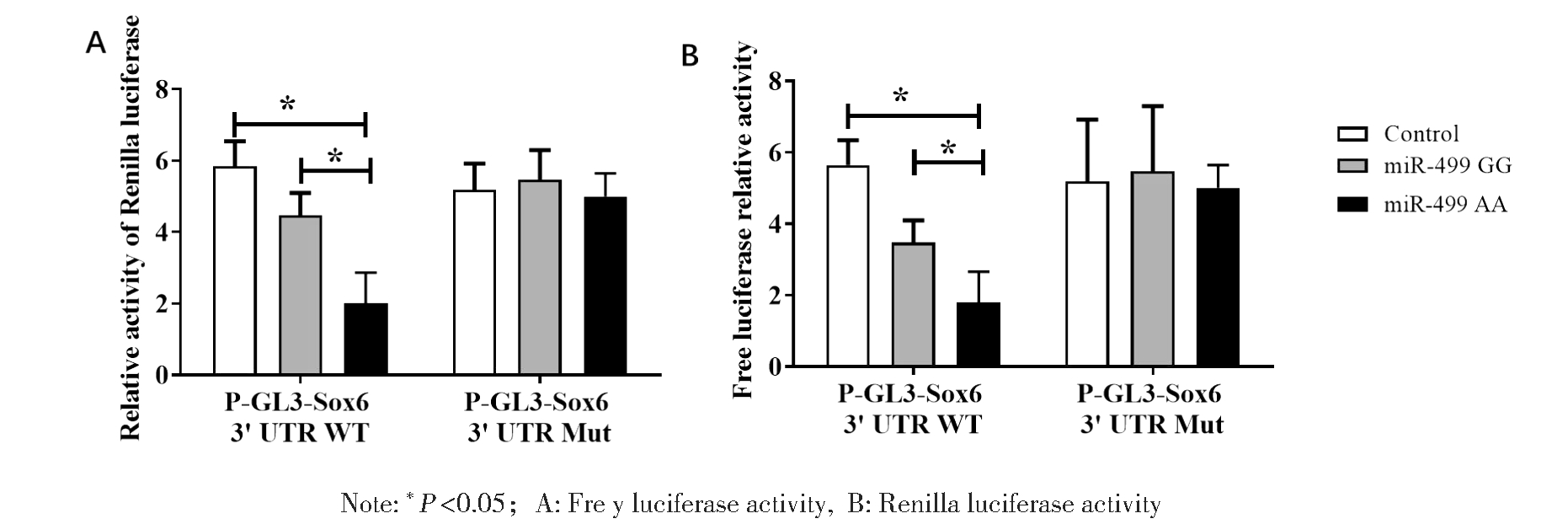
图4 过表达miR-499 GG基因型抑制Sox6野生型荧光素酶活性
Figure 4 Overexpression of miR-499 GG genotype inhibits Sox6 wild-type luciferase activity
讨 论
宫颈癌是当今威胁女性健康的重大癌症之一,临床研究证实早期诊断和治疗干预能够及时有效治疗宫颈癌[3]。除了寻找新的宫颈癌诊断标志物外,进一步了解宫颈癌发生的病理分子机制对于开发更有针对性和有效的治疗方法是至关重要的[8]。近年来,越来越多的研究发现机体miRNA的异常表达与癌症的发生具有强烈的关联性,这些miRNA可以作为癌症的预测和预后的分子标记[18-20]。
早期研究证实,miR-499等遗传变异对宫颈癌的恶化密切相关,其rs3746444突变(A>G)具有明显患宫颈癌的可能[20]。在本研究中对选取的宫颈癌患者标本进行基因分型分析发现,miR-499 GG的宫颈癌患者比AA患者的发生风险明显升高。并且GG表型比AA表型的宫颈癌患者都表现为高度分化,这与以往的研究报道一致[21],揭示GG表型具有抑制凋亡的作用及对宫颈癌恶化的重要性。前期对心肌细胞分化研究证实,miR-499可与转录因子Sox6和Cyclin D1作用调控细胞增殖和凋亡[15-16]。本研究亦发现,miR-499可结合Sox6的3′-UTR影响其转录,其GG突变上调Sox6蛋白介导的细胞周期蛋白表达,促进细胞增殖生长。
综上所述,宫颈癌miR-499的rs3746444突变(A>G)对宫颈癌细胞生长具有明显的促进作用,且与其Sox6介导的细胞周期蛋白CyclinD1上调密切相关。本研究结果为miR-499的rs3746444突变(A>G)用于宫颈癌的诊断和治疗提供了实验依据。同时揭示其突变可作为宫颈癌的危险因子,对临床宫颈癌诊断和治疗意义重大。
1 Zhao F,Qiao Y.Cervical cancer prevention in China:a key to cancer control.Lancet,2019,393:969-970.
2 Dos Sntos LN,Castaneda L,de Aguiar SS,et al.Health-related Quality of Life in Women with Cervical Cancer.Rev Bras Ginecol Obstet,2019,41:242-248.
3 Sun H,Shen K,Cao D.Progress in immunocytochemical staining for cervical cancer screening.Cancer Manag Res,2019,11:1817-1827.
4 Lea CS,Perez-Heydrich C,Des Marais AC,et al.Predictors of Cervical Cancer Screening Among Infrequently Screened Women Completing Human Papillomavirus Self-Collection:My Body My Test-1. J Womens Health (Larchmt),2019,28:1094-1104.
5 Matsuo K,Shimada M,Nakamura K,et al.Predictors for pathological parametrial invasion in clinical stage IIB cervical cancer.Eur J Surg Oncol,2019,45:1417-1424.
6 Pruski D,Millert-Kalinska S,Lewek A,et al.Sensitivity and specificity of hr hPV E6/E7 mrna test in detecting cervical squamous intraepithelial lesion and cervical cancer.Ginekol Pol,2019,90:66-71.
7 Kim M,Lee H,Kiang P,et al.HPV Vaccination and Korean American College Women:Cultural Factors,Knowledge,and Attitudes in Cervical Cancer Prevention.J Community Health,2019,44:646-655.
8 Murakami N,Kobayashi K,Shima S,et al.A hybrid technique of intracavitary and interstitial brachytherapy for locally advanced cervical cancer:initial outcomes of a single-institute experience.BMC Cancer,2019,19:221-229.
9 Li T,Li M,Xu C,et al.miR146a regulates the function of Th17 cell differentiation to modulate cervical cancer cell growth and apoptosis through NFkappaB signaling by targeting TRAF6. Oncol Rep,2019,41:2897-2908.
10 Wang L,Wang W,Wu Y.MicroRNA-26b acts as an antioncogene and prognostic factor in cervical cancer.Oncol Lett,2019,17:3418-3424.
11 Zhang X,Gee H,Rose B,et al.Regulation of the tumour suppressor PDCD4 by miR-499 and miR-21 in oropharyngeal cancers.BMC Cancer,2016,16:86-97.
12 Wang L,Zhang N,Wang Z,et al.Pseudogene PTENP1 Functions as a Competing Endogenous RNA (ceRNA) to Regulate PTEN Expression by Sponging miR-499-5p.Biochemistry (Mosc),2016,81:739-747.
13 Thakur N,Singhal P,Mehrotra R,et al.Impacts of single nucleotide polymorphisms in three microRNAs (miR-146a,miR-196a2 and miR-499) on the susceptibility to cervical cancer among Indian women.Biosci Rep,2019,39:29-39.
14 Yu H,Wang Y,Wang S,et al.Association between miR-499 rs3746444 and the susceptibility of hepatocellular carcinoma.Cell Mol Biol (Noisy-le-grand),2016,62:42-45.
15 Ding W,Li M,Sun T,et al.A polymorphism rs3746444 within the pre-miR-499 alters the maturation of miR-499-5p and its antiapoptotic function.J Cell Mol Med,2018,22:5418-5428.
16 Jia Z,Wang J,Shi Q,et al.SOX6 and PDCD4 enhance cardiomyocyte apoptosis through LPS-induced miR-499 inhibition.Apoptosis,2016,21:174-183.
17 Barbarani G,Fugazza C,Barabino S,et al.SOX6 blocks the proliferation of BCR-ABL1(+) and JAK2V617F(+) leukemic cells.Sci Rep,2019,9:3388-3396.
18 Zhu X,Hou R,Ma A,et al.Associations of miR-146a,miR-149,miR-196a2,and miR-499 Polymorphisms with Ischemic Stroke in the Northern Chinese Han Population.Med Sci Monit,2018,24:7366-7374.
19 Kim YR,Hong SH.Associations of MicroRNA Polymorphisms (miR-146a,miR-196a2,and miR-499) with the Risk of Hypertension in the Korean Population.Genet Test Mol Biomarkers,2016,20:420-426.
20 Yang X,Yan Z,Yang H,et al.Clinical value of combined detection of miR-1202 and miR-195 in early diagnosis of cervical cancer.Oncol Lett,2019,17:3387-3391.
21 Thakur N,Singhal P,Mehrotra R,et al.Impacts of Single Nucleotide Polymorphisms in three MicroRNAs (miR-146a,miR-196a2 and miR-499) on Susceptibility to Cervical Cancer among Indian Women.Biosci Rep,2019,39:723-734.