动脉导管是胎儿时期降主动脉与肺动脉之间的正常通道,足月儿多在24~48 h内实现功能性闭合,但是早产儿动脉导管常发生闭合延迟[1]。研究报道,胎龄大于30周和小于28周的早产儿动脉导管未闭(patent ductus arteriosus,PDA)的发生率分别约为10%和80%~90%[2]。PDA导致血液从主动脉向肺动脉分流,从而引起肺循环血流量增加和体循环血流量减少,可引起一系列并发症,严重者甚至危及生命[3]。研究指出,胎龄、出生体重、出生时窒息、新生儿呼吸窘迫综合征及败血症等可能是早产儿发生PDA的高危因素[4]。目前,国内外尚缺乏关于早产儿PDA发生率及高危因素的大样本研究。本研究回顾性分析本院近三年胎龄小于34周早产儿的临床资料,分析早产儿PDA的发生率、危险因素及其并发症的发生情况,旨在为进一步探讨和制定早产儿PDA的风险预测及早期防治提供参考。
对象与方法
1. 研究对象:选取2016年5月—2019年4月本院新生儿科收治的早产儿为研究对象。纳入标准为(1)胎龄<34周,生后24 h内入住新生儿科;(2)所有研究对象均于生后一周内完善彩色多普勒超声心动图检查;(3)临床资料完整。排除标准为(1)生后早期(1周内)发生败血症、严重疾患或死亡;(2)存在消化道或泌尿系畸形、遗传代谢性疾病、染色体异常;(3)合并肺动脉闭锁、法洛四联症等严重先天性心脏病;(4)家庭因素中断治疗。
根据超声心动图结果将入选早产儿分为PDA组(249例)和对照组(795例)。
2. 临床资料收集:采取病例对照回顾性研究方法,制订合适的早产儿PDA危险因素及并发症调查表,收集整理患儿住院资料,包括(1)一般资料。包括胎龄、出生体重、是否小于胎龄儿(small for gestational age,SGA)、性别、分娩方式、Apgar评分、窒息史等;(2)母亲资料。包括年龄、孕产史、是否患有妊娠期糖尿病(gestational diabetes mellitus,GDM)、妊娠期高血压、胎膜早破及产前糖皮质激素使用情况等;(3)临床资料。包括有创及无创呼吸机应用;是否发生肺炎、支气管肺发育不良(bronchopulmonary dysplasia,BPD)、喂养不耐受、中重度坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、颅内出血(intraventricular hemorrhage,IVH)或脑室周围白质软化(periventricular leukomalacia,PVL)、早产儿视网膜病变(retinopathy of prematurity,ROP)及肾损伤等并发症。并发症诊断标准参照《实用新生儿学》第5版诊断标准[5]。
3. 统计学处理:应用SPSS 23.0统计分析软件。计量资料均正态性检验,不符从正态分布,采用中位数M(Q1,Q3)进行统计描述,二组组间比较采用秩和检验。计数资料采用百分数进行统计描述,二组组间比较采用χ2检验。采用二元Logistic回归分析进行多因素分析。P<0.05表示差异有统计学意义。
结果
1.不同胎龄和出生体重早产儿PDA发生率:胎龄小于34周早产儿PDA发生率为23.9%。胎龄和出生体重越小,PDA发生率越高,见表1。
2.早产儿PDA危险因素的单因素分析:PDA组患儿胎龄、出生体重、产前应用糖皮质激素的比例及胎膜早破的发生率均小于对照组,而窒息及孕母妊娠期高血压发生率均高于对照组,差异均有统计学意义。而两组患儿在母亲年龄、分娩方式、性别、是否小于胎龄儿、孕母妊娠期糖尿病间的差异无统计学意义。见表2。
3.早产儿PDA危险因素的多因素二元Logistic回归分析:二元Logistic回归分析结果显示,胎龄小(OR=1.40,95% CI:1.24~1.59)、窒息(OR=1.82,95% CI:1.21~2.75)是PDA发生的独立危险因素,胎膜早破(OR=0.63,95% CI:0.45~0.88)、产前糖皮质激素使用(OR=0.52,95% CI:0.36~0.76)是PDA的独立保护因素,见表3。
4.早产儿PDA相关疾病分析:PDA组患儿有创及无创呼吸机应用时间大于对照组,肺炎、BPD、喂养不耐受、Bell分期II期以上NEC、IVH、ROP及肾损伤的发生率均高于对照组,差异均有统计学意义;而两组患儿在PVL的发生率之间的差异无统计学意义。见表4。
表1 不同胎龄和出生体重早产儿PDA发生情况
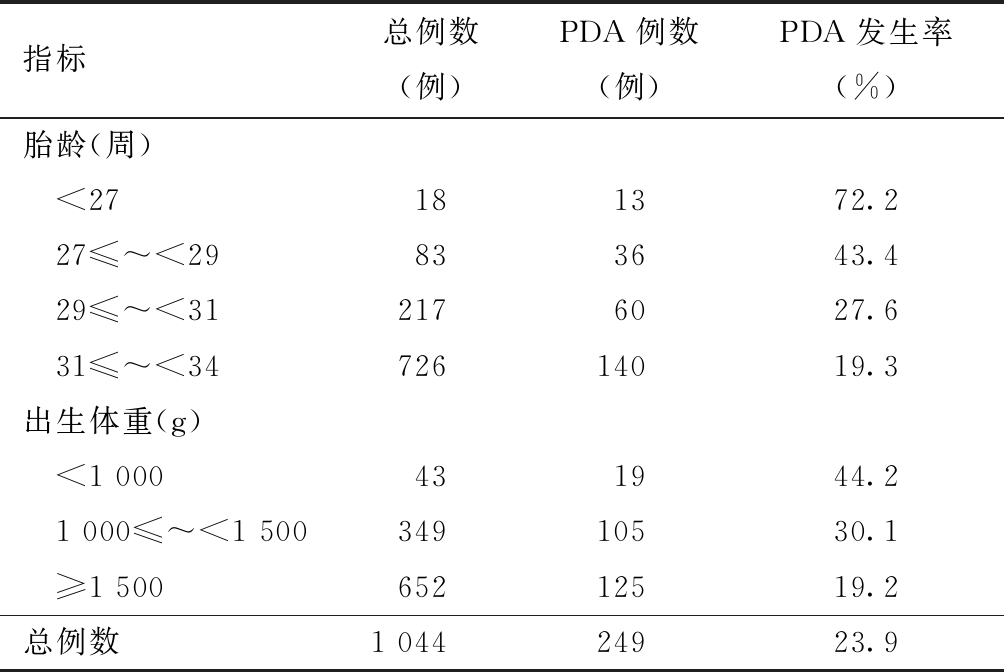
指标总例数(例)PDA例数(例)PDA发生率(%)胎龄(周) <27181372.2 27≤~<29833643.4 29≤~<312176027.6 31≤~<3472614019.3出生体重(g) <1 000431944.2 1 000≤~<1 50034910530.1 ≥1 50065212519.2总例数1 04424923.9
表2 早产儿PDA危险因素的单因素分析
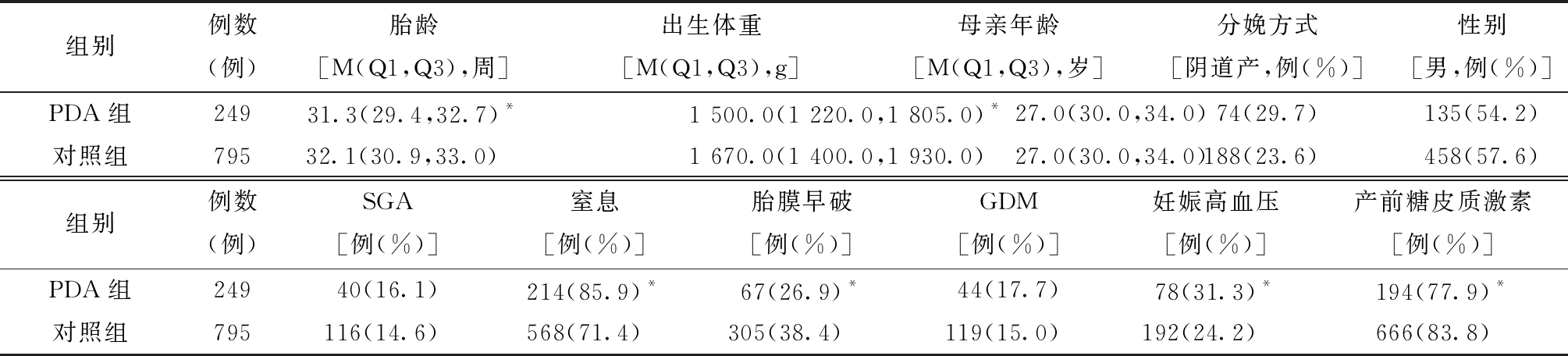
组别例数(例)胎龄[M(Q1,Q3),周]出生体重[M(Q1,Q3),g]母亲年龄[M(Q1,Q3),岁]分娩方式[阴道产,例(%)]性别[男,例(%)]PDA组24931.3(29.4,32.7)*1 500.0(1 220.0,1 805.0)*27.0(30.0,34.0)74(29.7)135(54.2)对照组79532.1(30.9,33.0) 1 670.0(1 400.0,1 930.0)27.0(30.0,34.0)188(23.6)458(57.6)组别例数(例)SGA[例(%)]窒息[例(%)]胎膜早破[例(%)]GDM[例(%)]妊娠高血压[例(%)]产前糖皮质激素[例(%)]PDA组24940(16.1)214(85.9) *67(26.9) *44(17.7)78(31.3) *194(77.9) *对照组795116(14.6)568(71.4)305(38.4)119(15.0)192(24.2)666(83.8)
与对照组比较,*P<0.05
表3 PDA危险因素的多因素分析
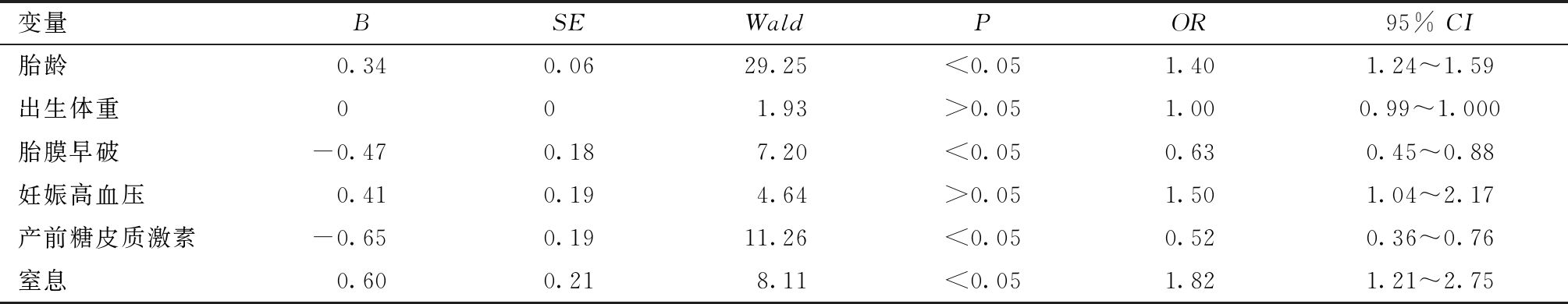
变量BSEWaldPOR95% CI胎龄0.340.0629.25<0.051.401.24~1.59出生体重001.93>0.051.000.99~1.000胎膜早破-0.470.187.20<0.050.630.45~0.88妊娠高血压0.410.194.64>0.051.501.04~2.17产前糖皮质激素-0.650.1911.26<0.050.520.36~0.76窒息0.600.218.11<0.051.821.21~2.75
表4 PDA相关并发症的比较
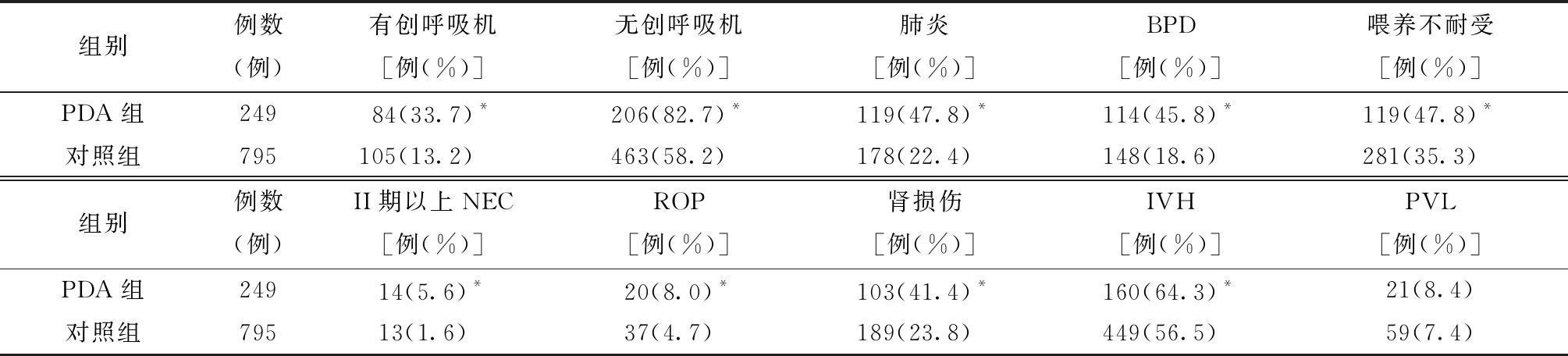
组别例数(例)有创呼吸机[例(%)]无创呼吸机[例(%)]肺炎[例(%)]BPD[例(%)]喂养不耐受[例(%)]PDA组24984(33.7) *206(82.7) *119(47.8) *114(45.8) *119(47.8) *对照组795105(13.2)463(58.2)178(22.4)148(18.6)281(35.3)组别例数(例)II期以上NEC[例(%)]ROP[例(%)]肾损伤[例(%)]IVH[例(%)]PVL[例(%)]PDA组24914(5.6) *20(8.0) *103(41.4) *160(64.3) *21(8.4)对照组79513(1.6)37(4.7)189(23.8)449(56.5)59(7.4)
与对照组比较,*P<0.05
讨论
国外研究指出,胎龄>30周和25~29周早产儿生后第4天PDA发生率分别为10%和80%,出生体重在1 000~1 500 g和小于1 000 g的早产儿生后第4天PDA发生率分别约65%和79%[2]。本研究在出生后1周内经超声心动图确诊PDA的发生率达到23.9%;且胎龄和出生体重越小,PDA发病率越高;特别是胎龄<29周,或出生体重<1 000 g的极小早产儿,其PDA发生率接近50%,说明极早早产儿出生一周动脉导管的自然关闭率较低。
本研究共纳入11个因素分析其与PDA发生的相关性。单因素分析提示,PDA组早产儿的胎龄和出生体重均低于对照组,且胎龄小是PDA发生的独立危险因素,说明胎龄是决定新生儿成熟的关键因素。胎龄越小,早产儿动脉导管平滑肌发育越不成熟,动脉导管内膜弹力纤维薄弱,仅由极薄的内皮细胞构成,导致PDA发生率增加。早产儿生后窒息常伴有低氧血症,低氧血症可影响细胞内活性氧的生成,从而抑制平滑肌细胞膜去极化所致的细胞内钙离子内流,影响动脉导管平滑肌的收缩,使动脉导管保持开放[6]。台湾的一项研究[4]纳入77例极低出生体重儿,分为PDA组34例和对照组43例,结果发现PDA组患儿生后5分钟Apgar评分显著低于对照组。本研究也认为早产儿生后窒息是PDA发生的独立危险因素。本研究表明,产前糖皮质激素应用、胎膜早破是PDA发生的独立保护因素。Kesiak[7]等的研究认为母亲产前糖皮质激素的应用可以促进早产儿生后动脉导管的关闭。糖皮质激素可以抑制环氧化酶,从而影响前列腺素的合成,促进导管周围血管平滑肌的收缩。而胎膜早破可推动产程发作,使糖皮质激素分泌增加,从而促进动脉导管关闭[8]。
早产儿生后动脉导管的持续开放可引起血液从主动脉向肺动脉分流,导致肺循环血流量增加,而体循环血流量减少,易于发生肺充血、肺水肿甚至呼吸衰竭和心力衰竭。体循环血流量的减少导致重要脏器如消化道、肾和脑灌注不足而发生脏器功能受损和相关并发症,如喂养不耐受、NEC、肾功能受损、IVH、PVL等[9]。本研究结果提示,PDA组早产儿有创及无创机械通气时间均明显长于对照组,且肺炎和BPD的发生率也较对照组高,差异有统计学意义。这与PDA引起肺循环血流量增多,肺泡及肺间质水肿,肺顺应性降低有关,且更易合并肺部感染[10]。Schena等[3]指出,PDA是小于28周早产儿后期发生BPD的独立危险因素。
本研究还发现,PDA组早产儿发生喂养不耐受、中重度NEC、IVH、ROP及肾损伤的比例均高于对照组,差异均有统计学意义。Shimada等[11]通过超声证实,PDA早产儿的肠道和肾脏血流均明显减少,流速降低,而PDA关闭后,肠道和肾脏血流量及流速均恢复至正常。肠系膜血供减少可引起肠系膜缺血、缺氧性坏死,此外PDA保守治疗时利尿、限液等处理可能进一步减少体循环血供,导致肠系膜血供减少而容易发生NEC。Khorshidifar等[12]的研究指出ROP组患儿PDA发生率显著高于对照组,可能与机械通气及用氧时间延长,血氧饱和度波动大等有关。生后前3 d是早产儿IVH发生的高峰期,Noori等[13]的研究指出动脉导管分流量增加可导致脑血流量减少,PDA早产儿脑血流速度可降低25%,主要以舒张期脑血流速度降低为主。有研究指出,当动脉导管直径>1.6 mm时,脑血流量将显著减少,可使Ⅲ~Ⅳ级IVH发生率明显增加[14]。本研究结果中PDA组患儿与对照组在PVL的发生率之间的差异无统计学意义,Kidokoro等[15]的多中心研究提示早产儿PDA更易导致严重脑损伤,包括IVH、PVL和小脑出血,然而PDA的存在不是发生3~4级PVL的独立危险因素。目前大部分研究认为PDA对PVL的影响机制仍不明确,需进一步深入研究[5]。
综上所述,本研究认为早产儿PDA发病率高,且胎龄和出生体重越小,动脉导管的自然关闭率越低。胎龄<29周或出生体重<1 000 g的极小早产儿,出生一周时PDA发生率接近一半。胎龄小和窒息是早产儿PDA的高危因素,而产前糖皮质激素使用和胎膜早破是其保护因素。PDA的发生与早产儿一系列并发症相关,可导致呼吸机应用时间延长,增加肺炎、BPD、喂养不耐受、中重度NEC、IVH、ROP及肾损伤的发生。说明对于胎龄小的早产儿PDA是影响其成活率和远期生存质量的重要因素之一,建议对极早早产儿应予以早期积极治疗,以改善早产儿的预后。
1 Beniz WE.Patent Ductus Arteriosus in Preterm Infants.Pediatrics,2016,137:e20153730.
2 Rolland A,Shankar-Aguilera S,Diomandé D,et al.Natural evolution of patent ductus arteriosus in the extremely preterm infant.Arch Dis Child Fetal Neonatal Ed,2015,100:F55-F58.
3 Schena F,Francescato G,Cappelleri A,et al.Association between Hemodynamically Significant Patent Ductus Arteriosus and Bronchopulmonary Dysplasia.J Pediatr,2015,166:1488-1492.
4 Chen YY,Wang HP,Chang JT,et al.Perinatal factors in patent ductus arteriosus in very low-birthweight infants.Pediatr Int,2014,56:72-76.
5 邵肖梅,叶鸿瑁,丘小汕.实用新生儿学.第5版.北京:人民卫生出版社,2019:831,633-634,856-857,861,598,1027.
6 Hamrick SE,Hansmann G.Patent ductus arteriosus of the preterm infant.Pediatrics,2010,125:1020-1030.
7 Kesiak M,Nowiczewski M,Gulczyńska E.Can we expect decreasing the incidence of patent ductus arteriosus(PDA) in the population of premature neonates who had received antenatal steroid therapy?Ginekol PoI,2005,76:812-818.
8 Kurek EM,Tüten A,Özkaya E,et al.Major determinants of survival and length of stay in the neonatal intensive care unit of newborns from women with premature preterm rupture of membranes.J Matern Fetal Neonatal Med,2017,30:1972-1975.
9 De Albuquerque BC,Da Rocha BA,Balensiefer T,et al.Oral pharmacological treatment for patent ductus arteriosus in premature neonates with hemodynamic repercussions.Asian Pac J Trop Med,2017,10:1080-1083.
10 De Felice C,Bechelli S,Tonni G,et al.Systematic underestimation of oxygen delivery in ventilated preterm infants.Neonatology,2010,98:18-22.
11 Shimada S,Kasai T,Hoshi A,et al.Cardiociculatory effects of patent ductus arteriosus in extremely low-birth-weight infants with respiratory distress syndrome.Pediatr Int,2003,45:255-262.
12 Khorshidifar M,Nikkhah H,Ramezani A,et al.Incidence and risk factors of retinopathy of prematurity and utility of the national screening criteria in a tertiary center in Iran.Int J Ophthalmol,2019,12:1330-1336.
13 Noori S,Wlodaver A,Gottipati V,et al.Transitional changes in cardiac and cerebral hemodynamics in term neonates at birth.J Pediatr,2012,160:943-948.
14 Fowlie PW,Davis PG,Mcguire W.Prophylactic intravenous indomethacin for preventing mortality and morbidity in preterm infants.Cochrane Database Syst Rev,2010:CD000174.
15 Kidokoro H,Anderson PJ,Doyle LW,et al.Brain injury and altered brain growth in preterm infants:predictors and prognosis.Pediatrics,2014,134:e444-453.