妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠前代谢正常或有潜在糖耐量减退,妊娠期才出现或确诊的糖尿病[1],是妊娠期最常见的并发症之一[2]。GDM对母亲和新生儿的风险均很高,其中围产期先兆子痫、巨大儿和肩难产及远期的代谢性疾病风险增加都会对母婴健康造成巨大影响[3]。随着生活方式的改变,久坐及不良饮食习惯在增加肥胖患病率的同时也导致了育龄期妇女罹患GDM的人数上升[4]。
人体成分分析在孕妇中的应用日益增多,但人体成分与GDM关联分析相对较少。本研究通过多频生物电阻抗法测定孕期各阶段体成分相对值(人体成分百分比),比较孕期各阶段体成分变化情况,探索孕期临床动态监测指标,并分析孕中期妇女体成分与GDM关联,为制定适合中国人的孕期体成分标准提供一定参考依据。
对象与方法
一、研究对象
1. 对象选择:采用方便抽样的方法,选择2018年4月至2019年4月在北京市某妇幼保健院产前门诊就诊的孕妇作为研究对象。研究对象分为GDM组和对照组,以孕期第24~28周进行的口服葡萄糖耐量实验(oral glucose tolerance test,OGTT)结果作为诊断GDM的主要依据。124例诊断GDM的孕妇作为GDM组,130例血糖正常孕妇作为对照组。本研究通过北京大学生物医学伦理委员会审查,所有研究对象均知情并签署同意书。
2.纳入标准:本次妊娠为单胎且孕妇无严重遗传缺陷病和精神疾病,本人同意参加研究并签署知情同意书。
3.排除标准:孕妇孕前患有糖尿病或其他代谢性疾病;孕妇本人有精神性疾病或严重沟通障碍不能完成调查,孕妇妊娠期间患上严重心肝肾疾病、恶性肿瘤、胃肠疾病、内分泌疾病、结缔组织病;孕妇妊娠期间因各种原因终止妊娠者、妊娠为双胎或多胎者、长期使用抗生素药物者等;孕妇妊娠期间因各种原因中止在本课题合作医院继续产检。
二、研究方法
1. 问卷调查:问卷由统一培训的调查员采用自行设计的问卷进行调查,调查内容包括研究对象的人口学特征、生育史、相关疾病家族史以及生活方式等信息。
2. 人体成分分析:采用人体成分分析仪(北京四海华辰H-key350)于孕22~24周测定研究对象体成分。研究对象于测试时去除佩戴的手镯、戒指、耳环、胸针等金属物品,身着薄衣、双脚赤足站在足部电极对应位置,双手持手部电极并自然下垂与身体分开,注意四肢与躯干间的皮肤不能接触,然后开始进行体成分测定。测试过程中,保持站立姿势及自然放松状态,测试中不讲话或移动以避免测量误差。
人体成分测量指标包括细胞内水分、细胞外水分、蛋白质、无机盐、体脂肪、去脂体重、肌肉量。将体成分各检测指标的测量值除以自身体重,得其占自身体重的百分比,如细胞内水分百分比、细胞外水分百分比、蛋白质百分比等,以消除自身因素的影响。
3. 口服葡萄糖耐量试验:在妊娠 24~28周进行OGTT试验。分别测其空腹、口服葡萄糖1 h、口服葡萄糖2 h的血糖值。参照IADPSG(the international association of the diabetes and pregnancy study group)诊断标准,75 g OGTT的正常值为空腹血糖、口服葡萄糖1 h和2 h血糖分别小于5.1 mmol/L、10.0 mmol/L和8.5 mmol/L。任意一点血糖值异常者诊断为GDM(剔除孕前或孕早期已经诊断为糖尿病的孕妇)[5]。
4.统计学处理:采用Epidata 3.1建立数据库进行双人双录入。应用SPSS 21.0软件统计分析。符合正态分布的定量资料,采用![]() 描述,定性资料采用例数、百分比描述。采用t检验、卡方检验或秩和检验进行GDM可能影响因素的单因素分析。利用非条件Logistic回归模型,以妊娠期糖尿病为因变量(是=1;否=0),分别以无机盐百分比、蛋白质百分比、体脂百分比等体成分指标为自变量,控制混杂因素(怀孕次数、职业、收入、文化程度、年龄及孕前BMI)后,分析人体成分对GDM的影响。变量入选标准为0.05,剔除标准为0.10。P<0.05为差异有统计学意义。
描述,定性资料采用例数、百分比描述。采用t检验、卡方检验或秩和检验进行GDM可能影响因素的单因素分析。利用非条件Logistic回归模型,以妊娠期糖尿病为因变量(是=1;否=0),分别以无机盐百分比、蛋白质百分比、体脂百分比等体成分指标为自变量,控制混杂因素(怀孕次数、职业、收入、文化程度、年龄及孕前BMI)后,分析人体成分对GDM的影响。变量入选标准为0.05,剔除标准为0.10。P<0.05为差异有统计学意义。
结 果
一、研究人群基本特征
共纳入研究对象254例,平均年龄为(29.4±4.0)岁,学历以大学专科/本科为主(63.8%),人均月收入≤10 000元为主(77.2%),详细信息见表1。对照组孕前体质指数(Body Mass Index,BMI)为(20.9±4.5)kg/m2,小于病例组孕前BMI(22.9±4.1)kg/m2,对照组怀孕次数为(1.6±0.9)次,小于病例组(1.9±1.2)次,差异均有统计学意义(P均<0.05),其余表1所示基本信息两组间无统计学差异(P>0.05),数据不再赘述。
表1 研究对象基本信息 [例(%)]
Table 1 Basic characteristics of participants [n(%)]

Characteristics n(%)Age (Year) <30144(56.7) 30~3586(33.9) >3524(9.4)Pre-pregnancy BMI (kg/m2) <18.536(14.2) 18.5~24.9168(66.1) 25~27.932(12.6) ≥2818(7.1)Education Illiteracy 0(0.0) Middle school or lower26(10.2) Senior high school34(13.4) Junior college86(33.9) College76(29.9) Postgraduate or higher32(12.6)Occupation Unemployed63(24.8) Student 2(0.8) Personnel of public organizations and enterprises13(5.1) Technical personnel70(27.6) Clerks21(8.3) Businessman and service staff56(22.0) Others29(11.4)Monthly Income (Yuan) <6 000111(43.7) 6 000~10 00085(33.5) >10 00026(10.2) Unknown32(12.6)Gravidity 1132(52.0) ≥2122(48.0)Parity 0173(68.1) ≥181(31.9)Age of Menarche <1340(15.7) 13~16201(79.1) >1613(5.1)
二、孕中期体成分与GDM关系的单因素分析
病例组体脂肪百分比高于对照组,细胞内、外水分及无机盐百分比均低于对照组,差异均有统计学差异(P均<0.01),见表2。
表2 对照组与病例组体成分指标![]()
Table 2 Body composition index by ![]()
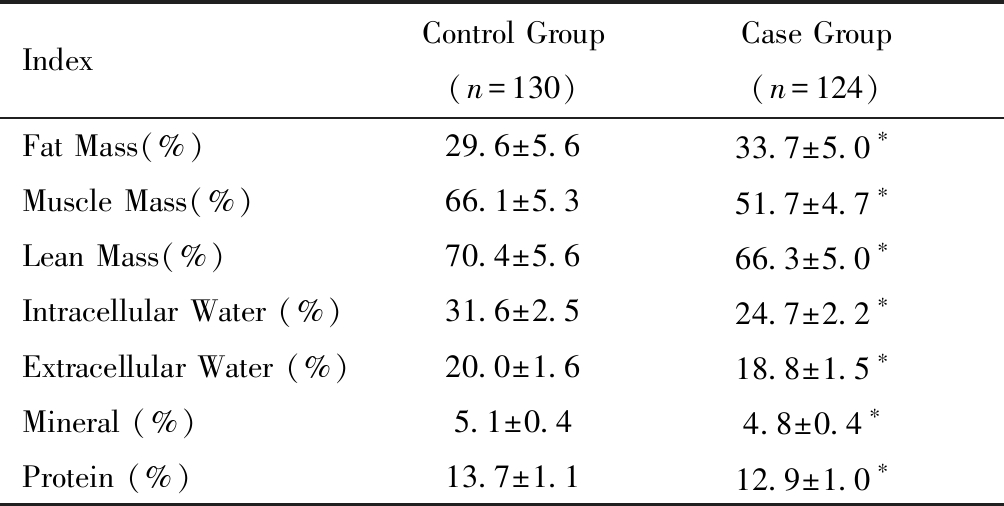
IndexControl Group(n=130)Case Group(n=124)Fat Mass(%)29.6±5.633.7±5.0∗Muscle Mass(%)66.1±5.351.7±4.7∗Lean Mass(%)70.4±5.666.3±5.0∗Intracellular Water (%)31.6±2.524.7±2.2∗Extracellular Water (%)20.0±1.618.8±1.5∗Mineral (%)5.1±0.44.8±0.4∗Protein (%)13.7±1.112.9±1.0∗
note: compared with control group,*P <0.01
三、孕中期体成分与GDM关系的多因素分析
非条件Logistic 回归分析结果显示,孕中期体脂百分比为孕中期GDM发生的危险因素(OR=1.1,95%CI=1.1~1.2),其余体成分指标均为GDM发生的保护因素,分别为去脂体重百分比(OR=0.9,95%CI=0.8~0.9)、肌肉量百分比(OR=0.9,95%CI=0.8~0.9)、无机盐百分比(OR=0.2,95%CI=0.1~0.4)、蛋白质百分比(OR=0.5,95%CI=0.4~0.7)、细胞外水分百分比(OR=0.7,95%CI=0.6~0.8)、细胞内水分百分比(OR=0.8,95%CI=0.7~0.9),差异均有统计学意义(P<0.01),结果见表3。
表3 孕中期体成分指标与GDM的Logistic回归分析
Table 3 Logistic regression analysis of body composition index and GDM in the second trimester of pregnancy

FactorsBSEWaldPOR(95%CI)Fat Mass (%) 0.10.0223.0<0.0011.1 (1.1-1.2)Lean Mass (%)-0.10.0323.6<0.0010.9 (0.8-0.9)Muscle Mass (%)-0.10.0323.3<0.0010.9 (0.8-0.9)Mineral (%)-1.60.324.0<0.0010.2 (0.1-0.4)Protein (%)-0.60.122.4<0.0010.5 (0.4-0.7)Extracellular Water (%)-0.40.124.0<0.0010.7 (0.6-0.8)Intracellular Water (%)-0.30.122.8<0.0010.8 (0.7-0.9)
讨 论
本研究以孕中期女性为研究对象,通过OGTT检测,以病例对照研究方法分析孕中期体成分指标与GDM之间的关系。将混杂因素孕妇职业、收入、文化程度、年龄及孕前BMI纳入Logistics回归分析中,发现体脂百分比与孕妇GDM的发生相关,体脂百分比较高的孕妇发生GDM的风险明显增加,该结果提示孕早期和孕中期体内脂肪贮存过多所引起的孕中期体脂肪百分比过高是GDM发生的危险因素。同时Logistics回归也表明其他体成分指标均为孕妇GDM的保护因素。
研究表明,肥胖女性GDM发生风险要比正常体重女性高很多,虽然一定程度的胰岛素抵抗是妊娠后半期的生理特征,但在GDM患者中更为明显。肥胖者的脂肪组织功能障碍和亚临床炎症是非孕受试者胰岛素抵抗增加的主要原因,并常见于II型糖尿病患者[2]。肥胖孕妇体内过量的脂肪组织导致白色脂肪组织和胎盘发生免疫和炎症反应,从而导致全身性炎症[6]。GDM会对母婴近远期健康均造成不良影响,GDM与新生儿出生缺陷之间的关联可能部分归因于与肥胖相关的孕前未经确诊的代谢紊乱,例如孕前糖尿病[7]。故育龄妇女必须加强怀孕前和怀孕期间的体重管理,以提高其生殖健康及后代健康水平。
大量临床研究表明,肥胖与脂肪组织组成和表达谱的改变有关[2],肥胖者机体中以脂肪形式贮存了过多能量,而非单纯的体重偏高[8]。而目前衡量人体肥胖程度常用的体重指数BMI指标无法区分体脂肪与去脂体重的差异,难以确定患者体内脂肪组织是否过量,在应用于GDM的预测和孕前及孕期体重管理中存在一定局限。而基于多频生物电阻抗技术的人体成分分析可以通过人体组织电阻抗技术精确测定人体脂肪、肌肉等成分,弥补单一BMI应用的不足[9-10]。但当前现有的关于人体成分与GDM关系的研究仍需继续深入,很多研究仅采用了单因素分析,大多未考虑混杂因素影响,结果缺乏一定可靠性[11-14]。本研究采用来自同一妇幼保健院门诊登记建档的孕妇人群进行病例对照研究,以多因素分析的方法,在排除孕妇年龄等混杂因素的影响后得出的结果相对客观。本研究发现,控制孕妇年龄后,体脂肪百分比较高的孕妇发生GDM风险明显增加,该结果提示孕早、中期体内脂肪贮存过多所引起的孕中期体脂肪百分比过高是GDM发生的危险因素。研究显示GDM患者脂肪组织中脂肪因子表达改变和局部炎症的证据表明,脂肪组织分泌的特定激素和脂肪因子在维持机体葡萄糖平衡及GDM的发病机制中起着至关重要的作用[2, 15-16]。孕早、中期体内脂肪贮存过多,会导致脂肪因子分泌增多进而造成胰岛素抵抗,而以胰岛素抵抗为特征的葡萄糖耐量异常状态,最终直接促使了GDM的发生[15]。吴成等[8]通过Logistic回归分析的方法,在控制了孕妇年龄与孕前BMI后发现,体脂百分比是GDM发生的独立危险因素,与本研究所得结果一致。但郑慧敏等[17]的研究结果显示,GDM组水分、肌肉、脂肪、体脂百分比、蛋白质、细胞内水及细胞外水均高于对照组,该结果与本研究结果存在较大差异,分析其原因可能与研究所选用的指标不同有关,郑慧敏等的研究采用体成分的测量绝对值,而本研究则以相对值(如体脂百分比)作为分析指标,排除自身体重对人体成分绝对值的影响,从而更真实地反映人体成分与GDM的关系。受研究条件的限制,本研究未进行孕前体成分检测,考虑到孕前超重或肥胖对GDM的影响,研究结果可能存在一定偏倚。
孕期体脂百分比过高是孕中期GDM发生的危险因素,此外肌肉量百分比,去脂体重百分比等均为GDM发生的保护因素,提示应合理减少孕期体脂肪的过量蓄积,适量增加肌肉储备以预防GDM的发生,以期改善妊娠结局。此外在未来的研究中还应加入对孕妇膳食的孕期全程记录和分析,通过合理的膳食指导,管理妊娠期妇女体重,在保证肌肉量的同时控制体脂肪的过量增加,降低GDM的发生风险。
1 妊娠合并糖尿病协作组,中华医学会妇产科学分会产科学组,中华医学会围产医学分会.妊娠合并糖尿病诊治指南.中华妇产科杂志,2014,8:561-569.
2  imják P,Cinkajzlová A,Anderlová K,et al.The role of obesity and adipose tissue dysfunction in gestational diabetes mellitus.J Endocrinol,2018,238:63-77.
imják P,Cinkajzlová A,Anderlová K,et al.The role of obesity and adipose tissue dysfunction in gestational diabetes mellitus.J Endocrinol,2018,238:63-77.
3 Mack LR,Tomich PG.Gestational Diabetes.Obstet Gyn Clin N Am,2017,44:207-217.
4 Chiefari E,Arcidiacono B,Foti D,et al.Gestational diabetes mellitus:an updated overview.J Endocrinol Invest,2017,40:899-909.
5 Weinert LS.International Association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy:comment to the international association of diabetes and pregnancy study groups consensus panel.Diabetes Care,2010,33:97.
6 Skórzyńska-Dziduszko KE,Kimber-Trojnar ![]() J,et al.An interplay between obesity andinflammation in gestational diabetes mellitus.Curr Pharm Biotechno,2016,17:603-613.
J,et al.An interplay between obesity andinflammation in gestational diabetes mellitus.Curr Pharm Biotechno,2016,17:603-613.
7 Parnell AS,Correa A,Reece EA.Pre-pregnancy obesity as a modifier of gestational diabetes and birth defects associations:a systematic review.Matern Child Health J,2017,21:1105-1120.
8 吴成,鲍妍宏,王玥,等.孕中期妇女体成分对妊娠期糖尿病影响.现代预防医学,2018,45:3316-3319.
9 苌飞霸,张和华,尹军.生物电阻抗测量技术研究与应用.中国医学物理学杂志,2015,32:234-238.
10 苌飞霸,尹军,颜乐先,等.基于生物电阻抗法的人体成分测量系统的研究与评价.中国医学物理学杂志,2014,31:4833-4838.
11 张龙龙,段姗姗,邹密,等.妊娠期糖尿病孕妇与健康孕妇的体成分比较.广西医学,2018,40:1413-1415.
12 徐庆,于晓明,杨雪艳,等.妊娠期糖尿病患者孕中期母体体成分分析.实用预防医学,2017,24:30-32.
13 徐庆,孔爱景,于晓明,等.应用生物电阻抗行妊娠期糖尿病患者孕晚期体成分分析.解放军医学院学报,2016,37:1026-1029.
14 苗健美,刘华平.妊娠期糖尿病患者孕期体成分分析及其与孕期血糖变化的相关性.中国医药导报,2016,13:38-42.
15 Tsiotra PC,Halvatsiotis P,Patsouras K,et al.Circulating adipokines and mRNA expression in adipose tissue and the placenta in women with gestational diabetes mellitus.Peptides,2018,101:157-166.
16 Bao W,Baecker A,Song YQ,et al.Adipokine levels during the first or early second trimester of pregnancy and subsequent risk of gestational diabetes mellitus:a systematic review.Metabolism,2015,64:756-764.
17 郑慧敏.微量元素和人体体成分与妊娠期糖尿病发生发展的关系.中国妇幼保健,2016,31:5334-5337.